文档内容
2023 届雅礼中学化学试卷(六)
时量:75分钟 满分:100分
可能用到的相对原子质量:H~1 C~12 N~14 O~16 F~19 Na~23 Al~27
Si~28 S~32 Cl~35.5 Ca~40 Fe~56 Ba~137
第Ⅰ卷(选择题共42分)
一、选择题(本题共14小题,每小题3分,共42分,每小题只有一个选项符合
题意。)
1. 成语、古诗词、谚语等都是我国传统文化的瑰宝。下列有关解读错误的是
A. “水滴石穿”过程中发生了是化学变化
B. “雨过天晴云破处,这般颜色做将来”,所描述的瓷器青色,不是来自氧化铁
C. “三月打雷麦谷堆”是指在雷电作用下 最终转化成被作物吸收的化合态氮
D. “日照香炉生紫烟”,描述的是碘的升华
2. 为阿伏加德罗常数的值,下列说法错误的是
A. 已知 ,14gR含有的中子数为8
B. 0.4mol联氨( )中含有共价键数目为2
C. 138g 与 完全反应时转移的电子数为3
D. 常温下1L pH=12的 溶液中, 电离出的 数为
3. 周期表中VIA族元素及其化合物应用广泛。用硫磺熏蒸中药材的传统由来已久;
是一种易燃的有毒气体(燃烧热为 ),可制取各种硫化物;硫酸、硫酸盐是
重要化工原料;硫酰氯 是重要的化工试剂,常作氯化剂或氯磺化剂。硒
和碲(52 的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精
炼铜的阳极泥(含CuSe)为原料回收 ,以电解强碱性 溶液制备 。下列化学反
应表示正确的是
A. 的燃烧:
B. 遇水强烈水解生成两种强酸:
C. 电解强碱性 溶液的阴极反应:
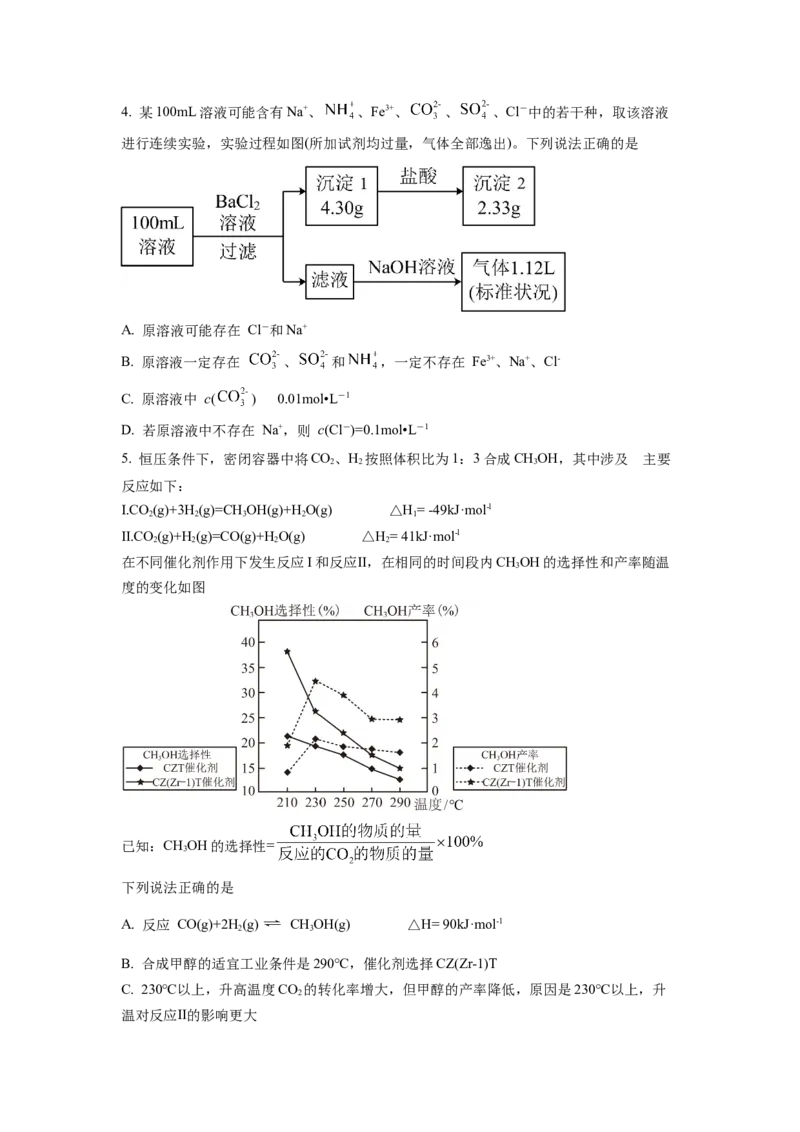
D. CuSe和浓硝酸反应:4. 某100mL溶液可能含有Na+、 、Fe3+、 、 、Cl-中的若干种,取该溶液
进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法正确的是
A. 原溶液可能存在 Cl-和Na+
B. 原溶液一定存在 、 和 ,一定不存在 Fe3+、Na+、Cl-
C. 原溶液中 c( ) 是 0.01mol•L-1
D. 若原溶液中不存在 Na+,则 c(Cl-)=0.1mol•L-1
5. 恒压条件下,密闭容器中将CO、H 按照体积比为1:3合成CHOH,其中涉及 主的要
2 2 3
反应如下:
Ⅰ.CO (g)+3H(g)=CH OH(g)+H O(g) △H= -49kJ·mol-l
2 2 3 2 1
Ⅱ.CO(g)+H(g)=CO(g)+HO(g) △H= 41kJ·mol-l
2 2 2 2
在不同催化剂作用下发生反应I和反应Ⅱ,在相同的时间段内CHOH的选择性和产率随温
3
度的变化如图
已知:CHOH的选择性=
3
下列说法正确的是
A. 反应 CO(g)+2H(g) CHOH(g) △H= 90kJ·mol-1
2 3
B. 合成甲醇的适宜工业条件是290℃,催化剂选择CZ(Zr-1)T
C. 230℃以上,升高温度CO 的转化率增大,但甲醇的产率降低,原因是230℃以上,升
2
温对反应Ⅱ的影响更大D. 保持恒压恒温下充入氦气,不影响CO 的转化率
2
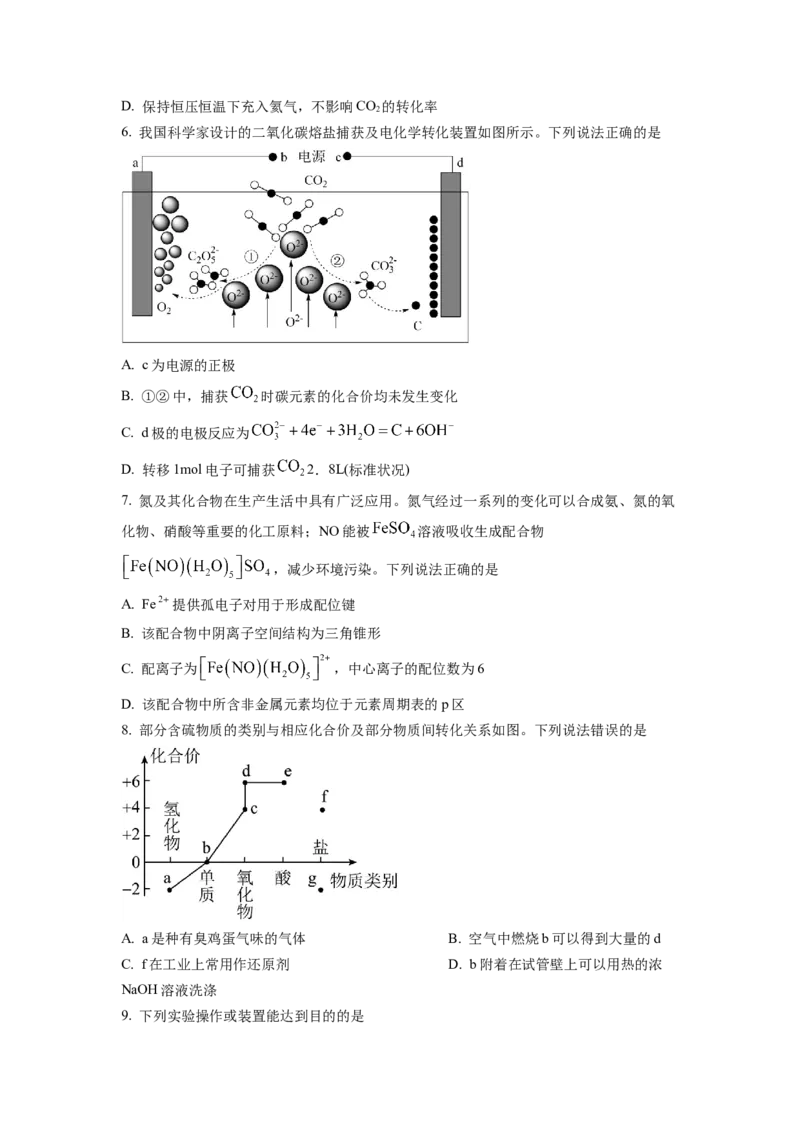
6. 我国科学家设计的二氧化碳熔盐捕获及电化学转化装置如图所示。下列说法正确的是
A. c为电源的正极
B. ①②中,捕获 时碳元素的化合价均未发生变化
C. d极的电极反应为
D. 转移1mol电子可捕获 2.8L(标准状况)
7. 氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化可以合成氨、氮的氧
化物、硝酸等重要的化工原料;NO能被 溶液吸收生成配合物
,减少环境污染。下列说法正确的是
A. Fe 提供孤电子对用于形成配位键
B. 该配合物中阴离子空间结构为三角锥形
C. 配离子为 ,中心离子的配位数为6
D. 该配合物中所含非金属元素均位于元素周期表的p区
8. 部分含硫物质的类别与相应化合价及部分物质间转化关系如图。下列说法错误的是
A. a是种有臭鸡蛋气味的气体 B. 空气中燃烧b可以得到大量的d
C. f在工业上常用作还原剂 D. b附着在试管壁上可以用热的浓
NaOH溶液洗涤
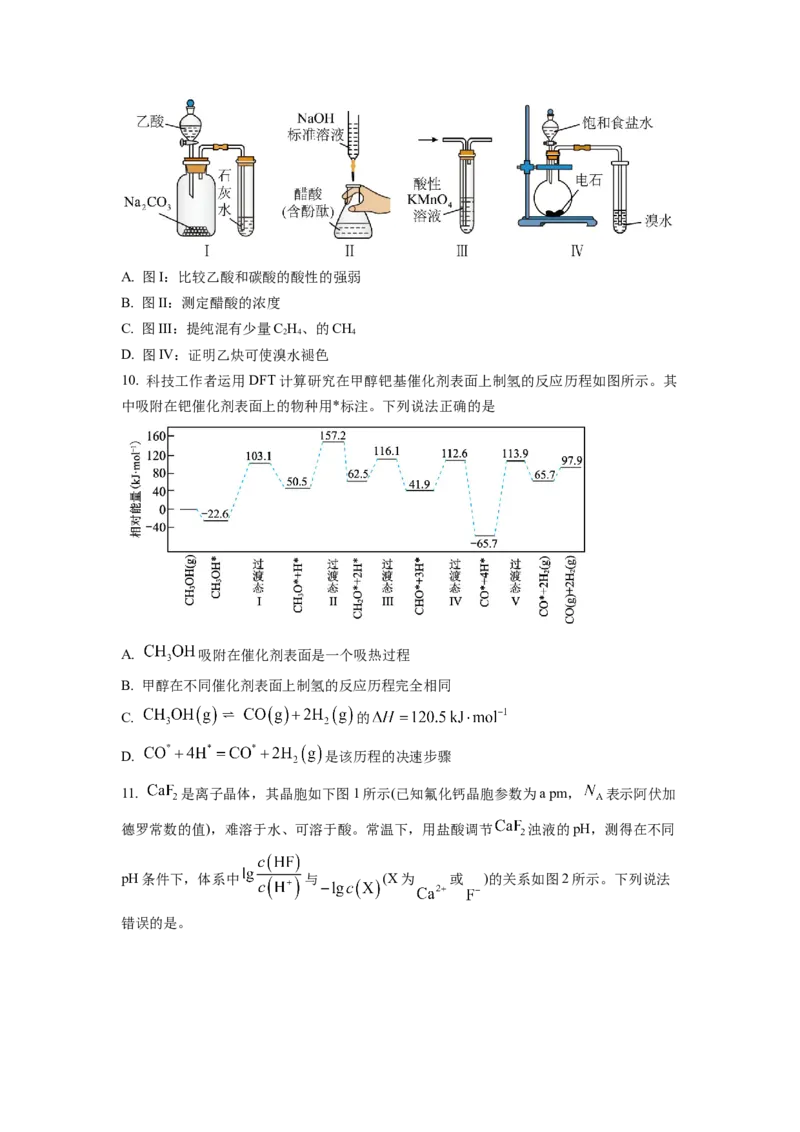
9. 下列实验操作或装置能达到目的的是A. 图I:比较乙酸和碳酸的酸性的强弱
B. 图II:测定醋酸的浓度
C. 图III:提纯混有少量C H、的CH
2 4 4
D. 图IV:证明乙炔可使溴水褪色
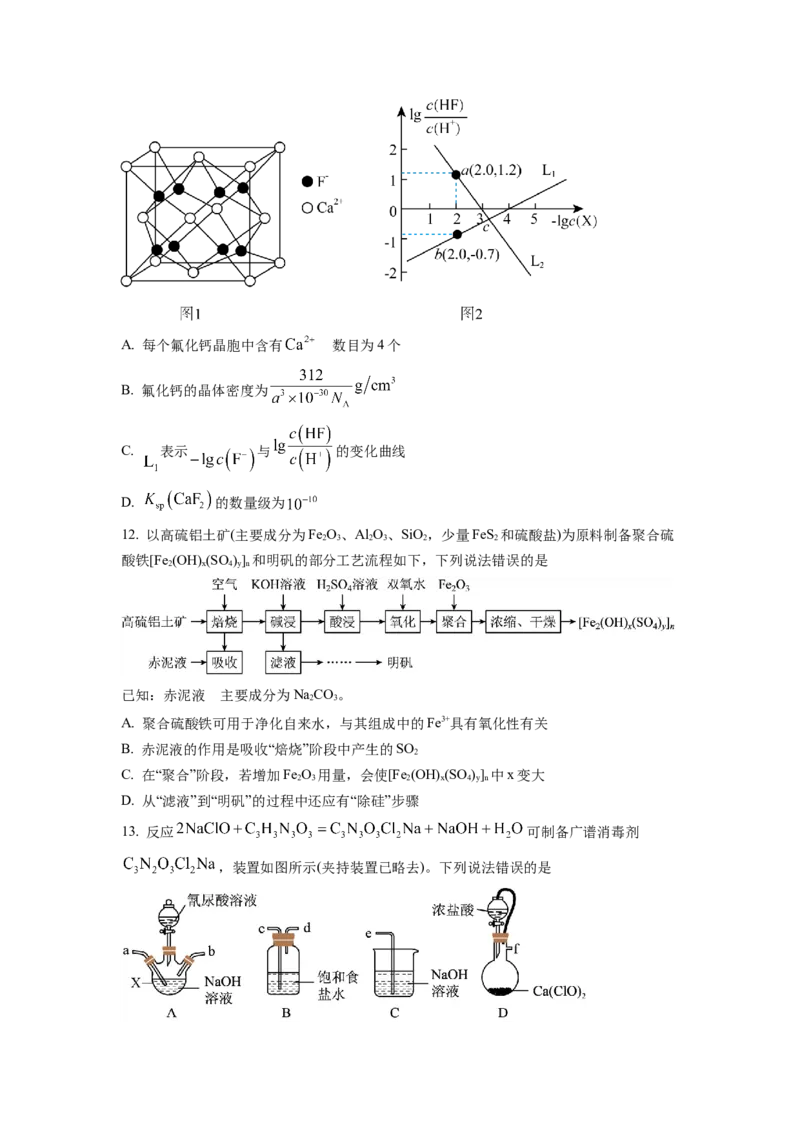
10. 科技工作者运用DFT计算研究在甲醇钯基催化剂表面上制氢的反应历程如图所示。其
中吸附在钯催化剂表面上的物种用*标注。下列说法正确的是
A. 吸附在催化剂表面是一个吸热过程
B. 甲醇在不同催化剂表面上制氢的反应历程完全相同
C. 的
D. 是该历程的决速步骤
11. 是离子晶体,其晶胞如下图1所示(已知氟化钙晶胞参数为a pm, 表示阿伏加
德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节 浊液的pH,测得在不同
pH条件下,体系中 与 (X为 或 )的关系如图2所示。下列说法
错误的是。A. 每个氟化钙晶胞中含有 的数目为4个
B. 氟化钙的晶体密度为
C. 表示 与 的变化曲线
D. 的数量级为
12. 以高硫铝土矿(主要成分为Fe O、Al O、SiO,少量FeS 和硫酸盐)为原料制备聚合硫
2 3 2 3 2 2
酸铁[Fe (OH) (SO )] 和明矾的部分工艺流程如下,下列说法错误的是
2 x 4 y n
已知:赤泥液 主的要成分为NaCO。
2 3
A. 聚合硫酸铁可用于净化自来水,与其组成中的Fe3+具有氧化性有关
B. 赤泥液的作用是吸收“焙烧”阶段中产生的SO
2
C. 在“聚合”阶段,若增加Fe O 用量,会使[Fe (OH) (SO )] 中x变大
2 3 2 x 4 y n
D. 从“滤液”到“明矾”的过程中还应有“除硅”步骤
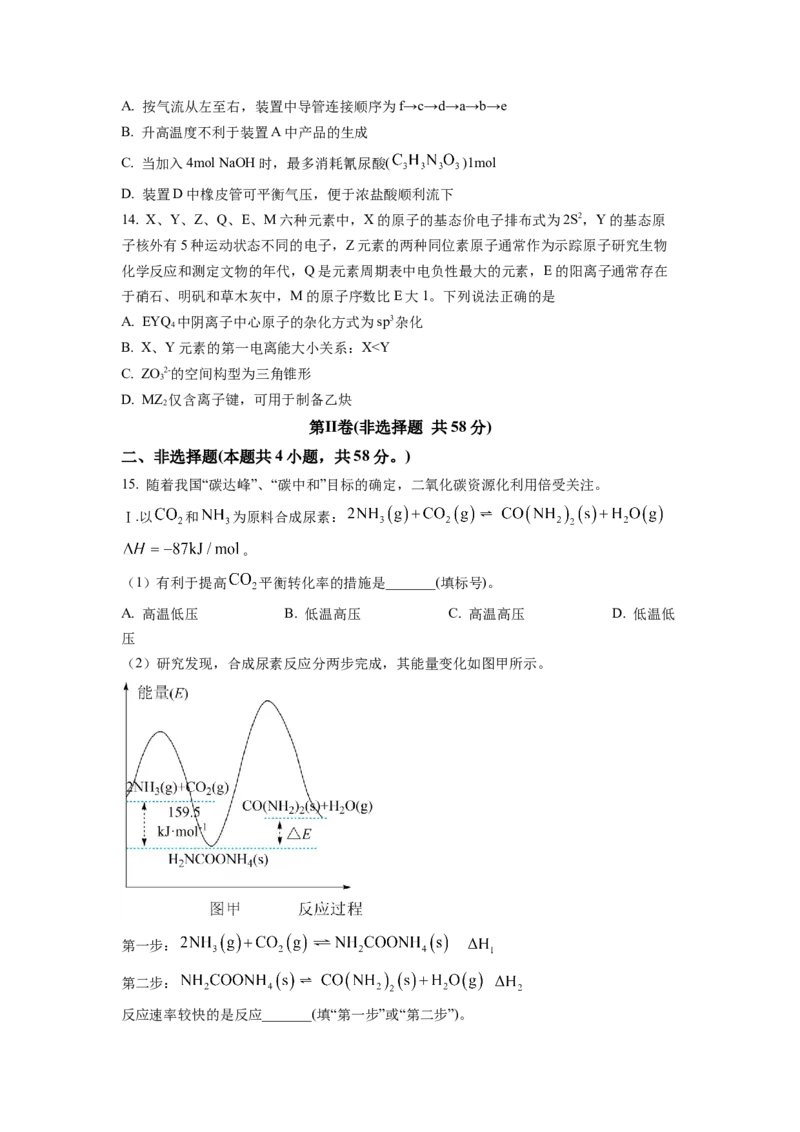
13. 反应 可制备广谱消毒剂
,装置如图所示(夹持装置已略去)。下列说法错误的是A. 按气流从左至右,装置中导管连接顺序为f→c→d→a→b→e
B. 升高温度不利于装置A中产品的生成
C. 当加入4mol NaOH时,最多消耗氰尿酸( )1mol
D. 装置D中橡皮管可平衡气压,便于浓盐酸顺利流下
14. X、Y、Z、Q、E、M六种元素中,X的原子的基态价电子排布式为2S2,Y的基态原
子核外有5种运动状态不同的电子,Z元素的两种同位素原子通常作为示踪原子研究生物
化学反应和测定文物的年代,Q是元素周期表中电负性最大的元素,E的阳离子通常存在
于硝石、明矾和草木灰中,M的原子序数比E大1。下列说法正确的是
A. EYQ 中阴离子中心原子的杂化方式为sp3杂化
4
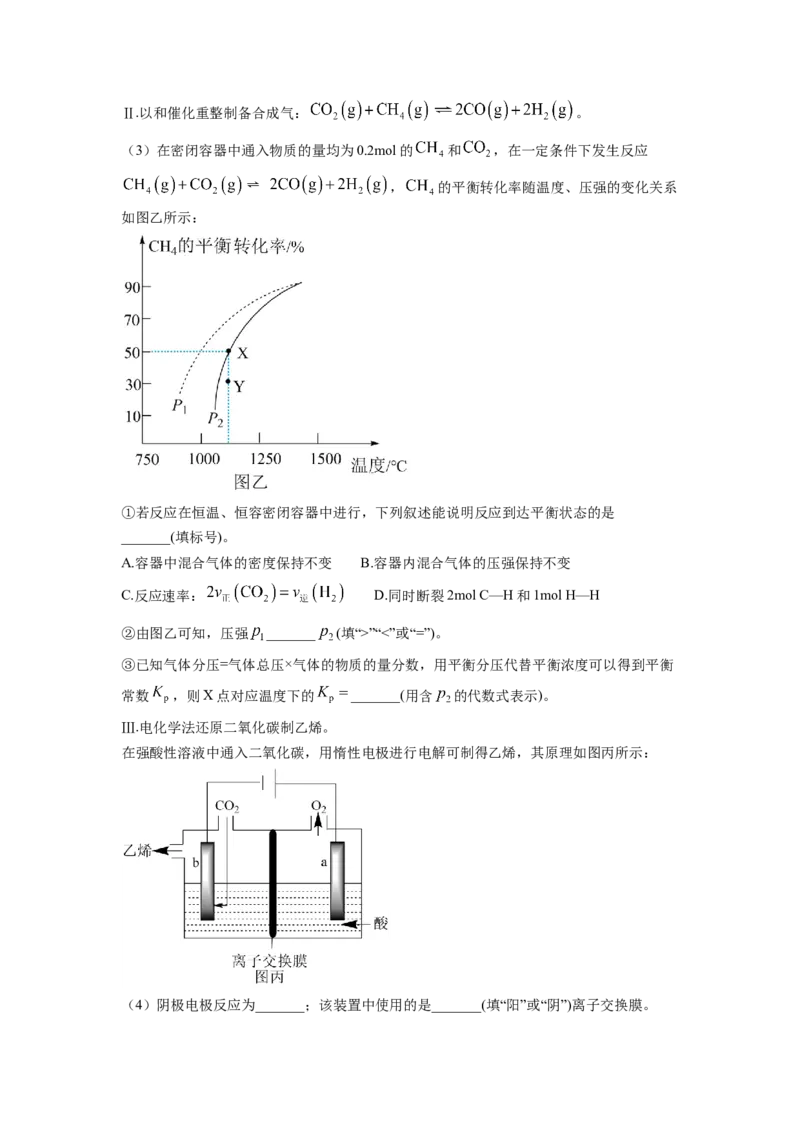
B. X、Y元素的第一电离能大小关系:X”“<”或“=”)。
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡
常数 ,则X点对应温度下的 _______(用含 的代数式表示)。
Ⅲ.电化学法还原二氧化碳制乙烯。
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:
(4)阴极电极反应为_______;该装置中使用的是_______(填“阳”或“阴”)离子交换膜。16. 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子激发态的电子排布式有_______(填标号)。
A. B. C.
(2)O、F、Cl电负性由大到小的顺序为_______; 分子的空间结构为_______;
的熔、沸点低于 ,原因是_______。
(3) (二氟氮烯)分子中,氮原子的杂化类型为 ,则 的结构式为_______。
(4) 晶体与NaCl晶体结构相似。
①设阿伏加德罗常数的值为 ,距离最近的两个 间距为apm,NiO的摩尔质量为
,则NiO晶体的密度为_______ 。
②晶体普遍存在各种缺陷。某种NiO晶体中存在如图所示的缺陷:当一个 空缺,会有
两个 被两个 所取代,但晶体仍呈电中性。经测定某氧化镍样品中 与 的
离子数之比为6∶91.若该晶体的化学式为 ,则 _______。
17. 明矾 可做中药,性味酸涩、寒、有毒。利用废铝制备明矾,并
测定其组成,实验过程如下。
Ⅰ.制备明矾
实验步骤如图:
(1)溶解步骤中主要发生的离子反应方程式为_______。
(2)用蒸馏水洗涤晶体的操作过程是_______。
(3)生活中明矾可用作净水剂,结合离子方程式说明净水原理:_______。
Ⅱ.样品中硫酸根的测定
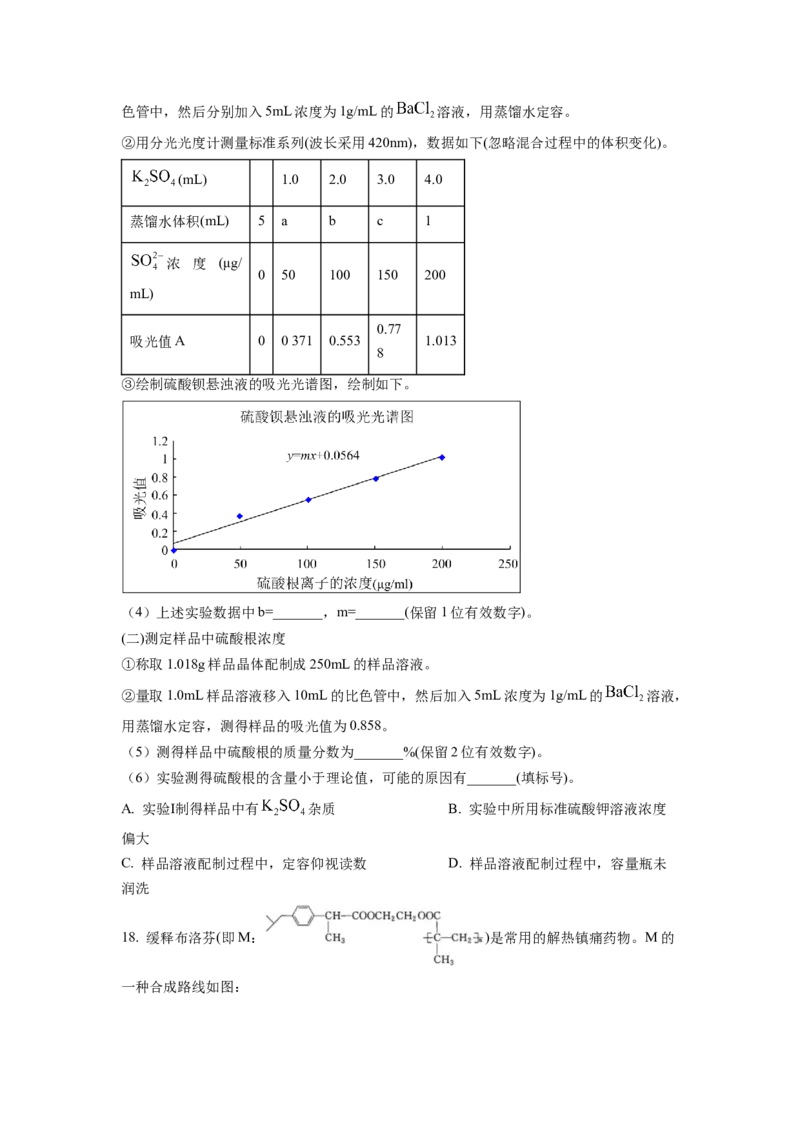
(一)绘制标准硫酸钡悬浊液吸光光谱图
①分别量取0、1.0、2.0、3.0、4.0mL浓度为500μg/mL的标准硫酸钾溶液移入10mL的比色管中,然后分别加入5mL浓度为1g/mL的 溶液,用蒸馏水定容。
②用分光光度计测量标准系列(波长采用420nm),数据如下(忽略混合过程中的体积变化)。
(mL) 1.0 2.0 3.0 4.0
蒸馏水体积(mL) 5 a b c 1
浓 度 (μg/
0 50 100 150 200
mL)
.
0.77
吸光值A 0 0371 0.553 1.013
8
③绘制硫酸钡悬浊液的吸光光谱图,绘制如下。
(4)上述实验数据中b=_______,m=_______(保留1位有效数字)。
(二)测定样品中硫酸根浓度
①称取1.018g样品晶体配制成250mL的样品溶液。
②量取1.0mL样品溶液移入10mL的比色管中,然后加入5mL浓度为1g/mL的 溶液,
用蒸馏水定容,测得样品的吸光值为0.858。
(5)测得样品中硫酸根的质量分数为_______%(保留2位有效数字)。
(6)实验测得硫酸根的含量小于理论值,可能的原因有_______(填标号)。
A. 实验Ⅰ制得样品中有 杂质 B. 实验中所用标准硫酸钾溶液浓度
偏大
C. 样品溶液配制过程中,定容仰视读数 D. 样品溶液配制过程中,容量瓶未
润洗
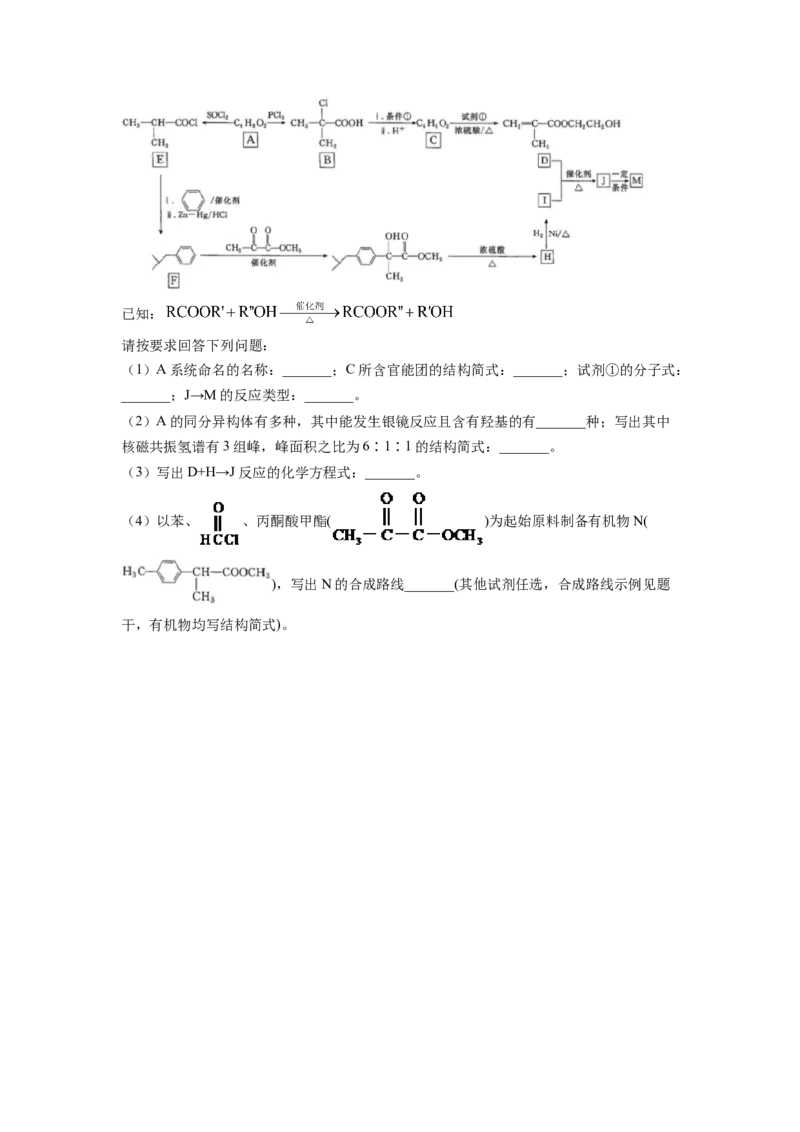
18. 缓释布洛芬(即M: )是常用的解热镇痛药物。M的
一种合成路线如图:已知:
请按要求回答下列问题:
(1)A系统命名的名称:_______;C所含官能团的结构简式:_______;试剂①的分子式:
_______;J→M的反应类型:_______。
(2)A的同分异构体有多种,其中能发生银镜反应且含有羟基的有_______种;写出其中
核磁共振氢谱有3组峰,峰面积之比为6∶1∶1的结构简式:_______。
(3)写出D+H→J反应的化学方程式:_______。
(4)以苯、 、丙酮酸甲酯( )为起始原料制备有机物N(
),写出N的合成路线_______(其他试剂任选,合成路线示例见题
干,有机物均写结构简式)。