文档内容
滁州市 2024届高三第二次教学质量监测
化 学
注意事项:
1答卷前,务必将自己的姓名和座位号填写在答题卡和试卷上。
2回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改
动,务必擦净后再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试
卷上无效。
3考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1 C12 O16 Na23 S32
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合
题目要求。
1中华瑰宝“笔”、“墨”、“纸”、“砚”,承载了几千年的文化传承,它们与化学密不可分。下列
说法错误的是
A笔尖材料多为狼毫(毛),其主要成分为天然有机高分子材料
B墨的主要材料为煤烟或松烟,其主要成分为碳单质
C宣纸的材料主要成分是天然无机高分子材料
D砚台的主要材料砚石中多含有赤铁矿和褐铁矿,所以砚台多为深褐色或深紫色
2下列化学用语正确的是
ACH 的球棍模型:
4
B乙醛的结构简式:CHCOH
3
CNHCl的电子式:
4
D基态 Cr原子的价层电子轨道表示式:
24
3已知:CH(g)+2KMnO(aq)+3HSO(aq)=2CO(g)+2MnSO(aq)+KSO(aq)+
2 2 4 2 4 2 4 2 4
4HO(l) ΔH=-mkJ·mol-1,设N 为阿伏伽德罗常数的数值。下列说法正确的是
2 A
A01mol·L-1KMnO 溶液中含有N 个K+
4 A
B1molCH 参与反应断裂的π键数目为N
2 2 A
C反应每放出mkJ的热量,生成N 个KSO 分子
A 2 4
D每转移10N 个电子,产生CO 的体积标况下约为448L
A 2
滁州市高三年级化学试卷第1页(共8页)
{#{QQABBQQUogCAApAAARhCAQWwCkCQkBECAAoGgBAMoAABCAFABAA=}#}
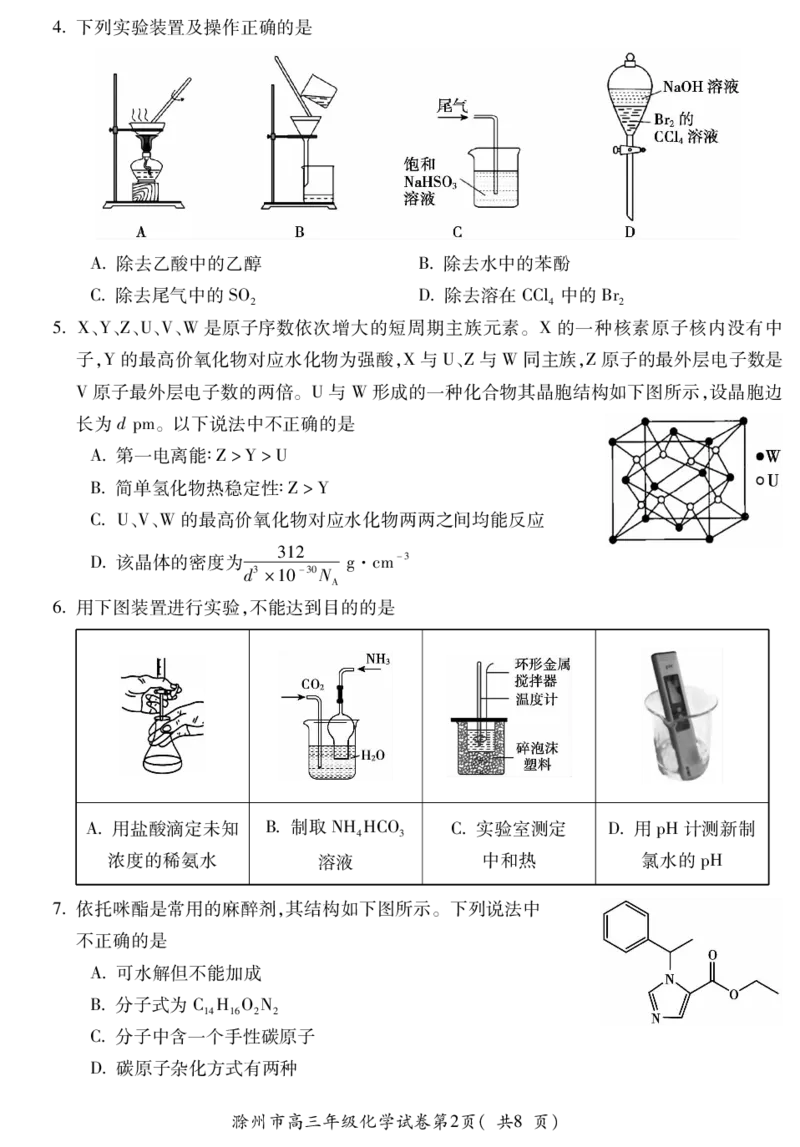
书书书4下列实验装置及操作正确的是
A除去乙酸中的乙醇 B除去水中的苯酚
C除去尾气中的SO D除去溶在CCl中的Br
2 4 2
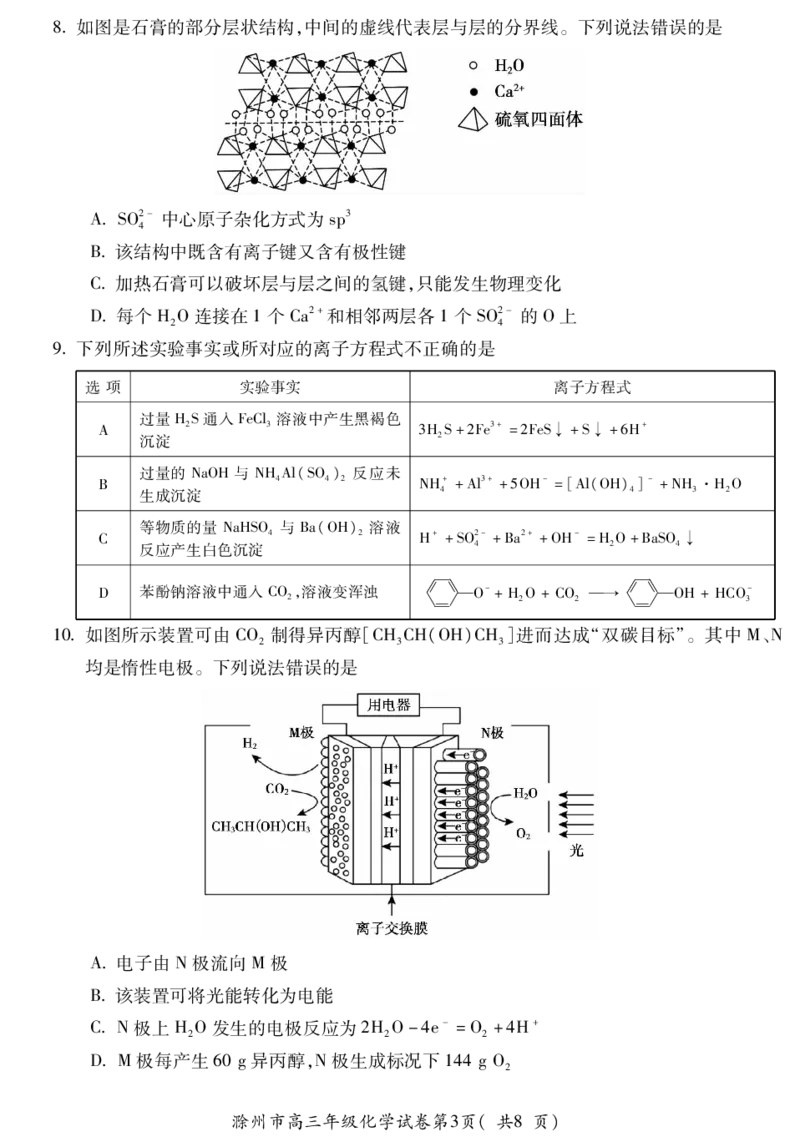
5X、Y、Z、U、V、W是原子序数依次增大的短周期主族元素。X的一种核素原子核内没有中
子,Y的最高价氧化物对应水化物为强酸,X与U、Z与W同主族,Z原子的最外层电子数是
V原子最外层电子数的两倍。U与W形成的一种化合物其晶胞结构如下图所示,设晶胞边
长为dpm。以下说法中不正确的是
A第一电离能∶Z>Y>U
B简单氢化物热稳定性∶Z>Y
CU、V、W的最高价氧化物对应水化物两两之间均能反应
312
D该晶体的密度为 g·cm-3
d3×10-30N
A
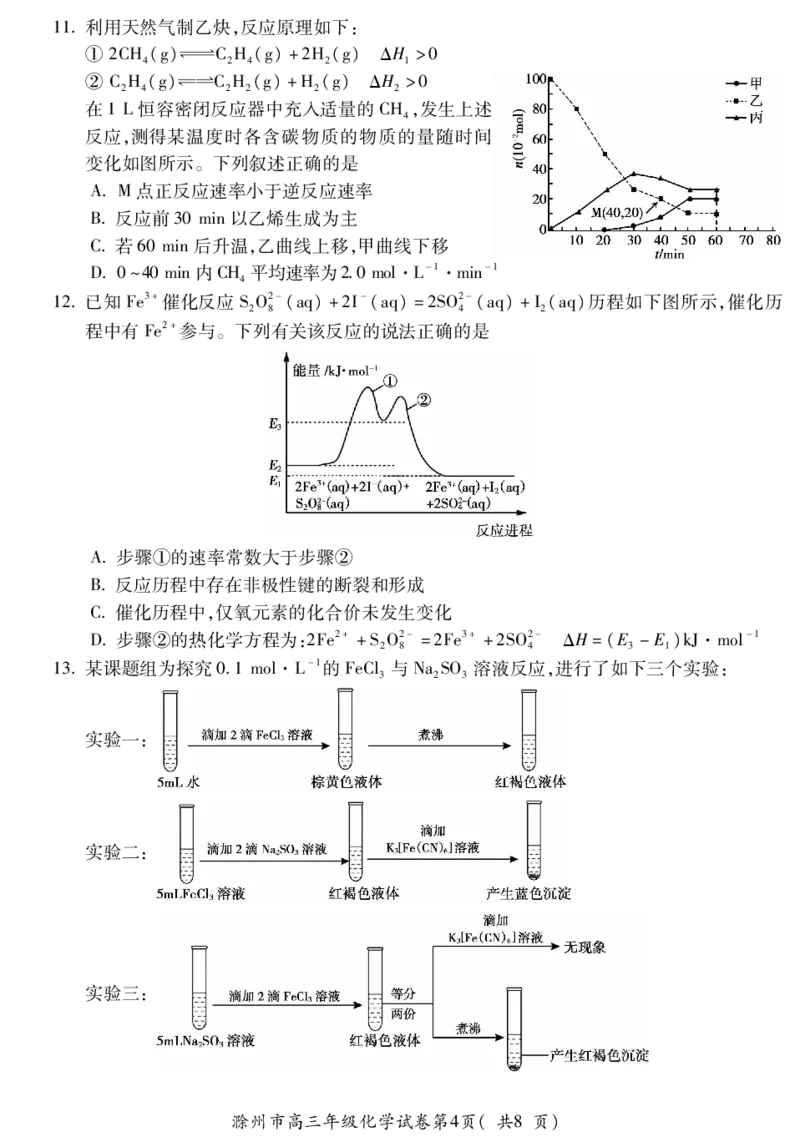
6用下图装置进行实验,不能达到目的的是
A用盐酸滴定未知 B制取NHHCO C实验室测定 D用pH计测新制
4 3
浓度的稀氨水 溶液 中和热 氯水的pH
7依托咪酯是常用的麻醉剂,其结构如下图所示。下列说法中
不正确的是
A可水解但不能加成
B分子式为C H ON
14 16 2 2
C分子中含一个手性碳原子
D碳原子杂化方式有两种
滁州市高三年级化学试卷第2页(共8页)
{#{QQABBQQUogCAApAAARhCAQWwCkCQkBECAAoGgBAMoAABCAFABAA=}#}8如图是石膏的部分层状结构,中间的虚线代表层与层的分界线。下列说法错误的是
ASO2-中心原子杂化方式为sp3
4
B该结构中既含有离子键又含有极性键
C加热石膏可以破坏层与层之间的氢键,只能发生物理变化
D每个HO连接在1个Ca2+和相邻两层各1个SO2-的O上
2 4
9下列所述实验事实或所对应的离子方程式不正确的是
选 项 实验事实 离子方程式
过量HS通入FeCl溶液中产生黑褐色
A 2 3 3HS+2Fe3+=2FeS↓+S↓+6H+
沉淀 2
过量的NaOH与 NHAl(SO) 反应未
B 4 4 2 NH++Al3++5OH-=[Al(OH)]-+NH·HO
生成沉淀 4 4 3 2
等物质的量 NaHSO 与 Ba(OH)溶液
C 4 2 H++SO2-+Ba2++OH-=HO+BaSO↓
反应产生白色沉淀 4 2 4
師師師師 師師師師
D 苯酚钠溶液中通入CO,溶液变浑浊 O-+HO+CO → OH+HCO-
2 2 2 3
帩帩 帩帩
10如图所示装置可由CO 制得异丙醇[CHCH(OH)CH]进而达成“双碳目标”。其中 M、N
2 3 3
均是惰性电极。下列说法错误的是
A电子由N极流向M极
B该装置可将光能转化为电能
CN极上HO发生的电极反应为2HO-4e-=O +4H+
2 2 2
DM极每产生60g异丙醇,N极生成标况下144gO
2
滁州市高三年级化学试卷第3页(共8页)
{#{QQABBQQUogCAApAAARhCAQWwCkCQkBECAAoGgBAMoAABCAFABAA=}#}11利用天然气制乙炔,反应原理如下:
① 2CH(g)幑幐CH(g)+2H(g) ΔH >0
4 2 4 2 1
② CH(g)幑幐CH(g)+H(g) ΔH >0
2 4 2 2 2 2
在1L恒容密闭反应器中充入适量的CH,发生上述
4
反应,测得某温度时各含碳物质的物质的量随时间
变化如图所示。下列叙述正确的是
AM点正反应速率小于逆反应速率
B反应前30min以乙烯生成为主
C若60min后升温,乙曲线上移,甲曲线下移
D0~40min内CH 平均速率为20mol·L-1·min-1
4
12已知Fe3+催化反应SO2-(aq)+2I-(aq)=2SO2-(aq)+I(aq)历程如下图所示,催化历
2 8 4 2
程中有Fe2+参与。下列有关该反应的说法正确的是
A步骤①的速率常数大于步骤②
B反应历程中存在非极性键的断裂和形成
C催化历程中,仅氧元素的化合价未发生变化
D步骤②的热化学方程为:2Fe2++SO2-=2Fe3++2SO2- ΔH=(E-E)kJ·mol-1
2 8 4 3 1
13某课题组为探究01mol·L-1的FeCl与NaSO 溶液反应,进行了如下三个实验:
3 2 3
实验一:
实验二:
实验三:
滁州市高三年级化学试卷第4页(共8页)
{#{QQABBQQUogCAApAAARhCAQWwCkCQkBECAAoGgBAMoAABCAFABAA=}#}分析实验现象,下列说法中不合理的是
A实验一的红褐色液体可产生丁达尔效应
B实验二说明Fe3+既发生了水解反应也被SO2-还原
3
C实验三说明Fe3+发生了水解反应但未被还原
D以上三个实验说明SO2-对Fe3+的水解无影响
3
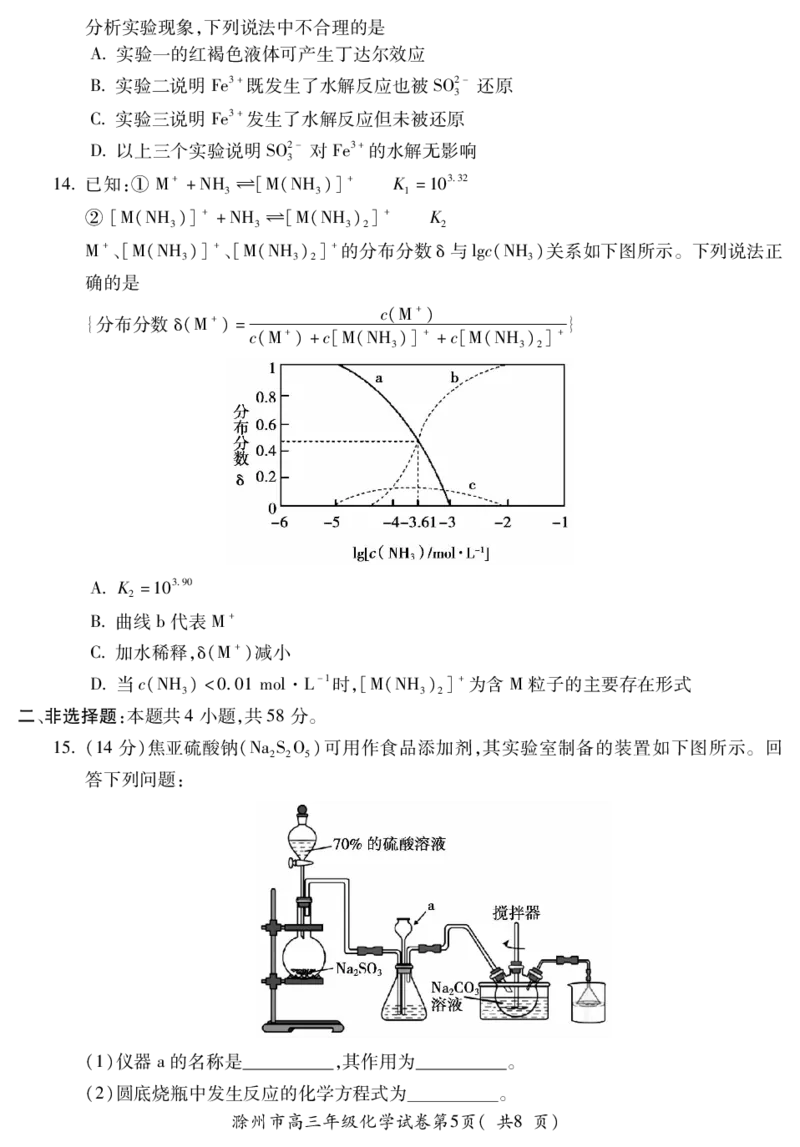
14已知:① M++NH 幑幐[M(NH)]+ K=10332
3 3 1
② [M(NH)]++NH 幑幐[M(NH)]+ K
3 3 3 2 2
M+、[M(NH)]+、[M(NH)]+的分布分数δ与lgc(NH)关系如下图所示。下列说法正
3 3 2 3
确的是
c(M+)
{分布分数δ(M+)= }
c(M+)+c[M(NH)]++c[M(NH)]+
3 3 2
AK=10390
2
B曲线b代表M+
C加水稀释,δ(M+)减小
D当c(NH)<001mol·L-1时,[M(NH)]+为含M粒子的主要存在形式
3 3 2
二、非选择题:本题共4小题,共58分。
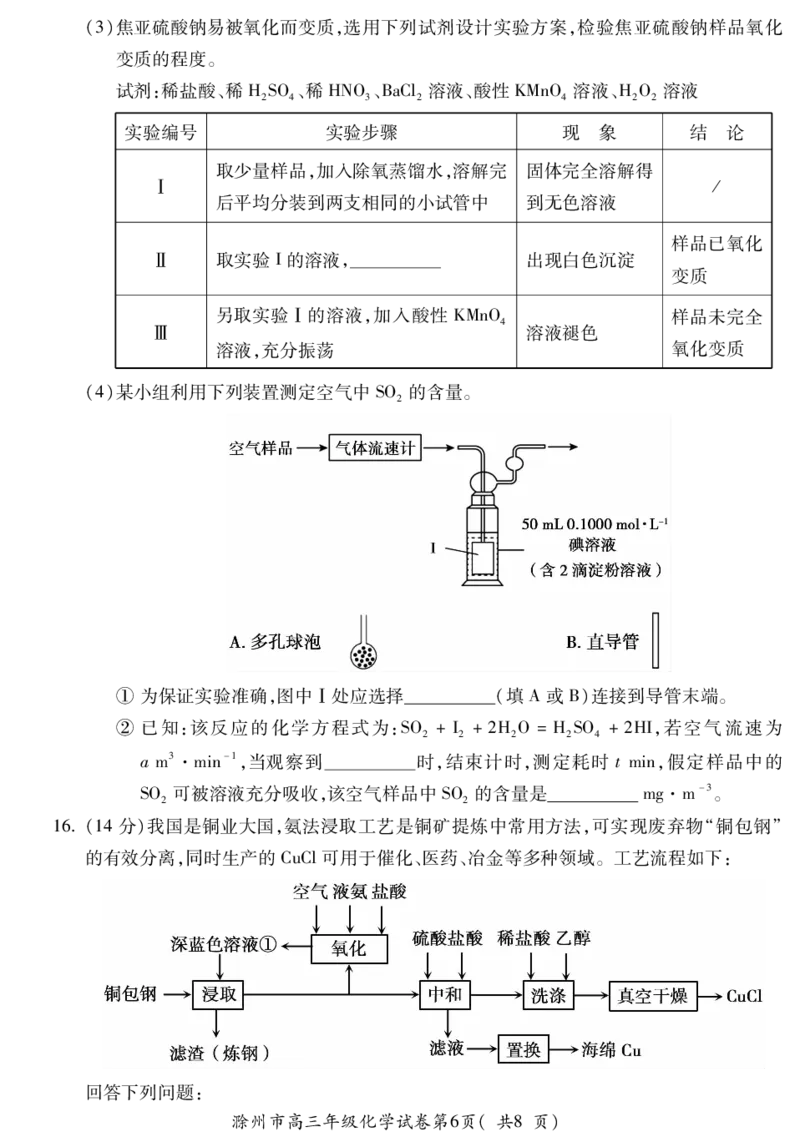
15(14分)焦亚硫酸钠(NaSO)可用作食品添加剂,其实验室制备的装置如下图所示。回
2 2 5
答下列问题:
(1)仪器a的名称是 ,其作用为 。
(2)圆底烧瓶中发生反应的化学方程式为 。
滁州市高三年级化学试卷第5页(共8页)
{#{QQABBQQUogCAApAAARhCAQWwCkCQkBECAAoGgBAMoAABCAFABAA=}#}(3)焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化
变质的程度。
试剂:稀盐酸、稀HSO、稀HNO、BaCl溶液、酸性KMnO 溶液、HO 溶液
2 4 3 2 4 2 2
实验编号 实验步骤 现 象 结 论
取少量样品,加入除氧蒸馏水,溶解完 固体完全溶解得
Ⅰ /
后平均分装到两支相同的小试管中 到无色溶液
样品已氧化
Ⅱ 取实验I的溶液, 出现白色沉淀
变质
另取实验Ⅰ的溶液,加入酸性 KMnO 样品未完全
4
Ⅲ 溶液褪色
溶液,充分振荡 氧化变质
(4)某小组利用下列装置测定空气中SO 的含量。
2
① 为保证实验准确,图中Ⅰ处应选择 (填A或B)连接到导管末端。
② 已知:该反应的化学方程式为:SO +I+2HO=HSO +2HI,若空气流速为
2 2 2 2 4
am3·min-1,当观察到 时,结束计时,测定耗时 tmin,假定样品中的
SO 可被溶液充分吸收,该空气样品中SO 的含量是 mg·m-3。
2 2
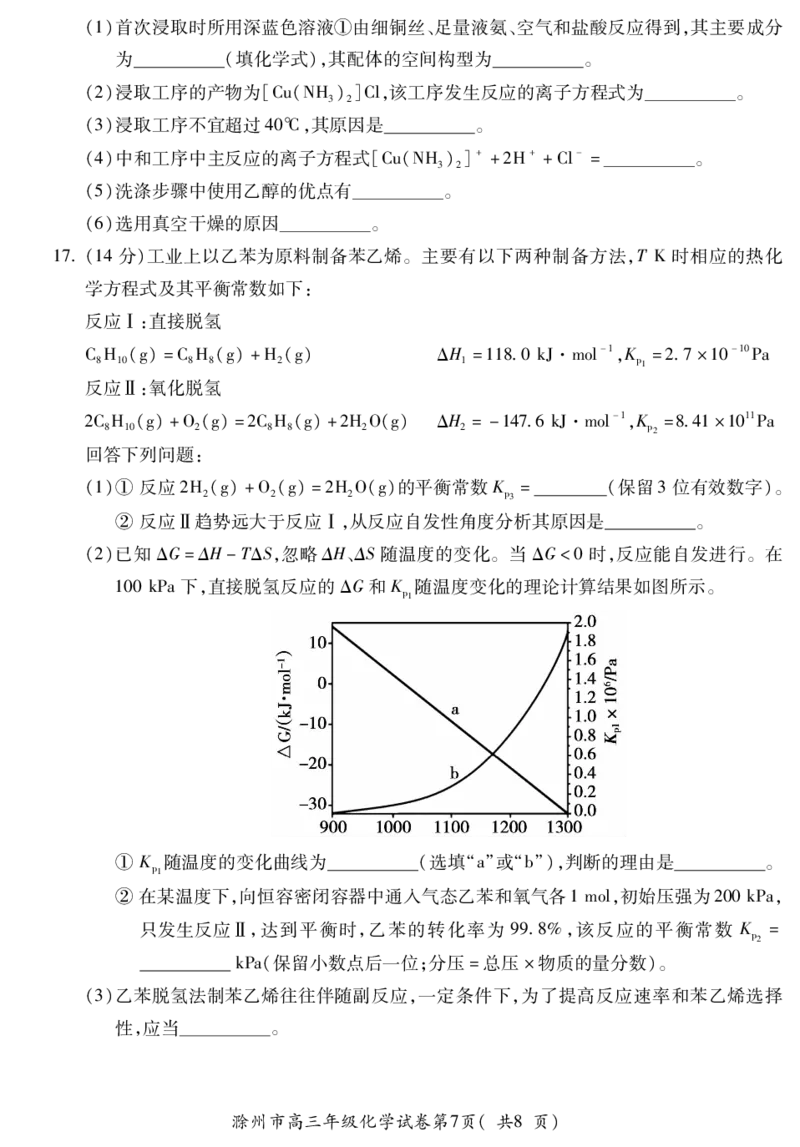
16(14分)我国是铜业大国,氨法浸取工艺是铜矿提炼中常用方法,可实现废弃物“铜包钢”
的有效分离,同时生产的CuCl可用于催化、医药、冶金等多种领域。工艺流程如下:
回答下列问题:
滁州市高三年级化学试卷第6页(共8页)
{#{QQABBQQUogCAApAAARhCAQWwCkCQkBECAAoGgBAMoAABCAFABAA=}#}(1)首次浸取时所用深蓝色溶液①由细铜丝、足量液氨、空气和盐酸反应得到,其主要成分
为 (填化学式),其配体的空间构型为 。
(2)浸取工序的产物为[Cu(NH)]Cl,该工序发生反应的离子方程式为 。
3 2
(3)浸取工序不宜超过40℃,其原因是 。
(4)中和工序中主反应的离子方程式[Cu(NH)]++2H++Cl-= 。
3 2
(5)洗涤步骤中使用乙醇的优点有 。
(6)选用真空干燥的原因 。
17(14分)工业上以乙苯为原料制备苯乙烯。主要有以下两种制备方法,TK时相应的热化
学方程式及其平衡常数如下:
反应Ⅰ:直接脱氢
CH (g)=CH(g)+H(g) ΔH =1180kJ·mol-1,K =27×10-10Pa
8 10 8 8 2 1 p1
反应Ⅱ:氧化脱氢
2CH (g)+O(g)=2CH(g)+2HO(g) ΔH =-1476kJ·mol-1,K =841×1011Pa
8 10 2 8 8 2 2 p2
回答下列问题:
(1)① 反应2H(g)+O(g)=2HO(g)的平衡常数K = (保留3位有效数字)。
2 2 2 p3
② 反应Ⅱ趋势远大于反应Ⅰ,从反应自发性角度分析其原因是 。
(2)已知ΔG=ΔH-TΔS,忽略ΔH、ΔS随温度的变化。当 ΔG<0时,反应能自发进行。在
100kPa下,直接脱氢反应的ΔG和K 随温度变化的理论计算结果如图所示。
p1
① K 随温度的变化曲线为 (选填“a”或“b”),判断的理由是 。
p1
② 在某温度下,向恒容密闭容器中通入气态乙苯和氧气各1mol,初始压强为200kPa,
只发生反应Ⅱ,达到平衡时,乙苯的转化率为 998%,该反应的平衡常数 K =
p2
kPa(保留小数点后一位;分压=总压×物质的量分数)。
(3)乙苯脱氢法制苯乙烯往往伴随副反应,一定条件下,为了提高反应速率和苯乙烯选择
性,应当 。
滁州市高三年级化学试卷第7页(共8页)
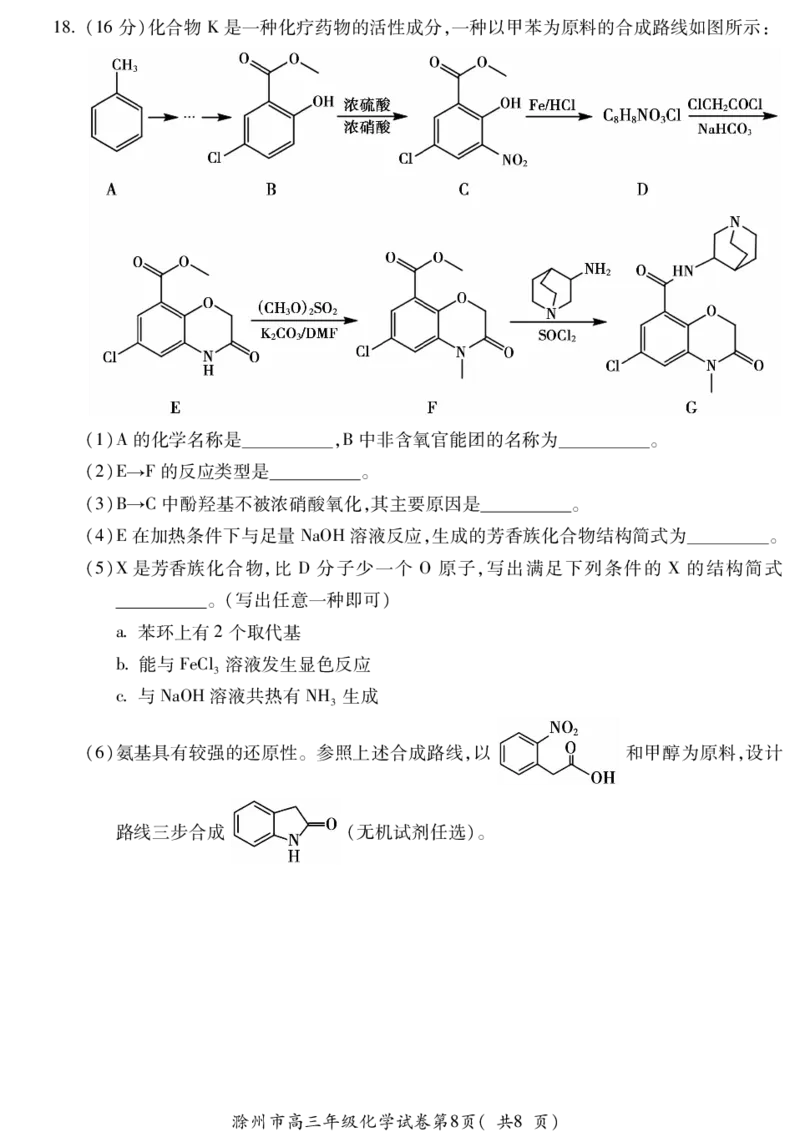
{#{QQABBQQUogCAApAAARhCAQWwCkCQkBECAAoGgBAMoAABCAFABAA=}#}18(16分)化合物K是一种化疗药物的活性成分,一种以甲苯为原料的合成路线如图所示:
(1)A的化学名称是 ,B中非含氧官能团的名称为 。
(2)E→F的反应类型是 。
(3)B→C中酚羟基不被浓硝酸氧化,其主要原因是 。
(4)E在加热条件下与足量NaOH溶液反应,生成的芳香族化合物结构简式为 。
(5)X是芳香族化合物,比 D分子少一个 O原子,写出满足下列条件的 X的结构简式
。(写出任意一种即可)
a苯环上有2个取代基
b能与FeCl溶液发生显色反应
3
c与NaOH溶液共热有NH 生成
3
(6)氨基具有较强的还原性。参照上述合成路线,以 和甲醇为原料,设计
路线三步合成 (无机试剂任选)。
滁州市高三年级化学试卷第8页(共8页)
{#{QQABBQQUogCAApAAARhCAQWwCkCQkBECAAoGgBAMoAABCAFABAA=}#}