文档内容
A绝密★启用并使用完毕前
山东省实验中学 2025 届高三第一次诊断考试
化 学 试 题
2024.10
注意事项:
1.答题前,考生先将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,用0.5mm黑色签字笔
将答案写在答题卡上,写在本试卷上无效。
可能用到的相对原子质量: Cl35.5 Co59 Cu64 I127 Cs133 Pb207
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.“新质生产力”的概念中,“新”的核心在于科技创新。下列有关说法正确的是
A.我国研发的小型核反应堆“玲龙一号”以235U为核燃料,235U与238U化学性质不同
B.废弃的秸秆通过发酵获得生物质燃料乙醇
C.“长征一号”运载火箭使用的是液氧煤油发动机,煤油主要由煤的干馏获得
D.利用CO 合成高级脂肪酸的甘油酯,实现无机小分子向有机高分子的转化
2
2.下列物质性质与用途具有对应关系的是
A.石墨能导电,可用作润滑剂 B.二氧化硅熔点高,可用于制备光导纤维
C.青铜比纯铜熔点低、硬度大,古代用青铜铸剑D.葡萄糖具有氧化性,可用于制葡萄糖酸钙
3.实验室安全至关重要,下列实验室事故处理方法正确的是
A.电器起火,先切断电源,再用二氧化碳灭火器灭火
B.皮肤溅上苯酚,立即用水冲洗,然后再涂上稀NaOH溶液
C.汞大量洒落,必须尽可能收集,并深埋处理
D.眼睛溅进酸液,先用大量水冲洗,再用饱和碳酸钠溶液冲洗
4.下列有关化学用语或表述正确的是
A.NH 和CO 都能作制冷剂是因为它们有相同类型的分子间作用力
3 2
B.NH ClO 中的阴、阳离子有相同的VSEPR模型和空间结构
4 4
C.在C 、石墨、金刚石中,碳原子杂化方式分别为sp、sp2和sp3三种杂化
60
D.NaCl溶液中的水合离子:
5.CO 的捕集和转化对实现双碳战略目标具有十分重要的意义,单乙醇胺(HOCH CH NH )
2 2 2 2
高三化学试题 第1页(共10页)
{#{QQABSQwEggAAAJJAAAhCQwWICgOQkACACQgGhAAEsAAACQFABCA=}#}可用作工业CO 的捕集剂。以CO 为原料可制备一系列化合物,如CH OH、HCHO、HCOOH、
2 2 3
葡萄糖等,可有效降低大气中的CO 浓度,还能缓解化石燃料资源短缺等问题。下列有关说
2
法正确的是
A.键角∠O—C—H:CH OH>HCHO B.酸性:HCOOH<CH COOH
3 3
C.单乙醇胺可捕集CO 因其含有的氨基呈碱性 D.HCHO分子间存在氢键
2
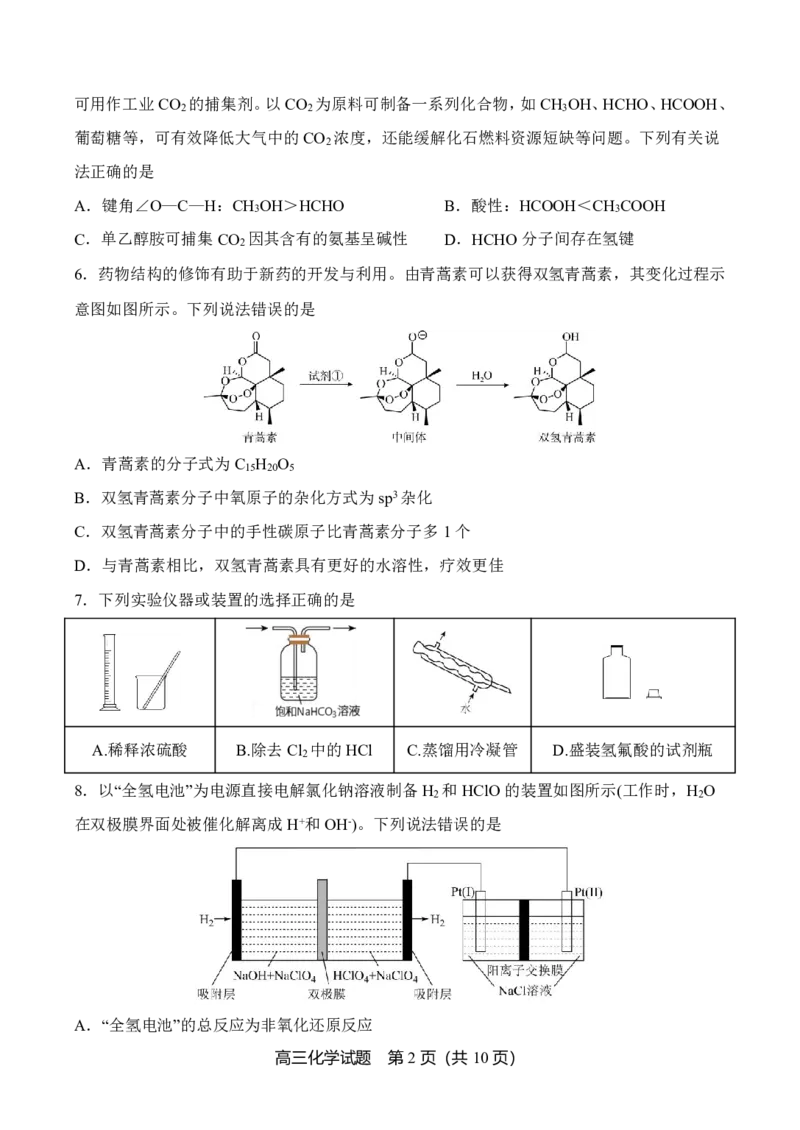
6.药物结构的修饰有助于新药的开发与利用。由青蒿素可以获得双氢青蒿素,其变化过程示
意图如图所示。下列说法错误的是
A.青蒿素的分子式为C H O
15 20 5
B.双氢青蒿素分子中氧原子的杂化方式为sp3杂化
C.双氢青蒿素分子中的手性碳原子比青蒿素分子多1个
D.与青蒿素相比,双氢青蒿素具有更好的水溶性,疗效更佳
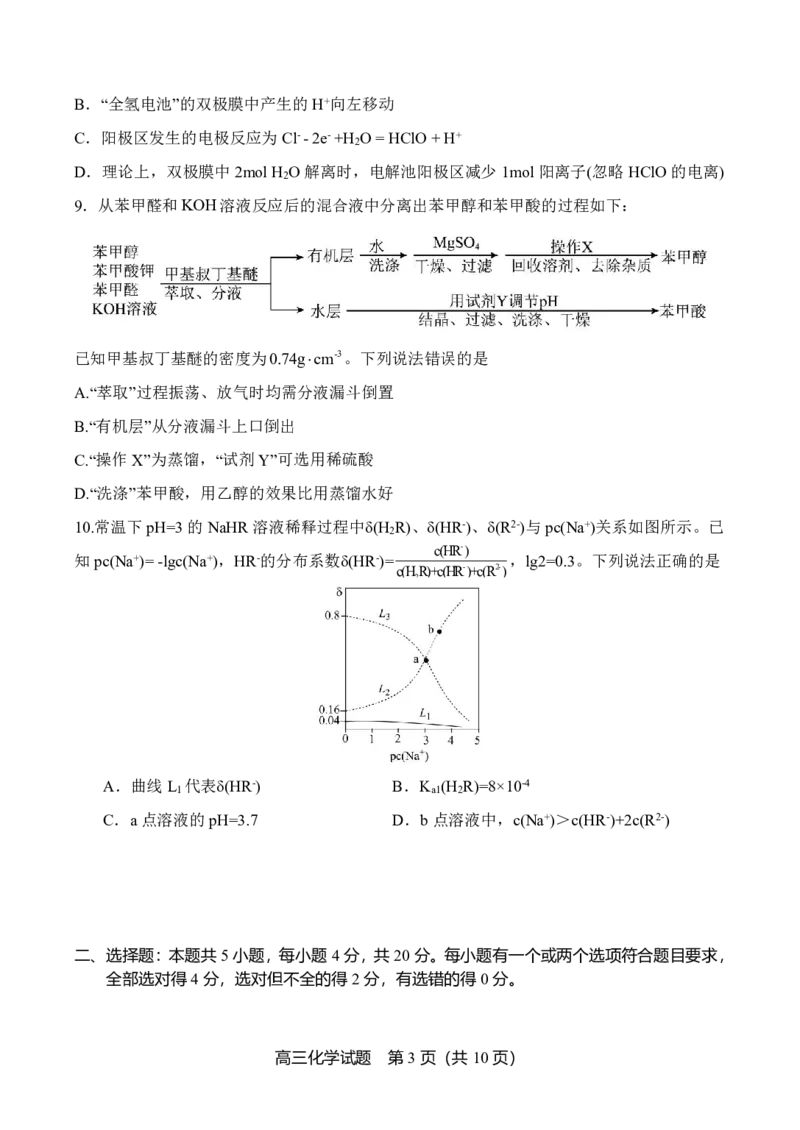
7.下列实验仪器或装置的选择正确的是
A.稀释浓硫酸 B.除去Cl 中的HCl C.蒸馏用冷凝管 D.盛装氢氟酸的试剂瓶
2
8.以“全氢电池”为电源直接电解氯化钠溶液制备H 和HClO的装置如图所示(工作时,H O
2 2
在双极膜界面处被催化解离成H+和OH-)。下列说法错误的是
A.“全氢电池”的总反应为非氧化还原反应
高三化学试题 第2页(共10页)
{#{QQABSQwEggAAAJJAAAhCQwWICgOQkACACQgGhAAEsAAACQFABCA=}#}B.“全氢电池”的双极膜中产生的H+向左移动
C.阳极区发生的电极反应为Cl--2e-+H O=HClO+H+
2
D.理论上,双极膜中2molH O解离时,电解池阳极区减少1mol阳离子(忽略HClO的电离)
2
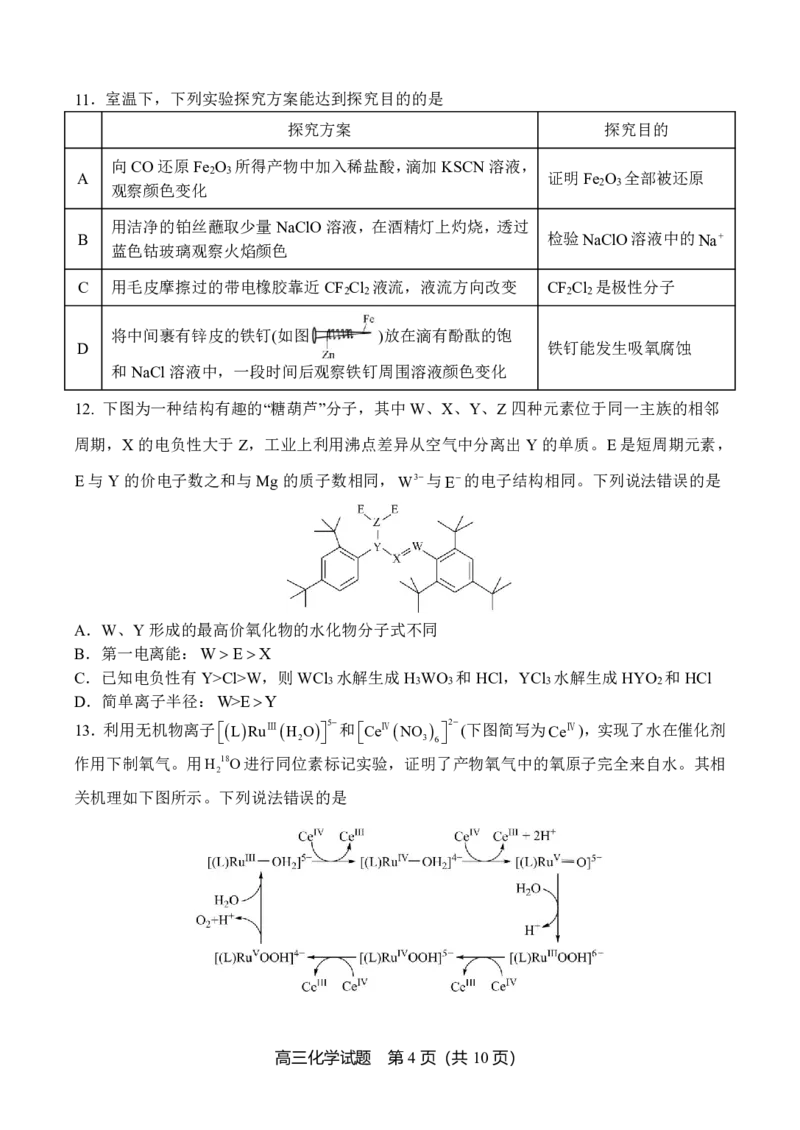
9.从苯甲醛和KOH溶液反应后的混合液中分离出苯甲醇和苯甲酸的过程如下:
已知甲基叔丁基醚的密度为0.74gcm-3。下列说法错误的是
A.“萃取”过程振荡、放气时均需分液漏斗倒置
B.“有机层”从分液漏斗上口倒出
C.“操作X”为蒸馏,“试剂Y”可选用稀硫酸
D.“洗涤”苯甲酸,用乙醇的效果比用蒸馏水好
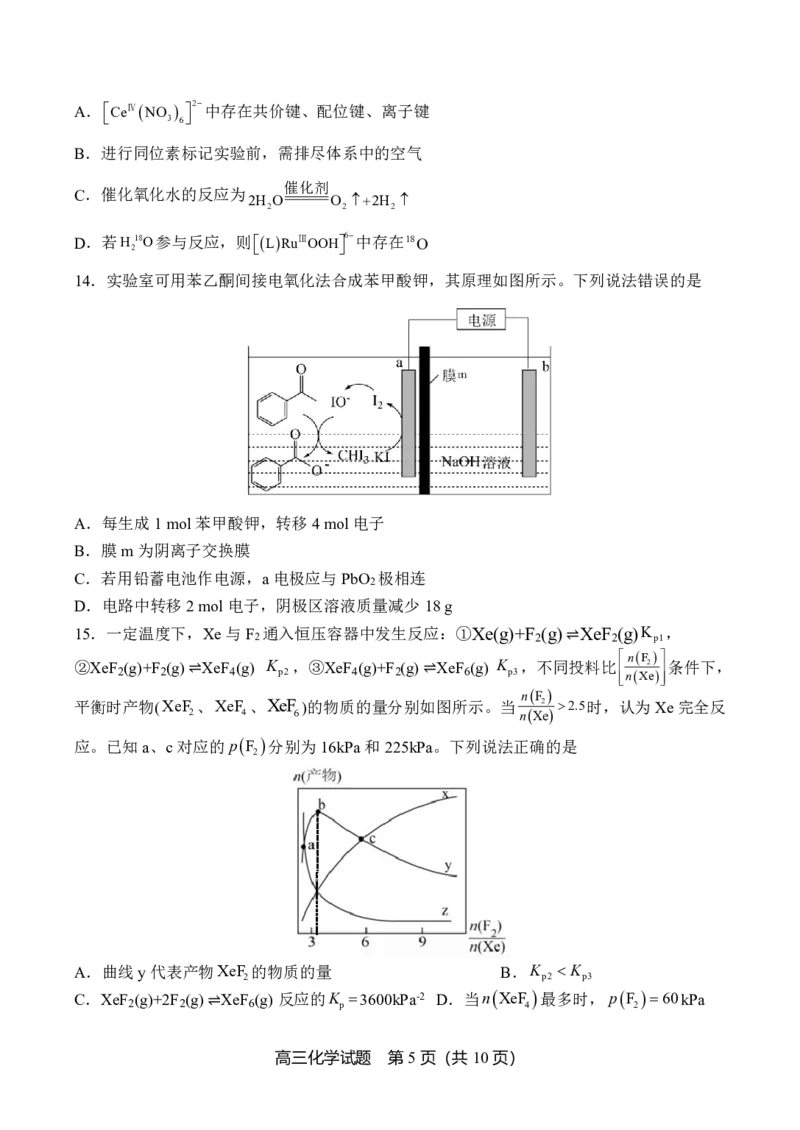
10.常温下pH=3的NaHR溶液稀释过程中δ(H R)、δ(HR-)、δ(R2-)与pc(Na+)关系如图所示。已
2
c(HR-)
知pc(Na+)=-lgc(Na+),HR-的分布系数δ(HR-)= ,lg2=0.3。下列说法正确的是
c(HR)+c(HR-)+c(R2-)
2
A.曲线L 代表δ(HR-) B.K (H R)=8×10-4
1 a1 2
C.a点溶液的pH=3.7 D.b点溶液中,c(Na+)>c(HR-)+2c(R2-)
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,
全部选对得4分,选对但不全的得2分,有选错的得0分。
高三化学试题 第3页(共10页)
{#{QQABSQwEggAAAJJAAAhCQwWICgOQkACACQgGhAAEsAAACQFABCA=}#}11.室温下,下列实验探究方案能达到探究目的的是
探究方案 探究目的
向CO还原Fe O 所得产物中加入稀盐酸,滴加KSCN溶液,
A 2 3 证明Fe O 全部被还原
观察颜色变化 2 3
用洁净的铂丝蘸取少量NaClO溶液,在酒精灯上灼烧,透过
B 检验NaClO溶液中的Na
蓝色钴玻璃观察火焰颜色
C 用毛皮摩擦过的带电橡胶靠近CF Cl 液流,液流方向改变 CF Cl 是极性分子
2 2 2 2
将中间裹有锌皮的铁钉(如图 )放在滴有酚酞的饱
D 铁钉能发生吸氧腐蚀
和NaCl溶液中,一段时间后观察铁钉周围溶液颜色变化
12. 下图为一种结构有趣的“糖葫芦”分子,其中W、X、Y、Z四种元素位于同一主族的相邻
周期,X的电负性大于Z,工业上利用沸点差异从空气中分离出Y的单质。E是短周期元素,
E与Y的价电子数之和与Mg的质子数相同,W3与E的电子结构相同。下列说法错误的是
A.W、Y形成的最高价氧化物的水化物分子式不同
B.第一电离能:WEX
C.已知电负性有Y>Cl>W,则WCl 水解生成H WO 和HCl,YCl 水解生成HYO 和HCl
3 3 3 3 2
D.简单离子半径:W>EY
13.利用无机物离子
LRuⅢH
2
O
5和
CeⅣNO
3
6
2 (下图简写为CeⅣ),实现了水在催化剂
作用下制氧气。用H 18O进行同位素标记实验,证明了产物氧气中的氧原子完全来自水。其相
2
关机理如下图所示。下列说法错误的是
高三化学试题 第4页(共10页)
{#{QQABSQwEggAAAJJAAAhCQwWICgOQkACACQgGhAAEsAAACQFABCA=}#}A.CeⅣNO 2中存在共价键、配位键、离子键
3 6
B.进行同位素标记实验前,需排尽体系中的空气
催化剂
C.催化氧化水的反应为
2H O O 2H
2 2 2
D.若H
2
18O参与反应,则
LRuⅢOOH
6中存在18O
14.实验室可用苯乙酮间接电氧化法合成苯甲酸钾,其原理如图所示。下列说法错误的是
A.每生成1mol苯甲酸钾,转移4mol电子
B.膜m为阴离子交换膜
C.若用铅蓄电池作电源,a电极应与PbO 极相连
2
D.电路中转移2mol电子,阴极区溶液质量减少18g
15.一定温度下,Xe与F 通入恒压容器中发生反应:①Xe(g)+F (g) XeF (g)K ,
2 2 2 p1
nF
②XeF 2 (g)+F 2 (g) XeF 4 (g) K p2 ,③XeF 4 (g)+F 2 (g) XeF 6 (g) K p3 ,不同⇌投料比 nX 2 e 条件下,
nF
平衡时产物(XeF⇌、XeF 、XeF )的物质的量分别如⇌图所示。当 2 2.5时,认为Xe完全反
2 4 6 nXe
应。已知a、c对应的pF 分别为16kPa和225kPa。下列说法正确的是
2
A.曲线y代表产物XeF 的物质的量 B.K K
2 p2 p3
C.XeF (g)+2F (g) XeF (g) 反应的K 13600kPa-2 D.当nXeF 最多时, pF 60kPa
2 2 6 p 4 2
⇌
高三化学试题 第5页(共10页)
{#{QQABSQwEggAAAJJAAAhCQwWICgOQkACACQgGhAAEsAAACQFABCA=}#}三、非选择题:本题共5小题,共60分。
16.(12分)卤族元素的单质和化合物在生产生活中有重要的用途。请回答:
(1)卤族元素位于元素周期表的 区,溴原子的M能层电子排布式为 。
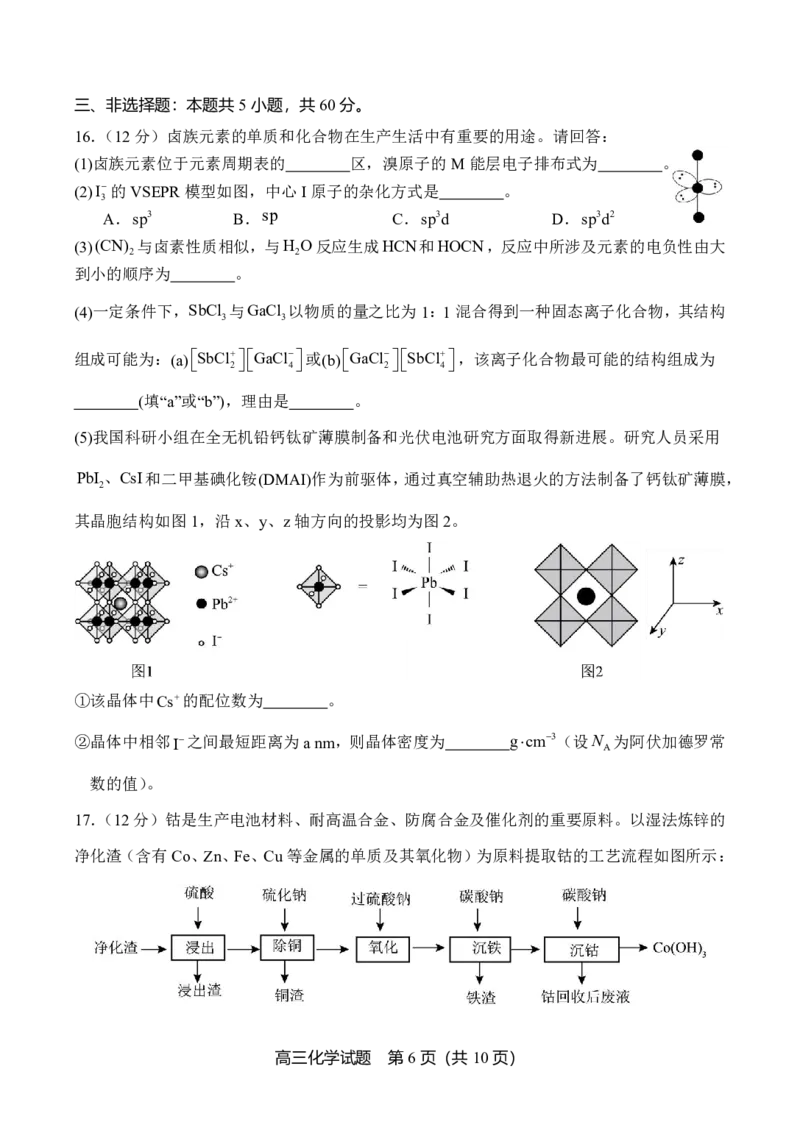
(2)I的VSEPR模型如图,中心I原子的杂化方式是 。
3
A.sp3 B.sp C.sp3d D.sp3d2
(3)(CN) 与卤素性质相似,与H O反应生成HCN和HOCN,反应中所涉及元素的电负性由大
2 2
到小的顺序为 。
(4)一定条件下,SbCl 与GaCl 以物质的量之比为1:1混合得到一种固态离子化合物,其结构
3 3
组成可能为:(a)
SbCl
2
GaCl
4
或(b)
GaCl
2
SbCl
4
,该离子化合物最可能的结构组成为
(填“a”或“b”),理由是 。
(5)我国科研小组在全无机铅钙钛矿薄膜制备和光伏电池研究方面取得新进展。研究人员采用
PbI、CsI和二甲基碘化铵(DMAI)作为前驱体,通过真空辅助热退火的方法制备了钙钛矿薄膜,
2
其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
①该晶体中Cs的配位数为 。
②晶体中相邻I之间最短距离为anm,则晶体密度为 ρgcm3(设N 为阿伏加德罗常
A
数的值)。
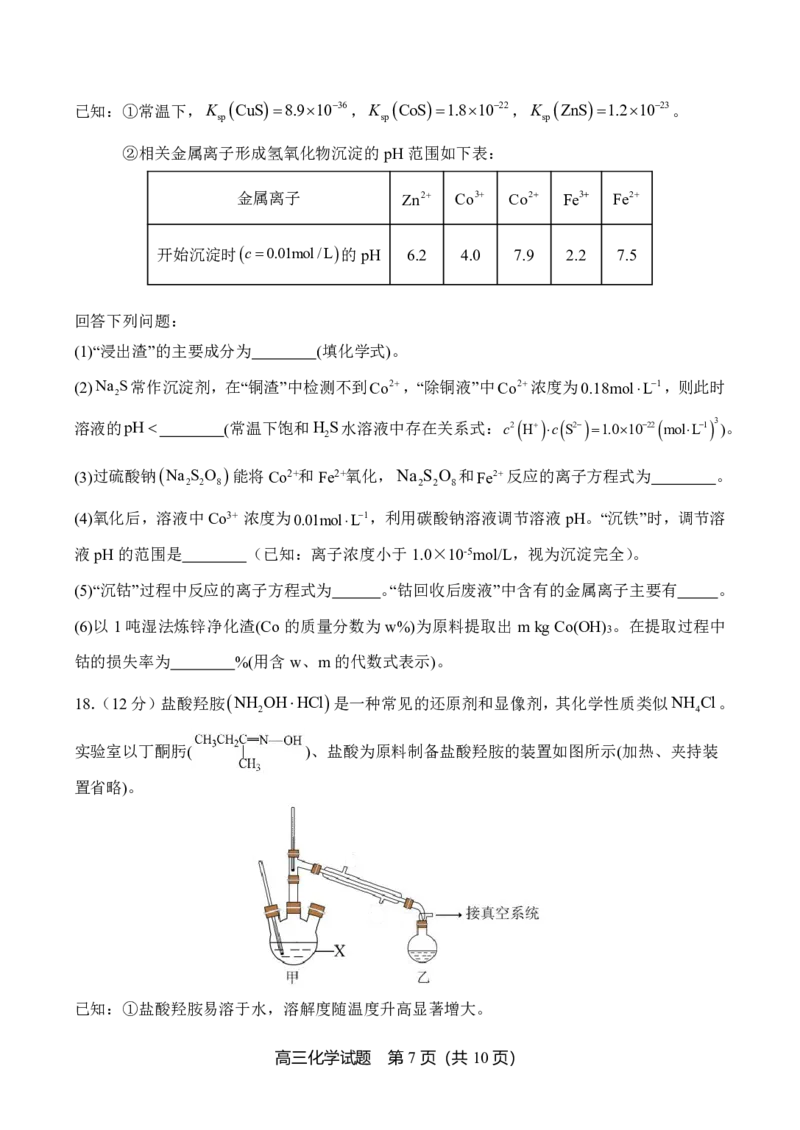
17.(12分)钴是生产电池材料、耐高温合金、防腐合金及催化剂的重要原料。以湿法炼锌的
净化渣(含有Co、Zn、Fe、Cu等金属的单质及其氧化物)为原料提取钴的工艺流程如图所示:
高三化学试题 第6页(共10页)
{#{QQABSQwEggAAAJJAAAhCQwWICgOQkACACQgGhAAEsAAACQFABCA=}#}已知:①常温下,K CuS8.91036,K CoS1.81022,K ZnS1.21023。
sp sp sp
②相关金属离子形成氢氧化物沉淀的pH范围如下表:
金属离子 Zn2 Co3 Co2 Fe3 Fe2
开始沉淀时c0.01mol/L的pH
6.2 4.0 7.9 2.2 7.5
回答下列问题:
(1)“浸出渣”的主要成分为 (填化学式)。
(2)Na S常作沉淀剂,在“铜渣”中检测不到Co2,“除铜液”中Co2浓度为0.18molL1,则此时
2
溶液的pH (常温下饱和H S水溶液中存在关系式:c2 H c S2 1.01022 molL13 )。
2
(3)过硫酸钠Na S O 能将Co2+和Fe2+氧化,Na S O 和Fe2反应的离子方程式为 。
2 2 8 2 2 8
(4)氧化后,溶液中Co3+ 浓度为0.01molL1,利用碳酸钠溶液调节溶液pH。“沉铁”时,调节溶
液pH的范围是 (已知:离子浓度小于1.0×10-5mol/L,视为沉淀完全)。
(5)“沉钴”过程中反应的离子方程式为 。“钴回收后废液”中含有的金属离子主要有 。
(6)以1吨湿法炼锌净化渣(Co的质量分数为w%)为原料提取出mkgCo(OH) 。在提取过程中
3
钴的损失率为 %(用含w、m的代数式表示)。
18.(12分)盐酸羟胺NH OHHCl是一种常见的还原剂和显像剂,其化学性质类似NH Cl。
2 4
实验室以丁酮肟( )、盐酸为原料制备盐酸羟胺的装置如图所示(加热、夹持装
置省略)。
已知:①盐酸羟胺易溶于水,溶解度随温度升高显著增大。
高三化学试题 第7页(共10页)
{#{QQABSQwEggAAAJJAAAhCQwWICgOQkACACQgGhAAEsAAACQFABCA=}#}②盐酸羟胺的熔点为152℃,丁酮肟的沸点为153℃,丁酮的沸点为79.6℃。
回答下列问题:
(1)NH OHHCl中N元素的化合价是 ;仪器X的名称是 。
2
(2)甲装置中生成盐酸羟胺和丁酮的化学反应方程式为 ;乙装置接真空系统,采用减
压蒸馏,其目的是 。
(3)从反应后的溶液中获取盐酸羟胺的方法为 ,洗涤干燥。
(4)测定产品纯度。
称取mg盐酸羟胺产品,配制成100mL溶液,量取20.00mL于锥形瓶中,加入适量稀硫酸酸化,
再加入过量硫酸铁溶液,发生反应:2NH OH 4Fe3 4Fe2 N O6H H O ,充分反
3 2 2
应后,用cmolL1K Cr O 标准溶液滴定Fe2(滴定过程中CrO2转化为Cr3,Cl不反应),
2 2 7 2 7
滴定达终点时消耗K CrO 溶液VmL。样品中NH OHHCl的质量分数为 (用含c、
2 2 7 2
m、V的代数式表示)。若滴定前平视读数,滴定终点时仰视读数,则测定结果 (填“偏
高”“偏低”或“无影响”)。
(5)电化学法制备盐酸羟胺:
工业上主要向两侧电极分别通入NO和H ,以盐酸为电解质来进行制备,其装置如图所示:
2
①电池工作时,Pt电极为 极;
②一段时间后,正极区的pH与反应前相比 (填“增大”“减小”或“不变”)(不考虑溶液体
积的变化)。
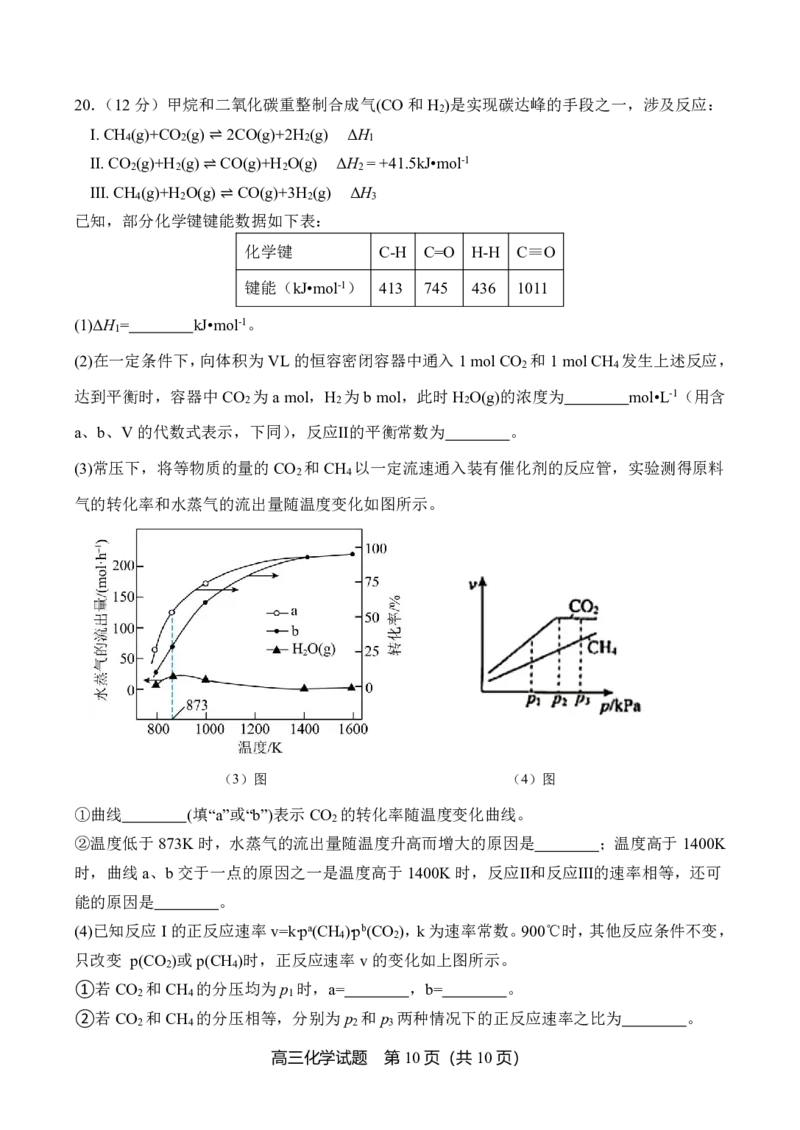
19.(12分)有机物K是一种可用于肺癌治疗的药物。其一条合成路线如下:
高三化学试题 第8页(共10页)
{#{QQABSQwEggAAAJJAAAhCQwWICgOQkACACQgGhAAEsAAACQFABCA=}#}已知:i. 酸酐可与酚羟基反应生成酚酯
iⅰ. (R为烃基,下同)
iⅱ.RCOOHSOCl2RCOCl。
回答下列问题:
(1)A的结构简式为 ,J中含氧官能团名称为 。
(2)E与NaOH溶液反应的化学方程式为 。
(3)反应①→⑤中属于取代反应的有 个。
(4)设计A→B、C→D的目的是 。
(5)符合下列条件的F的同分异构体有 种,其中一种结构简式为 。
①属于芳香族化合物,且不含NO 、OO、 ;
2
②核磁共振氢谱显示有4组峰,其峰面积比为2∶3∶3∶4。
(6)参照以上合成路线,以 为原料设计 的合成路线 。
高三化学试题 第9页(共10页)
{#{QQABSQwEggAAAJJAAAhCQwWICgOQkACACQgGhAAEsAAACQFABCA=}#}20.(12分)甲烷和二氧化碳重整制合成气(CO和H )是实现碳达峰的手段之一,涉及反应:
2
I.CH (g)+CO (g) 2CO(g)+2H (g) ΔH
4 2 2 1
Ⅱ.CO (g)+H (g) CO(g)+H O(g) ΔH =+41.5kJ•mol-1
2 2 ⇌ 2 2
Ⅲ.CH (g)+H O(g) CO(g)+3H (g) ΔH
4 2 ⇌ 2 3
已知,部分化学键键能数据如下表:
⇌
化学键 C-H C=O H-H C≡O
键能(kJ•mol-1) 413 745 436 1011
(1)ΔH = kJ•mol-1。
1
(2)在一定条件下,向体积为VL的恒容密闭容器中通入1molCO 和1molCH 发生上述反应,
2 4
达到平衡时,容器中CO 为amol,H 为bmol,此时H O(g)的浓度为 mol•L-1(用含
2 2 2
a、b、V的代数式表示,下同),反应Ⅱ的平衡常数为 。
(3)常压下,将等物质的量的CO 和CH 以一定流速通入装有催化剂的反应管,实验测得原料
2 4
气的转化率和水蒸气的流出量随温度变化如图所示。
(3)图 (4)图
①曲线 (填“a”或“b”)表示CO 的转化率随温度变化曲线。
2
②温度低于873K时,水蒸气的流出量随温度升高而增大的原因是 ;温度高于1400K
时,曲线a、b交于一点的原因之一是温度高于1400K时,反应Ⅱ和反应Ⅲ的速率相等,还可
能的原因是 。
(4)已知反应I的正反应速率v=k·pa(CH )·pb(CO ),k为速率常数。900℃时,其他反应条件不变,
4 2
只改变 p(CO )或p(CH )时,正反应速率v的变化如上图所示。
2 4
①若CO 和CH 的分压均为p 时,a= ,b= 。
2 4 1
②若CO 和CH 的分压相等,分别为p 和p 两种情况下的正反应速率之比为 。
2 4 2 3
高三化学试题 第10页(共10页)
{#{QQABSQwEggAAAJJAAAhCQwWICgOQkACACQgGhAAEsAAACQFABCA=}#}