文档内容
湘 豫 名 校 联 考
#$#%年%月高三第一次模拟考试
化学参考答案
题号 & ’ ( !$ !! !# !%
答案 ) * + , + * )
一!选择题"本题共&小题#每题-分#共"#分$在每小题给出的四个选项中#只有
一项是符合题目要求的$
&.)!%解析&!裘"也就是皮衣#其主要成分是蛋白质#,项错误$二氧化硫可以漂白干果#还可作为葡萄酒的抗
氧化剂和杀菌剂#*项错误$!绿宝石"的主要成分属于硅酸盐#!孔雀石"的主要成分是碱式碳酸铜#+项错误$
焰色反应是某些金属元素的特征性质#不同金属元素的焰色不同#!火树银花"中的焰火颜色实质上是金属元
素焰色的体现#)项正确%
’.*!%解析&化合物!分子中含有羟基和醚键#,项正确$化合物!不含不饱和键#不能发生加成反应#*项错
误$化合物#是#/甲基丙酸#与乙酸结构相似#分子组成相差#个+0 #故二者互为同系物#+项正确$化合
#
物#分子中含有次甲基结构#次甲基碳原子及其所连的三个碳原子不在同一平面#所以所有碳原子不可能共
平面#)项正确%
(.+!%解析&物质!和#发生加成反应生成物质%#只生成一种产物#原子利用率为!$$1#是一种最理想的绿
色化学工艺#,项正确$观察图示#23&+4)’*5虽在起始参与反应#但最终又生成23&+4)’*5#本身的
# " # "
质量和化学性质在反应前后没有发生改变#为总反应的催化剂#*项正确$题述反应历程中#23原子形成的
化学键数目发生了变化#+项错误$有机物%中苯基连接的碳原子是手性碳原子#其是手性分子#)项正确%
!$.,!%解析&向56*7
#
溶液中加入少量新制氯水#首先氧化亚铁离子#是因为56#8的还原性强于*7/#,项正
确$ 和/+04均能被酸性9:;4 溶液氧化而使其褪色#*项错误$银镜反应需要在碱性环境中进
"
行#该操作是酸性环境#操作中未出现银镜#不能说明蔗糖未水解#+项错误$将乙醇和浓硫酸混合#迅速加
热到!&$<#乙醇发生消去反应#同时该温度下浓硫酸也会使乙醇脱水碳化(生成的碳与浓硫酸反应#产生
的二氧化硫气体也能使溴水褪色#)项错误%
!!.+!%解析&由=元素最高正价和最低负价之和为##可知=为>元素$短周期主族元素?(@(A原子序数依
次增大#?和 A同主族#由该物质结构图知#A可形成-对共用电子对#?可形成#对共用电子对#则?为
4元素(A为B元素$又因为在短周期元素中@原子的原子半径最大#故@为>C元素%=(?(@的简单离子
分别为>%/(4#/(>C8#三种离子排布相同#核电荷数>"4">C#则离子半径>%/# 4#/# >C8#B#/有三
个电子层#其离子半径最大#,项错误$>元素最高价氧化物对应的水化物0>4 为强酸#*项错误$>C4
% # #
可用于呼吸面具供氧剂#+项正确$由图可知#>C(B和4形成的化合物为>CB4#其与稀硫酸反应)>CB4
# # % # # %
80
#
B4 "$$$>C
#
B4
"
80
#
48B4 #%8B&#产生气泡和淡黄色沉淀#)项错误%
!#.*!%解析&该电池为 :D/EF4
#
电池#由图可知#原电池工作时负极发生反应 :D/#6/8#40/$$$
:D&40’
#
#消耗40/#>C8向正极移动#即向*区移动#则 : 是阳离子交换膜$正极发生反应EF4
#
8
#6/8"088B4#
"
/ $$$EFB4
"
8#0
#
4#正极消耗08和B4#
"
/#同时B4#
"
/向负极移动#>是阴离子交换膜#
则,区为>C40溶液#*区为>CB4 溶液#+区为0B4 溶液%根据上述分析可知#,区中>C8经阳离子
# " # "
交换膜:向*区移动#同时+区中B4#/经阴离子交换膜>移向*区#,项正确$*区域>C8与B4#/ 不断
" "
进入#所以*区域的电解质>C
#
B4
"
浓度逐渐增大#*项错误$放电时#原电池工作时负极&:D极’发生反应
:D/#6/8#40/$$$:D&40’
#
#+项正确$消耗#."D:D时#转移电子$.#GHI#根据+区电极反应式
EF4
#
8#6/ 8"08 8B4#
"
/ $$$EFB4
"
8#0
#
4 知#+区消耗 $."GHI08($.!GHIB4#
"
/#同时有
$.!GHIB4#/移向*区#则相当于减少$.#GHI0B4 #同时生成$.#GHI04#则+区实际减少的质量为
" # " #
$.#GHIJ(’D*GHI/!/$.#GHIJ!’D*GHI/!K!-.$D#)项正确%
化学参考答案!第!!!!!页!共"页"
书书书!%.)!%解析&根据第一步电离常数大于第二步电离常数#!代表0
#
,#"代表0,/##代表,#/%根据图像
可知#! K!$/#.’L#! K!$/L.--%"K#$.$对应的溶质是>C0,#根据电离常数知#0,/的电离能力大于
C! C#
水解能力##&0,/’##&,#/’##&0
#
,’#,项错误$当"K"$.$时#酸碱恰好完全反应#溶液温度最高#即
"K"$.$时放出热量最多#温度最高#*项错误$"K"$.$时#体积约为原来%倍##&0 ,’8#&0,/’8
#
$.! ! !$/#.’L
#&,#/’K GHI*M/!#+项错误$!K C!K K!$#.’!#)项正确%
% ! !$/L.--
C#
三!非选择题"包括必考题和选考题两个部分#共L’分$第#-$#’题为必考题#每
个试题考生都必须作答$第%L!%-题为选考题#考生根据要求作答$
’一(必考题"本题共%小题#共"%分$
#-.%答案&!!"分"!!"粉碎废料#适当加热#适当增大>C40溶液浓度#搅拌等!任答两条即可$#分"
煅烧
!#"N
#
4
L
8>C
#
+4 %$$$#>CN4
%
8+4 #%!#分"
!%"N4
%
/8#08’(N4
#
880
#
4$碱性条件促进平衡向左移动$生成更多的N4
%
/!#分"
!""56!40"
%
!#分"!及时带走>0
%
$避免>0
%
还原N
#
4
L
!#分"
!L"’$!#分"!偏高!#分"
%解析&&!’从影响化学反应速率因素的角度选择可行措施%
&#’煅烧!中的反应物是N4 (>C+4 #产物是>CN4 (+4 %
# L # % % #
&%’依题意#>0
"
N4
%
难溶于水#&N4
#
’
#
B4
"
易溶于水可知#调节O0的两个目的#一是除去铁(铜离子$二
是将N48 转化成N4/$使含钒离子在后续操作中充分溶解%
# %
&"’根据表格数据#先生成氢氧化铁沉淀%煅烧#生成了N4 和>0 #N4 有氧化性#>0 有还原性#二
# L % # L %
者长时间接触时容易发生氧化还原反应#故在流动空气中进行时空气会带走氨气%
&L’第!组数据误差较大#舍去%"#组数据取平均值为#$.$$GM%根据氧化还原反应中得失电子守恒可
得关系式为#N4 #$P #$#>C
#
B
#
4
%
#$&N4
#
’K$&>C
#
B
#
4
%
’K#$.$$J!$/%MJ$.!GHI*M/!K#.$J
#L$.$$GM
$.!--DJ
#L.$$GM
!$/%GHI%%&N4
#
’K#.$J!$/%GHIJ’%D*GHI/!K$.!--D%!&N4
#
’K
#.$&LD
J!$$1K
’$1%长时间振荡#空气与9P溶液接触时间长#会发生氧化还原反应)"088"P/84 #$$$#P
#
8#0
#
4#消
耗硫代硫酸钠溶液体积增大#测定结果偏高%
#&.%答案&!!"分"!!"分液漏斗!!分"!56
&
B
’
与4
#
的反应需要较高的温度$酒精灯提供的温度达不到要求!#
分"
!#"用夹子夹住橡皮管C$打开分液漏斗瓶塞$再打开活塞$向分液漏斗中加水$若一段时间后水不能顺利滴
下则装置,气密性良好!#分"
!%"#>C
#
4
#
8#0
#
4$$$">C88"40/84 #%!#分"
!""吸收B4
#
气体$防止污染环境!#分"!取反应后)装置中溶液少许于试管中$向其中滴加*C+I
#
溶液$
溶液中出现白色沉淀$再滴加稀盐酸$若沉淀消失且有气泡产生$则溶液中只含B4#/$若沉淀不减少且无气
%
泡产生$则溶液中只含B4#/$若沉淀减少且有气泡产生$则溶液中含有B4#/ 和B4#/!%分$合理即可"
" % "
高温
!L""56B
#
8!!4 #$$$#56
#
4
%
8’B4
#
!#分"
%解析&&!’盛水仪器名称为分液漏斗#56B 与4 的反应需要较高的温度#而酒精灯提供的温度达不到要
& ’ #
求#故使用酒精喷灯%
&#’检查装置,气密性的方法是用夹子夹住橡皮管C#打开分液漏斗瓶塞#再打开活塞#向分液漏斗中加水#
若一段时间后水不能顺利滴下则装置,气密性良好%
&%’装置,中过氧化钠与水反应生成氢氧化钠与氧气#离子方程式为#>C
#
4
#
8#0
#
4$$$">C88"40/84 #%%
&"’装置)的作用是吸收B4 气体#防止其污染环境%检验反应后)装置溶液中含硫元素阴离子的方法是
#
取反应后)装置中溶液少许于试管中#向其中滴加*C+I 溶液#溶液中出现白色沉淀#再滴加稀盐酸#若沉
#
淀消失且有气泡产生#则溶液中只含B4#/#若沉淀不减少且无气泡产生#则溶液中只含B4#/#若沉淀减少
% "
且有气泡产生#则溶液中含有B4#/ 和B4#/%
% "
化学参考答案!第!!!!#页!共"页"&L’取#L.$$GM步骤四中所配溶液与稀盐酸酸化后的*C+I
#
溶液反应#得到*CB4
"
的质量为#%.%D#根据
硫元素守恒#溶液中B元素的物质的量为$.!GHI#故!$$GM溶液中B元素的物质的量为$."GHI#B元素
的质量为!#.’D#铁元素的质量为#".$D/!#.’DK!!.#D#则56元素的物质的量为$.#GHI#故56
&
B
’
的
高温
化学式为56B
#
#56B
#
与4
#
反应的化学方程式为"56B
#
8!!4 #$$$#56
#
4
%
8’B4
#
#’.%答案&!!L分"!!"副反应的活化能低于主反应的活化能!#分"! 8!#".%QR%GHI/!!#分"
!#"!S!#分"!""!!分"!小!!分"!#-$1!#分"
!%"!#!#分"!"
"(#
#EC#!%分"
(
%解析&&!’由图甲可知#副反应的活化能低于主反应的活化能#温度升高#活化能较低的副反应更容易发生$
由反应"和##利用盖斯定律可得#将"/#即得!#即%)
!
K%)
#
/%)
%
K&8’!.%QR*GHI/!’/
&/"%.$QR*GHI/!’K 8!#".%QR*GHI/!%
&#’!由反应物+4
#
的物质的量分数与温度变化曲线#结合反应物起始物质的量之比可知#曲线C表示氢气
的物质的量分数随温度变化#由化学方程式可知#曲线F表示水蒸气的物质的量分数随温度变化#曲线S表
示乙烯的物质的量分数随温度变化%"由图乙可知#升高温度#+4
#
的物质的量分数增大#说明平衡向逆反
应方向移动#该反应为放热反应#即%)"$$由于正反应方向为放热反应#则保持其他条件不变#在绝热密
闭容器中发生上述反应#反应放出的热量使反应体系温度升高#反应正向进行程度减小#达到平衡时#生成
物乙烯的物质的量分数比在恒温密闭容器中小%#设起始氢气的物质的量为%GHI#平衡时转化率为*1#
%J*1J"
由""$<平衡时氢气和水蒸气的物质的量分数相等可得#%/%J*1K #解得*K-$#即 0 的转
- #
化率为-$1%
&%’!由图示可知#T点甲烷的转化率小于平衡转化率#反应向正反应方向进行#所以T点)+正#+逆 $"根据
三段式计算可得)
!!!!!!+4
#
&D’8+0
"
&D’’(#+4&D’8#0
#
&D’
起始量+GHI!! $.!!!!$.!!! $!!!!$
转化量+GHI $.$L $.$L $.! $.!
平衡量+GHI $.$L $.$L $.! $.!
! $.!"# ! $.!"#
!K
(# J
$.%
J (# J
$.%
K
"(#
#EC#%
O ! $.$L" ! $.$L" (
(# J
$.%
J (# J
$.%
’二(选考题"共!L分$请考生从给出的两道题中任选一题作答$如果多做#则按所做的第一题计分$
%L.%答案&!!L分"!!"-U!!!分"!!"!!分"
!#"#! 冠醚 &!!分"!!UO%杂化!!分"!!4!!分"
!%">C8直径太小$+U8直径太大!#分"!!氧的电负性较大$=/带负电荷$冠醚与阴离子作用力太弱!合理
即可$#分"
!""($!#分"
槡%
!L" &J!$$1!#分"
’
#’槡%
!-" J!$%$!#分"
%,*#-
,
%解析&&!’根据碱金属元素排序可推知#铯位于元素周期表第六周期’,族#基态铯原子的价层电子排布式
为-U!%基态9原子核外电子排布式为!U##U##O-%U#%O-"U!#!U(#U(%U("U的电子云有!个伸展方向$#O(%O
的电子云有%个伸展方向#故钾原子核外电子云共有"个伸展方向%
&#’该冠醚#环上有#!个原子#其中&个氧原子#根据冠醚的命名规则#该冠醚的名称为#! 冠醚 &%冠醚
中氧原子形成#个单键#另外氧原子上还有#对孤电子对#氧原子共有"对价层电子对#采取UO%杂化%
&%’分析数据可知#识别离子的必要条件是冠醚直径与碱金属离子直径适配#既不能太大#也不能太小%因
化学参考答案!第!!!!%页!共"页"为适配时!作用力"最强#才能识别和运输%比较!’ 冠醚 -(>C8和+U8的直径#>C8直径太小#+U8直径太
大#故不能识别和运输%阴离子带负电荷#氧的电负性较大#故二者排斥#不能形成较强的作用力#故冠醚不
能识别和运输阴离子%
&"’观察足球烯分子结构可知#每个碳形成%个键#每个键被#个原子分摊#所以#!个+ 分子含-$J%J
-$
!
K($个(键%
#
&L’!个晶胞含#个铷离子#设晶胞参数为*#立方体的体对角线上的%个离子相切#设离子半径为.%&".’#
"
!槡% % &.%J# " 槡% % 槡%
K%*##.K
"
*# "K
*%
J!$$1K
%
&J&
"
’J#J!$$1K
’
&J!$$1%
槡%
&-’如图丁所示#!个晶胞含#个锂离子#晶胞体积为NK&*J!$/!$SG’J& *J!$/!$SG’J-J!$/!$SGK
#
槡% #J& #’槡%
#
*#-J!$/%$SG%#密度#K
, J 槡% *#-J!$/%$
D*SG/%K
%, , *#-
J!$%$D*SG/%%
, #
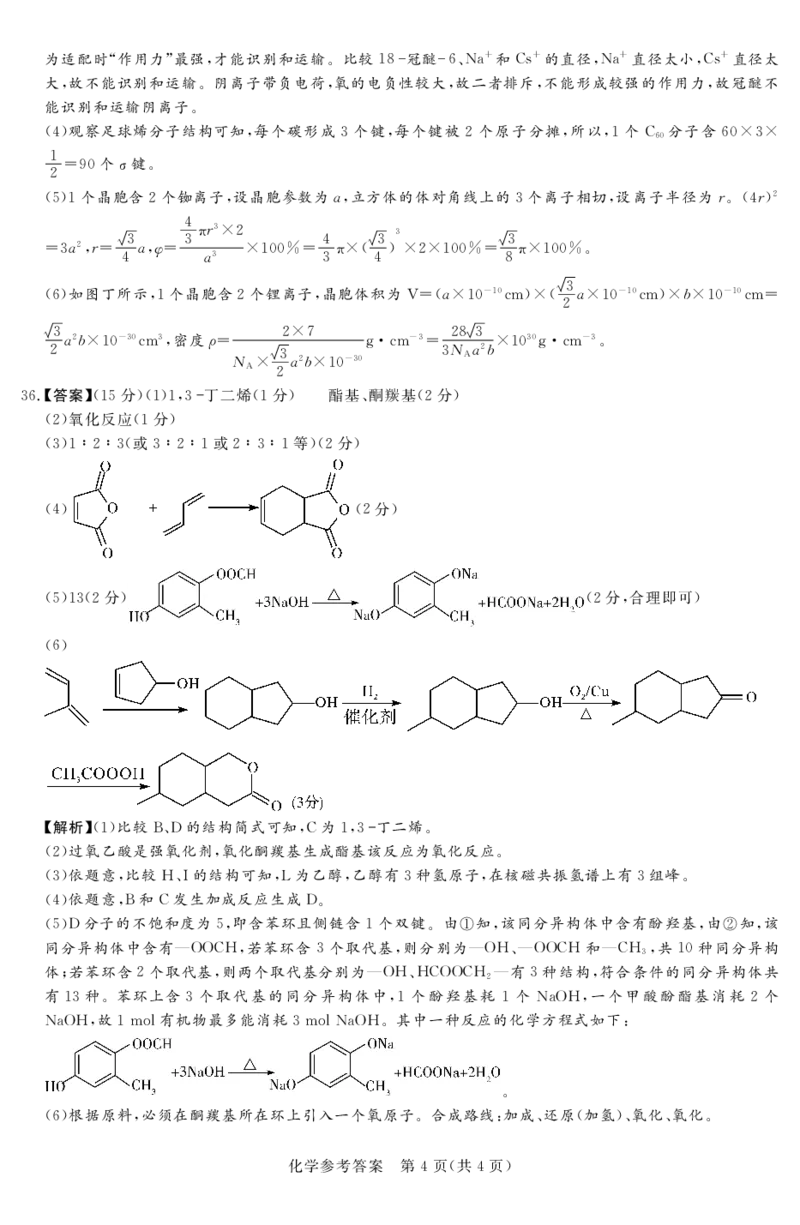
%-.%答案&!!L分"!!"!$% 丁二烯!!分"!!酯基#酮羰基!#分"
!#"氧化反应!!分"
!%"!V#V%!或%V#V!或#V%V!等"!#分"
!"" !#分"
!L"!%!#分" !#分$合理即可"
!-"
%解析&&!’比较*()的结构简式可知#+为!#% 丁二烯%
&#’过氧乙酸是强氧化剂#氧化酮羰基生成酯基该反应为氧化反应%
&%’依题意#比较0(P的结构可知#M为乙醇#乙醇有%种氢原子#在核磁共振氢谱上有%组峰%
&"’依题意#*和+发生加成反应生成)%
&L’)分子的不饱和度为L#即含苯环且侧链含!个双键%由!知#该同分异构体中含有酚羟基#由"知#该
同分异构体中含有,44+0#若苯环含%个取代基#则分别为,40(,44+0和,+0 #共!$种同分异构
%
体$若苯环含#个取代基#则两个取代基分别为,40(0+44+0 ,有%种结构#符合条件的同分异构体共
#
有!%种%苯环上含%个取代基的同分异构体中#!个酚羟基耗!个 >C40#一个甲酸酚酯基消耗#个
>C40#故!GHI有机物最多能消耗%GHI>C40%其中一种反应的化学方程式如下)
%
&-’根据原料#必须在酮羰基所在环上引入一个氧原子%合成路线)加成(还原&加氢’(氧化(氧化%
化学参考答案!第!!!!"页!共"页"