文档内容
重庆市高 2024 届高三第三次质量检测
化 学 试 题
2023.11
命审单位:重庆南开中学
考生注意:
1.本试卷满分100分,考试时间75分钟。
2.考生作答时,请将答案答在答题卡上。必须在题号所指示的答题区域作答,超
.
出
.
答
.
题
.
区
.
域
.
书
.
写的答案无效,在试题卷、草稿纸上答题无效。
....................
可能用到的相对原子质量:H—1 0—16 Ni—59 Cu—64 Tl—204
一、选择题:本题共 14 小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只有一项是符
合题目要求的。
1.科技发展离不开化学。下列说法不正确的是
A.“一带一路”,丝绸制品主要成分为纤维素
B.“乘风破浪”,航母上的钛合金铆钉属于金属材料
C.“筑梦天宫”,火箭助推剂液氧与臭氧互为同素异形体
D.“直上云霄”,客机所用燃油属于烃类物质
2.下列说法正确的是
A. SiO₂和Al₂O₃都属于两性氧化物
B.乙酸与乙醛均能使溴水褪色
C. Fe 和Cu均能溶于稀硝酸
D. CO₂和SO₃分别与BaCl₂溶液反应,均生成白色沉淀
3.下列操作中,不会影响溶液中 、 、 、 、 大量共存的是
+ + 2− 2− −
A.加入少量NH.₄Cl溶液 K N B a .加入 SO 少4 量 CO3 溶 N 液 O3
C.加入少量Ba(OH)₂溶液 D.通入足量 FeCl气₃ 体
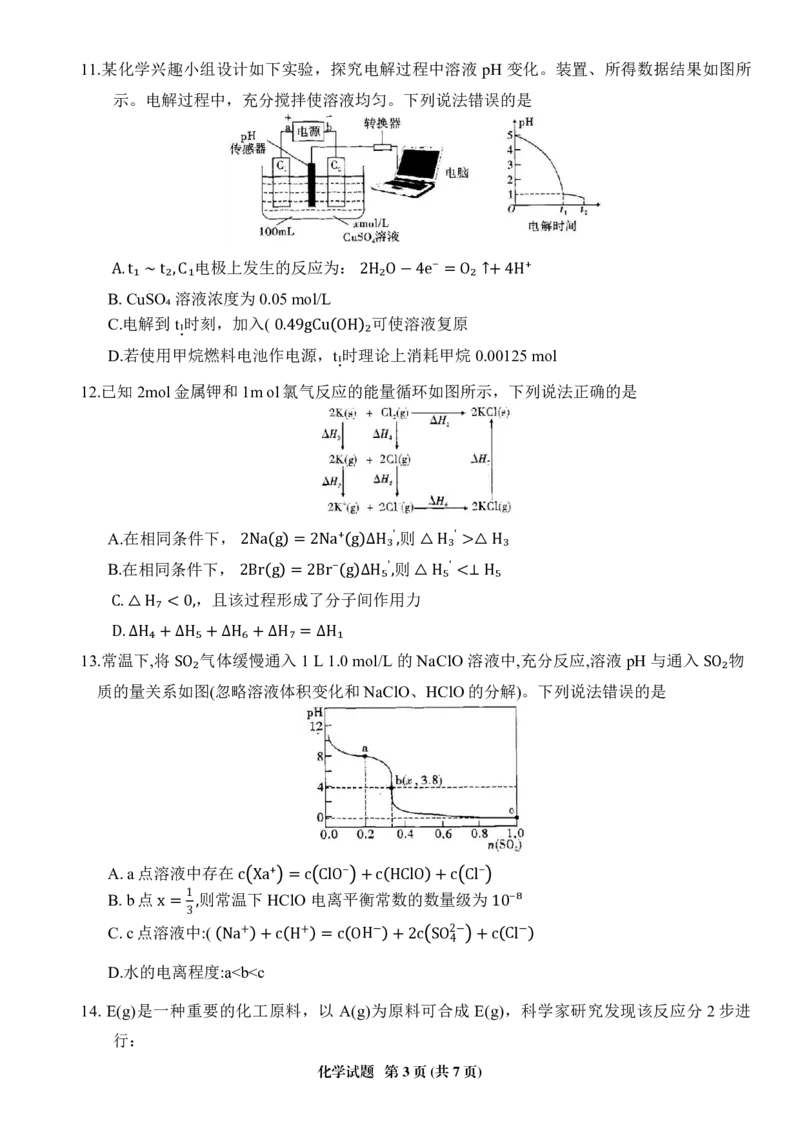
4.用下列实验方案不能达到实验目的的是
SO₂
A.图①装置——验证SO₂还原性 B.图②装置——在铁上镀铜
C.图③装置——证明铁发生吸氧腐蚀 D.图④装置——测定醋酸的浓度
5.臭氧能将污水中的氰化物转化为无毒物质,原理为:
下列有关说法正确的是 − −
503 +2CN +H2O = 2HCO3 +N2 +
A. N₂中σ键与π键数目之比为2:1
5O2,
B.第一电离能:CX>Y
C. X元素氧化物的水化物均为强酸
D. Y、Z的简单离子具有相同的电子层结构
9.室温下,将两种浓度均为 的溶液等体积混合,若溶液混合引起的体积变化可忽
略,下列各混合溶液中微粒物质的量浓度关系正确的是
0.10mol⋅L⁻¹
混合溶液:
B.氨水—NH₄Cl混合溶液 + − 2−
A.NaHCO₃−Na₂CO₃ 3c Na = 2c HCO3 +2c CO3 +2c H2CO3
−5)
Kb NH3 ⋅H2O = 1.8×10 :
+ − 混合溶液: − +
c NH4 > c Cl > c NH3 ⋅H2O > c OH > c(H
混合溶液:
C.CH₃COOH−CH₃COONa c H⁺ +c Na⁺ = c OH⁻ +c CH₃COOH
+ 2− −
10.D 根 . 据 H₂ 下 C₂ 列 O₄ 实 − 验 N 操 aH 作 C₂ 以 O₄ 及现象能得到 2 正 c H 确实 + 验 c 结 H 论2C 的2O 是4 = c C2O4 +2c OH
实验操作及现象 实验结论
将白色固体溶解,滴加足量稀盐酸,将样品产
A 该白色固体为亚硫酸盐
生的气体通入品红溶液,品红褪色
B 将甲醇与足量 KMnO₄溶液混合,紫红色变浅 甲醇被氧化为甲酸
向 Mg(OH)₂悬浊液中加入几滴 CuSO₄溶液,生成
C 证明Kₛₚ[Mg(OH)₂]>Kₛₚ[Cu(OH)₂]
蓝色沉淀
将盐酸与 NaHCO₃混合产生的气体直接通入苯
D 酸性:碳酸>苯酚
酚钠溶液,溶液变浑浊
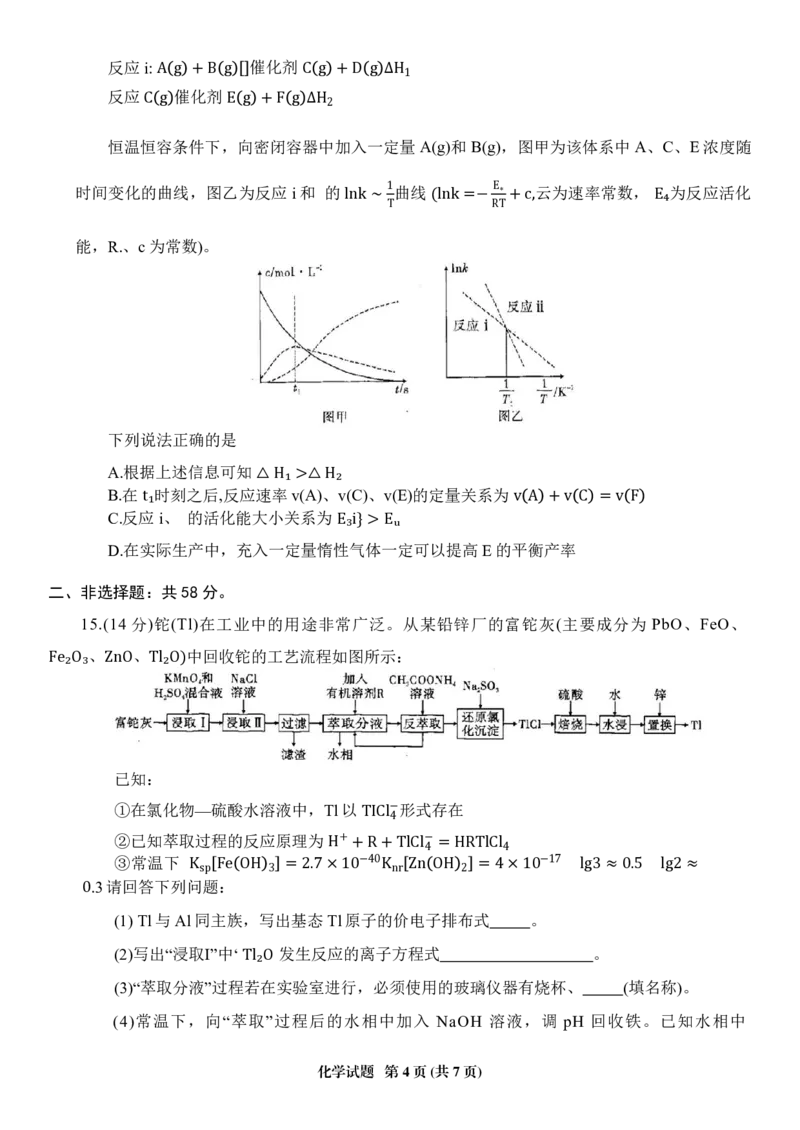
化学试题 第2页(共7页)11.某化学兴趣小组设计如下实验,探究电解过程中溶液 pH 变化。装置、所得数据结果如图所
示。电解过程中,充分搅拌使溶液均匀。下列说法错误的是
电极上发生的反应为:
BA..Ct₁u∼SOt₂₄, 溶 C₁ 液浓度为0.05mol/L 2H₂O−4e⁻ = O₂ ↑+4H⁺
C.电解到t.₁时刻,加入( 可使溶液复原
D.若使用甲烷燃料电池作
0.
电
49
源
gC
, ut.O₁时
H
理
₂
论上消耗甲烷0.00125mol
12.已知2mol金属钾和1m ol氯气反应的能量循环如图所示,下列说法正确的是
A.在相同条件下, 则
' '
B.在相同条件下,
2Na g = 2Na⁺ g ΔH₃
则
, △H₃ >△H₃
' '
,且该过程形成了分子间作用力
2Br g = 2Br⁻ g ΔH₅, △H₅ <⊥ H₅
C.△H₇ < 0,
13.常温下,将 气体缓慢通入 1 L 1.0 mol/L 的 NaClO 溶液中,充分反应,溶液 pH 与通入 物
D.ΔH₄+ΔH₅+ΔH₆+ΔH₇ = ΔH₁
质的量关系
S
如
O₂
图(忽略溶液体积变化和NaClO、HClO的分解)。下列说法错误的是
SO₂
A. a点溶液中存在
B.b点 则常温下HClO电离平衡常数的数量级为
c Xa⁺ = c ClO⁻ +c HClO +c Cl⁻
1
C.c点溶 x 液 = 中 3,:( 10⁻⁸
+ + − 2− −
D.水的电离程度: N a< a b△H₂
C.反应i、 的活化能大小关系为
t₁ v A +v C = v F
D.在实际生产中,充入一定量惰性
E₃
气
i}
体
>
一
Eᵤ
定可以提高E的平衡产率
二、非选择题:共58分。
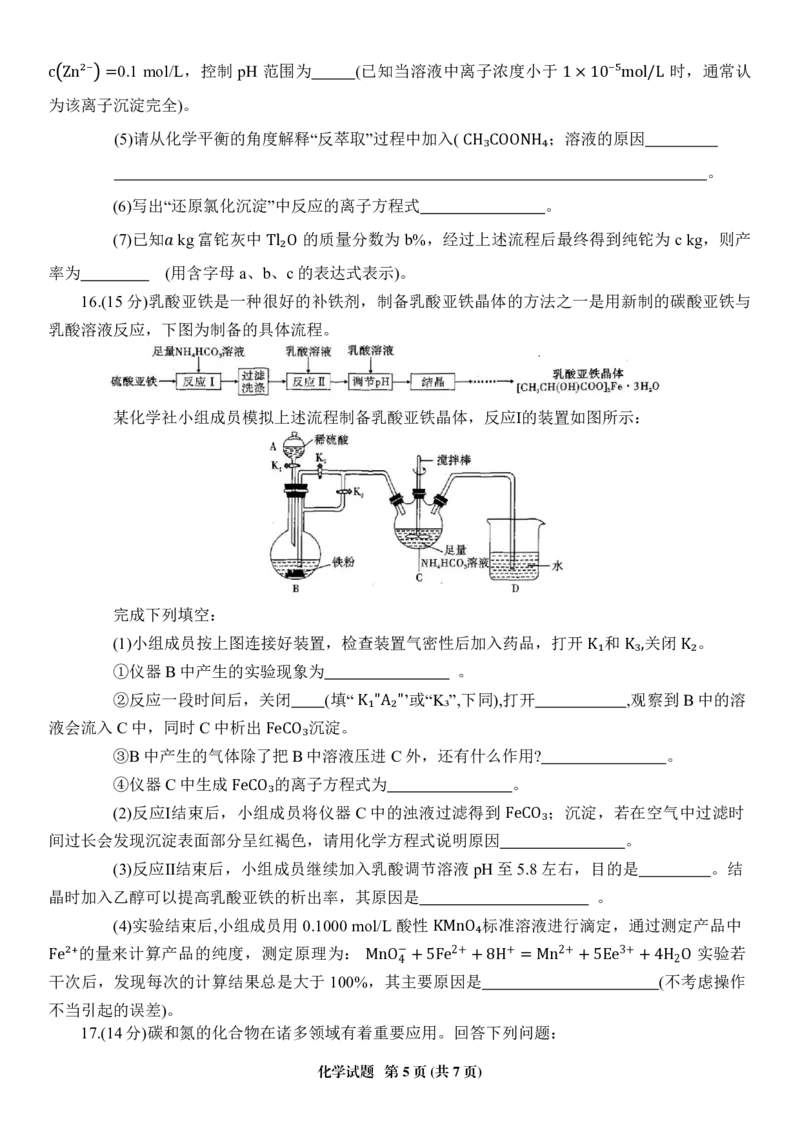
15.(14 分)铊(Tl)在工业中的用途非常广泛。从某铅锌厂的富铊灰(主要成分为 PbO、FeO、
、 、 中回收铊的工艺流程如图所示:
Fe₂O₃ ZnO Tl₂O)
已知:
①在氯化物—硫酸水溶液中,Tl以 形式存在
−
②已知萃取过程的反应原理为 TICl4
③常温下 + −
H +R+TlCl4 = HRTlCl4
.3请回答下列问题: −40 −17
Ksp Fe OH 3 = 2.7×10 Knr Zn OH 2 = 4×10 lg3 ≈ 0.5 lg2 ≈
0 (1) Tl与 Al同主族,写出基态Tl原子的价电子排布式 。
(2)写出“浸取Ⅰ”中‘ 发生反应的离子方程式 。
(3)“萃取分液”过程T若l₂在O实验室进行,必须使用的玻璃仪器有烧杯、 (填名称)。
(4)常温下,向“萃取”过程后的水相中加入 NaOH 溶液,调 pH 回收铁。已知水相中
化学试题 第4页(共7页)0.1 mol/L,控制 pH 范围为 (已知当溶液中离子浓度小于 时,通常认
c为Z该n²离⁻子=沉淀完全)。 1×10⁻⁵mol/L
(5)请从化学平衡的角度解释“反萃取”过程中加入( ;溶液的原因
CH₃COONH₄ 。
(6)写出“还原氯化沉淀”中反应的离子方程式 。
(7)已知 kg富铊灰中 的质量分数为 b%,经过上述流程后最终得到纯铊为 c kg,则产
率为 (用含字母a、bT、l₂cO的表达式表示)。
16.(15分)乳酸亚铁是一种很好的补铁剂,制备乳酸亚铁晶体的方法之一是用新制的碳酸亚铁与
乳酸溶液反应,下图为制备的具体流程。
某化学社小组成员模拟上述流程制备乳酸亚铁晶体,反应Ⅰ的装置如图所示:
完成下列填空:
(1)小组成员按上图连接好装置,检查装置气密性后加入药品,打开 和 关闭 。
①仪器B中产生的实验现象为 。
K₁ K₃, K₂
②反应一段时间后,关闭 (填“ ’或“K₃”,下同),打开 ,观察到 B中的溶
液会流入C中,同时C中析出 沉淀。
K₁"A₂"
③B中产生的气体除了把B中溶液压进C外,还有什么作用? 。
FeCO₃
④仪器C中生成 的离子方程式为 。
(2)反应Ⅰ结束后,小组成员将仪器 C中的浊液过滤得到 ;沉淀,若在空气中过滤时
FeCO₃
间过长会发现沉淀表面部分呈红褐色,请用化学方程式说明原因 。
FeCO₃
(3)反应Ⅱ结束后,小组成员继续加入乳酸调节溶液 pH至5.8左右,目的是 。结
晶时加入乙醇可以提高乳酸亚铁的析出率,其原因是 。
(4)实验结束后,小组成员用 0.1000 mol/L 酸性 标准溶液进行滴定,通过测定产品中
的量来计算产品的纯度,测定原理为: 实验若
KMnO₄
F 干 e 次 ²⁺ 后,发现每次的计算结果总是大于 100% M , n 其 O4 − 主 + 要 5 原 Fe 因2+是 +8H + = Mn 2+ +5Ee 3+ +4 ( H 不 2 考 O 虑操作
不当引起的误差)。
17.(14分)碳和氮的化合物在诸多领域有着重要应用。回答下列问题:
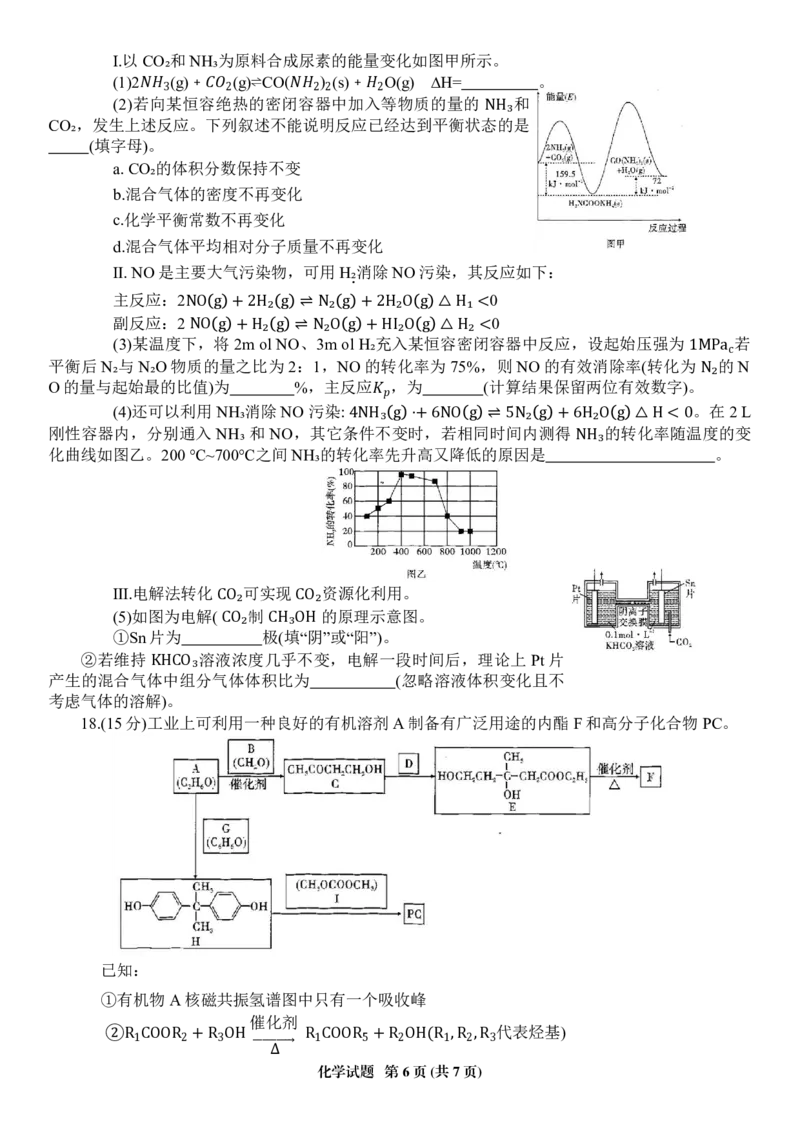
化学试题 第5页(共7页)Ⅰ.以CO₂和NH₃为原料合成尿素的能量变化如图甲所示。
(1)2 (g)﹢ (g)⇌CO( ) (s)﹢ O(g) ∆H= 。
(2)若向某恒容绝热的密闭容器中加入等物质的量的 和
3 2 2 2 2
CO₂,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是
NH₃
(填字母)。
a.CO₂的体积分数保持不变
b.混合气体的密度不再变化
c.化学平衡常数不再变化
d.混合气体平均相对分子质量不再变化
Ⅱ.NO是主要大气污染物,可用H.₂消除NO污染,其反应如下:
主反应:2 0
副反应:2 0
NO g +2H₂ g ⇌ N₂ g +2H₂O g △H₁ <
(3)某温度下,将 2m ol NO、3m ol H₂充入某恒容密闭容器中反应,设起始压强为 若
NO g +H₂ g ⇌ N₂O g +HI₂O g △H₂ <
平衡后 N₂与 N₂O物质的量之比为 2:1,NO的转化率为 75%,则 NO的有效消除率(转化为 的 N
1MPac
O的量与起始最的比值)为 %,主反应 ,为 (计算结果保留两位有效数字)。
N₂
(4)还可以利用 NH₃消除NO污染: 。在2L
刚性容器内,分别通入 NH₃ 和 NO,其它条件不变时,若相同时间内测得 的转化率随温度的变
4NH₃ g ⋅+6NO g ⇌ 5N₂ g +6H₂O g △H < 0
化曲线如图乙。200℃~700℃之间NH₃的转化率先升高又降低的原因是 。
NH₃
Ⅲ.电解法转化 可实现 资源化利用。
(5)如图为电解( 制 的原理示意图。
CO₂ CO₂
①Sn片为 极(填“阴”或“阳”)。
CO₂ CH₃OH
②若维持 溶液浓度几乎不变,电解一段时间后,理论上 Pt片
产生的混合气体中组分气体体积比为 (忽略溶液体积变化且不
KHCO₃
考虑气体的溶解)。
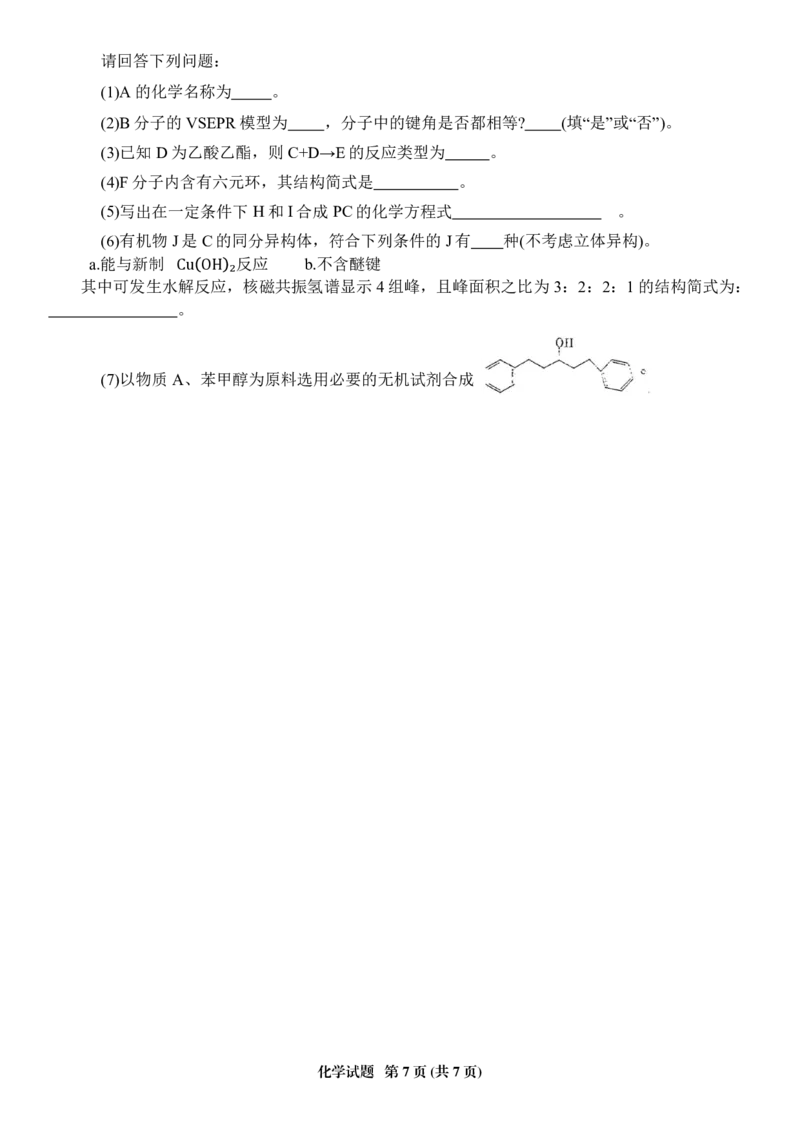
18.(15分)工业上可利用一种良好的有机溶剂A制备有广泛用途的内酯F和高分子化合物PC。
已知:
①有机物A核磁共振氢谱图中只有一个吸收峰
催化剂
代表烃基)
②R1COOR2 +R3OH R1COOR5 +R2OH(R1,R2,R3
化学试题 第6页(共7页)
����∆�����请回答下列问题:
(1)A的化学名称为 。
(2)B分子的 VSEPR模型为 ,分子中的键角是否都相等? (填“是”或“否”)。
(3)已知D为乙酸乙酯,则 C+D→E的反应类型为 。
(4)F分子内含有六元环,其结构简式是 。
(5)写出在一定条件下H和I合成PC的化学方程式 。
(6)有机物J是C的同分异构体,符合下列条件的J有 种(不考虑立体异构)。
a.能与新制 反应 b.不含醚键
其中可发生水解反应,核磁共振氢谱显示 4组峰,且峰面积之比为 3:2:2:1的结构简式为:
Cu OH ₂
。
(7)以物质A、苯甲醇为原料选用必要的无机试剂合成
化学试题 第7页(共7页)