文档内容
高二化学
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷
上无效。
3.考试结束后,将答题卡交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Cl-35.5 Fe-56
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.化学与科技、生产、生活息息相关。下列说法错误的是( )
A.含氟牙膏更好地保护牙齿是利用了沉淀转化原理
B.苯甲酸钠可作为食品防腐剂是由于其具有酸性
C.“奋斗者”号载人潜水器使用的锂离子电池是二次电池
D.煤气中毒与血红蛋白跟 、CO结合过程中的平衡移动有关
2.下列有关说法正确的是( )
A.任何水溶液中都存在电离平衡 B.能水解的盐溶液一定不显中性
C.非自发反应在任何条件下都不能发生 D.只有熵增加的反应才能正向自发进行
3.下列事实中能用化学平衡移动原理解释的是( )
A.实验室利用 制取 使用 加快反应速率
B.反应 达平衡后,加压使混合气体颜色变深
C.锌片与稀 反应过程中,加入少量 固体,促进 的产生
D.实验室配制 溶液时滴加几滴 溶液
4.下列离子方程式书写错误的是( )
A. 溶液和 溶液反应:
B.向 溶液中通入足量氯气:
C.澄清石灰水与少量 溶液反应:
D.索尔维制碱法的关键反应:
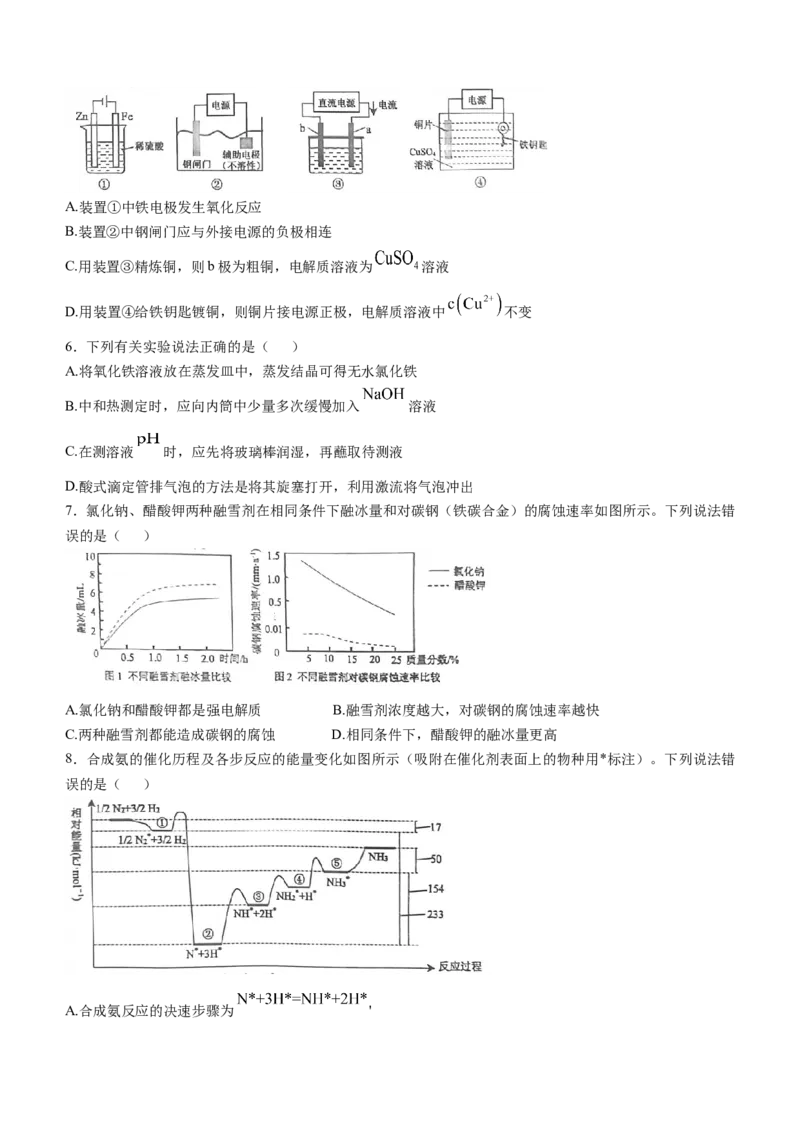
5.关于下列各装置图的说法中错误的是( )A.装置①中铁电极发生氧化反应
B.装置②中钢闸门应与外接电源的负极相连
C.用装置③精炼铜,则b极为粗铜,电解质溶液为 溶液
D.用装置④给铁钥匙镀铜,则铜片接电源正极,电解质溶液中 不变
6.下列有关实验说法正确的是( )
A.将氧化铁溶液放在蒸发皿中,蒸发结晶可得无水氯化铁
B.中和热测定时,应向内筒中少量多次缓慢加入 溶液
C.在测溶液 时,应先将玻璃棒润湿,再蘸取待测液
D.酸式滴定管排气泡的方法是将其旋塞打开,利用激流将气泡冲出
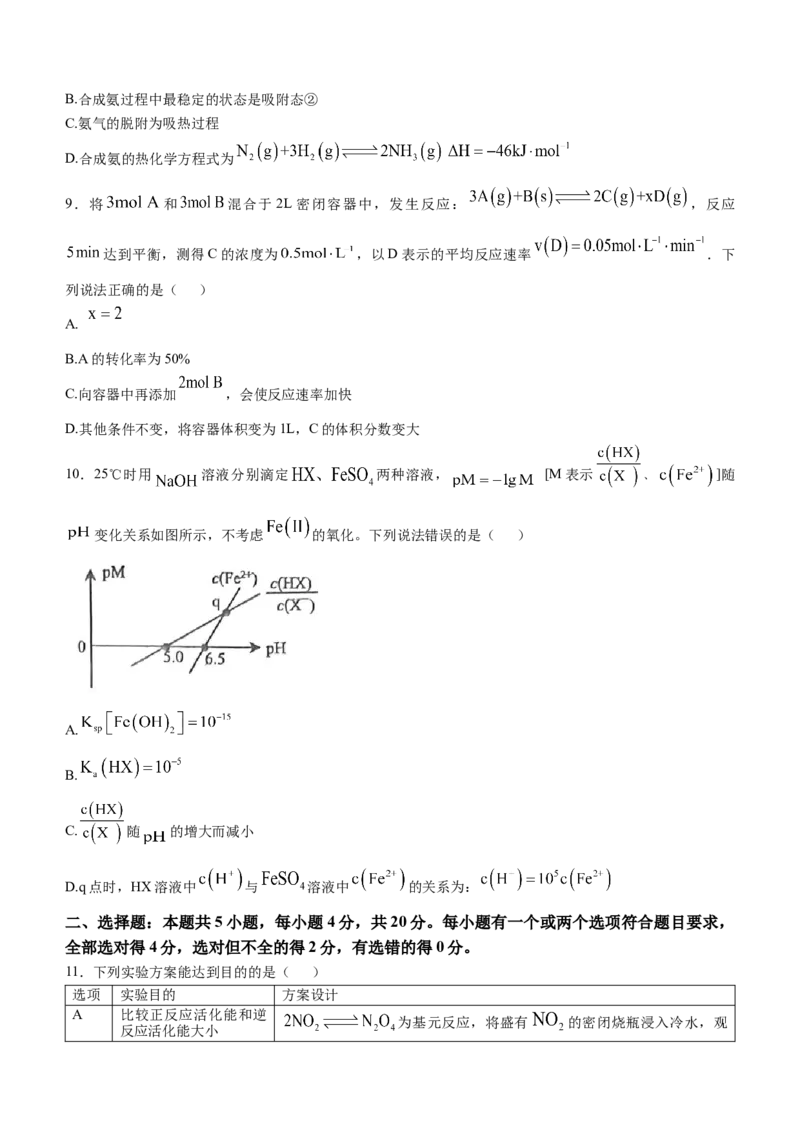
7.氯化钠、醋酸钾两种融雪剂在相同条件下融冰量和对碳钢(铁碳合金)的腐蚀速率如图所示。下列说法错
误的是( )
A.氯化钠和醋酸钾都是强电解质 B.融雪剂浓度越大,对碳钢的腐蚀速率越快
C.两种融雪剂都能造成碳钢的腐蚀 D.相同条件下,醋酸钾的融冰量更高
8.合成氨的催化历程及各步反应的能量变化如图所示(吸附在催化剂表面上的物种用*标注)。下列说法错
误的是( )
A.合成氨反应的决速步骤为 'B.合成氨过程中最稳定的状态是吸附态②
C.氨气的脱附为吸热过程
D.合成氨的热化学方程式为
9.将 和 混合于 2L 密闭容器中,发生反应: ,反应
达到平衡,测得C的浓度为 ,以D表示的平均反应速率 .下
列说法正确的是( )
A.
B.A的转化率为50%
C.向容器中再添加 ,会使反应速率加快
D.其他条件不变,将容器体积变为1L,C的体积分数变大
10.25℃时用 溶液分别滴定 两种溶液, [M表示 ﹑ ]随
变化关系如图所示,不考虑 的氧化。下列说法错误的是( )
A.
B.
C. 随 的增大而减小
D.q点时,HX溶液中 与 溶液中 的关系为:
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,
全部选对得4分,选对但不全的得2分,有选错的得0分。
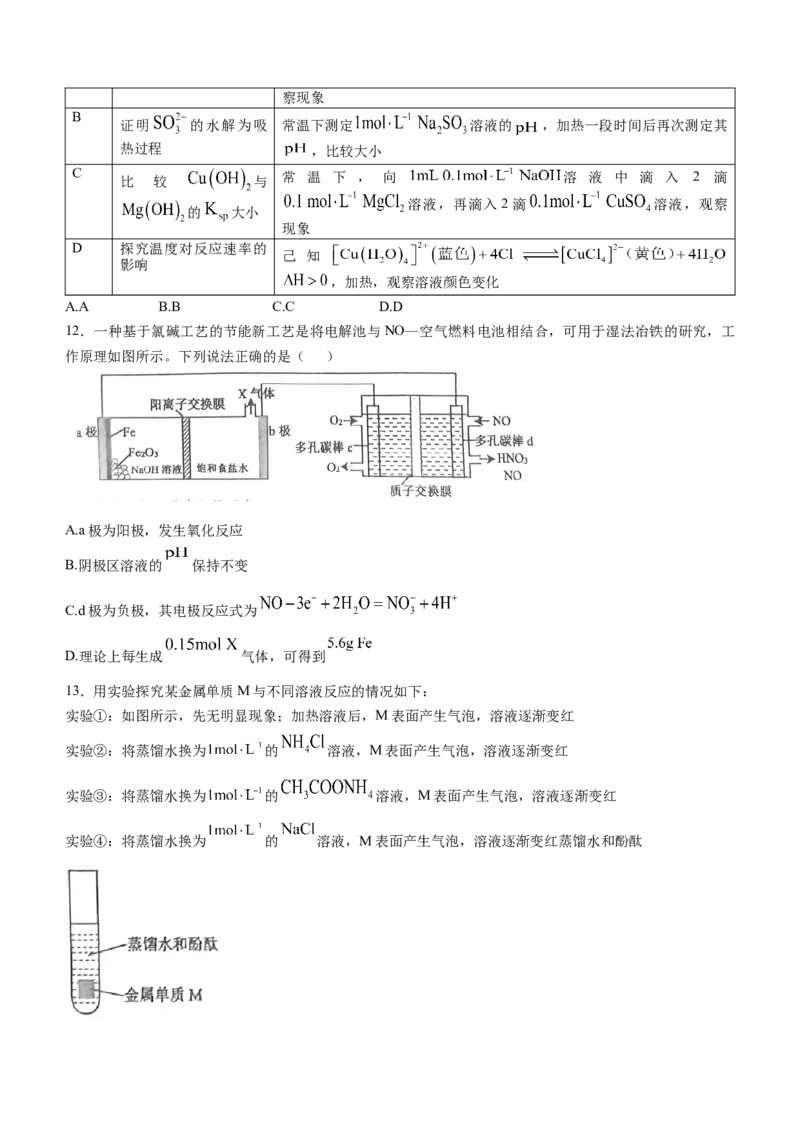
11.下列实验方案能达到目的的是( )
选项 实验目的 方案设计
A 比较正反应活化能和逆
为基元反应,将盛有 的密闭烧瓶浸入冷水,观
反应活化能大小察现象
B
证明 的水解为吸 常温下测定 溶液的 ,加热一段时间后再次测定其
热过程 ,比较大小
C 常 温 下 , 向 溶 液 中 滴 入 2 滴
比 较 与
溶液,再滴入2滴 溶液,观察
的 大小
现象
D 探究温度对反应速率的
己 知
影响
,加热,观察溶液颜色变化
A.A B.B C.C D.D
12.一种基于氯碱工艺的节能新工艺是将电解池与NO—空气燃料电池相结合,可用于湿法冶铁的研究,工
作原理如图所示。下列说法正确的是( )
A.a极为阳极,发生氧化反应
B.阴极区溶液的 保持不变
C.d极为负极,其电极反应式为
D.理论上每生成 气体,可得到
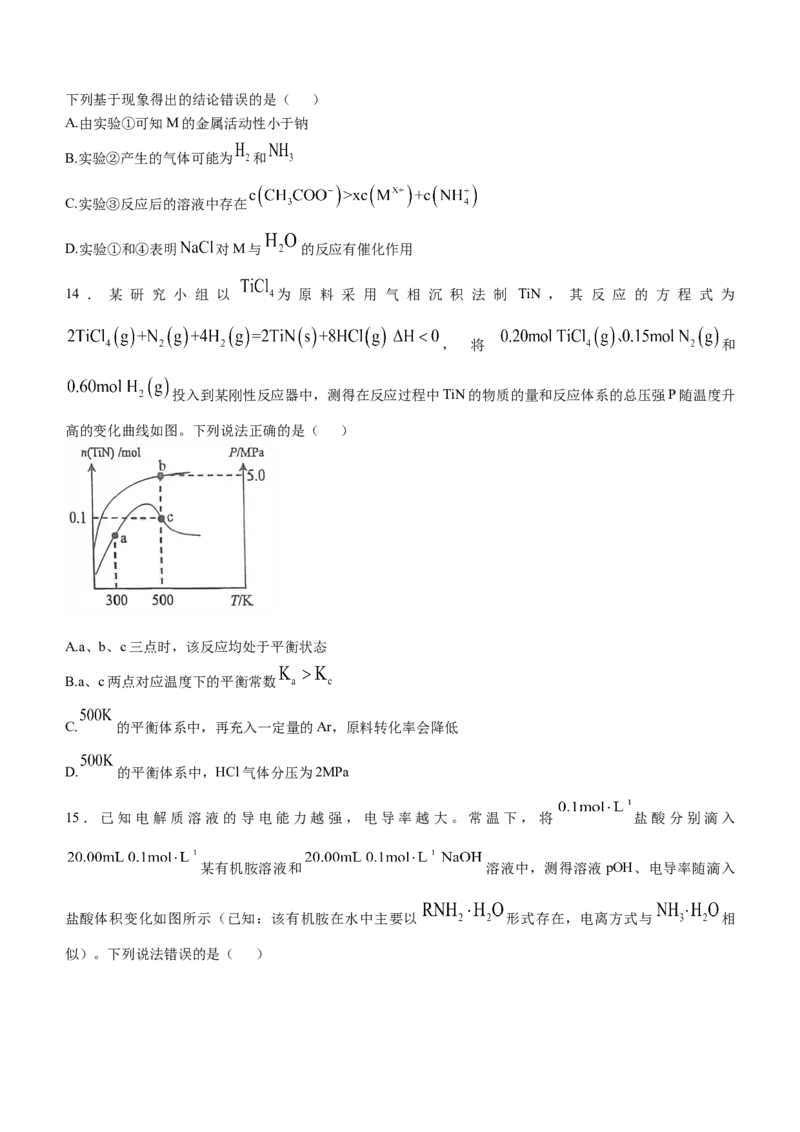
13.用实验探究某金属单质M与不同溶液反应的情况如下:
实验①:如图所示,先无明显现象;加热溶液后,M表面产生气泡,溶液逐渐变红
实验②:将蒸馏水换为 的 溶液,M表面产生气泡,溶液逐渐变红
实验③:将蒸馏水换为 的 溶液,M表面产生气泡,溶液逐渐变红
实验④:将蒸馏水换为 的 溶液,M表面产生气泡,溶液逐渐变红蒸馏水和酚酞下列基于现象得出的结论错误的是( )
A.由实验①可知M的金属活动性小于钠
B.实验②产生的气体可能为 和
C.实验③反应后的溶液中存在
D.实验①和④表明 对M与 的反应有催化作用
14 . 某 研 究 小 组 以 为 原 料 采 用 气 相 沉 积 法 制 TiN , 其 反 应 的 方 程 式 为
, 将 和
投入到某刚性反应器中,测得在反应过程中TiN的物质的量和反应体系的总压强P随温度升
高的变化曲线如图。下列说法正确的是( )
A.a、b、c三点时,该反应均处于平衡状态
B.a、c两点对应温度下的平衡常数
C. 的平衡体系中,再充入一定量的Ar,原料转化率会降低
D. 的平衡体系中,HCl气体分压为2MPa
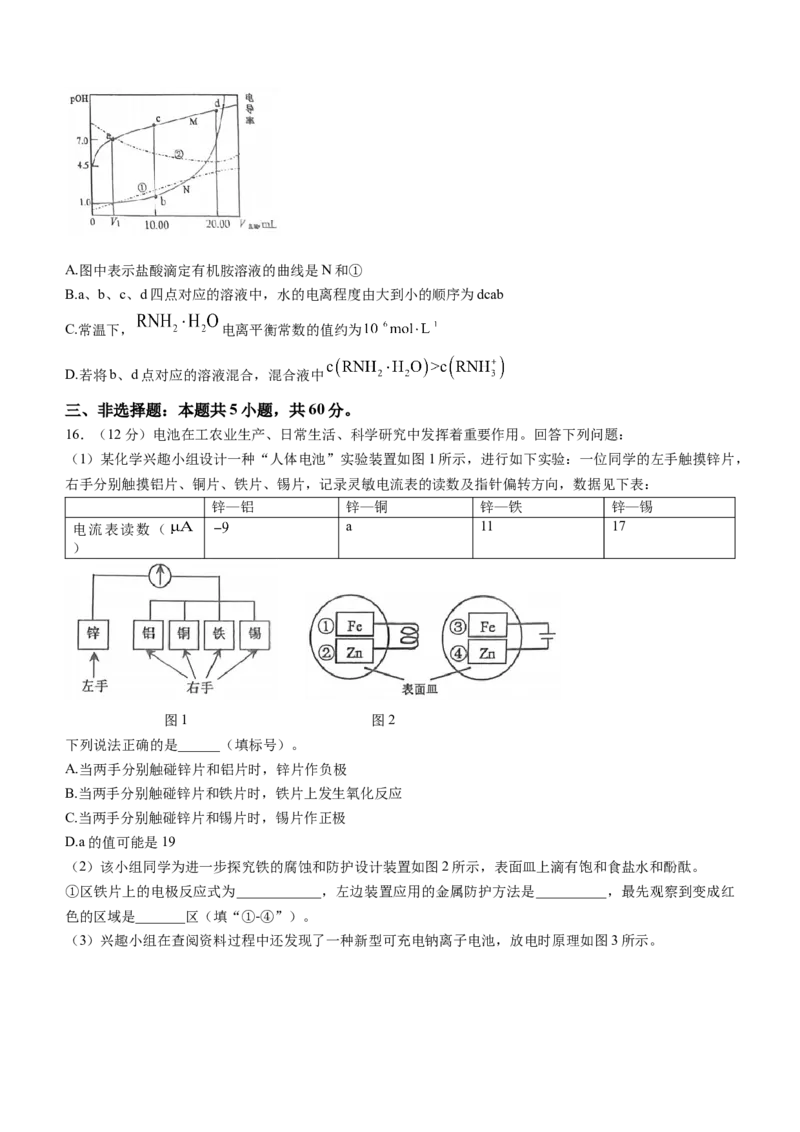
15.已知电解质溶液的导电能力越强,电导率越大。常温下,将 盐酸分别滴入
某有机胺溶液和 溶液中,测得溶液pOH、电导率随滴入
盐酸体积变化如图所示(已知:该有机胺在水中主要以 形式存在,电离方式与 相
似)。下列说法错误的是( )A.图中表示盐酸滴定有机胺溶液的曲线是N和①
B.a、b、c、d四点对应的溶液中,水的电离程度由大到小的顺序为dcab
C.常温下, 电离平衡常数的值约为
D.若将b、d点对应的溶液混合,混合液中
三、非选择题:本题共5小题,共60分。
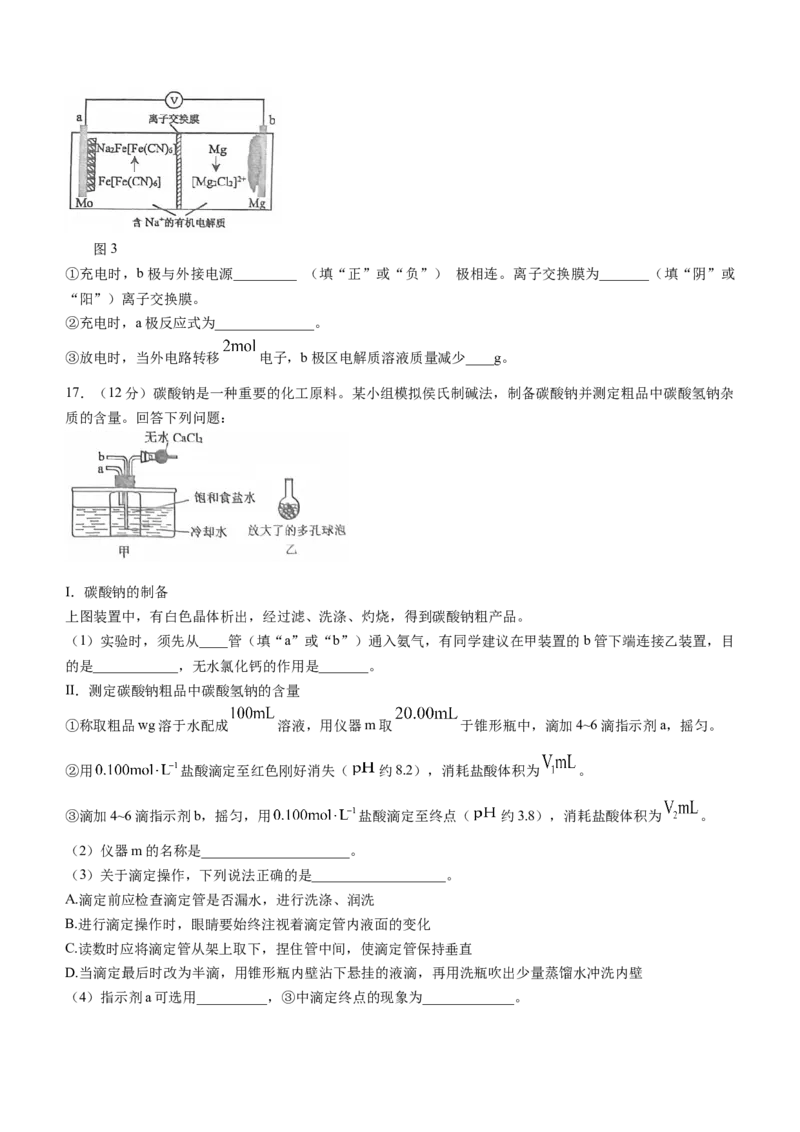
16.(12分)电池在工农业生产、日常生活、科学研究中发挥着重要作用。回答下列问题:
(1)某化学兴趣小组设计一种“人体电池”实验装置如图1所示,进行如下实验:一位同学的左手触摸锌片,
右手分别触摸铝片、铜片、铁片、锡片,记录灵敏电流表的读数及指针偏转方向,数据见下表:
锌—铝 锌—铜 锌—铁 锌—锡
电流表读数( a 11 17
)
图1 图2
下列说法正确的是______(填标号)。
A.当两手分别触碰锌片和铝片时,锌片作负极
B.当两手分别触碰锌片和铁片时,铁片上发生氧化反应
C.当两手分别触碰锌片和锡片时,锡片作正极
D.a的值可能是19
(2)该小组同学为进一步探究铁的腐蚀和防护设计装置如图2所示,表面皿上滴有饱和食盐水和酚酞。
①区铁片上的电极反应式为____________,左边装置应用的金属防护方法是__________,最先观察到变成红
色的区域是_______区(填“①-④”)。
(3)兴趣小组在查阅资料过程中还发现了一种新型可充电钠离子电池,放电时原理如图3所示。图3
①充电时,b极与外接电源_________ (填“正”或“负”) 极相连。离子交换膜为_______(填“阴”或
“阳”)离子交换膜。
②充电时,a极反应式为______________。
③放电时,当外电路转移 电子,b极区电解质溶液质量减少____g。
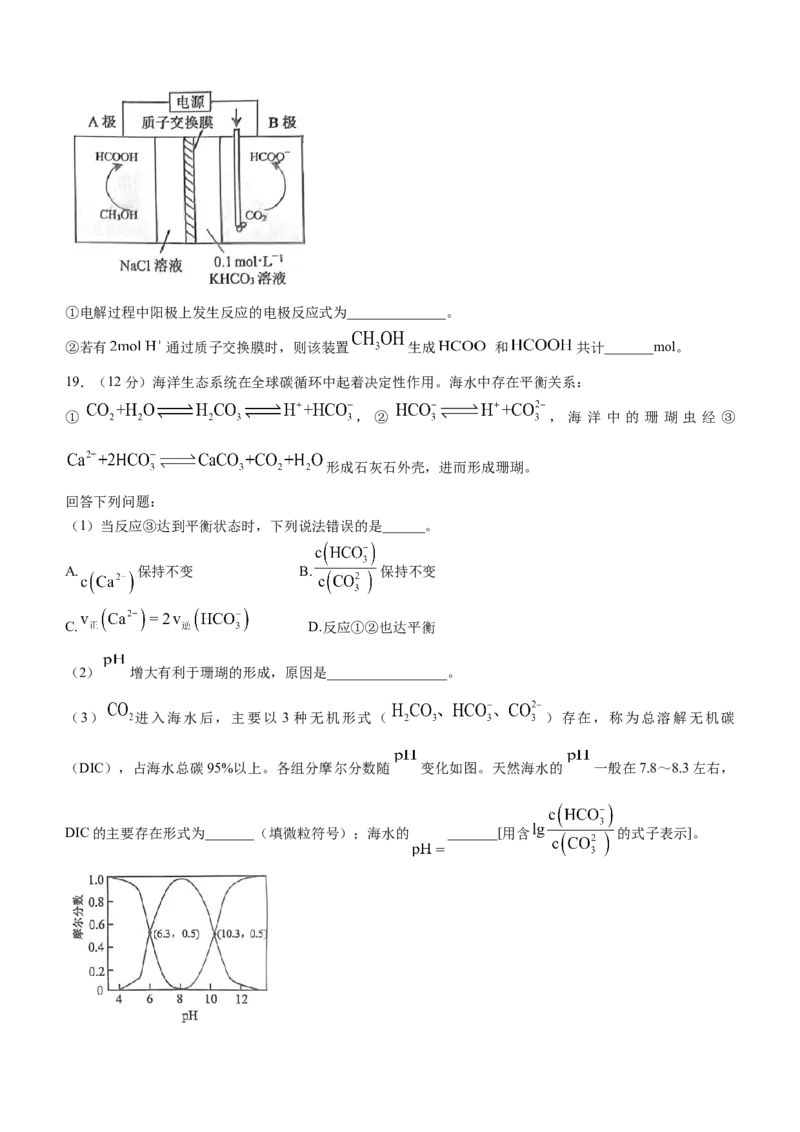
17.(12分)碳酸钠是一种重要的化工原料。某小组模拟侯氏制碱法,制备碳酸钠并测定粗品中碳酸氢钠杂
质的含量。回答下列问题:
I.碳酸钠的制备
上图装置中,有白色晶体析出,经过滤、洗涤、灼烧,得到碳酸钠粗产品。
(1)实验时,须先从____管(填“a”或“b”)通入氨气,有同学建议在甲装置的b管下端连接乙装置,目
的是____________,无水氯化钙的作用是_______。
II.测定碳酸钠粗品中碳酸氢钠的含量
①称取粗品wg溶于水配成 溶液,用仪器m取 于锥形瓶中,滴加4~6滴指示剂a,摇匀。
②用 盐酸滴定至红色刚好消失( 约8.2),消耗盐酸体积为 。
③滴加4~6滴指示剂b,摇匀,用 盐酸滴定至终点( 约3.8),消耗盐酸体积为 。
(2)仪器m的名称是_____________________。
(3)关于滴定操作,下列说法正确的是___________________。
A.滴定前应检查滴定管是否漏水,进行洗涤、润洗
B.进行滴定操作时,眼睛要始终注视着滴定管内液面的变化
C.读数时应将滴定管从架上取下,捏住管中间,使滴定管保持垂直
D.当滴定最后时改为半滴,用锥形瓶内壁沾下悬挂的液滴,再用洗瓶吹出少量蒸馏水冲洗内壁
(4)指示剂a可选用__________,③中滴定终点的现象为_____________。(5)该粗品中 的质量分数为_______ (用含w、 的式子表示)。②中若开始时读数准确,
终点时采用俯视的读数方法,会使测得的 的质量分数______(填“偏大”“偏小”或“无影
响”)。
18.(12分)甲酸( )是一种有机化工原料,广泛用于农药、医药等工业。回答下列问题:
(1)已知室温时, 且在水中有 1%发生电离,由其电离出的 约为水电离出的
的_______倍。
(2)部分弱酸、弱碱的电离平衡常数如下表:
弱酸、弱碱
或
(25℃)
①等物质的量浓度的 a. 溶液、b. 溶液、c. 溶液的 由大到小的顺序为
__________(填序号);浓度均为 的 和 等体积混合后,
溶液中d. 、e. 、f. 、g. 浓度由大到小的顺序为______(填序号)。
②25℃时,向 的氨水中滴加 的 溶液,当滴加 溶液
时,混合溶液的 ,则V_____ (填“>”“<”或“=”)。
③25℃时,将 的 与 的 溶液等体积混合(忽略溶液体积变化),充
分反应后,溶液中存在 ,则该混合溶液中 的电离常数
_______(用含a和b的代数式表示)。
(3)可利用如图装置由甲醇( )制备甲酸或甲酸盐,电极均为惰性电极,工作原理如图所示。①电解过程中阳极上发生反应的电极反应式为______________。
②若有 通过质子交换膜时,则该装置 生成 和 共计_______mol。
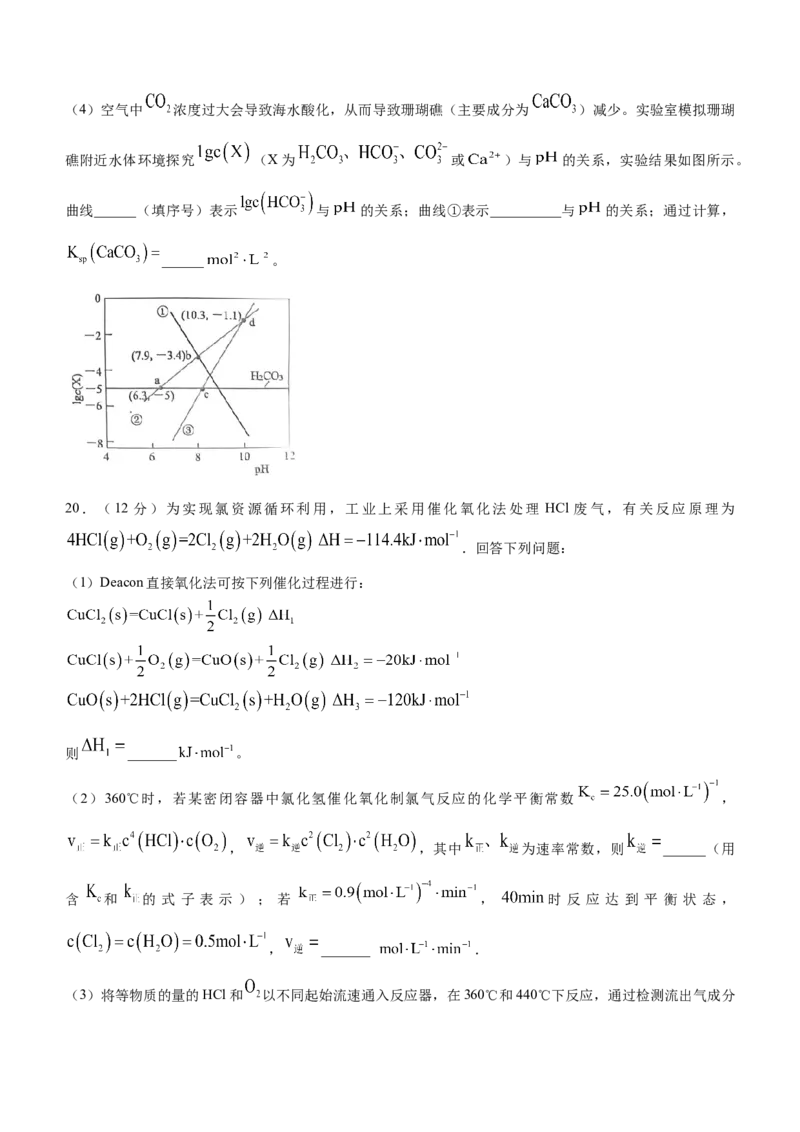
19.(12分)海洋生态系统在全球碳循环中起着决定性作用。海水中存在平衡关系:
① , ② , 海 洋 中 的 珊 瑚 虫 经 ③
形成石灰石外壳,进而形成珊瑚。
回答下列问题:
(1)当反应③达到平衡状态时,下列说法错误的是______。
A. 保持不变 B. 保持不变
C. D.反应①②也达平衡
(2) 增大有利于珊瑚的形成,原因是_________________。
(3) 进入海水后,主要以 3 种无机形式( )存在,称为总溶解无机碳
(DIC),占海水总碳95%以上。各组分摩尔分数随 变化如图。天然海水的 一般在7.8~8.3左右,
DIC的主要存在形式为_______(填微粒符号);海水的 _______[用含 的式子表示]。(4)空气中 浓度过大会导致海水酸化,从而导致珊瑚礁(主要成分为 )减少。实验室模拟珊瑚
礁附近水体环境探究 (X为 或 )与 的关系,实验结果如图所示。
曲线______(填序号)表示 与 的关系;曲线①表示__________与 的关系;通过计算,
______ 。
20.(12 分)为实现氯资源循环利用,工业上采用催化氧化法处理 HCl 废气,有关反应原理为
.回答下列问题:
(1)Deacon直接氧化法可按下列催化过程进行:
则 _______ 。
(2)360℃时,若某密闭容器中氯化氢催化氧化制氯气反应的化学平衡常数 ,
, ,其中 为速率常数,则 ______(用
含 和 的 式 子 表 示 ) ; 若 , 时 反 应 达 到 平 衡 状 态 ,
, _______ .
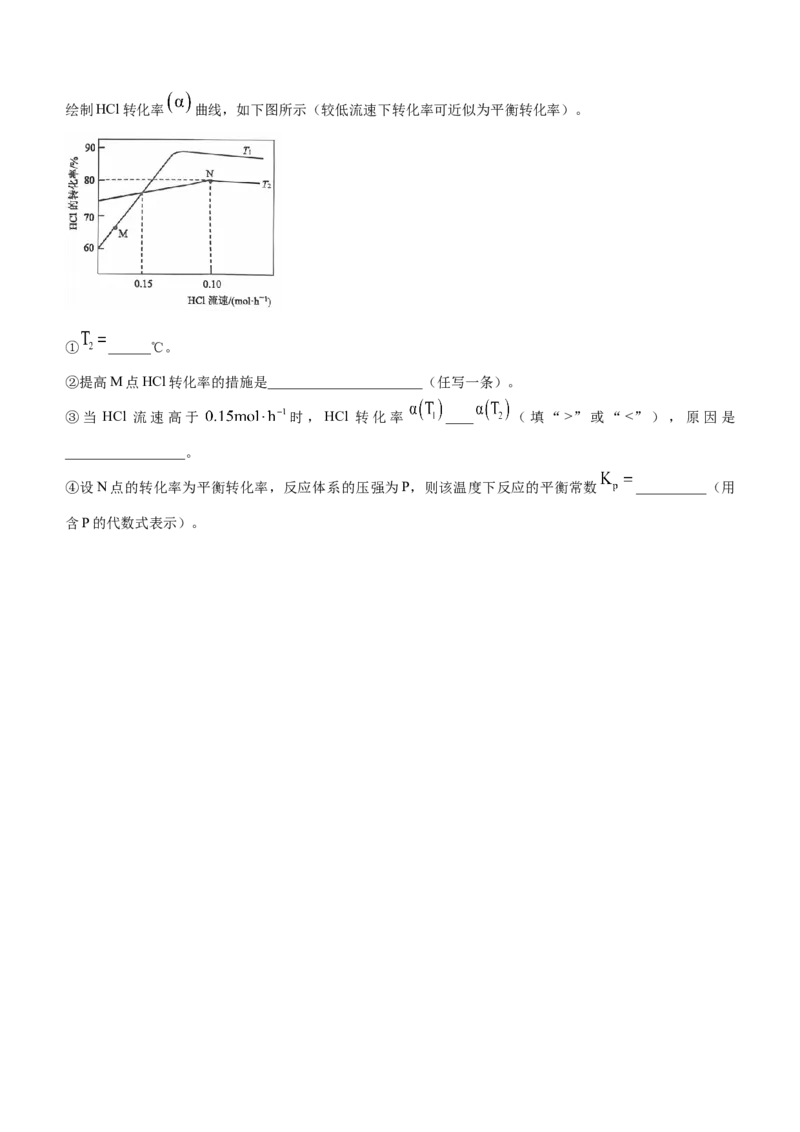
(3)将等物质的量的HCl和 以不同起始流速通入反应器,在360℃和440℃下反应,通过检测流出气成分绘制HCl转化率 曲线,如下图所示(较低流速下转化率可近似为平衡转化率)。
① ______℃。
②提高M点HCl转化率的措施是______________________(任写一条)。
③当 HCl 流速高于 时,HCl 转化率 ____ (填“>”或“<”),原因是
_________________。
④设N点的转化率为平衡转化率,反应体系的压强为P,则该温度下反应的平衡常数 __________(用
含P的代数式表示)。