文档内容
2024-2025 学年度第一学期六校联合体 10 月调研
高三化学
可能用到的相对原子量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Fe-56 Zn-65
一、单项选择题:共14题,每题3分,共42分。每题只有一个选项最符合题意。
1. 2024年政府工作报告中的新质生产力涉及新材料产业。下列材料不属于新型无机非金属材料的是
A. 碳纳米材料 B. 石墨烯 C. 石英光导纤维 D. 聚碳酸酯
2.氮化硅(SiN)可通过反应 制备。下列说法正确的是
3 4
A. 1mol SiO 中含有2molSi—O键 B. 的电子式为
2
C. CO是极性分子 D. Si N 晶体属于分子晶体
3 4
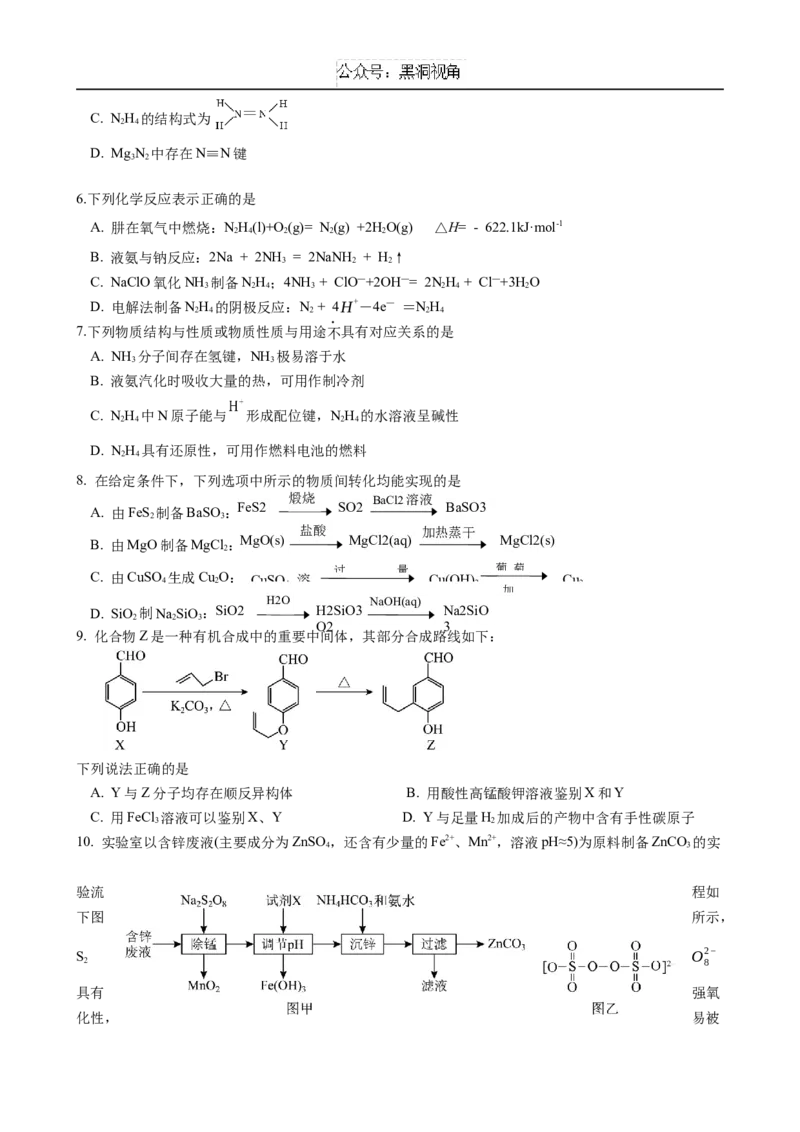
3.下列制取SO 、验证其还原性、收集并进行尾气处理的装置和原理能达到实验目的的是
2
A. 制取 B. 验证还原性 C. 收集 D. 尾气处理
4.臭氧(O)在 [Fe(HO)]2+催化下能将烟气中的SO 、NO 分别氧化为S 和N 。下列关于N、O、
3 2 6 2 x O2− O−
4 3
S、Fe元素及其化合物的说法正确的是
A. 原子半径:S>O>N B. 1mol[Fe(H O) ]2+含有 键数目为12mol
2 6
C. 键角:HO>NH D. 第一电离能: I(N)>I(O)>I(S)
2 3 1 1 1
阅读下列材料,完成5 7题
氮的常见氢化物有∼氨(NH
3
)和肼(N
2
H
4
)。Mg
3
N
2
可与水反应生成NH
3
。液氨可发生微弱电离产生NH−
2
,
液氨能与碱金属(如Na、K)反应产生H。NH 中一个H被—NH 取代可得NH,常温下NH 为液体,具
2 3 2 2 4 2 4
有很高的燃烧热(622kJ·mol-1)。以硫酸为电解质,通过催化电解可将N 转化为NH;碱性条件下,
2 2 4
NaClO氧化NH 也可制备NH。
3 2 4
5.下列说法正确的是
A. NH 和NH 分子中N原子杂化轨道类型不同
3 2 4
B. 液氨电离可表示为: 2NH
NH+
+
NH−
3 4 2C. NH 的结构式为
2 4
D. MgN 中存在N≡N键
3 2
6.下列化学反应表示正确的是
A. 肼在氧气中燃烧:NH(l)+O (g)= N(g) +2H O(g) △H= - 622.1kJ·mol-1
2 4 2 2 2
B. 液氨与钠反应:2Na + 2NH = 2NaNH + H↑
3 2 2
C. NaClO氧化NH 制备NH;4NH + ClO—+2OH—= 2NH + Cl—+3HO
3 2 4 3 2 4 2
D. 电解法制备NH 的阴极反应:N + 4H+-4e— =NH
2 4 2 2 4
7.下列物质结构与性质或物质性质与用途不具有对应关系的是
A. NH 分子间存在氢键,NH 极易溶于水
3 3
B. 液氨汽化时吸收大量的热,可用作制冷剂
C. NH 中N原子能与 形成配位键,NH 的水溶液呈碱性
2 4 2 4
D. NH 具有还原性,可用作燃料电池的燃料
2 4
8. 在给定条件下,下列选项中所示的物质间转化均能实现的是
煅烧 BaCl2溶液
FeS2 SO2 BaSO3
A. 由FeS 制备BaSO:
2 3
盐酸 加热蒸干
MgO(s) MgCl2(aq) MgCl2(s)
B. 由MgO制备MgCl :
2
过 量 葡 萄
C. 由CuSO 4 生成Cu 2 O: CuSO 4 溶 Cu(OH) 2 加 Cu 2
H2O NaOH(aq)
D. SiO 制NaSiO:SiO2 H2SiO3 Na2SiO
2 2 3
O2 3
9. 化合物Z是一种有机合成中的重要中间体,其部分合成路线如下:
下列说法正确的是
A. Y与Z分子均存在顺反异构体 B. 用酸性高锰酸钾溶液鉴别X和Y
C. 用FeCl 溶液可以鉴别X、Y D. Y与足量H 加成后的产物中含有手性碳原子
3 2
10. 实验室以含锌废液(主要成分为ZnSO,还含有少量的Fe2+、Mn2+,溶液pH≈5)为原料制备ZnCO 的实
4 3
验流 程如
下图 所示,
S
O2−
2 8
具有 强氧
化性, 易被还原为SO2− ,SO2−
的结构如图乙所示。下列说法正确的是
4 2 8
A. “除锰”反应的离子方程式为SO2− +Mn2++2H O=2SO2− +MnO↓+4H+
2 8 2 4 2
B. “除锰”反应中每消耗1 mol
SO2−
,硫元素共得到2 mol电子
2 8
C. 试剂X可以选用Zn、ZnO等物质
D. 滤液中一定大量存在的阳离子有Na+、NH 和Zn2+
11.下列实验方案能达到探究目的的是
选项 探究目的 实验方案
Al(OH) − 与CO2− 结合H+ 能 分别测量浓度均为0.1mol·L-1NaCO 溶液和Na[Al(OH) ]溶液
A 4 3 2 3 4
力大小 的pH,比较pH的大小
B HS与HSO 的酸性强弱 向CuSO 溶液中通入HS气体,观察现象
2 2 4 4 2
检验Fe2+对HO 分解是否有催
C 2 2 向HO 溶液中滴入FeCl 溶液,观察产生气泡的速率
化作用 2 2 2
将Fe O 溶于盐酸所得溶液浓缩后,滴入酸性KMnO 溶液,
D 检验Fe O 中含有Fe(II) 3 4 4
3 4 观察溶液颜色的变化
12. 硫酸工业尾气(主要含SO 、N 和O),用NaSO 溶液吸收尾气中的SO 可将其转化为NaHSO,
2 2 2 2 3 2 3
当c(HSO ):c(SO )≈10时,吸收能力下降,需要加热再生为NaSO 溶液。已知K (H SO )=10−1.9,
2 3 a1 2 3
K (H SO )= 10−7.2,下列说法不正确的是
a2 2 3
A. NaHSO 溶液中存在:2c(SO ) + c(HSO )> c(Na+)
3
B. NaSO 溶液吸收SO 的离子方程式为:SO +SO +HO=2HSO−
2 3 2 2 2 3
C. 当c(HSO ):c(SO )=10时,此时吸收液的pH=6.2
D. 与原NaSO 溶液相比,吸收液充分分解放出SO 再生后吸收SO 能力几乎不变
2 3 2 2
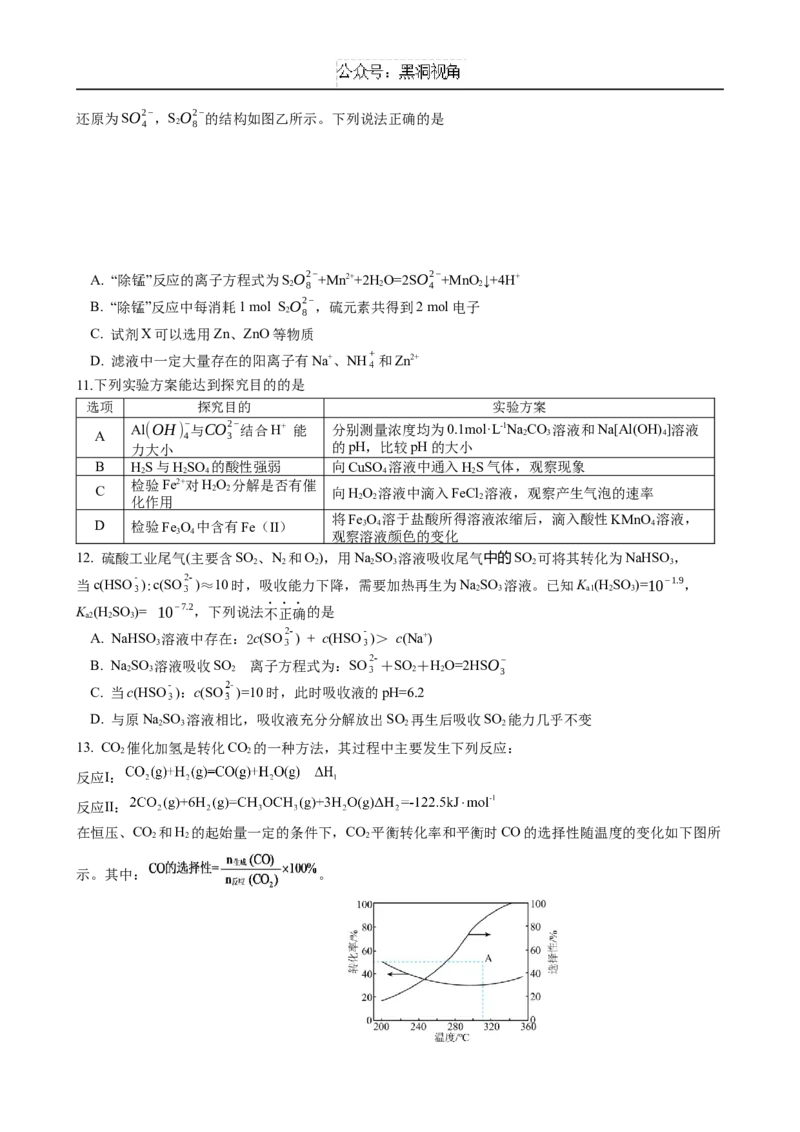
13. CO 催化加氢是转化CO 的一种方法,其过程中主要发生下列反应:
2 2
反应Ⅰ:
反应Ⅱ:
在恒压、CO 和H 的起始量一定的条件下,CO 平衡转化率和平衡时CO的选择性随温度的变化如下图所
2 2 2
示。其中: 。下列说法正确的是
A.
B. △H<0
1
C. 温度高于300 时主要发生反应Ⅱ
D. 其他条件不变,图中A点选择合适催化剂可提高CO的选择性
℃非选择题:共4题,共61分
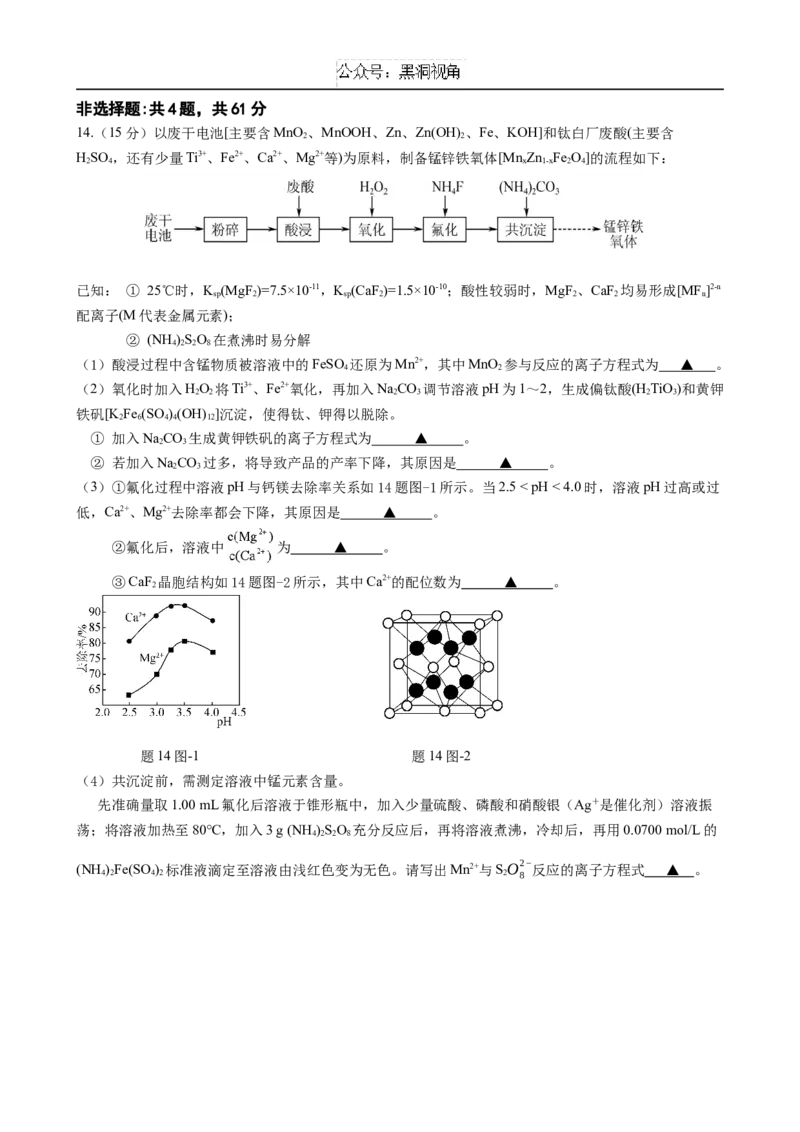
14.(15分)以废干电池[主要含MnO 、MnOOH、Zn、Zn(OH) 、Fe、KOH]和钛白厂废酸(主要含
2 2
HSO ,还有少量Ti3+、Fe2+、Ca2+、Mg2+等)为原料,制备锰锌铁氧体[Mn Zn Fe O]的流程如下:
2 4 x 1-x 2 4
已知: ① 25℃时,K (MgF )=7.5×10-11,K (CaF )=1.5×10-10;酸性较弱时,MgF 、CaF 均易形成[MF ]2-n
sp 2 sp 2 2 2 n
配离子(M代表金属元素);
② (NH )SO 在煮沸时易分解
4 2 2 8
(1)酸浸过程中含锰物质被溶液中的FeSO 还原为Mn2+,其中MnO 参与反应的离子方程式为 ▲ 。
4 2
(2)氧化时加入HO 将Ti3+、Fe2+氧化,再加入NaCO 调节溶液pH为1~2,生成偏钛酸(H TiO)和黄钾
2 2 2 3 2 3
铁矾[K Fe (SO )(OH) ]沉淀,使得钛、钾得以脱除。
2 6 4 4 12
① 加入NaCO 生成黄钾铁矾的离子方程式为 ▲ 。
2 3
② 若加入NaCO 过多,将导致产品的产率下降,其原因是 ▲ 。
2 3
(3)①氟化过程中溶液pH与钙镁去除率关系如14题图-1所示。当2.5 < pH < 4.0时,溶液pH过高或过
低,Ca2+、Mg2+去除率都会下降,其原因是 ▲ 。
②氟化后,溶液中 为 ▲ 。
③CaF 晶胞结构如14题图-2所示,其中Ca2+的配位数为 ▲ 。
2
题14图-1 题14图-2
(4)共沉淀前,需测定溶液中锰元素含量。
先准确量取1.00 mL氟化后溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银(Ag+是催化剂)溶液振
荡;将溶液加热至80℃,加入3 g (NH )SO 充分反应后,再将溶液煮沸,冷却后,再用0.0700 mol/L的
4 2 2 8
(NH )Fe(SO )
标准液滴定至溶液由浅红色变为无色。请写出Mn2+与SO2−
反应的离子方程式 ▲ 。
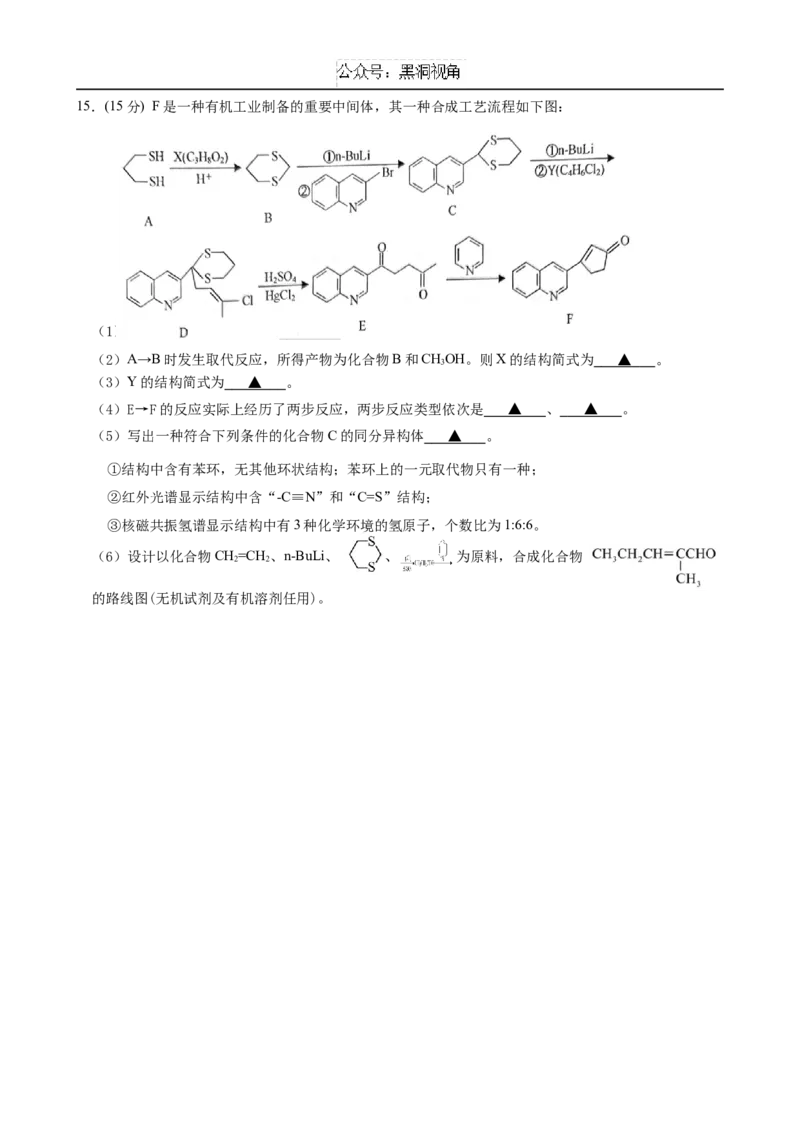
4 2 4 2 2 815.(15分) F是一种有机工业制备的重要中间体,其一种合成工艺流程如下图:
(1)E中含氧官能团的名称为 ▲ 。
(2)A→B时发生取代反应,所得产物为化合物B和CHOH。则X的结构简式为 ▲ 。
3
(3)Y的结构简式为 ▲ 。
(4)E→F的反应实际上经历了两步反应,两步反应类型依次是 ▲ 、 ▲ 。
(5)写出一种符合下列条件的化合物C的同分异构体 ▲ 。
①结构中含有苯环,无其他环状结构;苯环上的一元取代物只有一种;
②红外光谱显示结构中含“-C≡N”和“C=S”结构;
③核磁共振氢谱显示结构中有3种化学环境的氢原子,个数比为1:6:6。
(6)设计以化合物CH=CH 、n-BuLi、 、 为原料,合成化合物
2 2
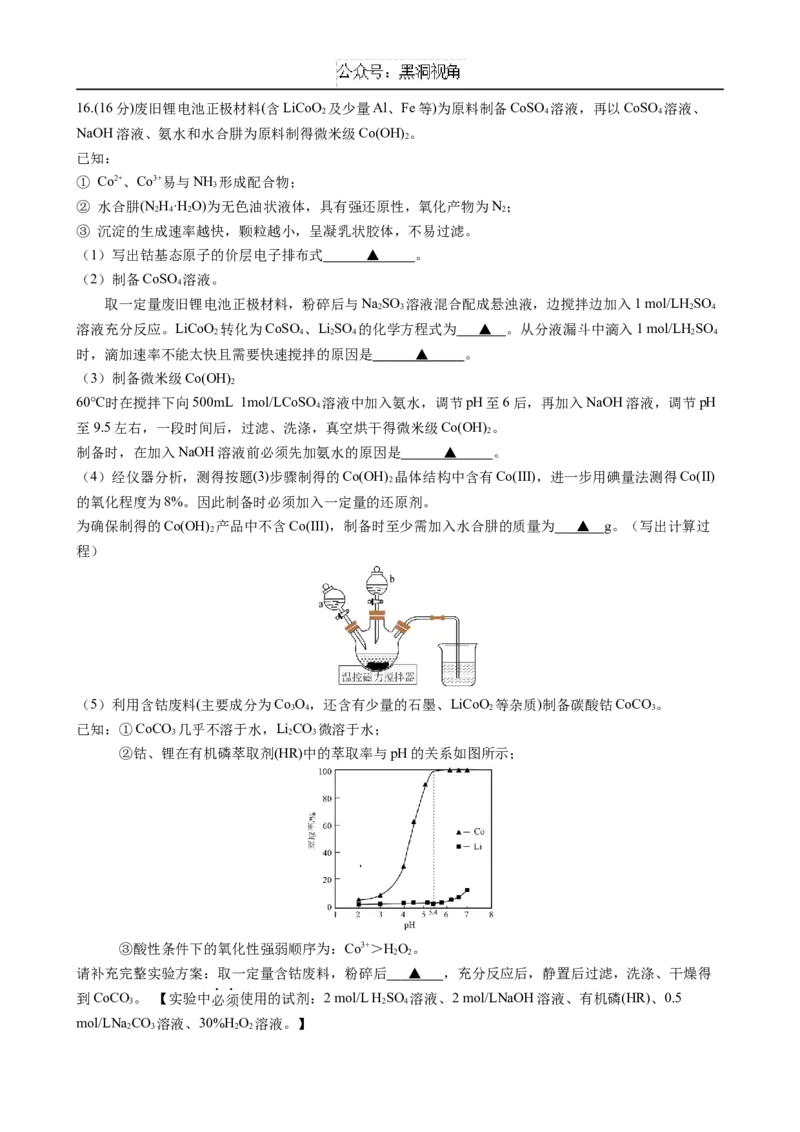
的路线图(无机试剂及有机溶剂任用)。16.(16分)废旧锂电池正极材料(含LiCoO 及少量Al、Fe等)为原料制备CoSO 溶液,再以CoSO 溶液、
2 4 4
NaOH溶液、氨水和水合肼为原料制得微米级Co(OH) 。
2
已知:
① Co2+、Co3+易与NH 形成配合物;
3
② 水合肼(N H·H O)为无色油状液体,具有强还原性,氧化产物为N;
2 4 2 2
③ 沉淀的生成速率越快,颗粒越小,呈凝乳状胶体,不易过滤。
(1)写出钴基态原子的价层电子排布式 ▲ 。
(2)制备CoSO 溶液。
4
取一定量废旧锂电池正极材料,粉碎后与NaSO 溶液混合配成悬浊液,边搅拌边加入1 mol/LH SO
2 3 2 4
溶液充分反应。LiCoO 转化为CoSO 、LiSO 的化学方程式为 ▲ 。从分液漏斗中滴入1 mol/LH SO
2 4 2 4 2 4
时,滴加速率不能太快且需要快速搅拌的原因是 ▲ 。
(3)制备微米级Co(OH)
2
60℃时在搅拌下向500mL 1mol/LCoSO 溶液中加入氨水,调节pH至6后,再加入NaOH溶液,调节pH
4
至9.5左右,一段时间后,过滤、洗涤,真空烘干得微米级Co(OH) 。
2
制备时,在加入NaOH溶液前必须先加氨水的原因是 ▲ 。
(4)经仪器分析,测得按题(3)步骤制得的Co(OH) 晶体结构中含有Co(III),进一步用碘量法测得Co(II)
2
的氧化程度为8%。因此制备时必须加入一定量的还原剂。
为确保制得的Co(OH) 产品中不含Co(III),制备时至少需加入水合肼的质量为 ▲ g。(写出计算过
2
程)
(5)利用含钴废料(主要成分为Co O,还含有少量的石墨、LiCoO 等杂质)制备碳酸钴CoCO。
3 4 2 3
已知:①CoCO 几乎不溶于水,LiCO 微溶于水;
3 2 3
②钴、锂在有机磷萃取剂(HR)中的萃取率与pH的关系如图所示;
③酸性条件下的氧化性强弱顺序为:Co3+>HO。
2 2
请补充完整实验方案:取一定量含钴废料,粉碎后 ▲ ,充分反应后,静置后过滤,洗涤、干燥得
到CoCO。 【实验中必须使用的试剂:2 mol/L H SO 溶液、2 mol/LNaOH溶液、有机磷(HR)、0.5
3 2 4
mol/LNa CO 溶液、30%H O 溶液。】
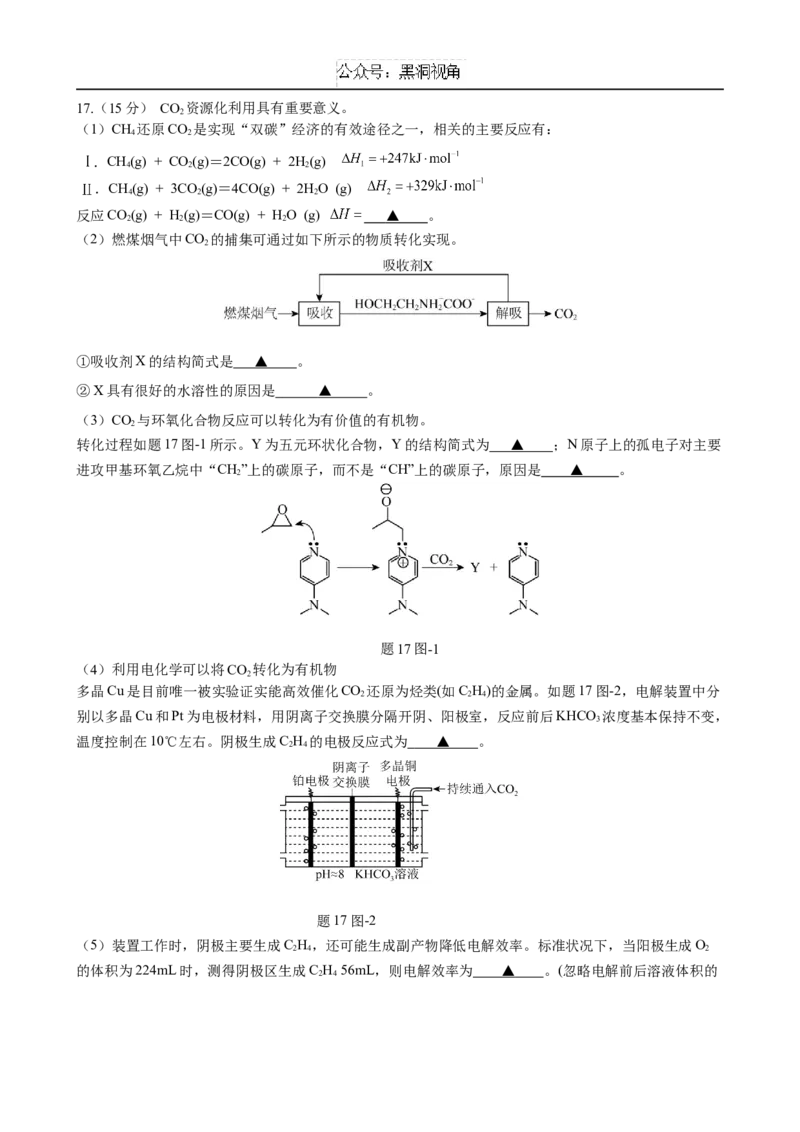
2 3 2 217.(15分) CO 资源化利用具有重要意义。
2
(1)CH 还原CO 是实现“双碳”经济的有效途径之一,相关的主要反应有:
4 2
.CH(g) + CO(g)=2CO(g) + 2H(g)
4 2 2
.CH(g) + 3CO(g)=4CO(g) + 2HO (g)
4 2 2
反应CO(g) + H(g)=CO(g) + HO (g) ▲ 。
2 2 2
(2)燃煤烟气中CO 的捕集可通过如下所示的物质转化实现。
2
①吸收剂X的结构简式是 ▲ 。
②X具有很好的水溶性的原因是 ▲ 。
(3)CO 与环氧化合物反应可以转化为有价值的有机物。
2
转化过程如题17图-1所示。Y为五元环状化合物,Y的结构简式为 ▲ ;N原子上的孤电子对主要
进攻甲基环氧乙烷中“CH”上的碳原子,而不是“CH”上的碳原子,原因是 ▲ 。
2
题17图-1
(4)利用电化学可以将CO 转化为有机物
2
多晶Cu是目前唯一被实验证实能高效催化CO 还原为烃类(如C H)的金属。如题17图-2,电解装置中分
2 2 4
别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO 浓度基本保持不变,
3
温度控制在10℃左右。阴极生成C H 的电极反应式为 ▲ 。
2 4
题17图-2
(5)装置工作时,阴极主要生成C H,还可能生成副产物降低电解效率。标准状况下,当阳极生成O
2 4 2
的体积为224mL时,测得阴极区生成C H 56mL,则电解效率为 ▲ 。(忽略电解前后溶液体积的
2 4变化)已知:电解效率