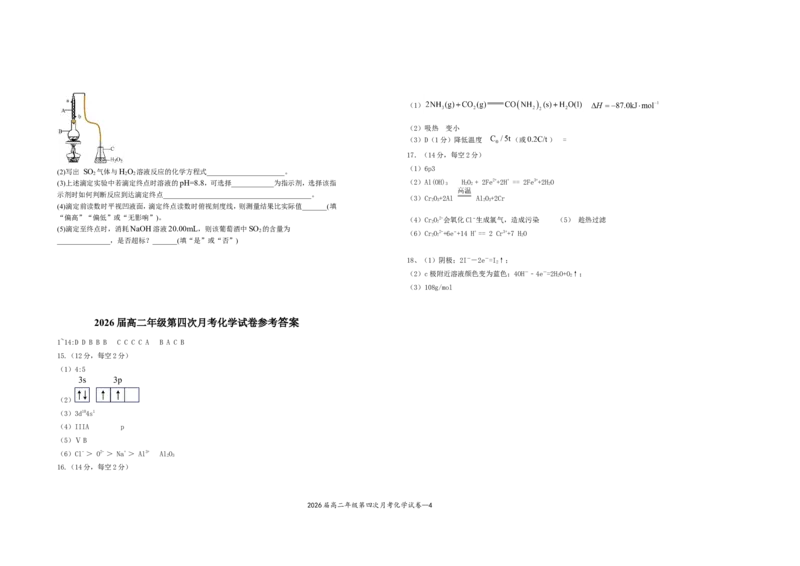文档内容
2026届高二年级第四次月考化学试卷(12.29)
1.下列有关实验操作或测量数据的说法正确的是( )
A.中和滴定实验中指示剂不宜加入过多,通常控制量在1 mL ~2mL
B.用碱式滴定管量取高锰酸钾溶液20.00 mL
C.用pH试纸测量次氯酸钠溶液的pH为11.5
D.滴定管、容量瓶和分液漏斗在使用前都要先查漏
2.下列变化一定会引起平衡移动的是 ( )
①反应速率的变化 ②浓度的变化 ③各组分百分含量的变化
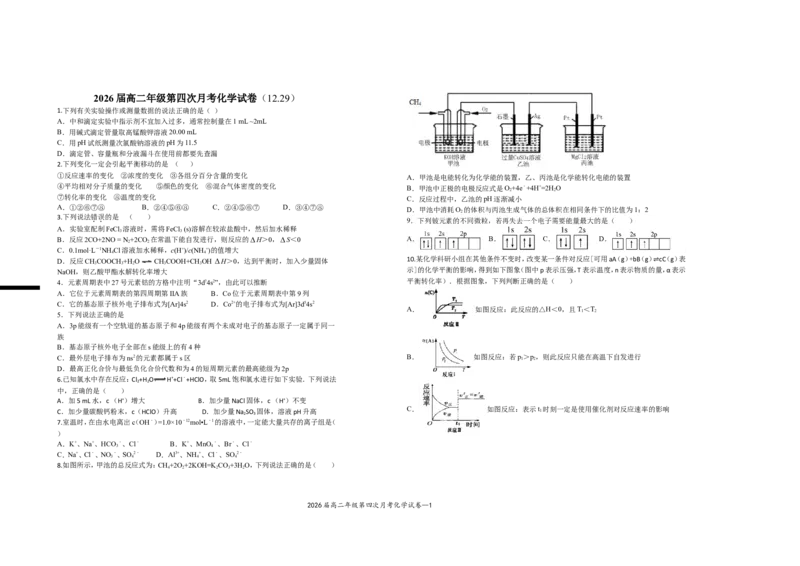
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
④平均相对分子质量的变化 ⑤颜色的变化 ⑥混合气体密度的变化 B.甲池中正极的电极反应式是O+4e﹣+4H+=2H O
2 2
⑦转化率的变化 ⑧温度的变化
C.反应过程中,乙池的pH逐渐减小
A.①②⑥⑦⑧ B.②④⑤⑥⑧ C.②④⑤⑥⑦ D.③④⑦⑧
D.甲池中消耗O 的体积与丙池生成气体的总体积在相同条件下的比值为1:2
2
3.下列说法错误的是 ( )
9.下列铍元素的不同微粒,若再失去一个电子需要能量最大的是( )
A.实验室配制FeCl 溶液时,需将FeCl (s)溶解在较浓盐酸中,然后加水稀释
3 3
B.反应2CO+2NO = N +2CO 在常温下能自发进行,则反应的H>0,S<0 A. B. C. D.
2 2
C.0.1mol·L-1NH Cl溶液加水稀释,c(H+)/c(NH +)的值增大
4 4
D.反应CHCOOCH +H O CHCOOH+CH OH H>0,达到平衡时,加入少量固体
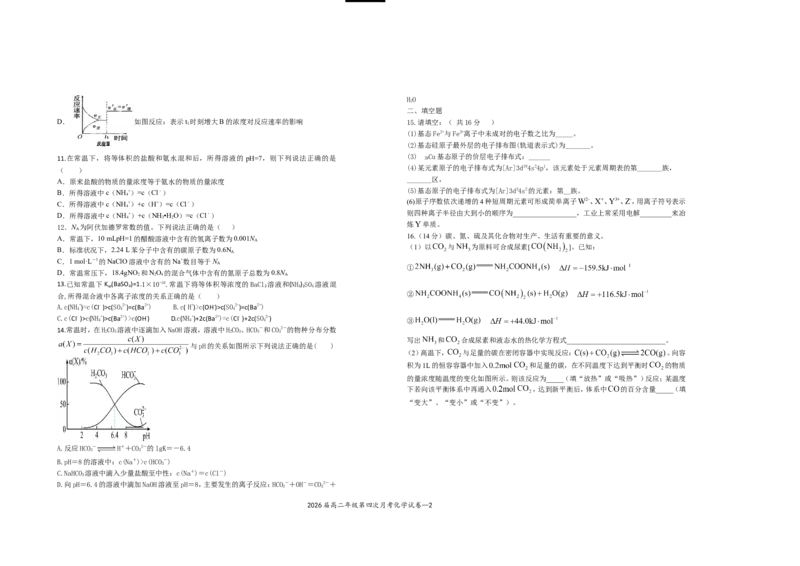
10.某化学科研小组在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g) cC(g)表
3 3 2 3 3
NaOH,则乙酸甲酯水解转化率增大
示]的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示
⇌
4.元素周期表中27号元素钴的方格中注明“3d74s2”,由此可以推断 平衡转化率).根据图象,下列判断正确的是( )
A.它位于元素周期表的第四周期第IIA族 B.Co位于元素周期表中第9列
C.它的基态原子核外电子排布式为[Ar]4s2 D.Co2+的电子排布式为[Ar]3d54s2
A. 如图反应:此反应的△H<0,且T<T
1 2
5.下列说法正确的是
A.3p能级有一个空轨道的基态原子和4p能级有两个未成对电子的基态原子一定属于同一
族
B.基态原子核外电子全部在s能级上的有4种
C.最外层电子排布为ns2的元素都属于s区 B. 如图反应:若p
1
>p
2
,则此反应只能在高温下自发进行
D.最高正化合价与最低负化合价代数和为4的短周期元素的最高能级为2p
6.已知氯水中存在反应:Cl +H O H++Cl﹣+HClO,取5mL饱和氯水进行如下实验.下列说法
2 2
中,正确的是( )
A.加5 mL水,c (H+)增大 B.加少量NaCl固体,c (H+)不变
C. 如图反应:表示t 时刻一定是使用催化剂对反应速率的影响
C.加少量碳酸钙粉末,c(HClO)升高 D.加少量Na SO 固体,溶液pH升高 1
2 3
7.室温时,在由水电离出c(OH﹣)=1.0×10﹣12mol•L﹣1的溶液中,一定能大量共存的离子组是(
)
A.K+、Na+、HCO ﹣、Cl﹣ B.K+、MnO ﹣、Br﹣、Cl﹣
3 4
C.Na+、Cl﹣、NO ﹣、SO 2﹣ D.Al3+、NH +、Cl﹣、SO 2﹣
3 4 4 4
8.如图所示,甲池的总反应式为:CH+2O +2KOH=K CO+3H O,下列说法正确的是( )
4 2 2 3 2
2026届高二年级第四次月考化学试卷--1HO
2
二、填空题
D. 如图反应:表示t 时刻增大B的浓度对反应速率的影响 15.请填空:( 共16分 )
1
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为_____。
(2)基态硅原子最外层的电子排布图(轨道表示式)为_______。
11.在常温下,将等体积的盐酸和氨水混和后,所得溶液的 pH=7,则下列说法正确的是 (3) 29 Cu基态原子的价层电子排布式:______
(4)某元素原子的电子排布式为[Ar]3d104s24p1,该元素处于元素周期表的第_______族,
( )
_______区,
A.原来盐酸的物质的量浓度等于氨水的物质的量浓度
B.所得溶液中c(NH +)=c(Cl﹣)
(5)基态原子的电子排布式为[Ar]3d34s2的元素:第__族。
4
C.所得溶液中c(NH +)+c(H+)=c(Cl﹣)
(6)原子序数依次递增的4种短周期元素可形成简单离子W2-、X+、Y3+、Z-,用离子符号表示
4
D.所得溶液中c(NH +)+c(NH •H O)=c(Cl﹣)
则四种离子半径由大到小的顺序为__________________,工业上常采用电解_________来冶
4 3 2
炼Y单质。
12.N 为阿伏加德罗常数的值。下列说法正确的是( )
A
16.(14分)碳、氮、硫及其化合物对生产、生活有重要的意义。
A.常温下,10 mLpH=1的醋酸溶液中含有的氢离子数为0.001N
A
(1)以 与 为原料可合成尿素[ ]。已知:
B.标准状况下,2.24 L苯分子中含有的碳原子数为0.6N
A
C.1 mol·L-1的NaClO溶液中含有的Na+数目等于N
A
①
D.常温常压下,18.4gNO 和NO 的混合气体中含有的氮原子总数为0.8N
2 2 4 A
13.已知常温下K (BaSO )=1.1×10-10.常温下将等体积等浓度的BaCl 溶液和(NH) SO 溶液混
sp 4 2 4 2 4
合,所得混合液中各离子浓度的关系正确的是( ) ②
A.c(NH+)=c(CI- )>c(SO2-)=c(Ba2+) B.c( H+)>c(OH-)>c(SO2-)=c(Ba2+)
4 4 4
C.c(CI- )>c(NH
4
+)>c(Ba2+)>c(OH-) D.c(NH
4
+)+2c(Ba2+)=c(CI- )+2c(SO
4
2-)
③
14.常温时,在HCO 溶液中逐滴加入NaOH溶液,溶液中HCO、HCO-和CO2-的物种分布分数
2 3 2 3 3 3
写出 和 合成尿素和液态水的热化学方程式____________________________。
与pH的关系如图所示下列说法正确的是( )
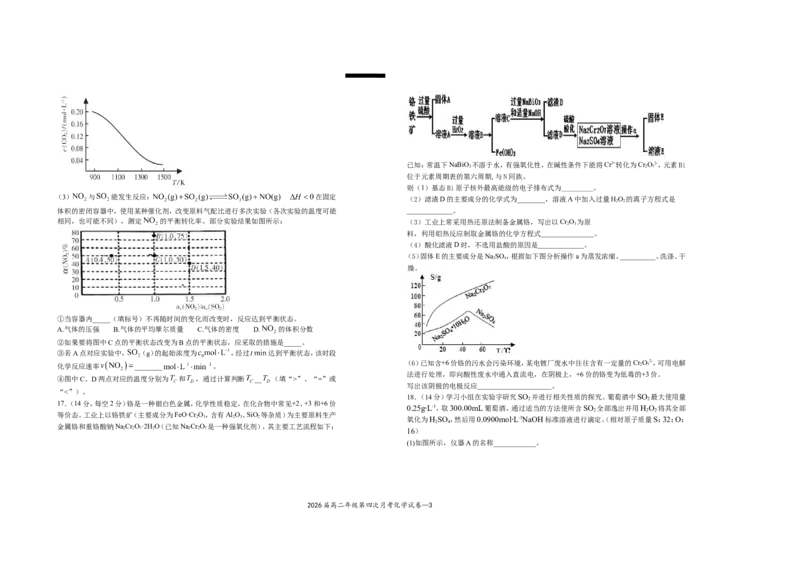
(2)高温下, 与足量的碳在密闭容器中实现反应: 。向容
积为1L的恒容容器中加入 和足量的碳,在不同温度下达到平衡时 的物质
的量浓度随温度的变化如图所示。则该反应为_____(填“放热”或“吸热”)反应;某温度
下若向该平衡体系中再通入 ,达到新平衡后,体系中 的百分含量_____(填
“变大”、“变小”或“不变”)。
A.反应HCO- H++CO2-的lgK=-6.4
3 3
B.pH=8的溶液中:c(Na+)>c(HCO-)
3
C.NaHCO 溶液中滴入少量盐酸至中性:c(Na+)=c(Cl-)
3
D.向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO-+OH-=CO2-+
3 3
2026届高二年级第四次月考化学试卷--2已知:常温下NaBiO 不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为Cr O2-,元素Bi
3 2 7
位于元素周期表的第六周期,与N同族。
则(1)基态Bi原子核外最高能级的电子排布式为_________。
(3) 与 能发生反应: 在固定
(2)滤渣D的主要成分的化学式为________,溶液A中加入过量HO 的离子方程式是
2 2
体积的密闭容器中,使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能 _____________。
相同,也可能不同),测定 的平衡转化率。部分实验结果如图所示: (3)工业上常采用热还原法制备金属铬,写出以Cr O 为原
2 3
料,利用铝热反应制取金属铬的化学方程式_______________。
(4)酸化滤液D时,不选用盐酸的原因是_____________。
(5)固体E的主要成分是NaSO ,根据如下图分析操作a为蒸发浓缩、__________、洗涤、干
2 4
燥。
①当容器内_____(填标号)不再随时间的变化而改变时,反应达到平衡状态。
A.气体的压强 B.气体的平均摩尔质量 C.气体的密度 D. 的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是_____。
③若A点对应实验中, (g)的起始浓度为 ,经过 达到平衡状态,该时段
(6)已知含+6价铬的污水会污染环境,某电镀厂废水中往往含有一定量的Cr O2-,可用电解
化学反应速率 ________ 。 2 7
法进行处理,即向酸性废水中通入直流电,在阴极上,+6价的铬变为低毒的+3价。
④图中C、D两点对应的温度分别为 和 ,通过计算判断 __ (填“>”、“=”或
写出该阴极的电极反应_____________________。
“<”)。
18.(14分)学习小组在实验字研究SO 并进行相关性质的探究。葡萄酒中SO 最大使用量
2 2
17.(14分,每空2分)铬是一种银白色金属,化学性质稳定,在化合物中常见+2、+3和+6价
0.25gL-1,取300.00mL葡萄酒,通过适当的方法使所含SO 全部逸出并用H O 将其全部
2 2 2
等价态。工业上以铬铁矿(主要成分为FeO·Cr O,含有Al O、SiO 等杂质)为主要原料生产
2 3 2 3 2 氧化为H SO ,然后用0.0900molL-1NaOH标准溶液进行滴定。(相对原子质量S:32;O:
2 4
金属铬和重铬酸钠NaCr O·2H O(已知NaCr O 是一种强氧化剂),其主要工艺流程如下: ∙
2 2 7 2 2 2 7 16)
∙
(1)如图所示,仪器A的名称____________。
2026届高二年级第四次月考化学试卷--3(1)
(2)吸热 变小
(3)D(1分)降低温度 (或 ) =
17.(14分,每空2分)
(1)6p3
(2)写出 SO 气体与H O 溶液反应的化学方程式______________________。
2 2 2
(3)上述滴定实验中若滴定终点时溶液的pH=8.8,可选择____________为指示剂,选择该指 (2)Al(OH)
3
H
2
O
2
+ 2Fe2++2H+ == 2Fe3++2H
2
O
示剂时如何判断反应到达滴定终点__________________________________________。
(3)CrO+2Al AlO+2Cr
2 3 2 3
(4)滴定前读数时平视凹液面,滴定终点读数时俯视刻度线,则测量结果比实际值_______(填
“偏高”“偏低”或“无影响”)。 (4)CrO2-会氧化Cl−生成氯气,造成污染 (5) 趁热过滤
2 7
(5)滴定至终点时,消耗NaOH溶液20.00mL,则该葡萄酒中SO 的含量为
2 (6)CrO2-+6e−+14 H+ == 2 Cr3++7 HO
2 7 2
_______________,是否超标?_______(填“是”或“否”)
18、(1)阴极;2I--2e-=I↑;
2
(2)c极附近溶液颜色变为蓝色;4OH-﹣4e-=2HO+O↑;
2 2
(3)108g/mol
2026届高二年级第四次月考化学试卷参考答案
1~14:D D B B B C C C C A B A C B
15.(12分,每空2分)
(1)4:5
(2)
(3)3d104s1
(4)IIIA p
(5)ⅤB
(6)Cl- > O2- > Na+ > Al3+ AlO
2 3
16.(14分,每空2分)
2026届高二年级第四次月考化学试卷--4