文档内容
2024 年高三基础测试
化学试题卷
(2024.9)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 K-39 Mn-55
一 、选择题(本大题共16小题,每小题3分,共48分。每小题列出的四个备选项中
只有 一个是符合题目要求的,不选、多选、错选均不得分)
1.按物质组成或性质分类,Na[Al(OH)₄] 属于
A. 碱 B. 酸 C. 碱式盐 D. 强电解质
2.下列说法不正确的是
A. 活性炭具有吸附性,可用于分解挣化室内甲醛
B. 甲烷具有还原性,可用于制作燃料电池
C. 次氯酸钠具有氧化性,可用于衣物漂白
D. 石灰乳具有碱性,可用于除去废气中的二氧化硫
3.下列化学用语或表述正确的是
A.O₃ 分子的球棍模型:
B.PHs的电子式:
C. 用电子云轮廓图示意 “p-p”π 键的形成:
Q-Q-C
D. 顺-2-丁烯的结构简式: —
)
4.下列说法不正确的是
① ② ③ ④
A.① 可用于精确测定某溶液的pH 值
B.② 可用于稀硫酸溶液的配制
C.③ 可用于制取乙酸乙酯
D.④ 可用于铜丝与稀硝酸反应并吸收尾气
5. 下列说法正确的是
A. 煤的焦化就是将煤在空气中加强热使之分解为燥气、煤焦油、焦炭等
B. 氛化钠不能使蛋白质变性,但可用作食品防腐剂
C, 毫饪菜有时不宜过早加入“加碘盐”,是为了防止KI 被氧化
D. 制作面点时加入食用纯碱,利用NaHCO₃ 中和发酵过程产生的
酸 高三基础测试化学试题卷第1页(共8页)10. 原子序数依次增大的 X 、Y 、Z 、M和 Q 五种短周期主族元素。X 的最高正化合
价和 最低负化合价的绝对值相等,基态Y 原子同能层各能级上的电子数均相等,基态
Z 原子 的第一电离能小于同周期的相邻元素、M 是同周期元素中简单离子半径最小
的,Q 的单 质为黄绿色气体。下列说法不正确的是
A. 沸点:X 和 Y 形成的化合物离子键成分
D. 酸性大小:
11.某温度下,在恒容密闭容器中充入一定量的X(g), 发生下列反应:
反应I X(g)一 Y(g)△H₁<0: 反应Ⅱ Y(g) 一 Z(g)△H₂<0
测得各气体浓度与反应时间的关系如图所示。下列说法不正确的是
A. 活化能:Ea(I)离子键成分
D. 酸性大小:
11.某温度下,在恒容密闭容器中充入一定量的X(g), 发生下列反应:
反应I X(g)一 Y(g)△H₁<0: 反应Ⅱ Y(g) 一 Z(g)△H₂<0
测得各气体浓度与反应时间的关系如图所示。下列说法不正确的是
A. 活化能:Ea(I)[Fc(CN)₆]³-
过 C 程 . 中电,负 F 性 e²⁴ : 与 N > F 0 e > ³+ C 含 量 发 生 变 化 、 依 次 变 为 A 、 B 、 C D 三 . ∠种结 H 构 CH , 其 大过小程如:图 C 甲 H₄ 所 > 示 CH 。 ₃ E
C
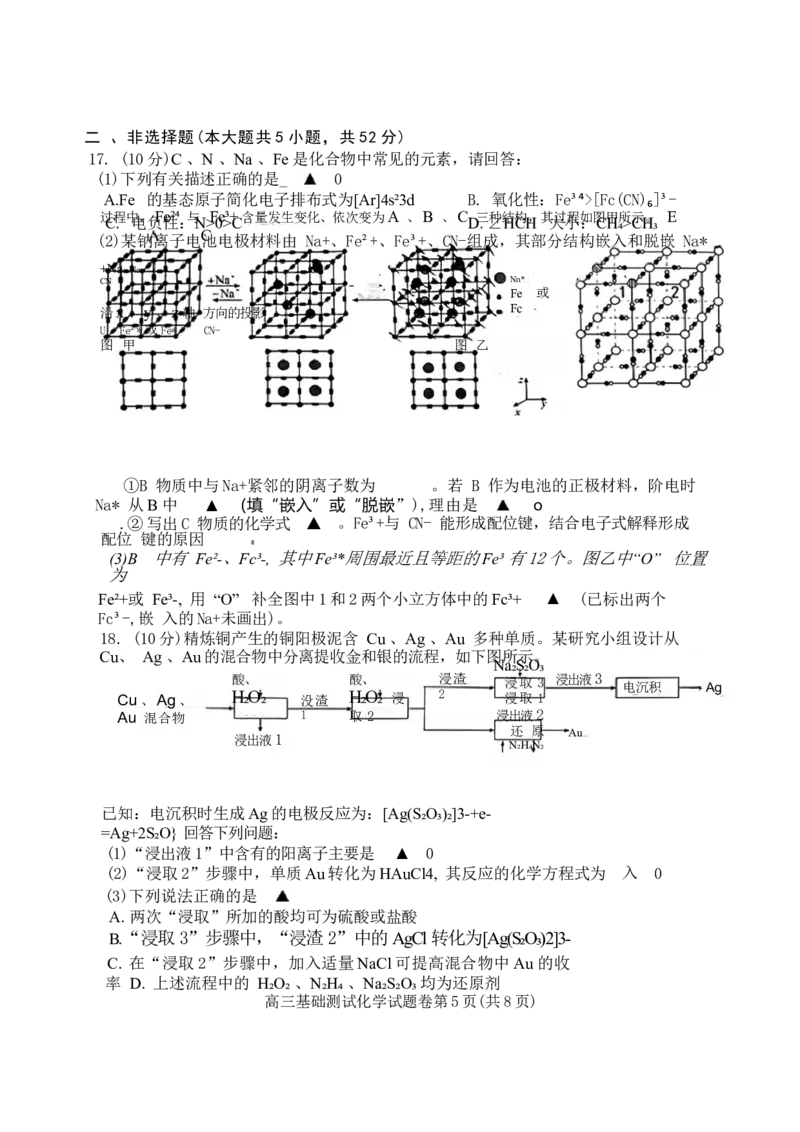
(2)某钠离子电池电极材料由 Na+、Fe²+、Fe³+、CN-组成,其部分结构嵌入和脱嵌 Na*
+Na -Na
CN Nn*
Fe 或
沿x、y、z轴 方向的投影 Fc
U Fe²*或Fe* CN-
图 甲 图 乙
①B 物质中与Na+紧邻的阴离子数为 。若 B 作为电池的正极材料,阶电时
Na* 从B中 ▲ (填“嵌入”或“脱嵌”),理由是 o
.②写出C 物质的化学式 ▲ 。Fe³+与 CN- 能形成配位键,结合电子式解释形成
配位 键的原因
(3)B 中有 Fe²-、Fc³-, 其中Fe³*周围最近且等距的Fe³ 有12个。图乙中“O” 位置
为
Fe²+或 Fe³-, 用 “O” 补全图中1和2两个小立方体中的Fc³+ ▲ (已标出两个
Fc³-,嵌 入的Na+未画出)。
18. (10分)精炼铜产生的铜阳极泥含 Cu 、Ag 、Au 多种单质。某研究小组设计从
Cu、 Ag 、Au的混合物中分离提收金和银的流程,如下图所示。
Na₂S₂O₃
酸、 酸、 浸渣 浸取 3 浸出液3
电沉积 →Ag
Cu、Ag、 H₂O₂ 没渣 H₂O₂ 浸 2 浸取 1
Au 混合物 1 取 2 浸出液2
还 原 Au
浸出液1
N₂H₄N₂
已知:电沉积时生成Ag的电极反应为:[Ag(S₂O₃)₂]3-+e-
=Ag+2S₂O} 回答下列问题:
(1)“浸出液1”中含有的阳离子主要是 ▲ 0
(2)“浸取2”步骤中,单质Au转化为HAuCl4, 其反应的化学方程式为 入 0
(3)下列说法正确的是
A. 两次“浸取”所加的酸均可为硫酸或盐酸
B.“浸取3”步骤中,“浸渣2”中的AgCl转化为[Ag(S₂O₃)2]3-
C. 在“浸取2”步骤中,加入适量NaCl可提高混合物中Au 的收
率 D. 上述流程中的 H₂O₂ 、N₂H₄ 、Na₂S₂O₃均为还原剂
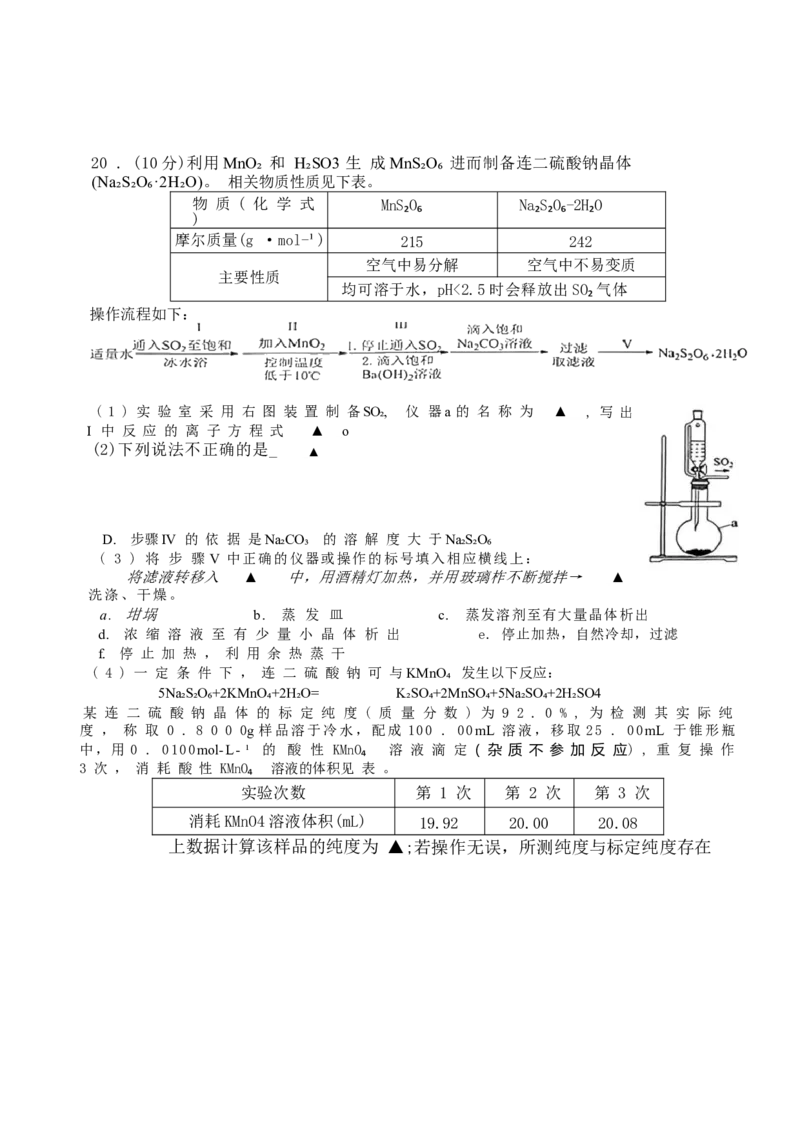
高三基础测试化学试题卷第5页(共8页)20 . (10分)利用MnO₂ 和 H₂SO3 生 成MnS₂O₆ 进而制备连二硫酸钠晶体
(Na₂S₂O₆·2H₂O)。 相关物质性质见下表。
物 质 ( 化 学 式 MnS₂O₆ Na₂S₂O₆-2H₂O
)
摩尔质量(g ·mol-¹) 215 242
空气中易分解 空气中不易变质
主要性质
均可溶于水,pH<2.5时会释放出SO₂气体
操作流程如下:
( 1 ) 实 验 室 采 用 右 图 装 置 制 备SO₂, 仪 器a 的 名 称 为 ▲ , 写 出 步 骤
I 中 反 应 的 离 子 方 程 式 ▲ o
(2)下列说法不正确的是_
▲
D. 步骤IV 的 依 据 是Na₂CO₃ 的 溶 解 度 大 于Na₂S₂O₆
( 3 ) 将 步 骤 V 中正确的仪器或操作的标号填入相应横线上:
将滤液转移入 ▲ 中,用酒精灯加热,并用玻璃柞不断搅拌→ ▲
洗涤、干燥。
a. 坩埚 b. 蒸 发 皿 c. 蒸发溶剂至有大量晶体析出
d. 浓 缩 溶 液 至 有 少 量 小 晶 体 析 出 e. 停止加热,自然冷却,过滤
f. 停 止 加 热 , 利 用 余 热 蒸 干
( 4 ) 一 定 条 件 下 , 连 二 硫 酸 钠 可 与KMnO₄ 发生以下反应:
5Na₂S₂O₆+2KMnO₄+2H₂O= K₂SO₄+2MnSO₄+5Na₂SO₄+2H₂SO4
某 连 二 硫 酸 钠 晶 体 的 标 定 纯 度 ( 质 量 分 数 ) 为 9 2 . 0 % , 为 检 测 其 实 际 纯
度 , 称 取 0 . 8 0 0 0g 样品溶于冷水,配成 100 . 00mL 溶液,移取 25 . 00mL 于锥形瓶
中,用 0 . 0100mol-L- ¹ 的 酸 性 KMnO₄ 溶 液 滴 定 ( 杂 质 不 参 加 反 应) , 重 复 操 作
3 次 , 消 耗 酸 性 KMnO₄ 溶液的体积见 表 。
实验次数 第 1 次 第 2 次 第 3 次
消耗KMnO4溶液体积(mL) 19.92 20.00 20.08
上数据计算该样品的纯度为 ▲ ;若操作无误,所测纯度与标定纯度存在(安航装置中常用超氧化钾(KO₂) 作 CO₂ 吸收剂和供氧剂,反应方程式(未配平)为:
7KO₂+CO₂+K₂CO₃+O₂,NA 为阿伏加德罗常数的值。下列说法不正确的是
A.7.1gKO₂ 晶体中离子的数目为0.2N;
B. 可 用Na₂O₂ 代替宇航装置中的KO₂
C. 氧化剂与还原剂的物质的量之比为3:1
D. 该反应生成11.2L (标准状况下)O₂ 时转移0.5NA个申子
7.物质微观结构决定宏观性质,进而影响用途。下列结构或性质不能解释其用途的是
选项 结构或性质 用途
在碳素钢里适量加入铬和镍后形成的不锈钢 可制成医疗器材、厨房用具和地
A
不易生锈,具有很强的抗腐蚀能力 铁列车的车体等
石墨层内未杂化的p轨道重叠使电子可在
B 石墨可作润滑剂
整 个碳原子层平面内运动
高铁酸钠具有氧化性,氢氧化铁胶体具有 高铁酸钠可用于水体的消毒、
C
吸附性 净化
能有效作用于疟原虫体内的膜丝
D
白,从而起到治疗疟疾的效果
青蒿素 )中含有过氧键
8.下列离子方程式或化学方程式正确的是
A.向 含 有 1mol明矾的溶液中滴加Ba(OH)₂ 溶液至铝离子完全沉
淀: Al³⁴+2SO2-+2Ba²-+30H-=Al(OH)₃I+2BaSO₄
B. 含氟牙膏防治龋齿:Cas(PO4)₃ (OHD(s)+F(aq)一 Cas(PO₄)₃F(s)+OH(aq)
C.2- 丙醇的催化氧化:
D. 用氢氟酸刻蚀玻璃:SiO₂+4F-+4H*=SiF₄t+2H₂O
9.某种用于制作镜片的聚碳酸酯 X 制备原理如下,若将有毒的光气改成碳酸二甲
酯
(CH₃OCOOCH₃),也可与 A 反应制得 X。以下说法不正确的是
A. 光气水解产生氯化氢和二氧化碳
B. 原 料A 为一种二酚类物质
C. 原 料A 与足量H₂ 加成后的产物分子中含4个手性碳原子
D. 碳酸二甲酯和A 反应的产物中有甲醇
高三基础测试化学试题卷第2页(共8页)13. 以 Pt 为电极,一定浓度的 NaBr 溶液为电解
液, 采用电解和催化相结合的循环方式,可实现高
效制 H₂ 和 O₂, 装置如图所示。下列说法不正确
的是
A.X 为 H₂Y 为 NaBr,Z 为 O
B. 电 极b 连接电源正极
C. 电解总反应式为
D. 催化阶段反应产物物质的量之比n(Z):n(Br~)=3:2
1 4 . 镓(Ga) 常用作半导体的原料,能形成化合物 Ga₆ I₆, 研究表明该物质由离子构
成, 其阴离子[Ga₂I₆]²- 中所有原子的价层均有8个电子。以下说法不正确的是
A. 镓和碘均位于元素周期表的p 区
B. 化合物Ga₆I₆ 中镓的化合价不止一种
C.[Ga₂ I₆ ]²- 的结构可以表示
D.[Ga₂ I6]²- 中Ga 原子的杂化方式为sp³
15.25℃时,草酸 (H₂C₂O₄) 的电离常数为Kat=5.0×10-2,K₂₂=5.4×10-5;CaC₂O₄ 的
Ksp=2.5×10-9:1g5≈0.7。常温下,下列说法不正确的是
A.0.1 mol-L-¹的 KHC₂O₄ 溶液呈酸性
B. 若某溶液中c(H₂C₂O₄)=c(HC₂Oz). 溶液的pH 约为1.3
C. 草酸钙饱和溶液中c(C₂O}-)>c(HC₂Oz)
D.Na₂C₂O₄ 溶液中粒子浓度关系: c(OH-)-c(H+)0
向盛有等体积等物质的量浓度的
溶液中存在
C FeCl₃ 和 KSCN混合溶液的试管中 溶液颜色变浅
Fe³++3SCN-=Fe(SCN)₃
加 入少量铁粉
分别向两支盛有 1mL 5%H₂O₂ 水溶
液的试管中滴3滴0.05mol-L-¹ 滴加 AgNO₃ 溶液 对 H₂O₂ 分解反应,
D
的 CuSO₄ 溶液和 0.05mol · L- 的试管产生气泡快 Ag 的催化能力优于
¹AgNO₃ 溶 Cu²+
液
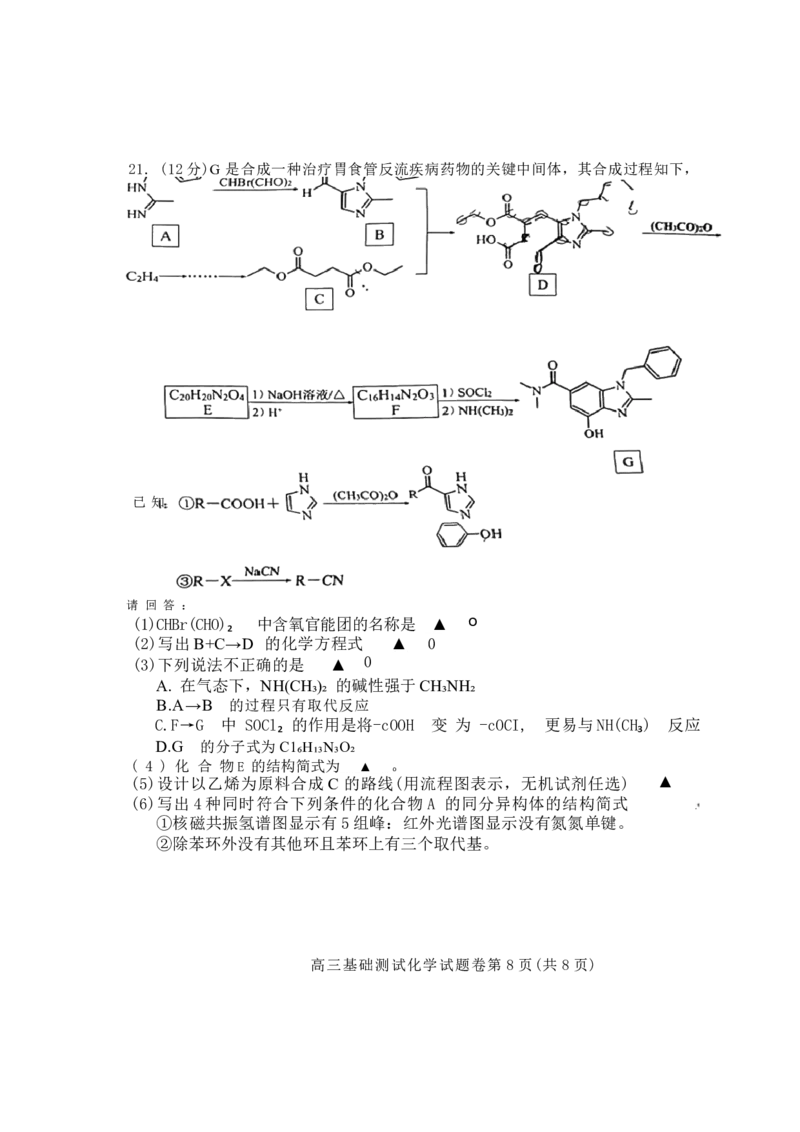
高三基础测试化学试题卷第4页(共8页)(4)Na₂S₂O₃ 可被I₂ 氧化为Na₂S₄O₆ 、从物质结构的角度分析Na₂S₄O₆中阴离子的结构应
为下图中的 ▲ (填“甲”或“乙”)。
(5)设计实验验证 Cu 、Ag 、Au混合物中含有A g ▲
0
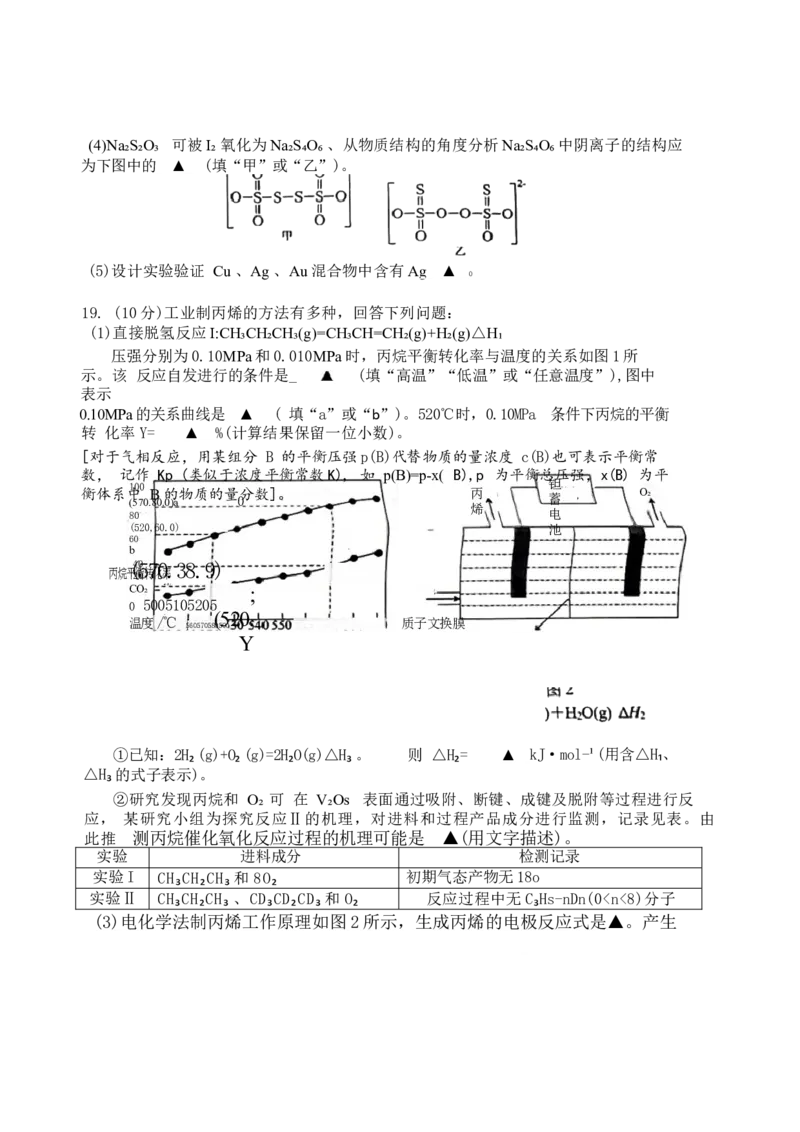
19. (10分)工业制丙烯的方法有多种,回答下列问题:
(1)直接脱氢反应I:CH₃CH₂CH₃(g)=CH₃CH=CH₂(g)+H₂(g)△H₁
压强分别为0.10MPa和0.010MPa时,丙烷平衡转化率与温度的关系如图1所
示。该 反应自发进行的条件是_ (填“高温”“低温”或“任意温度”),图中
表示
0.10MPa的关系曲线是 ▲ ( 填“a”或“b”)。520℃时,0.10MPa 条件下丙烷的平衡
转 化率Y= ▲ %(计算结果保留一位小数)。
[对于气相反应,用某组分 B 的平衡压强p(B)代替物质的量浓度 c(B)也可表示平衡常
数, 记作 Kp (类似于浓度平衡常数K), 如 p(B)=p-x( B),p 为平衡总压强,x(B) 为平
钽
100
衡体系中 B的物质的量分数]。 丙 O₂
(570.80.0)a 0 蓄
烯
80 电
(520,60.0) 池
60
b
(40570.38.9)
丙烷平2衡0转化率
CO₂ 1% ;
0 5005105205
(520.
温度/℃ 质子文换膜
560570580590
Y
①已知:2H₂ (g)+O₂ (g)=2H₂O(g)△H₃ 。 则 △H₂= ▲ kJ·mol-¹(用含△H₁、
△H₃ 的式子表示)。
②研究发现丙烷和 O₂ 可 在 V₂Os 表面通过吸附、断键、成键及脱附等过程进行反
应, 某研究小组为探究反应Ⅱ的机理,对进料和过程产品成分进行监测,记录见表。由
此推 测丙烷催化氧化反应过程的机理可能是 ▲(用文字描述)。
实验 进料成分 检测记录
实验I CH₃CH₂CH₃ 和 8O₂ 初期气态产物无18o
实验Ⅱ CH₃CH₂CH₃ 、CD₃CD₂CD₃ 和 O₂ 反应过程中无C₃Hs-nDn(0