文档内容
湖南师大附中 2025 届高三月考试卷(二)
化学
命题人:喻诗琪 审题人:曹艳 荣雷光华
得分:______
本试题卷分选择题和非选择题两部分,共10页。时量75分钟,满分100分。
可能用到的相对原子质量:H~1 B~11 O~16 Na~23 Ge~73
一、选择题:本题共 14 小题,每小题 3分,共 42分。每小题只有一个选项符合题目要求。
1.下列有关说法正确的是( )
A.利用CO 合成高级脂肪酸的甘油酯,实现无机小分子向有机高分子的转化
2
B.光学谐振器中使用的碳纳米管与金刚石、C 互为同素异形体
60
C.石墨烯粉体可用于制作高性能涂料,石墨烯属于不饱和有机物
D.我国研发的小型核反应堆“玲龙一号”以235U为核燃料,235U与238U化学性质不同
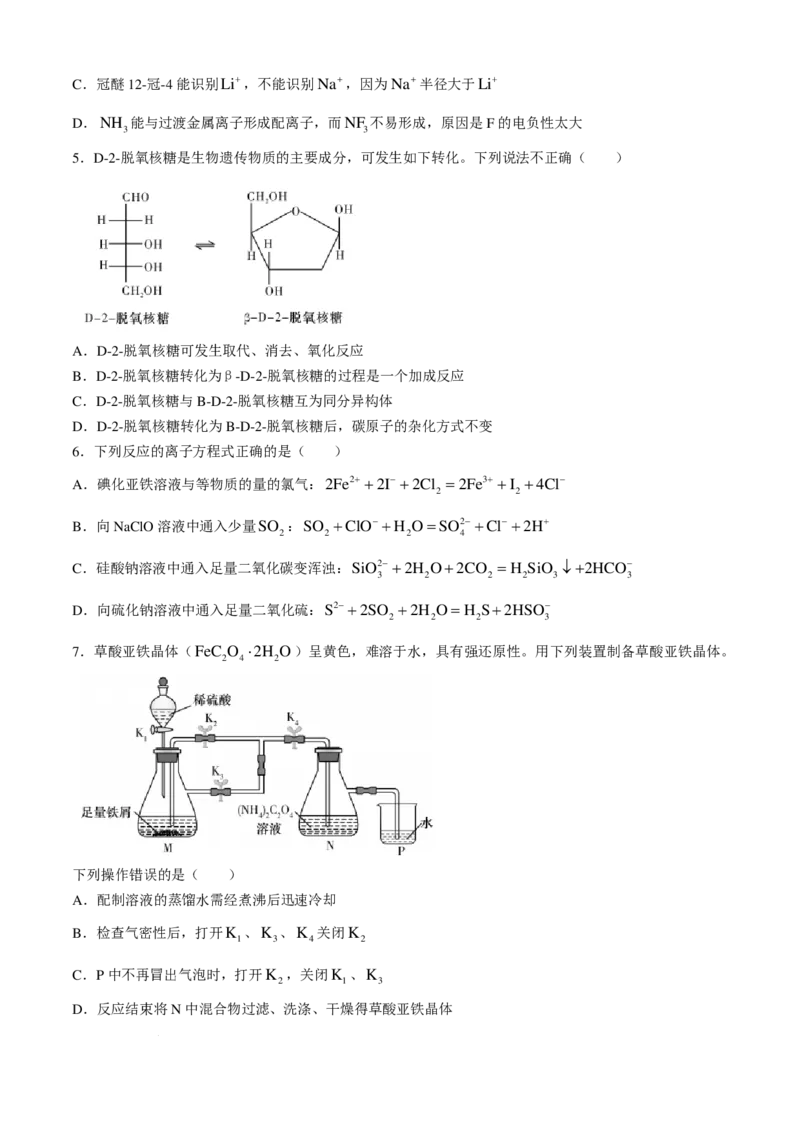
2.下列化学用语表示正确的是( )
A.1-丁醇的键线式:
B.Cl O的球棍模型:
2
C.HCl分子中σ键的形成:
D.用轨道表示式表示乙炔中碳原子的杂化:
3.化学是一门以实验为基础的学科。下列有关化学实验的说法错误的是( )
A.氨溶于水的喷泉实验需要标注的图标有
B.洒出的酒精在实验台面燃烧起来,立即使用湿抹布覆盖
C.中学实验室中未用完的钠、钾、白磷等不能放回原试剂瓶
D.液溴易挥发,在存放液溴的试剂瓶中应加水液封
4.下列有关化学概念或性质的推断错误的是( )
A.组成为C H O的有机物一定能与水互溶
2 6
B. 和 是同一种物质,说明苯分子中碳碳键完全相同
学科网(北京)股份有限公司C.冠醚12-冠-4能识别Li+,不能识别Na+,因为Na+半径大于Li+
D.NH 能与过渡金属离子形成配离子,而NF 不易形成,原因是F的电负性太大
3 3
5.D-2-脱氧核糖是生物遗传物质的主要成分,可发生如下转化。下列说法不正确( )
A.D-2-脱氧核糖可发生取代、消去、氧化反应
B.D-2-脱氧核糖转化为β-D-2-脱氧核糖的过程是一个加成反应
C.D-2-脱氧核糖与B-D-2-脱氧核糖互为同分异构体
D.D-2-脱氧核糖转化为B-D-2-脱氧核糖后,碳原子的杂化方式不变
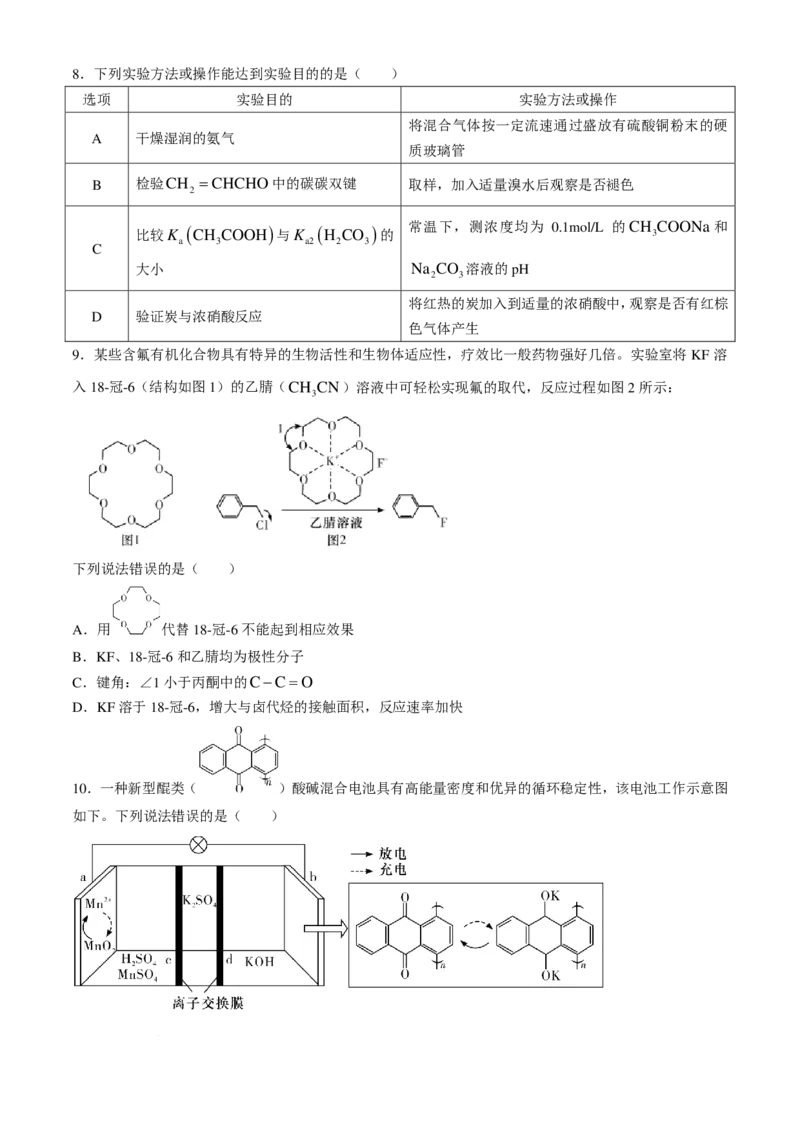
6.下列反应的离子方程式正确的是( )
A.碘化亚铁溶液与等物质的量的氯气:2Fe2+ +2I− +2Cl =2Fe3+ +I +4Cl−
2 2
B.向NaClO溶液中通入少量SO :SO +ClO−+H O=SO2− +Cl− +2H+
2 2 2 4
C.硅酸钠溶液中通入足量二氧化碳变浑浊:SiO2− +2H O+2CO =H SiO ↓+2HCO−
3 2 2 2 3 3
D.向硫化钠溶液中通入足量二氧化硫:S2− +2SO +2H O=H S+2HSO−
2 2 2 3
7.草酸亚铁晶体(FeC O ⋅2H O)呈黄色,难溶于水,具有强还原性。用下列装置制备草酸亚铁晶体。
2 4 2
下列操作错误的是( )
A.配制溶液的蒸馏水需经煮沸后迅速冷却
B.检查气密性后,打开K 、K 、K 关闭K
1 3 4 2
C.P中不再冒出气泡时,打开K ,关闭K 、K
2 1 3
D.反应结束将N中混合物过滤、洗涤、干燥得草酸亚铁晶体
学科网(北京)股份有限公司8.下列实验方法或操作能达到实验目的的是( )
选项 实验目的 实验方法或操作
将混合气体按一定流速通过盛放有硫酸铜粉末的硬
A 干燥湿润的氨气
质玻璃管
B 检验CH =CHCHO中的碳碳双键 取样,加入适量溴水后观察是否褪色
2
比较K ( CH COOH )与K ( H CO )的 常温下,测浓度均为 0.1mol/L 的CH 3 COONa和
a 3 a2 2 3
C
大小 Na CO 溶液的pH
2 3
将红热的炭加入到适量的浓硝酸中,观察是否有红棕
D 验证炭与浓硝酸反应
色气体产生
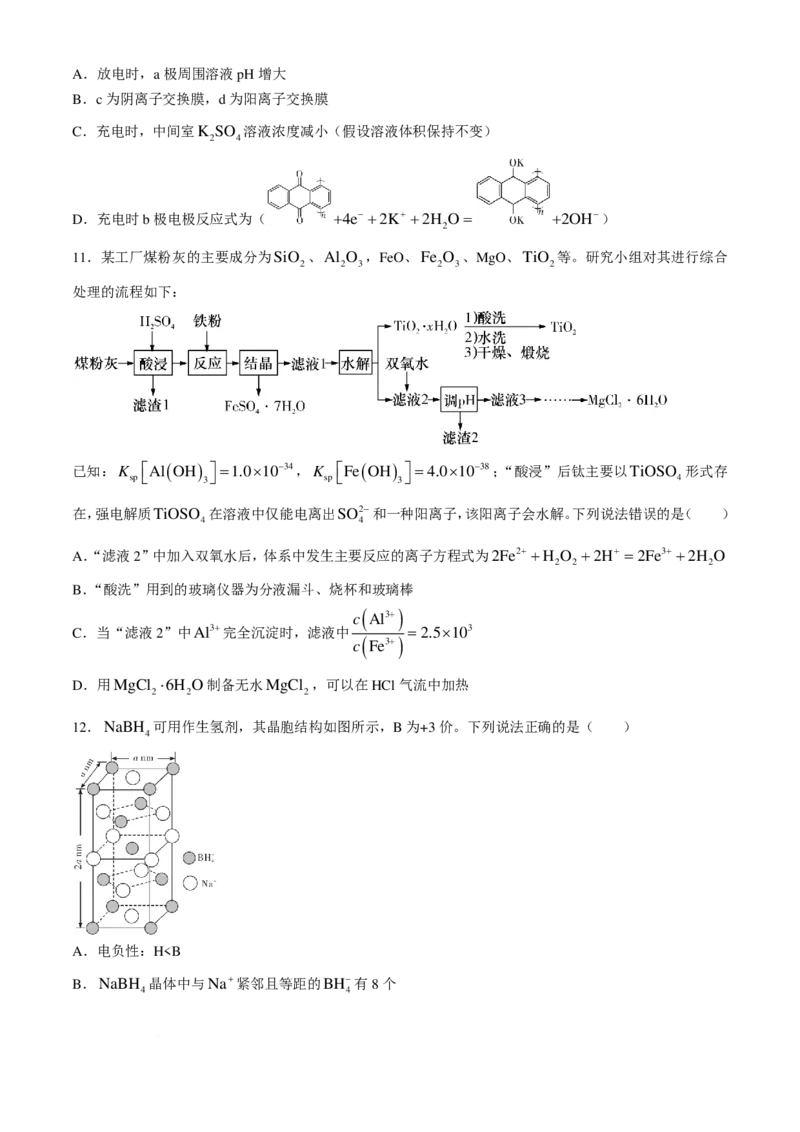
9.某些含氟有机化合物具有特异的生物活性和生物体适应性,疗效比一般药物强好几倍。实验室将 KF 溶
入18-冠-6(结构如图1)的乙腈(CH CN)溶液中可轻松实现氟的取代,反应过程如图2所示:
3
下列说法错误的是( )
A.用 代替18-冠-6不能起到相应效果
B.KF、18-冠-6和乙腈均为极性分子
C.键角:∠1小于丙酮中的C−C=O
D.KF溶于18-冠-6,增大与卤代烃的接触面积,反应速率加快
10.一种新型醌类( )酸碱混合电池具有高能量密度和优异的循环稳定性,该电池工作示意图
如下。下列说法错误的是( )
学科网(北京)股份有限公司A.放电时,a极周围溶液pH增大
B.c为阴离子交换膜,d为阳离子交换膜
C.充电时,中间室K SO 溶液浓度减小(假设溶液体积保持不变)
2 4
D.充电时b极电极反应式为( +4e− +2K+ +2H O= +2OH−)
2
11.某工厂煤粉灰的主要成分为SiO 、Al O ,FeO、Fe O 、MgO、TiO 等。研究小组对其进行综合
2 2 3 2 3 2
处理的流程如下:
已知:K Al ( OH ) =1.0×10−34,K Fe ( OH ) =4.0×10−38;“酸浸”后钛主要以TiOSO 形式存
sp 3 sp 3 4
在,强电解质TiOSO 在溶液中仅能电离出SO2−和一种阳离子,该阳离子会水解。下列说法错误的是( )
4 4
A.“滤液2”中加入双氧水后,体系中发生主要反应的离子方程式为2Fe2+ +H O +2H+ =2Fe3+ +2H O
2 2 2
B.“酸洗”用到的玻璃仪器为分液漏斗、烧杯和玻璃棒
c
( Al3+)
C.当“滤液2”中Al3+完全沉淀时,滤液中 =2.5×103
c
( Fe3+)
D.用MgCl ⋅6H O制备无水MgCl ,可以在HCl气流中加热
2 2 2
12.NaBH 可用作生氢剂,其晶胞结构如图所示,B为+3价。下列说法正确的是( )
4
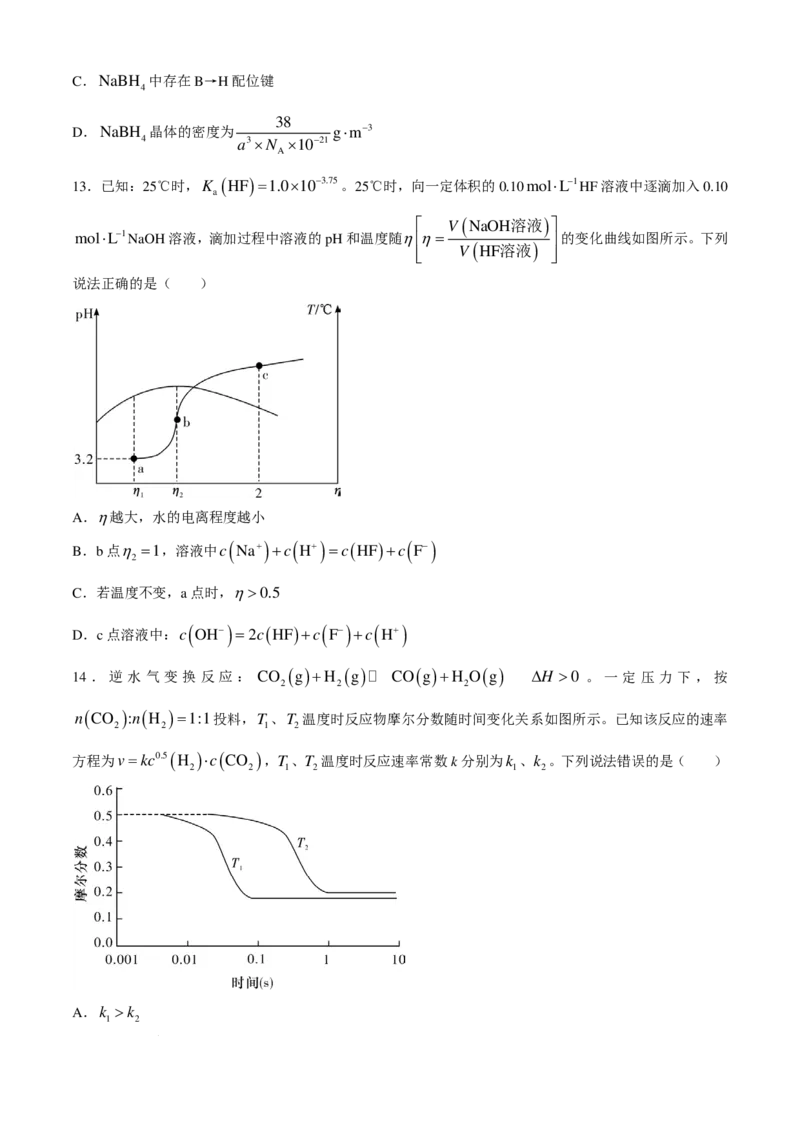
A.电负性:H0.5
D.c点溶液中:c ( OH−) =2c ( HF )+c ( F−) +c ( H+)
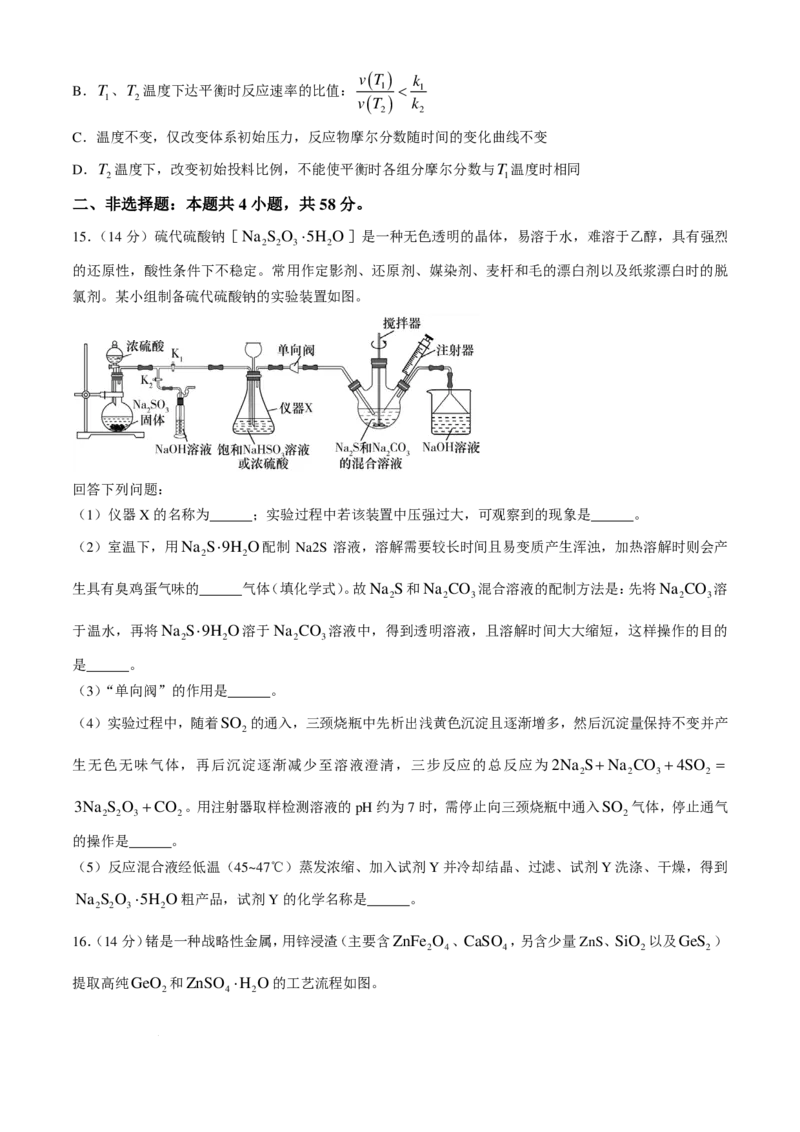
14 .逆 水气 变换 反应: CO ( g )+H ( g ) CO ( g )+H O ( g ) ∆H >0 。 一定 压力 下,按
2 2 2
n ( CO ) :n ( H )=1:1投料,T 、T 温度时反应物摩尔分数随时间变化关系如图所示。已知该反应的速率
2 2 1 2
方程为v=kc0.5( H )⋅c ( CO ),T 、T 温度时反应速率常数k分别为k 、k 。下列说法错误的是( )
2 2 1 2 1 2
A.k >k
1 2
学科网(北京)股份有限公司( )
v T k
B.T 、T 温度下达平衡时反应速率的比值: 1 < 1
1 2 v ( T ) k
2 2
C.温度不变,仅改变体系初始压力,反应物摩尔分数随时间的变化曲线不变
D.T 温度下,改变初始投料比例,不能使平衡时各组分摩尔分数与T 温度时相同
2 1
二、非选择题:本题共 4小题,共 58分。
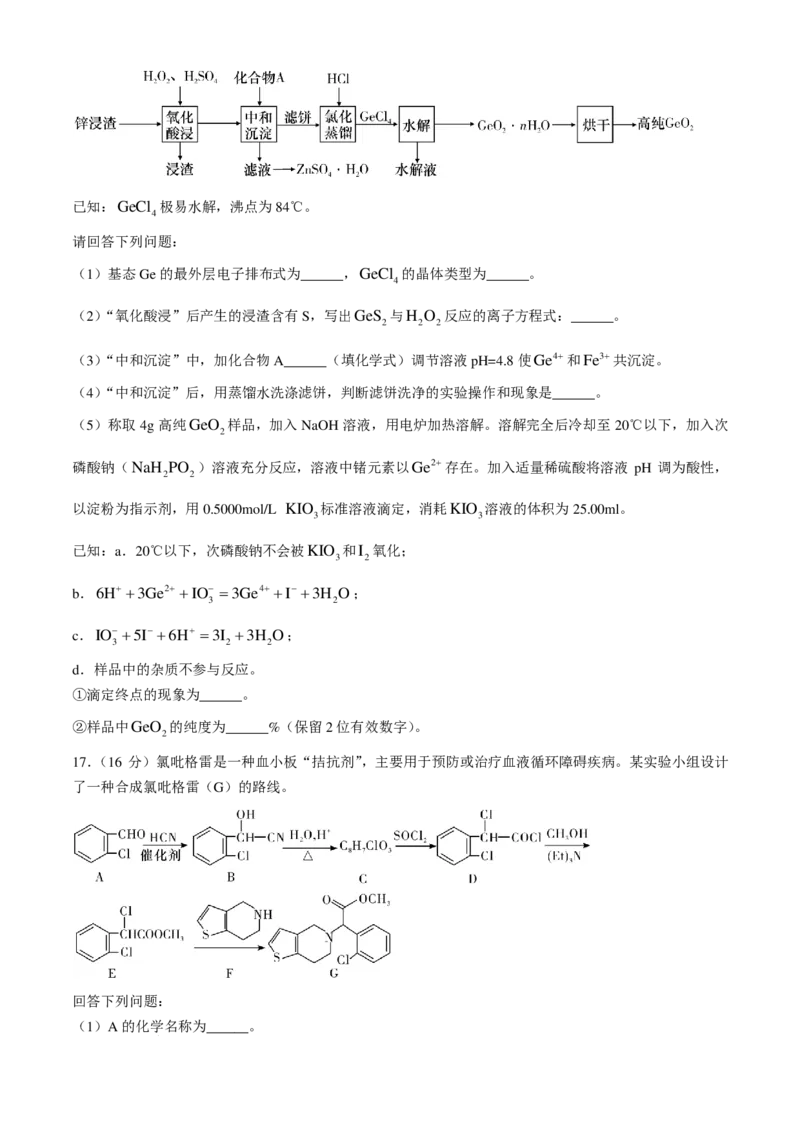
15.(14 分)硫代硫酸钠[Na S O ⋅5H O]是一种无色透明的晶体,易溶于水,难溶于乙醇,具有强烈
2 2 3 2
的还原性,酸性条件下不稳定。常用作定影剂、还原剂、媒染剂、麦杆和毛的漂白剂以及纸浆漂白时的脱
氯剂。某小组制备硫代硫酸钠的实验装置如图。
回答下列问题:
(1)仪器X的名称为______;实验过程中若该装置中压强过大,可观察到的现象是______。
(2)室温下,用Na S⋅9H O配制 Na2S 溶液,溶解需要较长时间且易变质产生浑浊,加热溶解时则会产
2 2
生具有臭鸡蛋气味的______气体(填化学式)。故Na S和Na CO 混合溶液的配制方法是:先将Na CO 溶
2 2 3 2 3
于温水,再将Na S⋅9H O溶于Na CO 溶液中,得到透明溶液,且溶解时间大大缩短,这样操作的目的
2 2 2 3
是______。
(3)“单向阀”的作用是______。
(4)实验过程中,随着SO 的通入,三颈烧瓶中先析出浅黄色沉淀且逐渐增多,然后沉淀量保持不变并产
2
生无色无味气体,再后沉淀逐渐减少至溶液澄清,三步反应的总反应为2Na S+Na CO +4SO =
2 2 3 2
3Na S O +CO 。用注射器取样检测溶液的pH约为7时,需停止向三颈烧瓶中通入SO 气体,停止通气
2 2 3 2 2
的操作是______。
(5)反应混合液经低温(45~47℃)蒸发浓缩、加入试剂Y并冷却结晶、过滤、试剂Y洗涤、干燥,得到
Na S O ⋅5H O粗产品,试剂Y的化学名称是______。
2 2 3 2
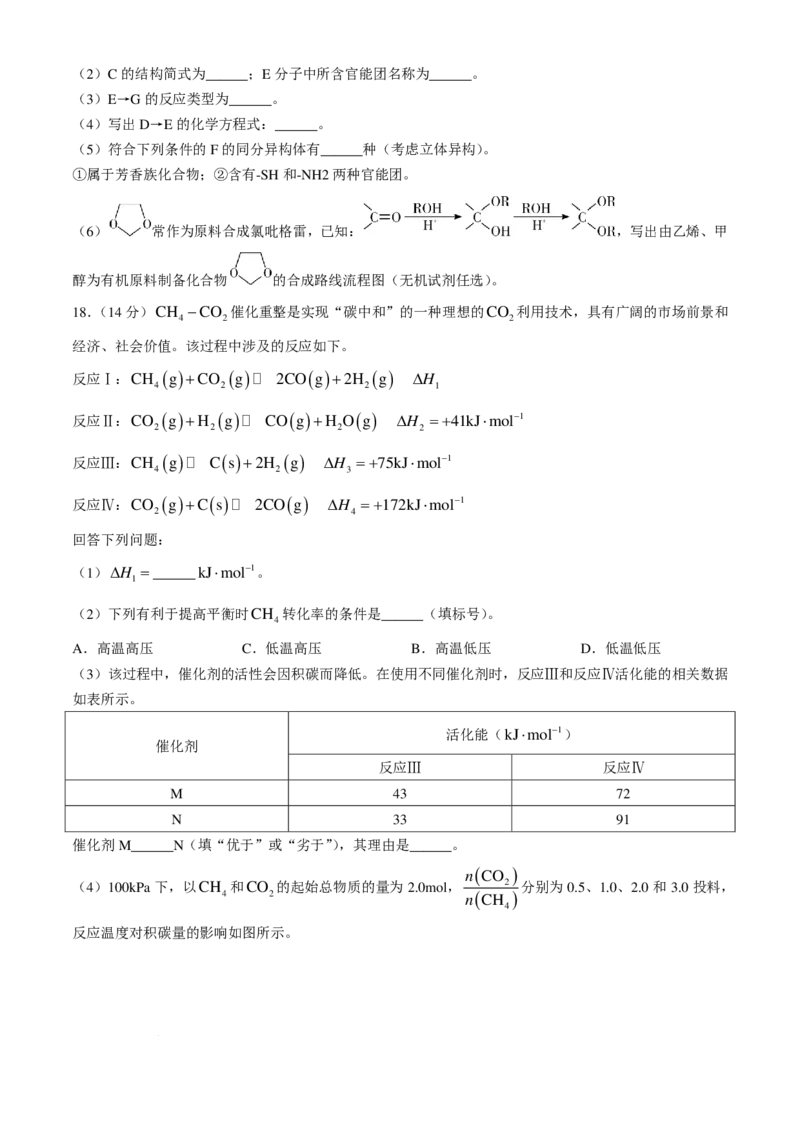
16.(14分)锗是一种战略性金属,用锌浸渣(主要含ZnFe O 、CaSO ,另含少量ZnS、SiO 以及GeS )
2 4 4 2 2
提取高纯GeO 和ZnSO ⋅H O的工艺流程如图。
2 4 2
学科网(北京)股份有限公司已知:GeCl 极易水解,沸点为84℃。
4
请回答下列问题:
(1)基态Ge的最外层电子排布式为______,GeCl 的晶体类型为______。
4
(2)“氧化酸浸”后产生的浸渣含有S,写出GeS 与H O 反应的离子方程式:______。
2 2 2
(3)“中和沉淀”中,加化合物A______(填化学式)调节溶液pH=4.8使Ge4+和Fe3+共沉淀。
(4)“中和沉淀”后,用蒸馏水洗涤滤饼,判断滤饼洗净的实验操作和现象是______。
(5)称取4g高纯GeO 样品,加入NaOH 溶液,用电炉加热溶解。溶解完全后冷却至 20℃以下,加入次
2
磷酸钠(NaH PO )溶液充分反应,溶液中锗元素以Ge2+存在。加入适量稀硫酸将溶液 pH 调为酸性,
2 2
以淀粉为指示剂,用0.5000mol/L KIO 标准溶液滴定,消耗KIO 溶液的体积为25.00ml。
3 3
已知:a.20℃以下,次磷酸钠不会被KIO 和I 氧化;
3 2
b.6H+ +3Ge2+ +IO− =3Ge4+ +I−+3H O;
3 2
c.IO− +5I− +6H+ =3I +3H O;
3 2 2
d.样品中的杂质不参与反应。
①滴定终点的现象为______。
②样品中GeO 的纯度为______%(保留2位有效数字)。
2
17.(16 分)氯吡格雷是一种血小板“拮抗剂”,主要用于预防或治疗血液循环障碍疾病。某实验小组设计
了一种合成氯吡格雷(G)的路线。
回答下列问题:
(1)A的化学名称为______。
学科网(北京)股份有限公司(2)C的结构简式为______;E分子中所含官能团名称为______。
(3)E→G的反应类型为______。
(4)写出D→E的化学方程式:______。
(5)符合下列条件的F的同分异构体有______种(考虑立体异构)。
①属于芳香族化合物;②含有-SH和-NH2两种官能团。
(6) 常作为原料合成氯吡格雷,已知: ,写出由乙烯、甲
醇为有机原料制备化合物 的合成路线流程图(无机试剂任选)。
18.(14分)CH −CO 催化重整是实现“碳中和”的一种理想的CO 利用技术,具有广阔的市场前景和
4 2 2
经济、社会价值。该过程中涉及的反应如下。
反应Ⅰ:CH ( g )+CO ( g ) 2CO ( g )+2H ( g ) ∆H
4 2 2 1
反应Ⅱ:CO ( g )+H ( g ) CO ( g )+H O ( g ) ∆H =+41kJ⋅mol−1
2 2 2 2
反应Ⅲ:CH ( g ) C ( s )+2H ( g ) ∆H =+75kJ⋅mol−1
4 2 3
反应Ⅳ:CO ( g )+C ( s ) 2CO ( g ) ∆H =+172kJ⋅mol−1
2 4
回答下列问题:
(1)∆H =______kJ⋅mol−1。
1
(2)下列有利于提高平衡时CH 转化率的条件是______(填标号)。
4
A.高温高压 C.低温高压 B.高温低压 D.低温低压
(3)该过程中,催化剂的活性会因积碳而降低。在使用不同催化剂时,反应Ⅲ和反应Ⅳ活化能的相关数据
如表所示。
活化能(kJ⋅mol−1)
催化剂
反应Ⅲ 反应Ⅳ
M 43 72
N 33 91
催化剂M______N(填“优于”或“劣于”),其理由是______。
( )
n CO
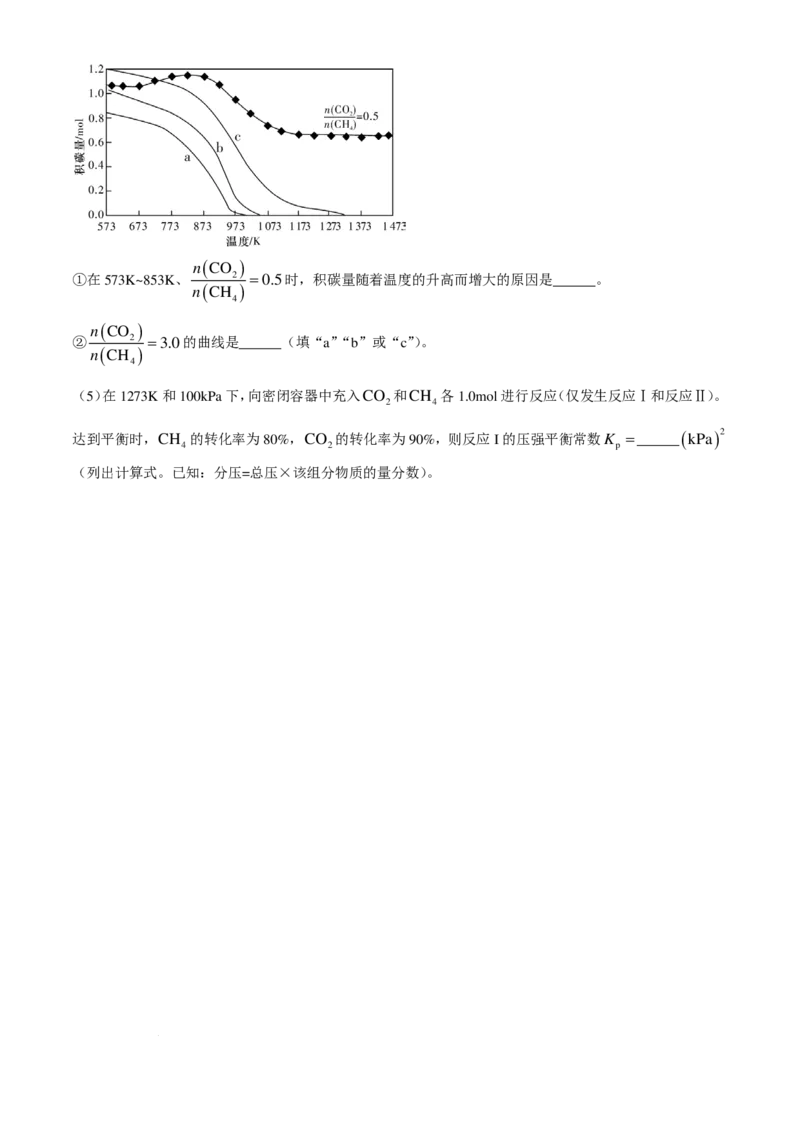
(4)100kPa 下,以CH 和CO 的起始总物质的量为 2.0mol, 2 分别为 0.5、1.0、2.0和3.0 投料,
4 2 n ( CH )
4
反应温度对积碳量的影响如图所示。
学科网(北京)股份有限公司( )
n CO
①在573K~853K、 2 =0.5时,积碳量随着温度的升高而增大的原因是______。
( )
n CH
4
( )
n CO
② 2 =3.0的曲线是______(填“a”“b”或“c”)。
( )
n CH
4
(5)在1273K和100kPa下,向密闭容器中充入CO 和CH 各1.0mol进行反应(仅发生反应Ⅰ和反应Ⅱ)。
2 4
达到平衡时,CH 的转化率为80%,CO 的转化率为90%,则反应I的压强平衡常数K =______ ( kPa )2
4 2 p
(列出计算式。已知:分压=总压×该组分物质的量分数)。
学科网(北京)股份有限公司湖南师大附中 2025 届高三月考试卷(二)
化学参考答案
一、选择题:本题共 14 小题,每小题 3分,共 42分。每小题只有一个选项符合题目要求。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 B C C A D C C C B D B B D C
1.B 【解析】高级脂肪酸的甘油酯(油脂)不是有机高分子,A错误;碳纳米管与金刚石、C 都是碳的
60
单质,三种物质互为同素异形体,B正确;石墨烯是碳的单质,不属于有机物,C错误;235U与238U互为
同位素,同位素的物理性质不同,但是核外电子数及排布情况相同,化学性质几乎相同,D错误。
6−2×1
2.C 【解析】所给的是1-丙醇的键线式,A错误;Cl O的中心原子孤电子对数= −2、价层电子
2 2
对数=2+2=4,故中心原子氧原子为sp3杂化,空间结构为V形,不是直线形,B错误;H的s能级轨道
为球形,Cl的2p能级轨道为哑铃形,形成HCl时,H的1s能级的原子轨道和Cl的2p能级的原子轨道相
互靠近,发生重叠,形成新的轨道,C正确;乙炔中碳原子为sp杂化,D错误。
4.A 【解析】C H O的结构简式为CH CH OH或CH OCH ,二甲醚不能与水互溶,A错误;
2 6 3 2 3 3
和 是同一种物质,说明苯分子中六个碳碳键等价,B正确;冠醚识别碱金属离子的条件是冠醚直径
与碱金属离子半径适配,否则不容易形成超分子,C 正确;氟的电负性大于氮,NF 中 N 原子上孤电子对
3
偏向氟,电子云密度降低,不容易提供电子对形成配位键,D正确。
5.D 【解析】D-2-脱氧核糖含有羟基,可以发生取代反应和氧化反应,羟基所连碳原子的相邻碳原子上有
氢原子,可以发生消去反应,A 正确;D-2-脱氧核糖转化为β-D-2-脱氧核糖的过程中醛基转化为羟基,该
反应为加成反应,B 正确;D-2-脱氧核糖与β-D-2-脱氧核糖的分子式相同,都是C H O ,结构式不同,
5 10 4
互为同分异构体,C正确;D-2-脱氧核糖中含有醛基和亚甲基,碳原子的杂化方式为sp2和sp3,β-D-2-脱
氧核糖中都是饱和碳原子,碳原子的杂化方式只有sp3,D-2-脱氧核糖转化为β-D-2-脱氧核糖后,碳原子的
杂化方式改变,D错误。
6.C 【解析】因还原性:I− >Fe2+,碘化亚铁溶液与等物质的量的氯气反应时,氯气先与碘离子反应,
且两者恰好完全反应,Fe2+还未参与反应,则反应的离子方程式为2I− +Cl =I +2Cl−,A错误;向NaClO
2 2
溶液中通入少量SO ,离子方程式为SO +3ClO−+H O=SO2− +Cl− +2HClO,B错误;向硫化钠溶液
2 2 2 4
学科网(北京)股份有限公司中通入足量二氧化硫,溶液变浑浊,同时生成亚硫酸氢钠,反应的离子方程式为2S2− +5SO +2H O=3S↓
2 2
+4HSO−,D错误。
3
7.C 【解析】草酸亚铁具有强还原性,为防止草酸亚铁被氧化,先用M中生成的氢气把N中的空气排出,
再用 M 中生成的氢气把 M 中的硫酸亚铁溶液压入 N 中与草酸铵反应生成草酸亚铁晶体。使用煮沸后的蒸
馏水可以有效地排除水中的溶解氧,避免草酸亚铁被氧化,迅速冷却煮沸后的蒸馏水可以防止外界的氧气
再次溶解到水中,A正确;检查气密性后,打开K 、K 、K ,关闭K ,用M中生成的氢气把N中的空
1 3 4 2
气排出,B正确;P中出来的气体经验纯后,打开K ,关闭K 、K ,将硫酸亚铁溶液压入N中与草酸铵
2 1 3
反应,C 错误;硫酸亚铁溶液被压入至 N 中与草酸铵反应生成草酸亚铁沉淀,N 中沉淀经过滤、洗涤、干
燥得草酸亚铁晶体,D正确。
8.C 【解析】氨气和水混合时也能与无水硫酸铜反应,A错误;溴水可以与碳碳双键反应,也可以和醛基
反应,故加入适量溴水无法检验CH =CHCHO 中的碳碳双键,B 错误;比较K ( CH COOH )与
2 a 3
K ( H CO )即比较CH COOH与HCO−酸性强弱,故可以比较Na CO 和CH COONa溶液的pH,C
a2 2 3 3 3 2 3 3
正确;浓硝酸受热分解生成NO ,红棕色气体可能是硝酸分解产生的,不能说明炭与浓硝酸发生了反应,
2
D错误。
9.B 【解析】12-冠-4 和18-冠-6 的孔径不同,络合的离子不同,用 12-冠-4替换 18-冠-6不能起到相应的
效果,A正确;KF为离子化合物,不是极性分子,B错误;∠1的中心原子O为sp3杂化,丙酮C−C=O
的中心原子 C 为sp2杂化,故键角∠1 小于C−C=O,C 正确;钾离子与 18-冠-6 之间形成超分子,这种
超分子可溶于有机溶剂乙腈,并把阴离子Cl−带入乙腈中,卤代烃也溶于乙腈,氟离子与卤代烃接触很充分,
加之氯离子游离于超分子之外,静电约束减小,反应活性增强,导致反应速率加快,D正确。
10.D 【解析】图中显示,放电时 a 极的二氧化锰发生还原反应生成锰离子,所以 a 极为原电池的正极,
则b极为原电池
的负极;充电时 a 极为电解池的阳极,b 极为电解池的阴极。放电时,a 极为原电池的正极,a 极电极反应
式为MnO +2e− +4H+ =Mn2+ +2H O,氢离子浓度减小,所以a极周围溶液pH增大,A正确;放电时,
2 2
b极电极反应式为 ,此时阳离子移向正极、阴离
子移向负极,则硫酸根离子通过c离子交换膜进入中间室,c为阴离子交换膜,钾离子通过d离子交换膜进
入中间室,则 d 为阳离子交换膜,B 正确;充电时,a 极为电解池的阳极、b 极为电解池的阴极,c 为阴离
子交换膜,d为阳离子交换膜,则中间室硫酸根离子经c离子交换膜进入a电极室,钾离子经d离子交换膜
进入b电极室,所以中间室K SO 溶液浓度减小(假设溶液体积保持不变),C正确;充电时,b极电极反
2 4
学科网(北京)股份有限公司应式为 ,D错误。
1.B 【解析】煤粉灰的主要成分为SiO 、Al O 、FeO、Fe O 、MgO、TiO 等,“酸浸”后,Al O 、
2 2 3 2 3 2 2 3
FeO、Fe O 、MgO分别转化为Al3+、Fe2+、Fe3+、Mg2+,TiO 转化为TiOSO ,强电解质TiOSO
2 3 2 4 4
在溶液中仅能电离出SO2−和一种阳离子,该阳离子会水解,为TiO2+,SiO 不反应,进入“滤渣 1”中,
4 2
加入铁粉,Fe3+被还原为Fe2+,结晶得FeSO ⋅7H O,TiO2+水解后得到TiO ⋅xH O,经过“酸洗、
4 2 2 2
水洗、干燥、煅烧”后得到TiO ,“滤液2”中加入双氧水,Fe2+被氧化为Fe3+,调节pH,可生成Al ( OH ) 、
2 3
Fe ( OH ) 沉淀,“滤液3”含有Mg2+,经过一系列操作,最后结晶得到MgCl ⋅6H O。“滤液2”中加入
3 2 2
双氧水后,Fe2+被氧化为Fe3+,体系中发生主要反应的离子方程式为2Fe2+ +H O +2H+ =2Fe3+ +2H O,
2 2 2
A 正 确 ;“ 酸 洗 ” 用 到 的 玻 璃 仪 器 为 普 通 漏 斗 、 烧 杯 和 玻 璃 棒 ,B 错 误 ;
c ( Al3+)
=
c ( Al3+) ⋅c3 ( OH−)
=
K
sp
Al ( OH )
3
=
1.0×10−34
=2.5×103,C 正确;用MgCl ⋅6H O制
c ( Fe3+) c ( Fe3+) ⋅c3 ( OH−) K Fe ( OH ) 4.0×10−38 2 2
sp 3
备无水MgCl ,为了防止MgCl 水解,需要在HCl气流中加热,D正确。
2 2
12.B 【解析】NaBH 中B为+3价,故H为-1价,说明B−H中H显负价,故电负性:H>B,A错误;
4
每个Na+周围紧邻且等距的BH−有8个(即两个互相垂直的平面正方形的8个顶点),B正确;B有空轨道,
4
H−有孤电子对,故配位键应为B←H,C 错误;每个晶胞均摊到 4 个NaBH ,故晶体的密度为
4
4×38 76
g⋅cm−3 = g⋅cm−3,D错误。
2a3×N ×10−21 a3×N ×10−21
A A
13.D 【解析】中和反应为放热反应,η 时,温度最高,此时HF 与NaOH恰好完全反应生成NaF,b点
2
为恰好完全反应的点。酸和碱均会抑制水的电离,a 点酸过量、c 点碱过量,均抑制水的电离,b 点的溶质
为 NaF,其水解促进水的电离,故 b 点水的电离程度最大,A 错误;b 点 HF 与 NaOH 恰好完全反应生成
NaF,则η =1,结合元素守恒可知,溶液中c ( Na+) =c ( HF )+c ( F−) ,B错误;当η=0.5时,溶质为等
2
物质的量的 NaF、HF,由于 HF 的电离程度大于 NaF 的水解程度,则 c ( HF )3.75,a 点
a c ( HF ) c ( F−)
的 pH=3.2,说明η <0.5,C 错误;c 点溶液溶质为等物质的量的 NaF 和 NaOH,由电荷守恒可知,
1
学科网(北京)股份有限公司c ( Na+) +c ( H+) =c ( F−) +c ( OH−) ,由元素守恒可知,c ( Na+) =2c ( HF )+2c ( F−) ,两式联立可知,
c ( OH−) =2c ( HF )+c ( F−) +c ( H+) ,D正确。
14.C 【解析】由图可知,T 比T 反应速率快,则T >T ;T 温度下达到平衡时反应物的摩尔分数低于T
1 2 1 2 1 2
温度下平衡时;由于起始n ( CO ) :n ( H )=1:1,则达到平衡时CO 和H 的摩尔分数相等。根据分析,T
2 2 2 2 1
比T 反应速率快,反应速率常数与温度有关,结合反应速率方程知k >k ,A 正确;反应的速率方程为
2 1 2
v
(
T
) kc0.5(
H
)⋅c (
CO
)
v=kc0.5( H )⋅c ( CO ),则 1 = 1 1 2 1 ,T 温度下达到平衡时反应物的摩尔分数低于T
2 2 v ( T ) k c0.5( H )⋅c ( CO ) 1 2
2 2 2 2 2
( )
v T k
温度下平衡时的,则 1 < 1 ,B 正确;温度不变,仅改变体系初始压力,虽然平衡不移动,但反应物
( )
v T k
2 2
的浓度改变,反应速率改变,反应达到平衡的时间改变,反应物摩尔分数随时间的变化曲线改变,C错误;
T 温度下,改变初始投料比,相当于改变某一反应物的浓度,达到平衡时H 和CO 的摩尔分数不可能相
2 2 2
等,故不能使平衡时各组分摩尔分数与T 温度时相同,D正确。
1
15.(14分,每空2分)
(1)锥形瓶 长颈漏斗中的液面上升
(2)H S 抑制S2−水解,防止其被氧化
2
(3)防倒吸
(4)关闭K ,打开K
1 2
(5)乙醇
【解析】左侧装置用亚硫酸钠和浓硫酸制取SO ,NaOH溶液用于实验结束后吸收尾气,锥形瓶是缓冲瓶,
2
用于观察气体流速,三颈烧瓶中发生一系列反应制取硫代硫酸钠,最右侧NaOH溶液用于吸收尾气。
(1)仪器X的名称为锥形瓶;若装置中压强过大,则气体会将液体压入长颈漏斗,使长颈漏斗中的液面上
升。
(3)“单向阀”具有正向流通、反向截止的作用,其作用是防倒吸。
(5)根据题目已知信息,硫代硫酸钠[Na S O ⋅5H O]是一种无色透明的晶体,易溶于水,难溶于乙
2 2 3 2
醇,则试剂Y为乙醇。
16.(14分,每空2分)
(1)4s24p2 分子晶体
(2)GeS +2H O +4H+ =Ge4+ +4H O+2S
2 2 2 2
学科网(北京)股份有限公司(3)ZnO或Zn ( OH )
2
(4)取最后一次洗涤液于试管中,加入BaCl 溶液,若未产生白色沉淀,则证明已洗净
2
(5)①当最后半滴标准溶液滴下时,溶液由无色变为蓝色,且30s内不褪色 ②98
【解析】由题给流程可知,向锌浸渣中加入过氧化氢和硫酸的混合溶液,将ZnFe O 转化为硫酸锌、硫酸
2 4
铁,硫化锌、二硫化锗转化为硫酸锌、硫酸锗和硫,二氧化硅不反应,过滤得到含有硫酸钙、二氧化硅和
硫的浸渣和滤液;向滤液中加入化合物 A,根据不引入新的杂质这一原则可知,A 可以为氧化锌或氢氧化
锌,调节溶液pH,将溶液中的铁离子、锗离子转化为氢氧化铁、氢氧化锗沉淀,过滤得到滤液和滤饼;滤
液经一系列操作后可得到一水硫酸锌晶体;向滤饼中加入饱和盐酸溶解后,蒸馏得到四氯化锗,四氧化锗
在一定条件下水解,过滤得到水解液和二氧化锗。
(1)Ge是第四周期第ⅣA族元素,所以其最外层电子排布式为4s24p2,GeCl 可被蒸馏分离,沸点较低,
4
为分子晶体。
(2)根据分析可知,二硫化锗转化为硫酸锗和硫,所以离子方程式为GeS +2H O +4H+ =Ge4+ +
2 2 2
4H O+2S。
2
(3)根据分析可知,向滤液中加入化合物 A 的目的是为了调节溶液 pH,将溶液中的铁离子、锗离子转化
为氢氧化铁、氢氧化锗沉淀,根据不引入新的杂质原则,所以A可以为氧化锌或氢氧化锌。
(4)沉淀上面附着的杂质主要是硫酸锌,检验滤饼是否洗净可以检验是否还含有硫酸根,离子检验操作为
取最后一次洗涤液于试管中,加入BaCl 溶液,若未产生白色沉淀,则证明已洗净。
2
(5)①根据已知,碘酸根和Ge2+反应生成碘离子,当Ge2+反应完,碘酸根就会和生成的I−反应得到碘单
质,遇溶液中淀粉变蓝,故滴定终点现象为当最后半滴标准溶液滴下时,溶液由无色变为蓝色,且30s内不
褪色。
②根据所给反应可得n ( GeO )=n ( Ge2+) =3n ( IO−) =0.5000mol/L×0.025L×3=0.0375mol,故样品
2 3
0.0375mol×105g/mol
中GeO 的纯度为 ×100%=98%。
2 4g
17.(16分,除标注外,每空2分)
(1)邻氯苯甲醛(或2-氯苯甲醛)
(2) 碳氯键、酯基
(3)取代反应
学科网(北京)股份有限公司(4)
(5)18
(6) 或
【解析】A 发生加成反应生成 B,B 中−CN发生水解反应生成 C 中−COOH,C 中−COOH发生取代反
应生成D中−COCl,D发生取代反应生成E,E发生取代反应生成氯吡格雷。
(5)F的分子式为C H NS,符合条件的F的同分异构体:若苯环上有3个取代基−SH,−NH 、−CH ,
7 9 2 3
则有10种;若苯环上有2个取代基−CH SH、−NH 或−CH NH 、−SH,有2×3=6种;若苯环上只
2 2 2 2
有1个取代基,则有2种(手性异构),一共18种。
18.(14分,每空2分)
(1)+247
(2)B
(3)优于 该过程中,催化剂的活性会因积碳而降低,反应Ⅲ会生成碳,使用催化剂M时相同时间内积碳
量更少
(4)①温度升高对反应Ⅲ的促进程度比反应Ⅳ的促进程度大 ②a
1.52×1.72×1002
(5)
3.62×0.1×0.2
【解析】(1)由盖斯定律可知,反应Ⅲ+反应Ⅳ可得反应Ⅰ:CH ( g )+CO ( g ) 2CO ( g )+2H ( g )
4 2 2
∆H =∆H +∆H =+75kJ⋅mol−1+172kJ⋅mol−1 =+247kJ⋅mol−1。
1 3 4
(2)反应Ⅰ、反应Ⅱ、反应Ⅲ和反应Ⅳ都是吸热反应,且反应过程中气体体积增大,则升高温度和减小压
强可以促进平街正向移动,有利于提高平衡时CH 转化率,故选B。
4
(3)该过程中,催化剂的活性会因积碳而降低,反应Ⅲ会生成碳,使用催化剂M时相同时间内积碳量会更
少,说明催化剂M优于N。
( )
n CO
(4)①反应Ⅲ生成碳,反应Ⅳ消耗积碳,这两个反应都是吸热反应,在 573K~853K、 2 =0.5时,
( )
n CH
4
积碳量随着温度的升高而增大的原因是温度升高对反应Ⅲ的促进程度比对反应Ⅳ的促进程度大。
学科网(北京)股份有限公司( )
n CO
②反应Ⅲ生成碳,反应Ⅳ消耗积碳, 2 越大,相当于增大CO 的物质的量,反应Ⅳ平衡正向移动,
n ( CH ) 2
4
( )
n CO
积碳量会减少, 2 =3.0的曲线是a。
( )
n CH
4
(5)在1273K和100kPa下,向密闭容器中充入CO 和CH 各1.0mol进行反应(仅发生反应Ⅰ和反应Ⅱ),
2 4
列出三段式:
CH ( g ) + CO ( g ) 2CO ( g ) + 2H ( g )
4 2 2
起始(
mol
)
1 1 0 0
转化(
mol
)
x x 2x 2x
平衡( mol ) 1−x 1−x 2x 2x
CO ( g ) + H ( g ) CO ( g ) + H O ( g )
2 2 2
起始( mol ) 1−x 2x 2x 0
转化(
mol
)
y y y y
平衡( mol ) 1−x− y 2x− y 2x+ y y
x x+ y
达到平衡时,CH 的转化率为 ×100%=80%,CO 的转化率为 ×100%=90%,则x=0.8,
4 1 2 1
2 2
1.5 1.7
×100kPa ×
×100kPa
y =0.1,则反应Ⅰ的压强平衡常数K = 3.6 3.6 = 1.52×1.72×1002 ( kPa )2 。
p 0.1 0.2 3.62×0.1×0.2
×100kPa ×
×100kPa
3.6 3.6
学科网(北京)股份有限公司