文档内容
大联考萍乡实验学校 2025 届高三月考试卷(四)
暨长郡十八校联考考前演练
化学参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14
A A B C A B C D C D D D C C
1.A【解析】铁置换铜有新物质生成,发生了化学变化,故B错;铝粉和金属氧化物反应获得金属单质的反
应属于化学变化,故C错;新物质二氧化碳等生成属于化学变化,故D错。
2.A【解析】SO 有毒,有漂白性但是不能用于熏蒸粉丝。
2
3.B【解析】主要成分不属于天然有机高分子,A错误;蔗糖不是还原糖,C错;蛋白质发生变质,D错。
4.C【解析】曲线上最低点Q为平衡点,正反应是放热反应,达到平衡之后,升高温度,平衡逆向移动,平
衡常数减小,A错误;W点对应的温度低于M点对应的温度,温度越高,反应速率越高,所以W点X的正反
应速率小于M点X的正反应速率,故B错误;反应前后气体的物质的量不变,平衡时充入Z,达到平衡时与
原平衡是等效平衡,所以达到新平衡时Z的体积分数不变,故D错误;
5.A【解析】[Cu(H O) ]2+呈蓝色,[CuCl ]2-呈黄色,[Cu(H O) ]2+与[CuCl ]2-溶液呈绿色,[Cu(H O) ]2+ +
2 4 4 2 4 4 2 4
4Cl- ⇌ [CuCl 4 ]2-+ 4H 2 O ΔH>0,加热2mL 0.5mol/LCuCl 2 溶液,溶液由蓝色变为绿色,陈述Ⅰ正确,但
[Cu(H O) ]2+转化为[CuCl ]2-的反应是吸热的陈述Ⅱ错误,B错误;常温下,往装有少量AgCl悬浊液的试管中
2 4 4
加入几滴0.1mol·L-1Ag S溶液,有黑色沉淀生成,溶解度小的沉淀转化为溶解度更小的沉淀,陈述Ⅰ正确;
2
根据数据,K (AgCl)=1.77×10-10 > K (Ag S) = 6.3×10-50,陈述Ⅱ正确,AgCl、Ag S不是同类型的沉淀,
sp sp 2 2
不能从沉淀的转化比较K 的大小,只可得到溶解度大小;因此陈述Ⅰ与陈述Ⅱ没有因果关系,C错误;电解
sp
质:在水溶液或熔融状态下能够导电的化合物;KNO 固体不导电,陈述Ⅰ正确,但KNO 水溶液或熔融
3 3
KNO 导电,KNO 是电解质,陈述Ⅱ错误,D错误;
3 3
6.B【解析】由现象可知,实验2双水解反应产生的 沉淀和过量的 又发生了反应,生成的白
色沉淀b中含有 ,加稀硫酸,沉淀溶解,有少量气泡产生,但白色沉淀b的化学成分不一定是
,B错。
7.C【解析】燃料电池中,通入 的电极为正极,因此电极电势: ,A项错误;溶液为碱性, 的电
极反应式为 ,B项错;标准状况下, 的物质的量是 ,则转移电
子 ,故电极X消耗 肼,质量为 ,D项错。
8.D【解析】由图可知,NbO的立方晶胞中距离Nb原子最近且距离相等的O原子有4个,Nb的配位数是
4,A错;由图可知,Nb和O最短距离为边长的 ,晶胞参数为anm,Nb和O最短距离为 anm,B错;
根据均摊法计算可知,Nb的个数为6× =3,O的个数为12× =3,即晶胞中含有3个NbO,晶胞密度为
ρ= ,C错。
9.C【解析】R是26号元素,则R是Fe,根据原子核外电子排布规律可知Fe原子结构示意图为: ,
可知Fe位于第四周期第Ⅷ族,C错误。
化学参考答案(萍实版)-1
学科网(北京)股份有限公司10.D【解析】聚丙烯是有丙烯通过加聚反应生成的,聚丙烯的结构简式为: ,属于加聚反
应。A项错;NH 的价层电子对数为 ,故为sp3杂化,VSEPR模型是四面体结构,题
3
中是空间构型,B项错;臭氧分子是离域 ,中心氧原子显正电性,两边氧原子显负电性,共用电子对有偏
移,是由极性键形成极性分子,C项错。
11.D【解析】V(HCl)=10mL时,此时溶液组成为NH Cl与 之比为1:1,根据物料守恒 +
4
=2c(Cl-),根据电荷守恒 + =c(Cl-)+c(OH-),二者结合可得 + =c( )+c(OH-),D错。
12.D【解析】N点HCOOH溶液与NaOH溶液恰好反应生成HCOONa,甲酸根发生水解,因此
及 观察图中N点可知, ,根据
,可知 ,故D错。
13.C【解析】二氧化碳中混入氯化氢气体杂质,氯化氢溶于水以后,与碳酸钠要反应生成二氧化碳,同时,
二氧化碳也会与碳酸钠反应,方程式为: ,A错误; 不会与氢氧化钠反
应,当 与 同时遇到氢氧化钠会反应,方程式为: ,B错误;碳酸
钠固体和二氧化碳不反应,在溶液中二者才反应,方程式为: ;同时加热会
导致碳酸氢钠固体分解,方程式为: ,D错误。
14.C【解析】由以上分析L 为CaSO ,L 为CaCO ,A错;c 、c 分别为饱和溶液中的离子浓度,则c 的
2 4 1 3 1 2 1
数量级为10-5而c =3×10-3,B错;降低温度,CaCO 溶解平衡逆向,饱和溶液中离子浓度降低,a不会移向
2 3
c点,D错。
15.(每空2分,共14分)
(1) 粉碎矿石、适当增大硫酸的浓度、适当升高温度、搅拌等
(2) 、
(3) 2.44
(4)乙醇易挥发便于快速干燥,且能防止碳酸锰被氧化
(5)
【解析】(1)加热、搅拌、粉碎固体、适当增大硫酸的浓度等措施,都能加快浸取速率;浸取过程中,
做还原剂,将 还原为 ,本身被氧化为 ,离子方程式为: ;
(2)通过过滤Ⅰ得到的滤液含有 、 、 ,加入 氧化 ,加入 除杂是通过调pH,
将 、 转化为 、 除掉,故滤渣Ⅱ为 、 ;
(3)过滤Ⅱ流程后,向得到的滤液中加入溶液 溶液或 溶液目的是沉锰,得到 固
体,故选用 溶液,反应的离子方程式为 ;“沉锰”后的溶
液中 ,根据 ,
,由于两溶液等体积混合,与 反应掉的
,则混合前剩余的 ,故加入的 溶液浓度为
;
(4) 难溶于水和乙醇,但潮湿时易被空气氧化,所以不能用水洗涤,而用乙醇洗涤,同时乙醇易挥
发,便于碳酸锰的干燥;
化学参考答案(萍实版)-2
学科网(北京)股份有限公司(5)11.5g碳酸锰的物质的量为0.1mol,含有0.1mol锰元素,到A点,质量减少了
11.5g-8.7g=2.8g,说明生成了0.1molCO,A点固体为 ,B点固体质量为7.9g,也含有0.1mol锰元
素,锰元素的质量为 ,剩余为氧元素的质量,则氧元素的物质的量为
,因此锰元素与氧元素的物质的量之比为 2:3,化学式为 ;
16.(每空2分,共14分)
(1)-49.5
(2) 40%(或0.4) 40%(或0.4) 66.7%(或 或0.667) 或0.003或能转换成0.003
(3) CO、CHOH选择性的和 增大(或变大)
3
【解析】(1)T ℃时,向恒压容器中充入0.2 mol CO (g)和0.6 mol H (g),若在该条件下只发生反应Ⅰ:
1 2 2
,达平衡时,放出4 kJ能量,则加入1 mol CO (g)和3 mol
2
H (g),反应达到平衡时放出热量Q = =20 kJ;若向相同容器中充入0.4 mol CH OH(g)和0.4 mol
2 正 3
H O(g),吸收11.8 kJ能量,则充入1 mol CH OH(g)和1 mol H O(g)反应达到平衡时吸收热量Q =
2 3 2 逆
=29.5 kJ,该反应是可逆反应,反应物不能完全转化为生成物,当按照反应方程式的计量数加入物质
时,正反应的转化率与逆反应的转化率的和为1,故反应Ⅰ的△H=-(29.5kJ/mol+20 kJ/mol)=- 49.5
1
kJ/mol;
(2)根据三个反应方程式中物质反应转化关系可知:反应产生CO与H O的量相等,则根据CO含量是5%
2
可知反应Ⅲ产生H O占5%;根据反应Ⅱ中物质反应转化关系可知反应产生10% CH OCH (g),会同时产生
2 3 3
H O占10%,消耗20%的CH OH(g),此时容器中CH OH(g)占5%,则反应Ⅰ产生CH OH(g)为20%
2 3 3 3
+5%=25%,同时产生H O占25%,故该容器中水的含量为5%+10%+25%=40%(或写为0.4);
2
CO 气体参加三个化学反应,其中部分转化为CH OCH (g),部分转化为CH OH(g)和CO(g),反应达到平衡
2 3 3 3
时CH OH(g)、CH OCH (g)和CO(g)体积分数分别为5%、10%、5%,根据转化关系可知:理论上反应产生
3 3 3
CH OCH (g)的CO 的体积分数为5%+2×10%+5%,根据C原子守恒可知:每有2个CO 参加反应,理论上
3 3 2 2
可制取1个 CH OCH (g),现在反应达到平衡时产生CH OH(g)、CH OCH (g)和CO(g)体积分数分别为
3 3 3 3 3
5%、10%、5%,则发生反应消耗CO 依次占5%、20%、5%,
2
反应Ⅲ. 为放热反应,升高温度平衡正向移动,根据
图中曲线可知,当A、B两直线相交时, ,当温度降低时, 增大,则 ,则A为lgk 随 的变
逆
化曲线,B为lgk 随 的变化曲线,T ℃时,lgk -lgk =lg =a-1-(a-0.7)=-0.3,K= =10-0.3=0.50,
正 2 正 逆
对于反应Ⅰ,反应达到平衡时CH OCH (g)占10%,H O占40%,CH OH(g)和CO(g)体积分数均为5%,则
3 3 2 3
CO 和H 的体积分数之和为1-10%-40%-5%-5%=40%,设CO 占x,则H 占40%-x,根据三段式有:
2 2 2 2
Kp= =0.50,解得x=20%,根据C守恒,理论上CO 转化成CH OCH (g)的体
2 3 3
积分数为20% +(5%+5%) +10%=25%,实际转化10%,则CH OCH (g)产率为 ;
3 3
CO 转化成CH OCH (g)的选择性为 ;
2 3 3
化学参考答案(萍实版)-3
学科网(北京)股份有限公司则对于反应反应Ⅰ的K= = ;
p
(3)①反应Ⅱ为放热反应,升高温度平衡逆向移动,CH OCH (g)选择性减小,则曲线A为CH OCH (g)选
3 3 3 3
择性;反应Ⅱ的进行使部分CH OH继续消耗,故CO 的转化率大于CO、CH OH选择性的和,因此曲线C
3 2 3
表示CO、CH OH选择性的和;
3
②T -T 温度之间,升高温度,反应Ⅰ、Ⅱ为放热反应,逆向移动,n(H O)减小,反应Ⅲ为吸热反应,升高温
1 5 2
度平衡正向移动,但n(H O)、n(CO)增加的量相等,故比值 将增大。
2
17.(每空2分,共14分)
(1) 氨水 沉淀恰好溶解
(2) dacbe 在室内不同点位进行空气取样
(3) 减小空气通入速率,保证空气中的HCHO被吸收完全
(4)0.03
【解析】(1)由分析可知,B为氨水;A中为硝酸银溶液,向硝酸银溶液中滴加氨水生成AgOH白色沉淀,
加入过量氨水沉淀溶解,得到银氨溶液,故氨水逐滴加入A中至沉淀恰好溶解;
(2)结合分析可知,室内空气中甲醛含量的测定操作为:取下玻璃塞后加热仪器A,打开 ,关闭 排除
装置C中气体,使可滑动隔板处于最右端,再将可滑动隔板拉至最左端,使装置C中充满室内空气后,打开
,关闭 ,将可滑动隔板缓慢推至最右端,使气体通入装置A中,则操作①、②、③、④、⑤依次为
dacbe;为保证数据样本的多样性,可以在室内不同点位进行空气取样;
(3)装置中使用毛细管,可以减小空气通入速率,保证空气中的HCHO被吸收完全;甲醛与银氨溶液反应的
化学方程式为 ;
(4)经上述分析可得到比例关系: ,测定生成1.12mg ,则 的物质的量为
,则空气中 的质量为 ,因实验进行了5次操作,
所以测得1L空气中甲醛的含量为 ,则空气中甲醛的含量为 。
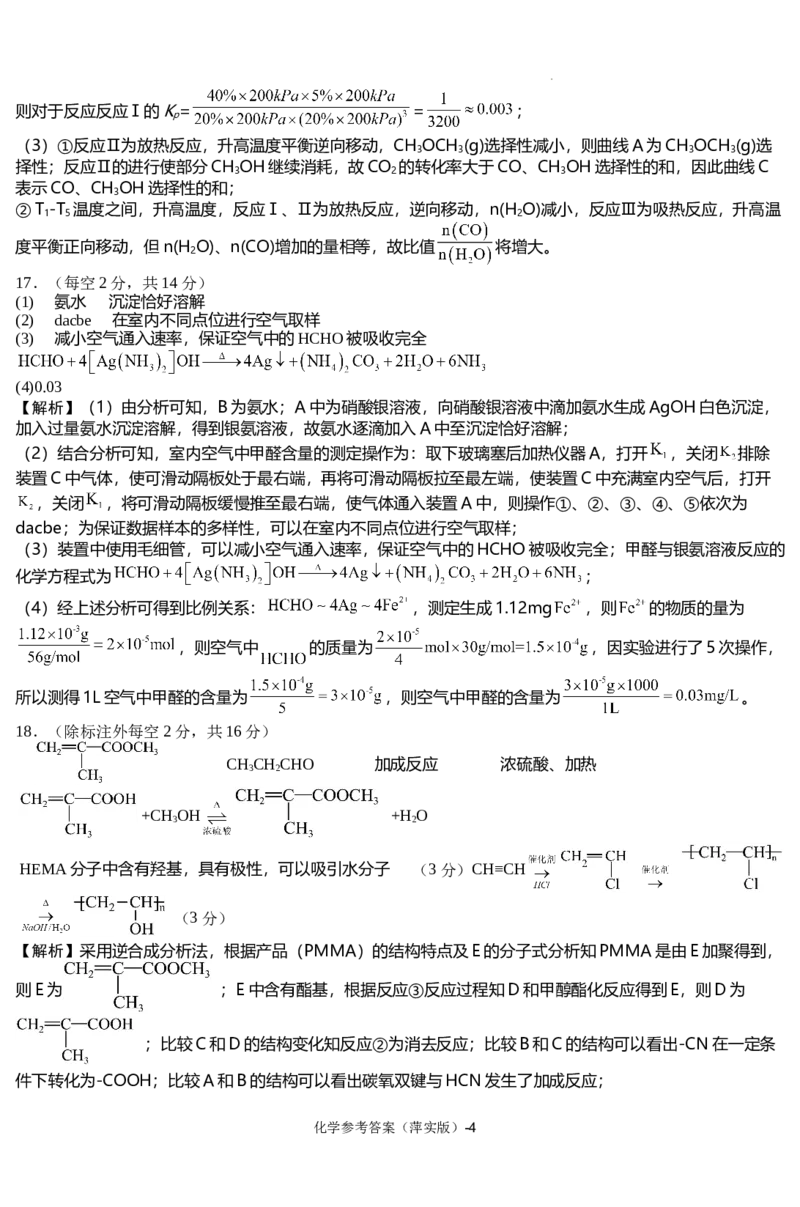
18.(除标注外每空2分,共16分)
CHCHCHO 加成反应 浓硫酸、加热
3 2
+CHOH +H O
3 2
HEMA分子中含有羟基,具有极性,可以吸引水分子 (3分)CH≡CH
(3分)
【解析】采用逆合成分析法,根据产品(PMMA)的结构特点及E的分子式分析知PMMA是由E加聚得到,
则E为 ;E中含有酯基,根据反应③反应过程知D和甲醇酯化反应得到E,则D为
;比较C和D的结构变化知反应②为消去反应;比较B和C的结构可以看出-CN在一定条
件下转化为-COOH;比较A和B的结构可以看出碳氧双键与HCN发生了加成反应;
化学参考答案(萍实版)-4
学科网(北京)股份有限公司(1)PMMA由E通过加聚反应得到,则E的结构简式为 ;A的同分异构体能与新制氢
氧化铜反应,则其结构中含有醛基,结合A的结构简式可知其同分异构体为:CH CH CHO,
3 2
(2)根据A和B的结构特征分析可知,该变化中碳氧双键发生了加成反应,
(3)根据C和E的结构及反应条件可知,D的结构简式为: ,反应②为消去反应,反应
试剂及条件为浓硫酸、加热。.
(4)根据D 和E 的结构可知,反应③为酯化反应,化学方程式为
+CH OH +H O 。
3 2
故答案为 +CH OH +H O ;公众号:高中试卷君
3 2
(5)根据有机物的分子结构及用途分析,其原因为: HEMA分子中含有羟基,具有极性,可以吸引水分
子,
(6)聚乙烯醇的单体为乙烯醇,由题干信息知乙烯醇不稳定,所以可以通过聚氯乙烯水解得到聚乙烯醇,聚
氯乙烯的单体是氯乙烯,可以由原料乙炔通过加成制得,所以设计合成路线为:CH≡CH
,
化学参考答案(萍实版)-5
学科网(北京)股份有限公司