文档内容
2024届高三级11月四校联考 化学试题
佛山市第一中学、广州市第六中学
汕头市金山中学、中山市第一中学
试卷总分:100分 考试时间:75分钟
注意事项:
1. 答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。本次考试采用特殊编排
考号,请考生正确填涂。
2. 回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如
需改动用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡
上。写在本试卷上无效。
可能用到的相对原子质量:H 1 B 11 C 12 O 16 Na 23 Cl 35.5 Cu 64
第一部分 选择题(共44分)
一、单项选择题(共44分,其中1-10每题2分,11-16每题4分)。
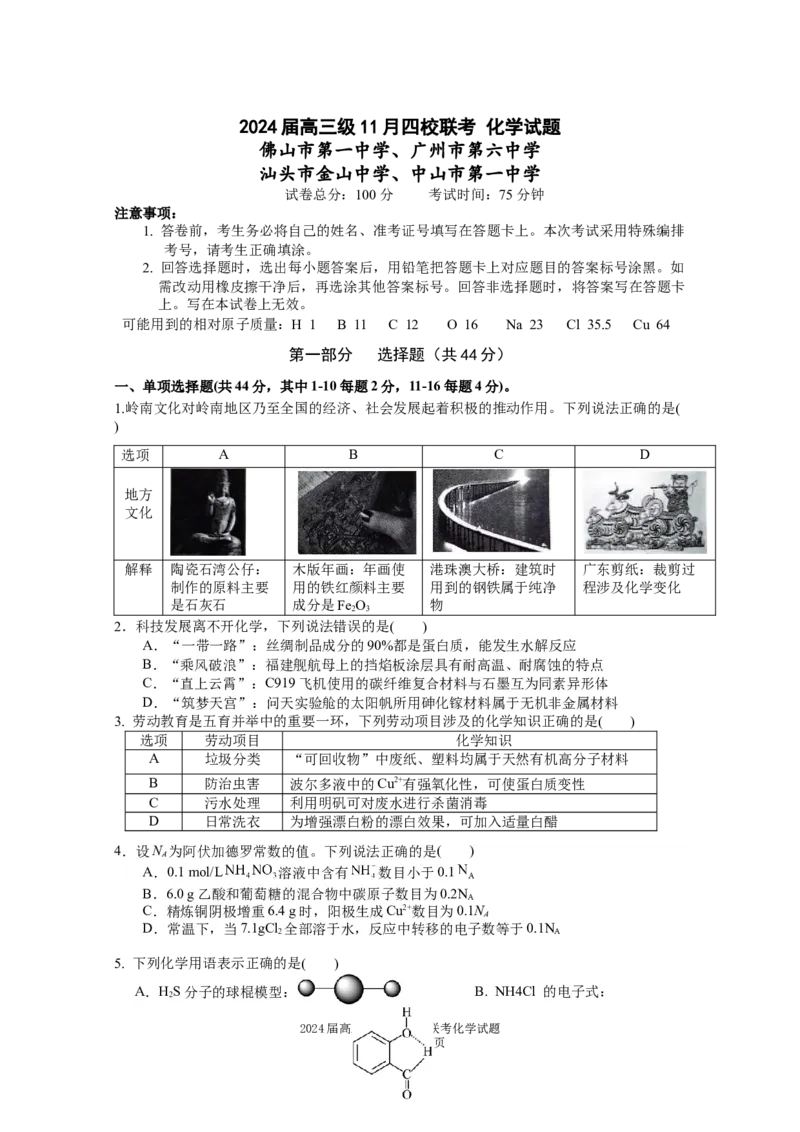
1.岭南文化对岭南地区乃至全国的经济、社会发展起着积极的推动作用。下列说法正确的是(
)
选项 A B C D
地方
文化
解释 陶瓷石湾公仔: 木版年画:年画使 港珠澳大桥:建筑时 广东剪纸:裁剪过
制作的原料主要 用的铁红颜料主要 用到的钢铁属于纯净 程涉及化学变化
是石灰石 成分是Fe O 物
2 3
2.科技发展离不开化学,下列说法错误的是( )
A.“一带一路”:丝绸制品成分的90%都是蛋白质,能发生水解反应
B.“乘风破浪”:福建舰航母上的挡焰板涂层具有耐高温、耐腐蚀的特点
C.“直上云霄”:C919飞机使用的碳纤维复合材料与石墨互为同素异形体
D.“筑梦天宫”:问天实验舱的太阳帆所用砷化镓材料属于无机非金属材料
3. 劳动教育是五育并举中的重要一环,下列劳动项目涉及的化学知识正确的是( )
选项 劳动项目 化学知识
A 垃圾分类 “可回收物”中废纸、塑料均属于天然有机高分子材料
B 防治虫害 波尔多液中的Cu2+有强氧化性,可使蛋白质变性
C 污水处理 利用明矾可对废水进行杀菌消毒
D 日常洗衣 为增强漂白粉的漂白效果,可加入适量白醋
4.设N 为阿伏加德罗常数的值。下列说法正确的是( )
A
A.0.1 mol/L 溶液中含有 数目小于0.1
B.6.0 g乙酸和葡萄糖的混合物中碳原子数目为0.2N
A
C.精炼铜阴极增重6.4 g时,阳极生成Cu2+数目为0.1N
A
D.常温下,当7.1gCl 全部溶于水,反应中转移的电子数等于0.1N
2 A
5. 下列化学用语表示正确的是( )
A.HS分子的球棍模型: B. NH4Cl 的电子式:
2
2024届高三级11月四校联考化学试题
第 1 页 共 8 页C.邻羟基苯甲醛分子内氢键示意图: D.2p 电子云轮廓图:
z
6. 下列有关离子方程式书写正确的是( )
A. 向NH HSO 溶液中滴加少量NaOH溶液: +OH-=NH·H O
4 4 3 2
B. 溶于 溶液中:
C. 泡沫灭火器的工作原理:
D. 纯碱溶液浸泡锅炉水垢(CaSO ):
4
CaSO (s)+CO2− (aq)⇌SO2− (aq)+CaCO (s)
4 3 4 3
7. CO与 在铁催化剂表面进行如下两步反应:
第一步: (慢) 第二步: (快)
其相对能量与反应历程如下图所示,下列说法错误的是( )
A.两步反应均为放热反应
B.总反应的反应速率由第一步反应决定
C.在整个反应历程中,有极性键的断裂和生成
D.FeO*和Fe *均为反应的催化剂
8. M是中药狼把草的成分之一,具有消炎杀菌作用,其结构如图所示。下列叙述正确的是(
)
A.该化合物属于苯的同系物
B.M的分子式为C H O
9 10 4
C.1 mol M最多能与3 mol Br 发生反应
2
D.M能分别与Na、NaOH、NaHCO 发生反应
3
9.陈述Ⅰ和陈述Ⅱ均正确且具有因果关系的是( )
选项 陈述Ⅰ 陈述Ⅱ
A FeCl 溶液可用作蚀刻铜电路板 FeCl 溶液显酸性
3 3
B 水加热到很高的温度都难以分解 水分子间存在氢键
C 不能用电解AlCl 制备铝单质 AlCl 属于共价化合物
3 3
D NaS用于除去废水中的Cu2+、Hg2+ NaS还原性较强
2 2
2024届高三级11月四校联考化学试题
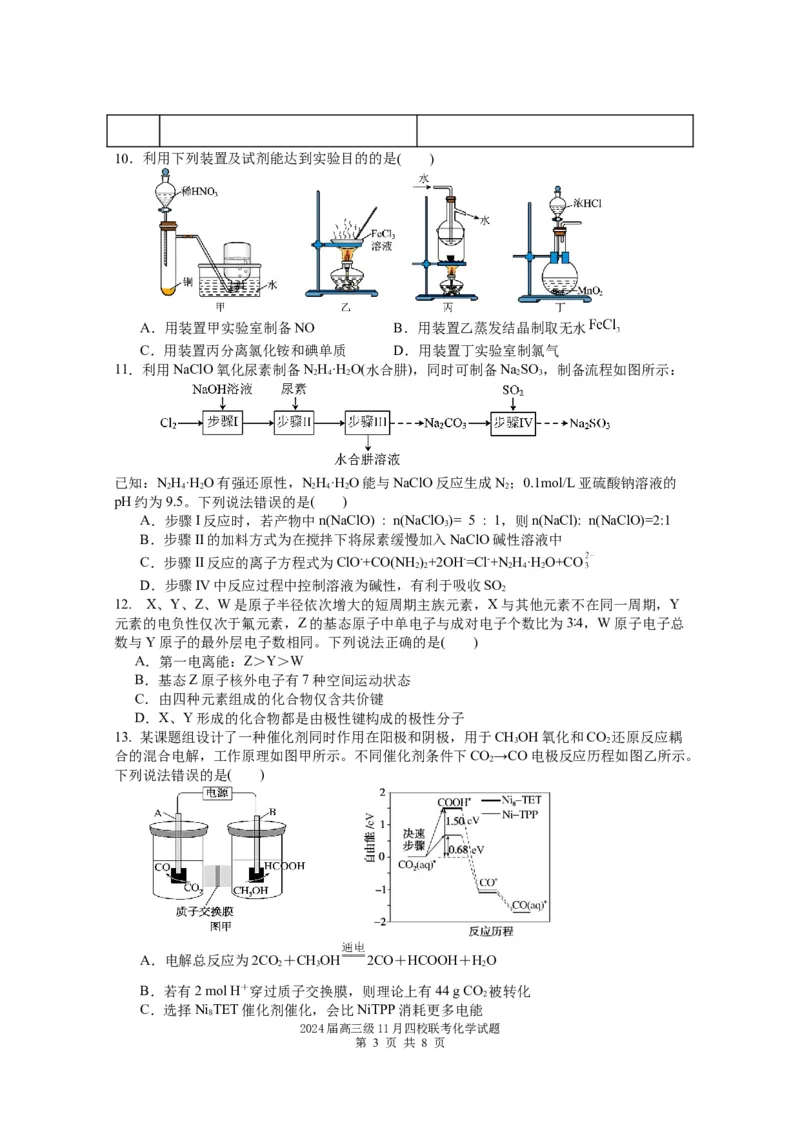
第 2 页 共 8 页10.利用下列装置及试剂能达到实验目的的是( )
A.用装置甲实验室制备NO B.用装置乙蒸发结晶制取无水
C.用装置丙分离氯化铵和碘单质 D.用装置丁实验室制氯气
11.利用NaClO氧化尿素制备NH·H O(水合肼),同时可制备NaSO ,制备流程如图所示:
2 4 2 2 3
已知:NH·H O有强还原性,NH·H O能与NaClO反应生成N;0.1mol/L亚硫酸钠溶液的
2 4 2 2 4 2 2
pH约为9.5。下列说法错误的是( )
A.步骤I反应时,若产物中n(NaClO) : n(NaClO)= 5 : 1,则n(NaCl): n(NaClO)=2:1
3
B.步骤II的加料方式为在搅拌下将尿素缓慢加入NaClO碱性溶液中
C.步骤II反应的离子方程式为ClO-+CO(NH )+2OH-=Cl-+N H·H O+CO
2 2 2 4 2
D.步骤IV中反应过程中控制溶液为碱性,有利于吸收SO
2
12. X、Y、Z、W是原子半径依次增大的短周期主族元素,X与其他元素不在同一周期,Y
元素的电负性仅次于氟元素,Z的基态原子中单电子与成对电子个数比为3∶4,W原子电子总
数与Y原子的最外层电子数相同。下列说法正确的是( )
A.第一电离能:Z>Y>W
B.基态Z原子核外电子有7种空间运动状态
C.由四种元素组成的化合物仅含共价键
D.X、Y形成的化合物都是由极性键构成的极性分子
13. 某课题组设计了一种催化剂同时作用在阳极和阴极,用于CHOH氧化和CO 还原反应耦
3 2
合的混合电解,工作原理如图甲所示。不同催化剂条件下CO→CO电极反应历程如图乙所示。
2
下列说法错误的是( )
A.电解总反应为2CO+CHOH 2CO+HCOOH+HO
2 3 2
B.若有2 mol H+穿过质子交换膜,则理论上有44 g CO 被转化
2
C.选择Ni TET催化剂催化,会比NiTPP消耗更多电能
8
2024届高三级11月四校联考化学试题
第 3 页 共 8 页D.若以铅蓄电池为电源,则B极应与PbO 极相连接
2
14. 下列实验目的对应的实验方案设计、现象和结论都正确的是( )
选项 实验目的 实验方案设计 现象和结论
证明溶液是否含 向溶液中加入稀氢氧化钠溶液, 试纸未变蓝,说明不含
A
NH + 用湿润的红色石蕊试纸靠近瓶口 NH +
4 4
溶液红色逐渐变浅,产生
证明NaSO 溶液 向含有酚酞的NaSO 溶液中滴入
B 2 3 2 3 白色沉淀,证明NaSO
中存在水解平衡 Ba(ClO) 溶液至过量 2 3
2 溶液中存在水解平衡
取5 mL 0.1mol·L-1 KI溶液于试管
溶液变血红色,说明KI
探究KI与FeCl 中,加入1 mL 0.1 mol·L-1FeCl 溶
C 3 3 与FeCl 的反应具有可逆
反应的可逆性 液,充分反应后萃取分液,向水 3
性
层滴KSCN溶液
探究 Cu(OH) 和 向足量氢氧化钠溶液中先加入少 先产生白色沉淀,后产生
2
D Mg(OH) 溶度积 量MgCl 溶液,充分反应后再加 蓝色沉淀,说明Cu(OH)
2 2 2
的大小 入少量CuSO 溶液 比Mg(OH) 的溶度积小
4 2
15. 下列类比或推理合理的是( )
选项 已知 方法 结论
A 沸点: 类比 沸点:LiMg>Al 推理 碱性:
16.常温下,用 盐酸滴定 溶液,所得溶液pH、
和 的物质的量分数与滴加盐酸体积的关系如
图所示。下列叙述错误的是( )
A.曲线①代表 ,曲线②代表
B.a点溶液中存在c(NH )=c(NH•H O)>c(Cl-)
3 2
C. 的电离常数的数量级为
D.若选择甲基橙为指示剂,滴定终点的溶液颜色变化
为黄色变为橙色
第二部分 非选择题(共56分)
2024届高三级11月四校联考化学试题
第 4 页 共 8 页17. 三草酸合铁(Ⅲ)酸钾{K [Fe(C O)]·3H O}是制备负载型活性铁催化剂的主要原料。实验
3 2 4 3 2
室欲制备少量三草酸合铁(Ⅲ)酸钾。
已知:K[Fe(C O)]·3H O(M=491) 为翠绿色晶体、难溶于乙醇;0℃时在水中溶解度为
3 2 4 3 2 r
4.7g,100℃时溶解度为117.7g。
Ⅰ.制备Fe(OH)
3
称取2g莫尔盐[(NH )Fe(SO )]于锥形瓶中,溶于水,滴加足量6%HO,加热并搅拌。
4 2 4 2 2 2
当变成红褐色后,再煮沸十分钟,冷却后,过滤、洗涤。
Ⅱ.制备草酸氢钾
取2gHC O·2H O溶于20mL水中,加入1.2gK CO,反应生成KHC O。
2 2 4 2 2 3 2 4
Ⅲ.制备三草酸合铁(Ⅲ)酸钾晶体。步骤如图:
请回答下列问题:
(1) I中制备Fe(OH) 的离子反应方程式为 。
3
(2) ①制备三草酸合铁(Ⅲ)酸钾晶体,步骤1装置中仪器a的名称为 。采用水
浴加热的目的是 。
②步骤2的操作名称是 ,步骤3采用冰水冷却的目的 。
③过滤后需要用乙醇溶液洗涤,其优点是
。
(3) 三草酸合铁(Ⅲ)酸钾晶体具有光敏性,在强光下分解生成草酸亚铁(FeC O)且产物中只有
2 4
一种气体,该反应的化学方程式为 。
(4) 产品纯度的测定
从上述反应后的溶液中分离得到K[Fe(C O)]·3H O晶体,测定所得产品的纯度:称取a
3 2 4 3 2
g晶体溶于100 mL水中配成溶液,取20 mL溶液于锥形瓶中,用c mol·L-1的酸性KCr O 标
2 2 7
准溶液进行滴定 ( 被还原为Cr3+) ,进行了三次平行实验,达到滴定终点时平均消耗标
准溶液V mL,则所得产品的纯度为 %(用含V、c、a的代数式表示)。
18. 钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛
白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪(Sc O)的一种流程如图:
2 3
2024届高三级11月四校联考化学试题
第 5 页 共 8 页已知:K [Mn(OH) ]=1.1×10-13、K [Fe(OH) ]=1.0×10-39、K [Sc(OH) ]=2.0×10-31
sp 2 sp 3 sp 3
请回答下列问题:
(1) 洗涤“油相”可除去大量的钛离子。洗涤液是用93%的硫酸、27.5%的双氧水和水按一定
比例混合而成。混合的实验操作是
,冷却后,再慢慢注入27. 5%的双氧水中,并不断搅拌。
(2) 第一次“酸溶”后,若溶液中存在的c(Fe3+) = c(Sc3+) = c(Mn2+) = 0.1 mol·L-1,离子浓度为
1×10-6mol·L-1时认为完全沉淀。用氨水调节溶液的pH分两步进行,则先加入氨水调节pH的
范围是 (保留一位小数,已知lg2=0.3);过滤后,滤液中继续加入氨水
调节pH=6,过滤得到的滤渣是 (填化学式),此时滤液中含量最多的金属元素是
。
(3) 用草酸沉钪,“沉钪”得到草酸钪的离子方程式是 。
(4) 草酸钪在空气中“灼烧”可制得Sc O,写出反应的化学方式
2 3
。
(5) Ti(BH) 是一种储氢材料,可由TiCl 和LiBH 反应制得。
3 4 4
①基态Ti原子的价电子排布式为
②LiBH 由Li+和BH-构成,BH-的空间构型是
4 4 4
(6) 硼氢化钠(NaBH)是一种常用的还原剂,其晶胞结构如图所示。
4
①该晶体中 的配位数为
②设N 为阿伏加德罗常数的值,则硼氢化钠晶体的
A
密度 = (用含a、N 的最简式表示)g·cm-3。
A
19.“碳达峰”、“碳中和”是我国社会发展重大战略之一。
I.中国首次实现了利用二氧化碳人工合成淀粉,其中最关键的一步是以CO 为原料制
2
CHOH。在某CO 催化加氢制CHOH的反应体系中,发生的主要反应有:
3 2 3
反应①CO(g)+H(g) CO(g)+HO(g) △H=+41.1kJ/mol
2 2 2 1
⇌
2024届高三级11月四校联考化学试题
第 6 页 共 8 页反应②CO(g)+2H(g) CHOH(g) △H
2 3 2
反应③CO(g)+3H(g) CHOH(g)+H O(g) △H=-57.9kJ/mol
2 2 ⇌ 3 2 3
(1)反应②活化能Ea(正) Ea(逆)(填“>”、“<”或“=”),该反应在 (填“高温”
⇌
或“低温")条件下自发进行。
(2)恒温恒容下,向密闭容器按投料比n(CO):n(H )=1:1通入原料气,若只发生主反应
2 2
③CO(g)+3H(g) CHOH(g)+H O(g),能判断该反应处于平衡状态的是_______(填标号)
2 2 3 2
A.v (CO)=3v (H ) B.体系内压强保持不变
正 2 ⇌ 逆 2
C.混合气体的平均相对分子质量保持不变 D.反应的焓变 保持不变
Ⅱ. 上述反应①的逆反应:CO(g)+HO(g) CO(g)+H(g) 是目前催化制氢的重要方法之一。
2 2 2
在T℃时,将0.10molCO与0.40molHO充入5L的容器中,反应平衡后H 的物质的量分数
1 2 ⇌ 2
x(H )=0.08。
2
(3)CO的平衡转化率 %,反应平衡常数 。(结果保留2位有效数字)
(4)保持K不变,提高CO平衡转化率措施有: 。(任意一条)
(5)由 ℃时上述实验数据计算得到
~x(CO)和 ~x( )的关系可用如图
表示。当升高到某一温度时,反应重新达到
平衡,相应的点分别为 。(填字
母)
III.中科院福建物质结构研究所基于CO 和甲酸(HCOOH)的相互转化设计并实现了一种可逆的
2
水系金属—二氧化碳二次电池,结构如图所示。
(6)该装置充电时,阳极的电极反应式为 。
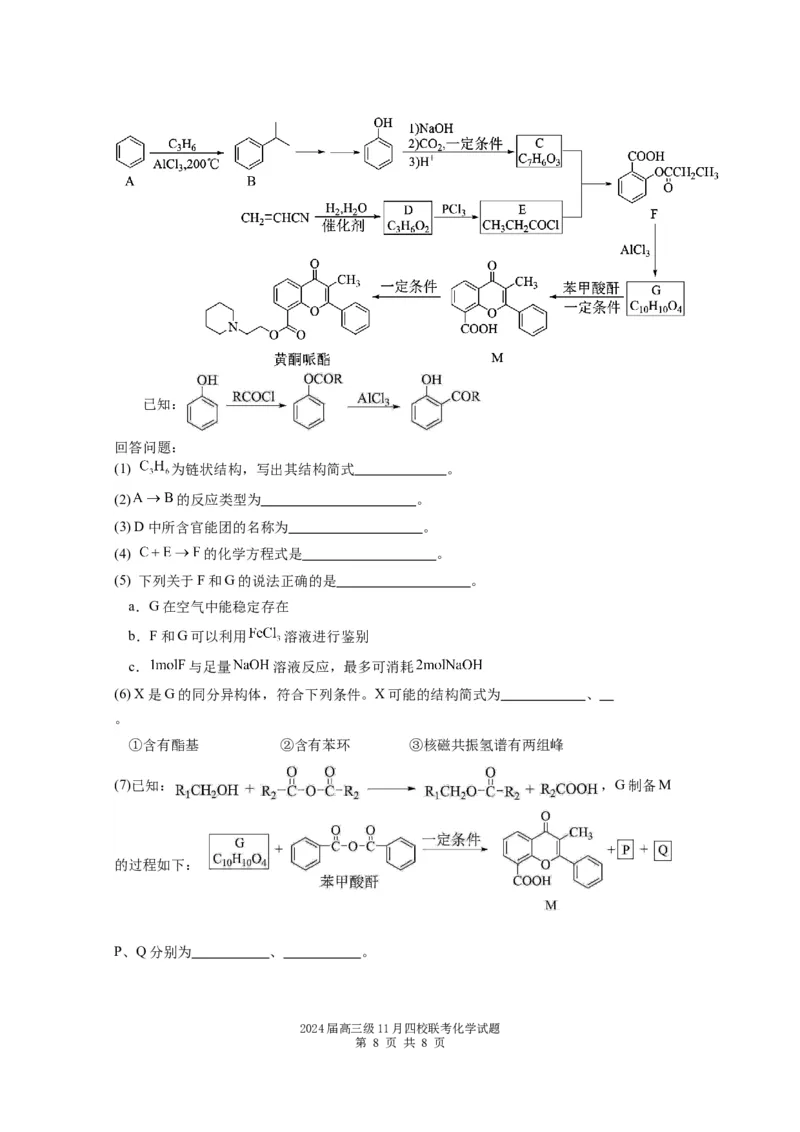
20.黄酮哌酯是一种解痉药,可通过如下路线合成:
2024届高三级11月四校联考化学试题
第 7 页 共 8 页已知:
回答问题:
(1) 为链状结构,写出其结构简式 。
(2) 的反应类型为 。
(3) D中所含官能团的名称为 。
(4) 的化学方程式是 。
(5) 下列关于F和G的说法正确的是 。
a.G在空气中能稳定存在
b.F和G可以利用 溶液进行鉴别
c. 与足量 溶液反应,最多可消耗
(6) X是G的同分异构体,符合下列条件。X可能的结构简式为 、
。
①含有酯基 ②含有苯环 ③核磁共振氢谱有两组峰
(7)已知: ,G制备M
的过程如下:
P、Q分别为 、 。
2024届高三级11月四校联考化学试题
第 8 页 共 8 页