文档内容
腾冲市第八中学2024--2025学年下学期高二年级期中考试化学试卷
可能用到的相对原子质量:H—1 C—1 2N—14 O—16 S—32 Cr—52 Fe—56
第Ⅰ卷(选择题 共42分)
一、单项选择题(本大题共14小题,每小题3分,共42分。在每小题所给的四个选项中,只
有一项是符合题目要求的。)
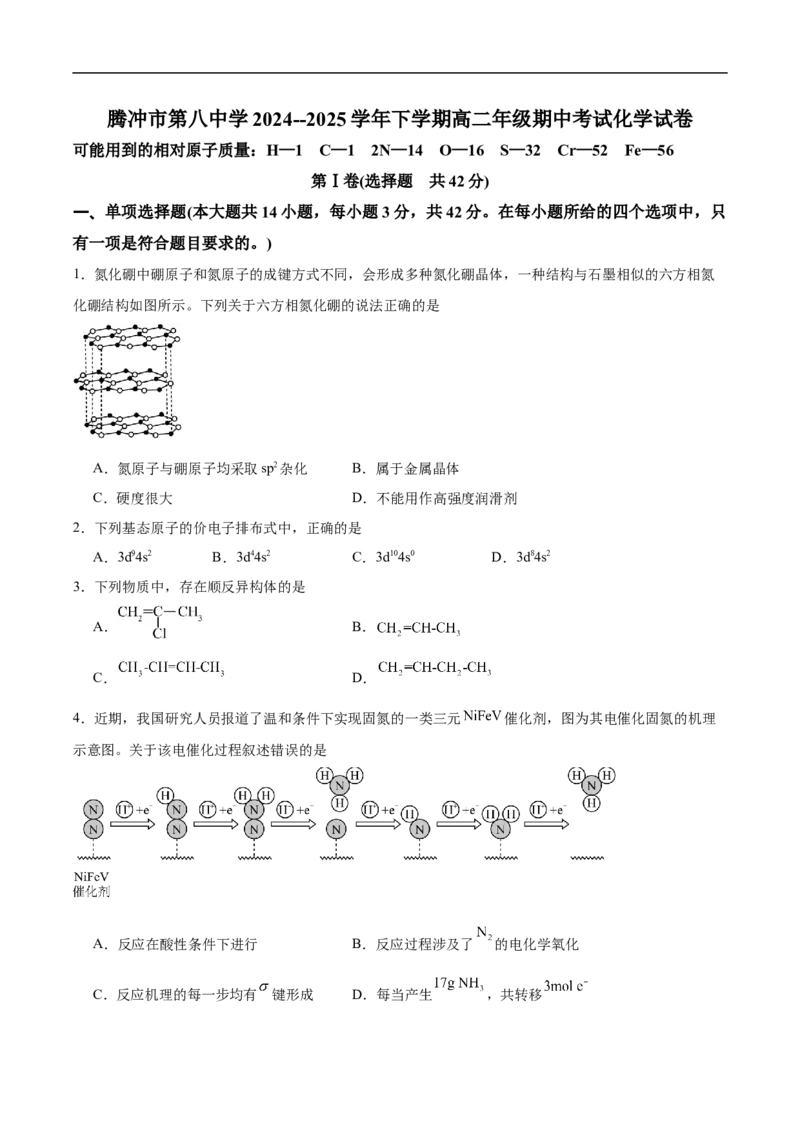
1.氮化硼中硼原子和氮原子的成键方式不同,会形成多种氮化硼晶体,一种结构与石墨相似的六方相氮
化硼结构如图所示。下列关于六方相氮化硼的说法正确的是
A.氮原子与硼原子均采取sp2杂化 B.属于金属晶体
C.硬度很大 D.不能用作高强度润滑剂
2.下列基态原子的价电子排布式中,正确的是
A.3d94s2 B.3d44s2 C.3d104s0 D.3d84s2
3.下列物质中,存在顺反异构体的是
A. B.
C. D.
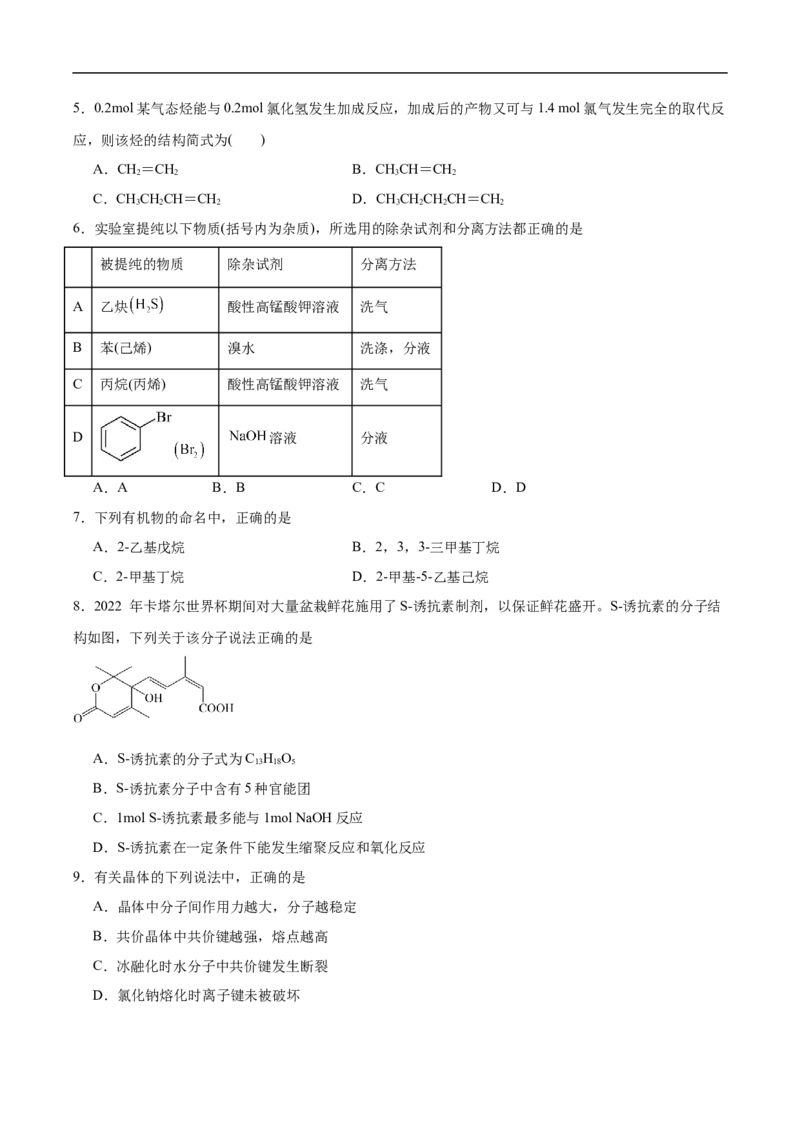
4.近期,我国研究人员报道了温和条件下实现固氮的一类三元 催化剂,图为其电催化固氮的机理
示意图。关于该电催化过程叙述错误的是
A.反应在酸性条件下进行 B.反应过程涉及了 的电化学氧化
C.反应机理的每一步均有 键形成 D.每当产生 ,共转移5.0.2mol某气态烃能与0.2mol氯化氢发生加成反应,加成后的产物又可与1.4 mol氯气发生完全的取代反
应,则该烃的结构简式为( )
A.CH=CH B.CHCH=CH
2 2 3 2
C.CHCHCH=CH D.CHCHCHCH=CH
3 2 2 3 2 2 2
6.实验室提纯以下物质(括号内为杂质),所选用的除杂试剂和分离方法都正确的是
被提纯的物质 除杂试剂 分离方法
A 乙炔 酸性高锰酸钾溶液 洗气
B 苯(己烯) 溴水 洗涤,分液
C 丙烷(丙烯) 酸性高锰酸钾溶液 洗气
D 溶液 分液
A.A B.B C.C D.D
7.下列有机物的命名中,正确的是
A.2-乙基戊烷 B.2,3,3-三甲基丁烷
C.2-甲基丁烷 D.2-甲基-5-乙基己烷
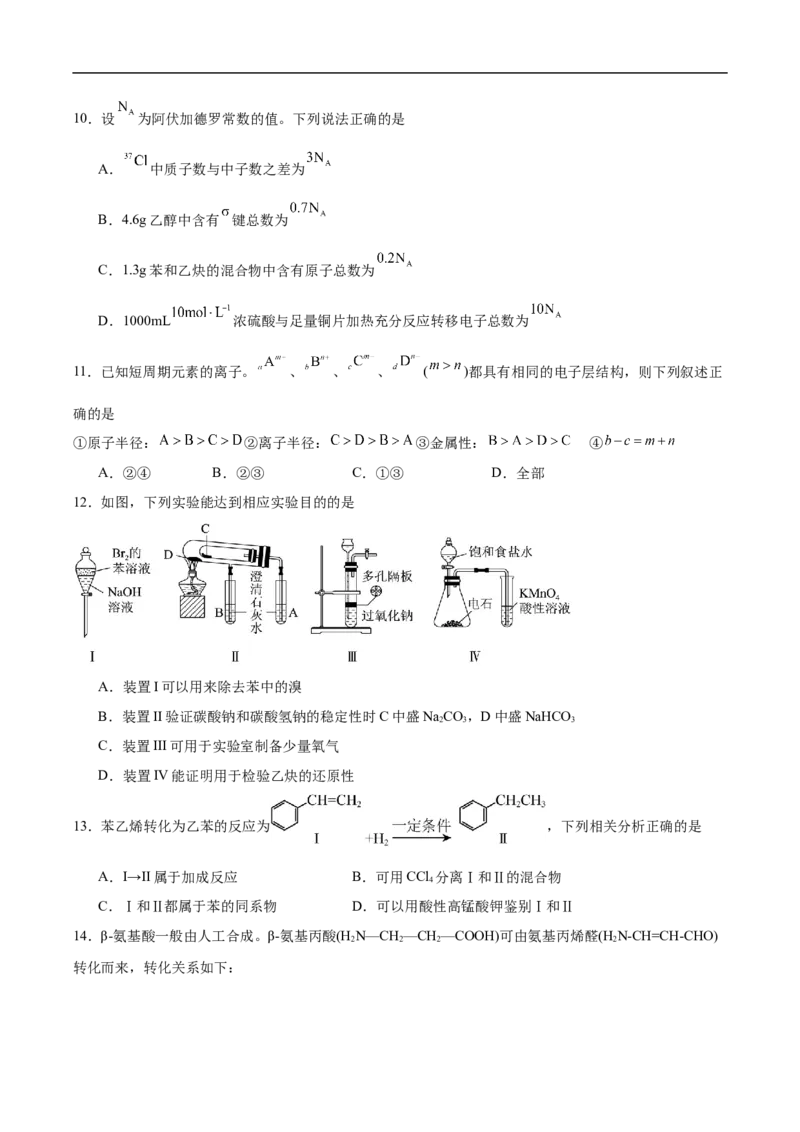
8.2022 年卡塔尔世界杯期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结
构如图,下列关于该分子说法正确的是
A.S-诱抗素的分子式为C H O
13 18 5
B.S-诱抗素分子中含有5种官能团
C.1mol S-诱抗素最多能与1mol NaOH反应
D.S-诱抗素在一定条件下能发生缩聚反应和氧化反应
9.有关晶体的下列说法中,正确的是
A.晶体中分子间作用力越大,分子越稳定
B.共价晶体中共价键越强,熔点越高
C.冰融化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏10.设 为阿伏加德罗常数的值。下列说法正确的是
A. 中质子数与中子数之差为
B.4.6g乙醇中含有 键总数为
C.1.3g苯和乙炔的混合物中含有原子总数为
D.1000mL 浓硫酸与足量铜片加热充分反应转移电子总数为
11.已知短周期元素的离子。 、 、 、 ( )都具有相同的电子层结构,则下列叙述正
确的是
①原子半径: ②离子半径: ③金属性: ④
A.②④ B.②③ C.①③ D.全部
12.如图,下列实验能达到相应实验目的的是
A.装置I可以用来除去苯中的溴
B.装置II验证碳酸钠和碳酸氢钠的稳定性时C中盛NaCO,D中盛NaHCO
2 3 3
C.装置III可用于实验室制备少量氧气
D.装置IV能证明用于检验乙炔的还原性
13.苯乙烯转化为乙苯的反应为 ,下列相关分析正确的是
A.I→Ⅱ属于加成反应 B.可用CCl 分离Ⅰ和Ⅱ的混合物
4
C.Ⅰ和Ⅱ都属于苯的同系物 D.可以用酸性高锰酸钾鉴别Ⅰ和Ⅱ
14.β-氨基酸一般由人工合成。β-氨基丙酸(H N—CH —CH—COOH)可由氨基丙烯醛(H N-CH=CH-CHO)
2 2 2 2
转化而来,转化关系如下:下列说法错误的是
A.I、Ⅱ的分子均存在顺反异构现象
B.I、Ⅱ和Ⅲ的分子中均存在4种化学环境的氢原子
C.I、Ⅱ和Ⅲ的分子中均不含手性碳原子
D.I的同分异构体中含有醛基的物质有4种
第Ⅱ卷(非选择题 共58分)
二、填空题(本大题共4小题,共58分)
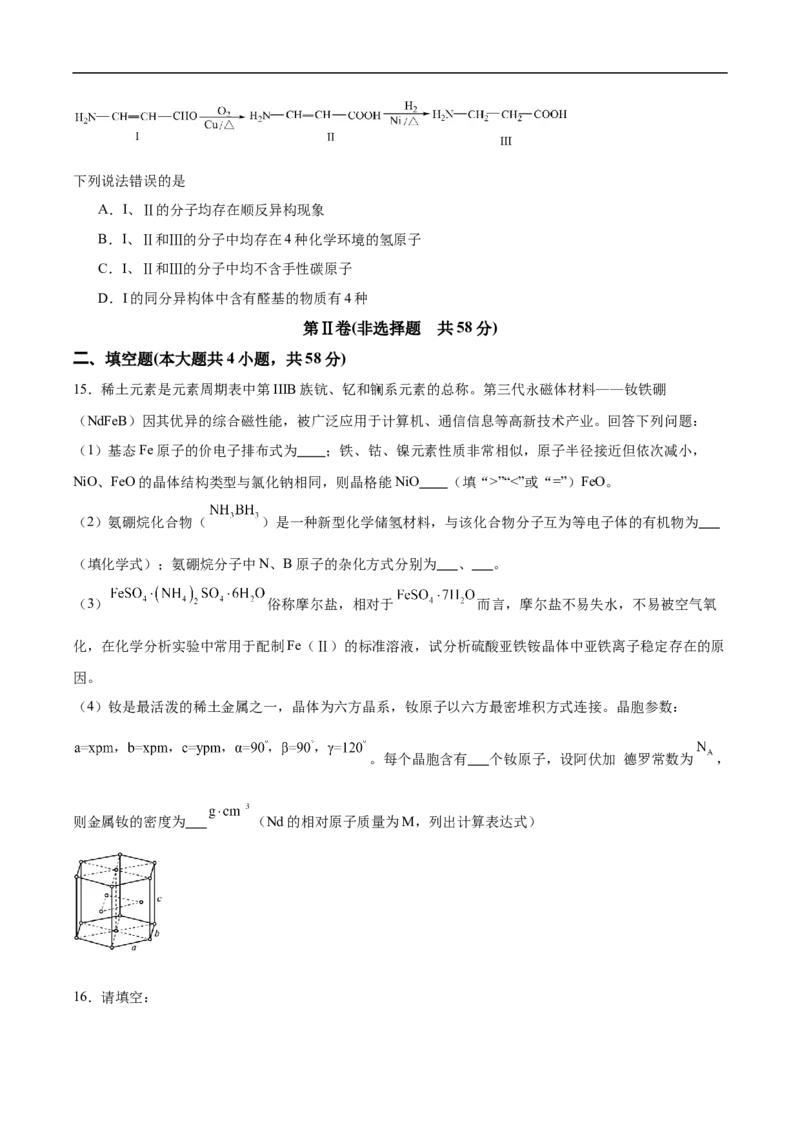
15.稀土元素是元素周期表中第IIIB族钪、钇和镧系元素的总称。第三代永磁体材料——钕铁硼
(NdFeB)因其优异的综合磁性能,被广泛应用于计算机、通信信息等高新技术产业。回答下列问题:
(1)基态Fe原子的价电子排布式为 ;铁、钴、镍元素性质非常相似,原子半径接近但依次减小,
NiO、FeO的晶体结构类型与氯化钠相同,则晶格能NiO (填“>”“<”或“=”)FeO。
(2)氨硼烷化合物( )是一种新型化学储氢材料,与该化合物分子互为等电子体的有机物为
(填化学式);氨硼烷分子中N、B原子的杂化方式分别为 、 。
(3) 俗称摩尔盐,相对于 而言,摩尔盐不易失水,不易被空气氧
化,在化学分析实验中常用于配制Fe(Ⅱ)的标准溶液,试分析硫酸亚铁铵晶体中亚铁离子稳定存在的原
因。
(4)钕是最活泼的稀土金属之一,晶体为六方晶系,钕原子以六方最密堆积方式连接。晶胞参数:
。每个晶胞含有 个钕原子,设阿伏加 德罗常数为 ,
则金属钕的密度为 (Nd的相对原子质量为M,列出计算表达式)
16.请填空:(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为 。
(2)B元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,B的元素号为 ,
其正二价离子的电子排布式为 。
(3)C元素的原子最外层电子排布式为nsnnpn+2,则C的电子排布图为 。
(4)第三周期p轨道半充满的元素是 。
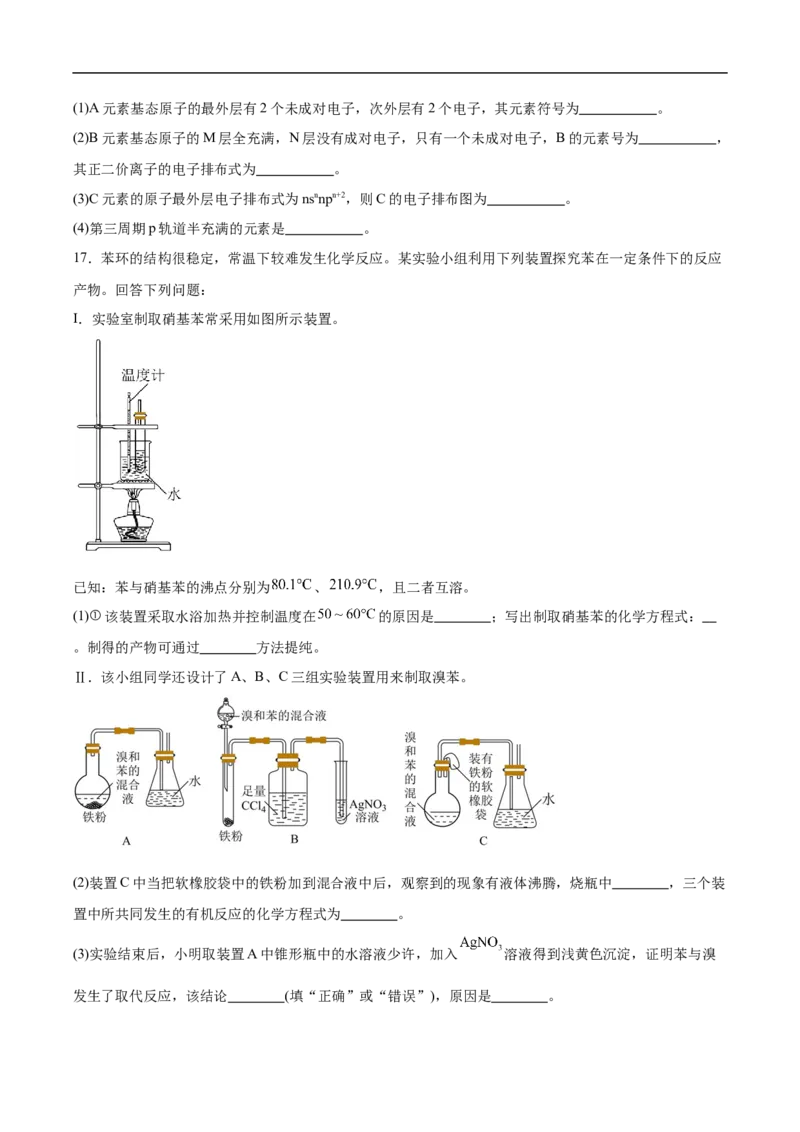
17.苯环的结构很稳定,常温下较难发生化学反应。某实验小组利用下列装置探究苯在一定条件下的反应
产物。回答下列问题:
I.实验室制取硝基苯常采用如图所示装置。
已知:苯与硝基苯的沸点分别为 、 ,且二者互溶。
(1)①该装置采取水浴加热并控制温度在 的原因是 ;写出制取硝基苯的化学方程式:
。制得的产物可通过 方法提纯。
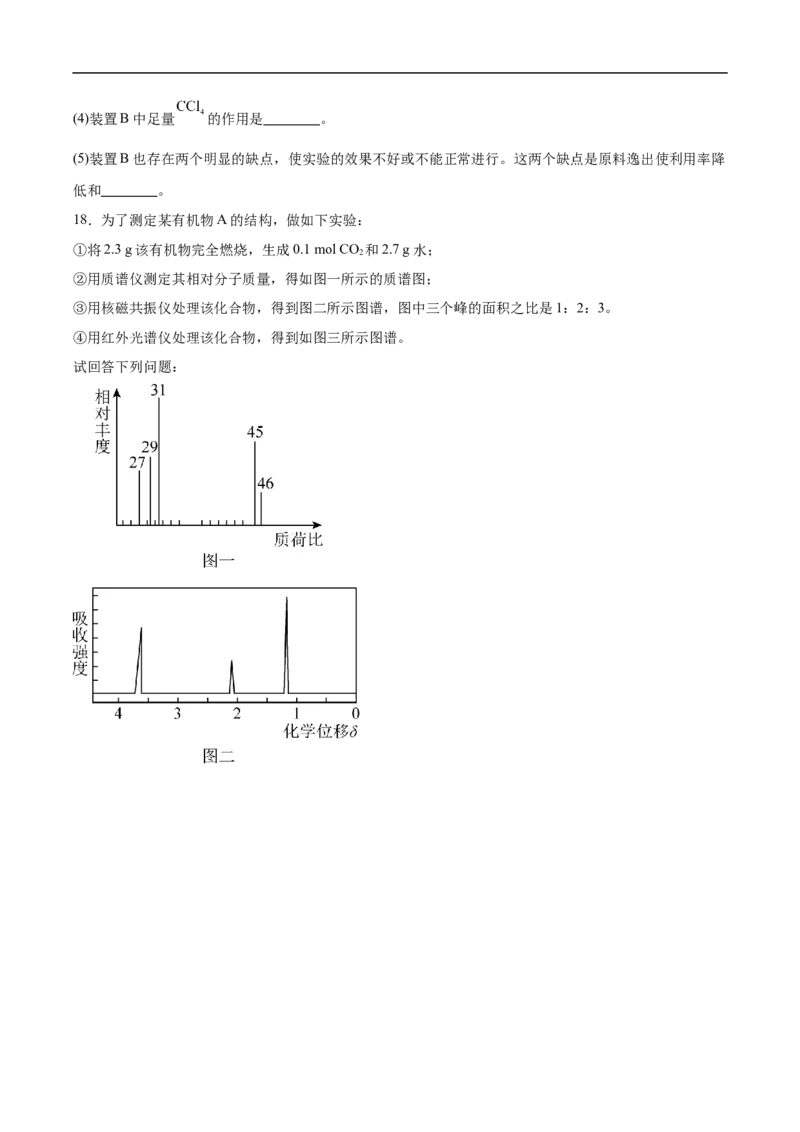
Ⅱ.该小组同学还设计了A、B、C三组实验装置用来制取溴苯。
(2)装置C中当把软橡胶袋中的铁粉加到混合液中后,观察到的现象有液体沸腾,烧瓶中 ,三个装
置中所共同发生的有机反应的化学方程式为 。
(3)实验结束后,小明取装置A中锥形瓶中的水溶液少许,加入 溶液得到浅黄色沉淀,证明苯与溴
发生了取代反应,该结论 (填“正确”或“错误”),原因是 。(4)装置B中足量 的作用是 。
(5)装置B也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是原料逸出使利用率降
低和 。
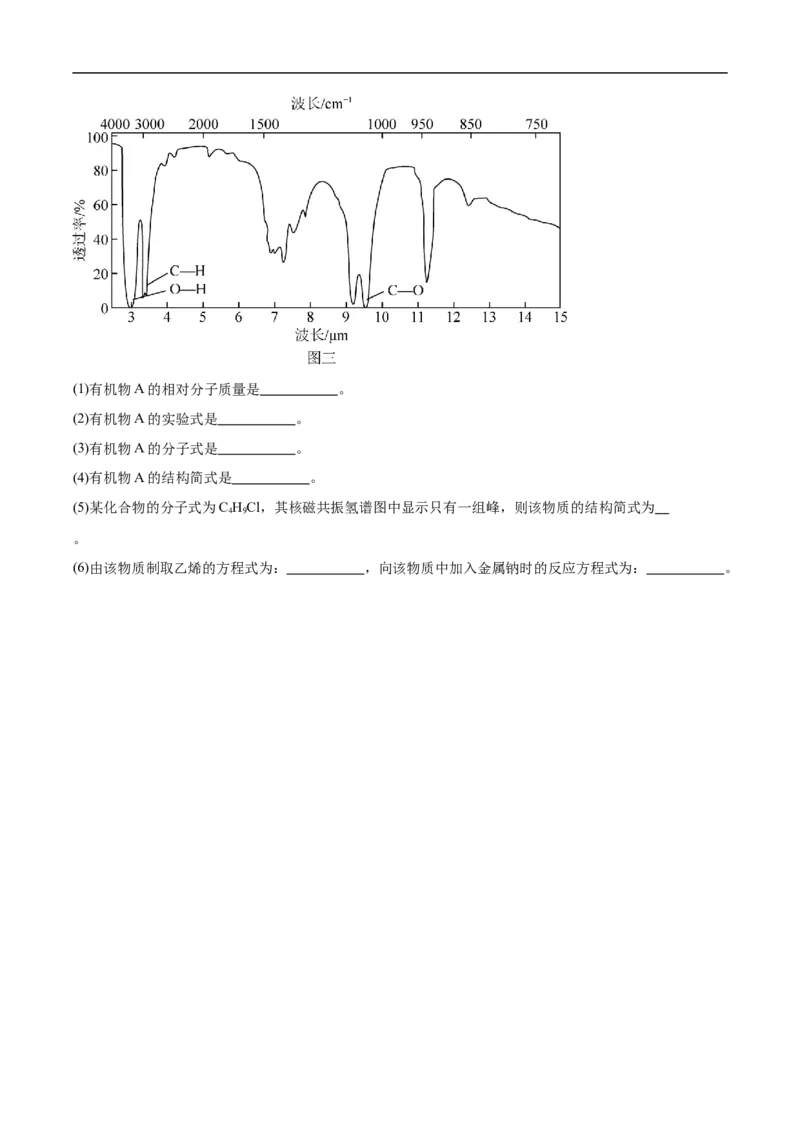
18.为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO 和2.7 g水;
2
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到图二所示图谱,图中三个峰的面积之比是1:2:3。
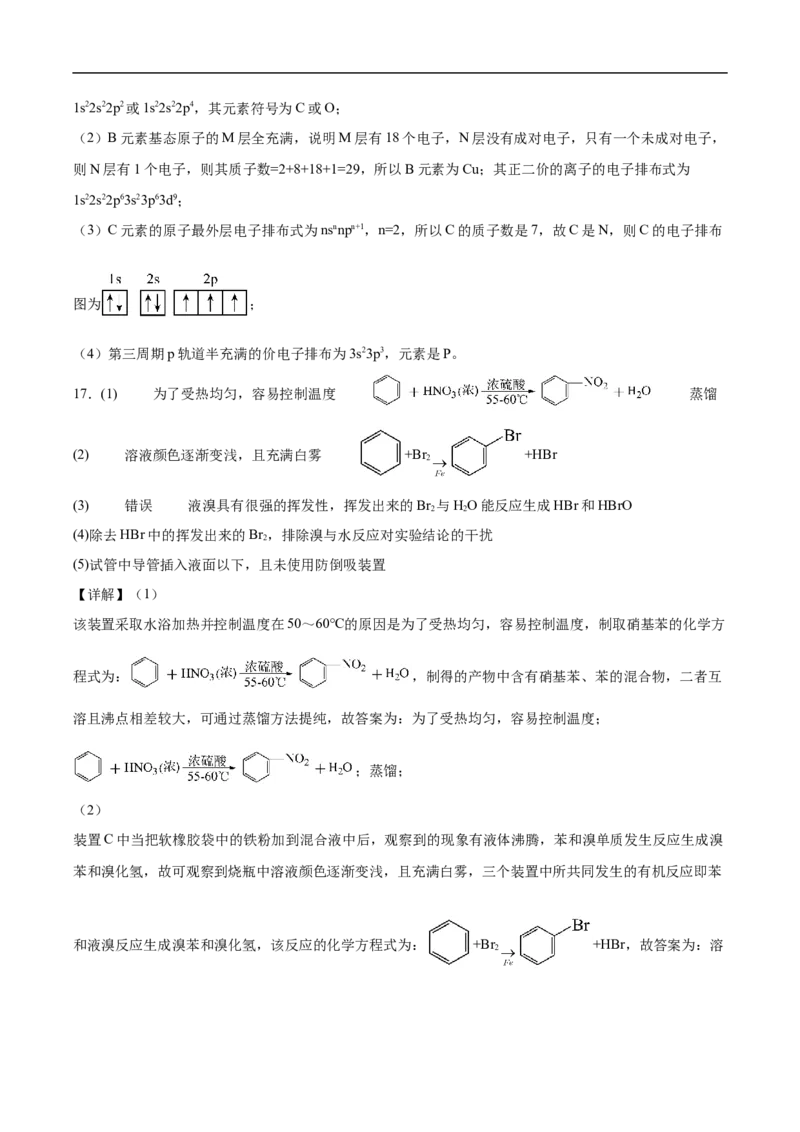
④用红外光谱仪处理该化合物,得到如图三所示图谱。
试回答下列问题:(1)有机物A的相对分子质量是 。
(2)有机物A的实验式是 。
(3)有机物A的分子式是 。
(4)有机物A的结构简式是 。
(5)某化合物的分子式为C HCl,其核磁共振氢谱图中显示只有一组峰,则该物质的结构简式为
4 9
。
(6)由该物质制取乙烯的方程式为: ,向该物质中加入金属钠时的反应方程式为: 。参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 A D C B B D C D B C
题号 11 12 13 14
答案 A A A D
15. 3 > 晶体中H、O、N三种元素之间形成网络化氢
键对Fe(Ⅱ)起保护作用 2 2
【详解】(1)基态Fe原子的价电子排布式为 ;晶格能大小决定离子晶体熔点高低,晶格能与离子所
带电荷数目成正比,与离子间距成反比,NiO晶体中离子间距小于FeO晶体中离子间距,故晶格能NiO大
于FeO。
(2)氨硼烷化合物分子中B、N分别与3个H原子以共价键连接,连接B、N原子的是由N原子单独提供
孤对电子的配位键,因此B、N原子周围形成4个共价键,可知中心原子B、N皆为 杂化;与之互为等
电子体的有机物的分子式为 。
(3)从组成结构上看, 晶体中存在电负性大的元素O和N,可以与H元素形成
多个氢键,把亚铁离子包围起来避免与氧化性物质接触,从而使得Fe(Ⅱ)可以稳定存在。
(4)六棱柱结构体现了六方晶系层与层之间原子堆积方式,其实每个六棱柱可分割为三个底面为菱形的
平行六面体晶胞,即每个晶胞含有2个Nd原子;每摩尔金属晶体含有 个晶胞,一个晶胞的体积即为
底面为菱形的四棱柱体积, ,可求得晶体密度为 。
16.(1)C或O
(2) Cu 1s22s22p63s23p63d9
(3)
(4)P
【详解】(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,则其核外电子排布式为1s22s22p2或1s22s22p4,其元素符号为C或O;
(2)B元素基态原子的M层全充满,说明M层有18个电子,N层没有成对电子,只有一个未成对电子,
则N层有1个电子,则其质子数=2+8+18+1=29,所以B元素为Cu;其正二价的离子的电子排布式为
1s22s22p63s23p63d9;
(3)C元素的原子最外层电子排布式为nsnnpn+1,n=2,所以C的质子数是7,故C是N,则C的电子排布
图为 ;
(4)第三周期p轨道半充满的价电子排布为3s23p3,元素是P。
17.(1) 为了受热均匀,容易控制温度 蒸馏
(2) 溶液颜色逐渐变浅,且充满白雾 +Br +HBr
2
(3) 错误 液溴具有很强的挥发性,挥发出来的Br 与HO能反应生成HBr和HBrO
2 2
(4)除去HBr中的挥发出来的Br ,排除溴与水反应对实验结论的干扰
2
(5)试管中导管插入液面以下,且未使用防倒吸装置
【详解】(1)
该装置采取水浴加热并控制温度在50~60℃的原因是为了受热均匀,容易控制温度,制取硝基苯的化学方
程式为: ,制得的产物中含有硝基苯、苯的混合物,二者互
溶且沸点相差较大,可通过蒸馏方法提纯,故答案为:为了受热均匀,容易控制温度;
;蒸馏;
(2)
装置C中当把软橡胶袋中的铁粉加到混合液中后,观察到的现象有液体沸腾,苯和溴单质发生反应生成溴
苯和溴化氢,故可观察到烧瓶中溶液颜色逐渐变浅,且充满白雾,三个装置中所共同发生的有机反应即苯
和液溴反应生成溴苯和溴化氢,该反应的化学方程式为: +Br +HBr,故答案为:溶
2液颜色逐渐变浅,且充满白雾; +Br +HBr;
2
(3)由于液溴具有很强的挥发性,挥发出来的Br 与HO能反应生成HBr和HBrO,故实验结束后,小明
2 2
取装置A中锥形瓶中的水溶液少许,加入AgNO 溶液得到浅黄色沉淀,证明苯与溴发生了取代反应,该结
3
论是错误的,故答案为:错误;液溴具有很强的挥发性,挥发出来的Br 与HO能反应生成HBr和
2 2
HBrO;
(4)由(3)分析可知,装置B中足量CCl 的作用是除去HBr中的挥发出来的Br ,排除溴与水反应对实验
4 2
结论的干扰,故答案为:除去HBr中的挥发出来的Br ,排除溴与水反应对实验结论的干扰;
2
(5)HBr极易溶于水,吸收HBr时需要防倒吸装置,故装置B也存在两个明显的缺点,使实验的效果不
好或不能正常进行,这两个缺点是原料逸出使利用率降低和试管中导管插入液面以下,且为使用防倒吸装
置,故答案为:试管中导管插入液面以下,且未使用防倒吸装置。
18. 46 C HO C HO CH CHOH CHCHOH
2 6 2 6 3 2 3 2
CH=CH ↑+H O 2CH CHOH+2Na→2CH CHONa+H ↑
2 2 2 3 2 3 2 2
【详解】(1)在A的质谱图中,最大质荷比为46,所以其相对分子质量也是46;
(2)2.3 g有机物完全燃烧产生0.1 mol CO、2.7 g H O, n(C)=n(CO)=0.1 mol,n(H)=2n(H O)=2×
2 2 2 2
=0.3 mol,则该有机物中含有O m(O)=2.3 g-1.2 g-0.3 g=0.8 g,n(O)= =0.05 mol,则n(C):n(H):
n(O)=0.1 mol:0.3 mol:0.05 mol=2:6:1,所以A的实验式是C HO;
2 6
(3)由M=(最简式式量)n,46=46n,解得n=1,所以该物质实验式就是分子式,其分子式是C HO;
2 6
(4)由核磁共振氢谱可知:该有机物分子中有3中化学环境不同的H原子,三种H原子数目之比为1:2:
3,故该有机物结构式为:CHCHOH;
3 2
(5)某化合物的分子式为C HCl,其核磁共振氢谱图中显示只有一组峰,说明该分子中只有一种位置的H原
4 9
子,则该物质的结构简式为 ;(6)乙醇与浓硫酸混合加热170℃,发生消去反应产生乙烯和水,则由该物质制取乙烯的方程式为:
CHCHOH CH=CH ↑+H O;
3 2 2 2 2
乙醇与Na反应产生乙醇钠和氢气,该反应的化学方程式为:2CHCHOH+2Na→2CH CHONa+H ↑。
3 2 3 2 2