文档内容
{#{QQABbQyAogAAQIBAAAgCEwGqCAIQkAGAAYgGABAAIAAASAFABCA=}#}{#{QQABbQyAogAAQIBAAAgCEwGqCAIQkAGAAYgGABAAIAAASAFABCA=}#}{#{QQABbQyAogAAQIBAAAgCEwGqCAIQkAGAAYgGABAAIAAASAFABCA=}#}{#{QQABbQyAogAAQIBAAAgCEwGqCAIQkAGAAYgGABAAIAAASAFABCA=}#}{#{QQABbQyAogAAQIBAAAgCEwGqCAIQkAGAAYgGABAAIAAASAFABCA=}#}{#{QQABbQyAogAAQIBAAAgCEwGqCAIQkAGAAYgGABAAIAAASAFABCA=}#}湖湘名校教育联合体 年下学期高二 月大联考化学
2024 10
参考答案、提示及评分细则
【答案】
1. B
【解析】 曾青得铁化为铜 即铁和硫酸铜反应生成硫酸亚铁和铜 铜 铁元素的化合价发生了变化 为氧化还原
A. , , 、 ,
反应 故 正确 青矾 绿矾 主要成分是 根据元素守恒可知 分解时 青矾厂气不可能是
, A ;B. ( ) FeSO4∙7H2O, , , CO
和 应该有 与水蒸气结合生成硫酸 硫酸具有腐蚀性 衣服当之易烂 故 错误 合金的硬度大 抗
CO2, SO3, , ,“ ”, B ;C. 、
腐蚀性强 则高铁车用大部分材料是铝合金 铝合金材料具有强度大 质量轻 抗腐蚀能力强等优点 故 正确
, , 、 、 , C ;
废井中的可燃性气体常常为天然气或沼气 主要成分为甲烷 即产生 井火 的气体主要成分为甲烷 故 正
D. , , “ ” , D
确 故选
; B.
【答案】
2. C
【解析】 根据元素守恒可知 的化学式为 故 正确 由化学方程式可知 中元素化合价降低 所以
A. ,X Ag2S, A ;B. ,O ,
银针验毒时 空气中氧气得到电子 故 正确 反应时 化合价升高 所以 是还原剂 元素化合价不变
, , B ;C. ,Ag , Ag ,S ,
不是还原剂 故 错误 根据 元素的化合价变化 每生成 转移电子的物质的量为 故
H2S , C ;D. Ag , 1molAg2S, 2mol,
正确
D .
【答案】
3. B
【解析】 钠与硫酸铜溶液反应 错误 向碳酸钠溶液
2+ +
A. :2Na+Cu +2H2OCu(OH)2↓+2Na +H2↑,A ;B.
中通入等物质的量的氯气 正确 溶液与足量
2- - -
:Cl2+CO3 +H2OCl +HCO3 +HClO,B ;C.NH4HSO4
溶液混合 错误 小苏打溶液与过量澄清石灰水混合
+ - +
NaOH :NH4 +2OH +H NH3H2O+H2O,C ;D. :
错误 故选
2+ - -
Ca +OH +HCO3 CaCO3↓+H2O,D ; B.
【答案】
4. C
【解析】 吸热反应和放热反应的判断跟条件无关 有些吸热反应需要加热 比如碳与水的反应 有些不需要加
A. , , ,
热 比如 与 的反应 放热反应也是如此 错误 若反应物的总能量低于生成物的总
, Ba(OH)2∙H2O NH4Cl , ,A ;B.
能量 该反应是吸热反应 错误 化学反应发生时有化学键的断裂和形成 就伴随着能量的变化 正确 浓
, ,B ;C. , ,C ;D.
硫酸使蔗糖变黑是因为浓硫酸具有脱水性 将蔗糖中的 和 元素脱出生成水 错误 故选
, H O ,D ; C.
【答案】
5. C
c +
【解析】 加入蒸馏水之后 氨水的电离平衡得到促进 c - 减小 电离常数不变 (NH4 )
A. , , (OH ) , ,c =
(NH3H2O)
K c +
b (NH4 ) 增大 错误 通入氨气之后 氨水的电离平衡正移 的电离程度减小
c (OH - ) ,c (NH3H2O) ,A ;B. , ,NH3H2O ,B
错误 加 入 固 体 氯 化 铵 之 后 铵 根 离 子 浓 度 增 大 氨 水 的 电 离 平 衡 逆 移 c 增 大
;C. , , , (NH3 H2O) ,
c + c -
(NH4 ) (OH ) K 温度不变 比值维持不变 正确 电离吸热 升高温度 的电离平衡得
c = b, , ,C ;D. , ,NH3H2O
(NH3H2O)
到促进c
-
增大 错误 故选
,(OH ) ,D ; C.
【答案】
6. B
【解析】 H 根据 H T S 反应在高温下可以自发进行 在低温下可能 H T S大于
A.Δ >0,ΔS>0, Δ - Δ <0, , Δ - Δ 0,
高二化学试题参考答案 第 页 共 页
【 1 ( 6 )】
{#{QQABbQyAogAAQIBAAAgCEwGqCAIQkAGAAYgGABAAIAAASAFABCA=}#}此时反应非自发 错误 都能与血红蛋白结合 在人体血液中的血红蛋白 建立平衡
,A ;B.CO、O2 , (Hb) :CO+HbO2
中毒时应将中毒患者转移至高压氧舱吸氧 提高氧气浓度促使平衡逆向进行 减缓中毒症
HbCO+O2,CO , ,
状 正确 吸热的熵增反应 在一定条件下也能自发进行 错误 根据反应的自发性可以预测该反应能否
,B ;C. , ,C ;D.
发生 但是不能判断反应发生的快慢 错误 故选
, ,D ; B.
【答案】
7. C
【解析】 后反应达到平衡时 的平均反应速率为 则 的物质的量为
5min ,D 0.1mol/(Lmin), D 0.1mol/(Lmin)×
由题意可建立如下三段式
5min×2L=1mol, :
3A(g)+ B(g) C(g)+ 2D(g)
起
(mol) 3 2.5 0 0
变
(mol) 1.5 0.5 0.5 1
平
(mol) 1.5 2 0.5 1
由反应速率之比等于化学计量数之比可知 的平均反应速率为 3 故
A. ,A 0.1mol/(Lmin)× =0.15mol/(Lmin),
2
错误 由三段式数据可知 的浓度为0.5mol 故 错误 由三段式数据可知 的转化率为
A ;B. ,C =0.25mol/L, B ;C. ,B
2L
0.5mol 故 正确 由平衡时 容器内压强之比等于气体物质的量之比可知 5mol 10 故
×100%=20%, C ;D. , : = , D
2.5mol 5.5mol 11
错误 故选
; C.
【答案】
8. A
K
【解析】根据盖斯定律可知 反应 反应 反应 有 H H H K 2 项正确
, ③= ②-3× ①, Δ 3=Δ 2-3Δ 1; 3=K3 ,A .
1
【答案】
9. C
【解析】该反应为熵变大的吸热反应 故有利于提高 平衡产率的条件是高温低压 故选
, CO2 ; C.
【答案】
10. B
【解析】分子式为 的同分异构体如图所示 只画出碳骨架 数字代表 原子的位置
C4H8F2 ( , F ): 、
共 种 故选
、 , 9 , B.
【答案】
11. C
【解析】设两份盐酸的体积均为x 加水后 增大 说明加入水的体积为 x 设另一份加入 的
L, pH 1, 9 L, 0.1mol/L
x y
溶液体积为y 反应后 也增大 则0.1mol/L× L-0.1mol/L× L 解得y 9x
NaOH L, pH 1, x y =0.01mol/L, = ,
(+ )L 11
则加入水和 的体积比为 x 9x 故答案选
NaOH 9 ∶ =11∶1, C.
11
【答案】
12. B
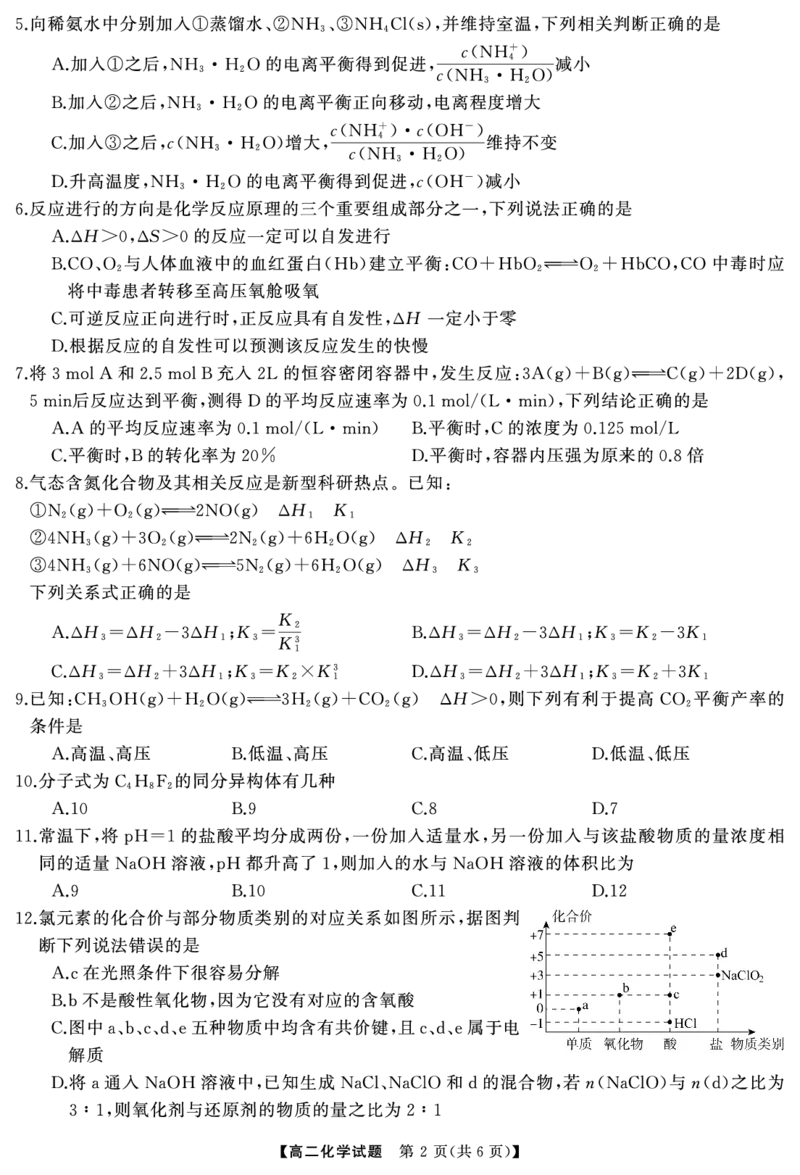
【解析】由图可知 为氯元素的单质 即 为 价的氯的氧化物 即 为 价的含氧酸 即
,a , Cl2,b +1 , Cl2O,c +1 , HClO,
为 价的含氧酸盐 如氯酸盐 为 价的含氧酸 即 据此分析作答即可 光照易分解
d +5 , ,e +7 , HClO4, ;A.HClO ,A
正确 为 对应的含氧酸为 错误 根据分析可知 五种物质中均含有共价键 且
;B.b Cl2O, HClO,B ;C. a、b、c、d、e ,
含氧酸盐和 属于电解质 正确 与 溶液反应生成 和 价的含氧酸
HClO、 HClO4 ,C ;D.Cl2 NaOH NaCl、NaClO +5
高二化学试题参考答案 第 页 共 页
【 2 ( 6 )】
{#{QQABbQyAogAAQIBAAAgCEwGqCAIQkAGAAYgGABAAIAAASAFABCA=}#}盐 若n 与n 之比为 化合价升高被氧化的 个数为 个 根据得失电子守恒可知 化合价降
, (NaClO) (d) 3∶1, Cl 4 , ,
低被还原的 个数为 个 即氧化剂与还原剂的物质的量之比为 正确 答案选
Cl 8 , 2∶1,D ; B.
【答案】
13. D
【解析】 由图可知 随温度升高 的平衡转化率增大 正反应吸热 H 项错误 反应的正反应为气
A. , CH4 , ,Δ >0,A ;B.
体分子数增大的反应 增大压强平衡向逆反应方向移动 的转化率减小 由图知在相同温度下p 时
, ,CH4 , 1 CH4
的平衡转化率大于p 时 的平衡转化率 则p p 项错误 由图知y点 的转化率小于平衡时
2 CH4 , 1< 2,B ;C. , CH4
CH4
的转化率
,
反应正向进行
,
v正
>
v逆,C 项错误
;D.
y点的温度与x点的温度相同
,
y点平衡常数与x点相
等 用三段式
,
CH4(g) + CO2(g) 2CO(g) + 2H2(g)
开始
(mol/L) 0.1 0.1 0 0
反应
(mol/L) 0.1×0.8=0.08 0.08 0.16 0.16
平衡
(mol/L) 0.02 0.02 0.16 0.16
K c2 (CO) c2 (H2) 0.16 2 ×0.16 2 项正确
=c c = =1.6384,D .
(CH4) (CO2) 0.02×0.02
【答案】
14. C
【分析】据图可看出 浓度随 增大的曲线应为c
-
浓度减小的曲线应为c 点时
, pH (CH3COO ), (CH3COOH),W
c c - 据此分析解答
(CH3COOH)= (CH3COO ); .
c - c +
【解析】 点c c - 平衡常数 K (CH3COO ) (H ) c +
A.W (CH3COOH)= (CH3COO ), = c = (H )=
(CH3COOH)
-4.8 -1 故 正确 由图可知 点所表示的溶液中c c -
10 molL , A ;B. ,W (CH3COOH)= (CH3COO )=
-1 溶液中电荷守恒c + + c - c - 所以c + c +
0.05molL , (Na )+c(H )= (CH3COO )+ (OH ), (H )+ (Na )=
c c - 故 正确 由图可知 的溶液中 c - c
(CH3COOH)+ (OH ), B ;C. ,pH=5.0 : (CH3COO )> (CH3COOH)
c + c - 故 错误 由电荷守恒c + c + c - c - 及c
> (H )> (OH ), C ;D. (Na )+ (H )= (CH3COO )+ (OH ) (CH3COOH)
c - -1 可知 c + c + c - c c
+ (CH3COO )=0.1molL , (Na )+ (H )- (OH )+ (CH3COOH)= (CH3COOH)+
c - -1 故 正确 故选
(CH3COO )=0.1molL , D ; C.
【答案】每空 分 共 分 少答且答对给 分 答错不给分
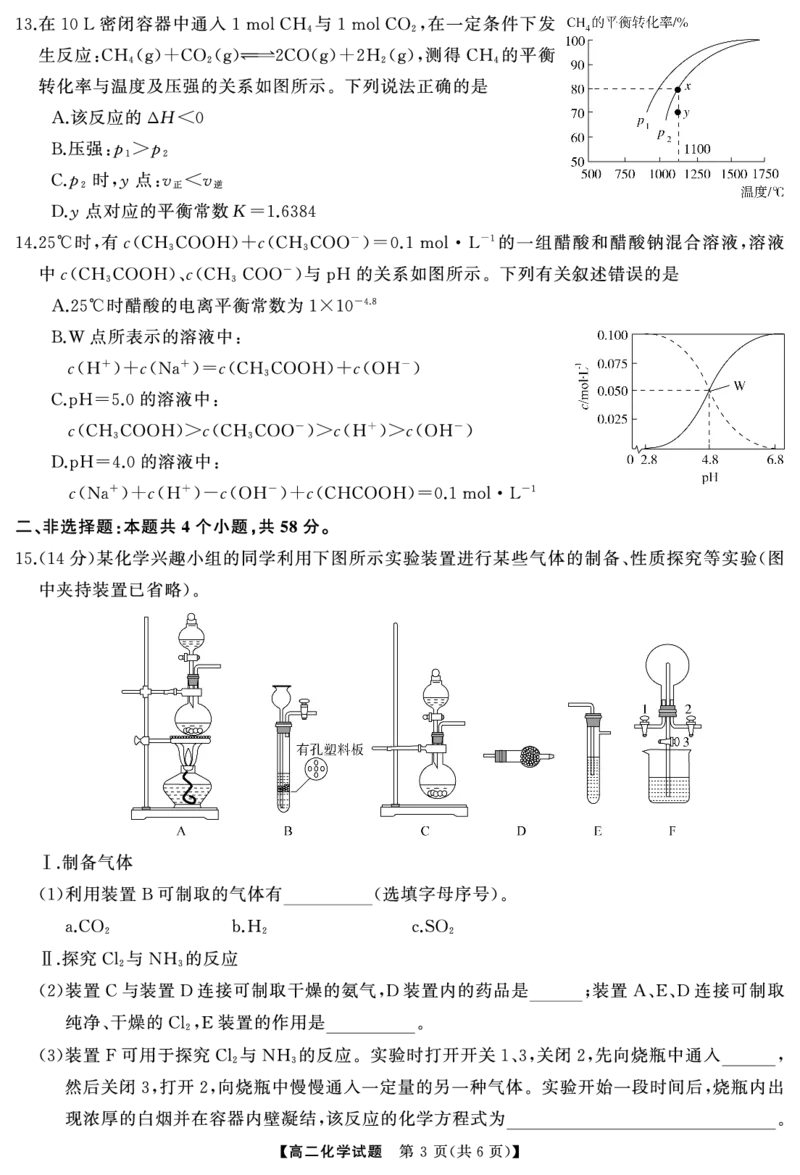
15. ( 2 , 14 )(1)a、b( 1 , )
碱石灰 生石灰或氢氧化钠固体 除去氯气中混有的 气体
(2) ( ) HCl
氯气
(3) (Cl2) 8NH3+3Cl2N2+6NH4Cl
向盛有饱和 或 溶液的烧瓶中滴加稀硫酸 将产生的气体通入盛有 溶液的装置
(4) NaHCO3( Na2CO3) , Na2SiO3
中 若装置 中有白色沉淀产生 则证明碳的非金属性比硅的强
E , E ,
(5)2H2S+SO23S↓+2H2O
【解析】 该装置是启普发生器的简易装置 适用于难溶于水的块状固体或大颗粒状固体与溶液反应不加热制
(1) ,
取溶解性较小的气体 故应选
, a、b;
干燥氨气可用碱石灰 生石灰或氢氧化钠固体 制取纯净 干燥的 要除去氯气中混有的杂质水和氯化
(2) ( ), 、 Cl2,
氢 装置的作用是除去氯气中混有的 气体
,E HCl ;
实验时打开开关 关闭 向烧瓶中通入氯气 然后关闭 打开 向烧瓶中缓慢通入一定量的氨气 实
(3) 1、3 2, , 1、3 2, ,
验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结 若先通氨气 由于开关 打开 水会倒吸进入烧瓶生
, , 3 ,
高二化学试题参考答案 第 页 共 页
【 3 ( 6 )】
{#{QQABbQyAogAAQIBAAAgCEwGqCAIQkAGAAYgGABAAIAAASAFABCA=}#}成的白烟为 根据得失电子守恒配平化学方程式
NH4Cl, :3Cl2+8NH3N2+6NH4Cl;
利用强酸制弱酸 证明酸性 从而证明非
(4) Na2SiO3+H2O+CO2Na2CO3+H2SiO3↓, H2CO3>H2SiO3,
金属性 具体的实验方案为 向盛有饱和 或 溶液的烧瓶中滴加稀硫酸 将产生的气体
:C>Si, : NaHCO3( Na2CO3) ,
通入盛有 溶液的装置 中 若装置 中有白色沉淀产生 则证明碳的非金属性比硅的强
Na2SiO3 E , E , ;
将装置 分别与 相连后 进行 与 反应的实验 是制备硫化氢气体的发生装置 是二氧化
(5) B、C F , H2S SO2 ,B ,C
硫气体制备的装置 通入 中二氧化硫氧化硫化氢生成硫单质
, F ,2H2S+SO23S↓+2H2O.
【答案】每空 分 共 分 b a -1
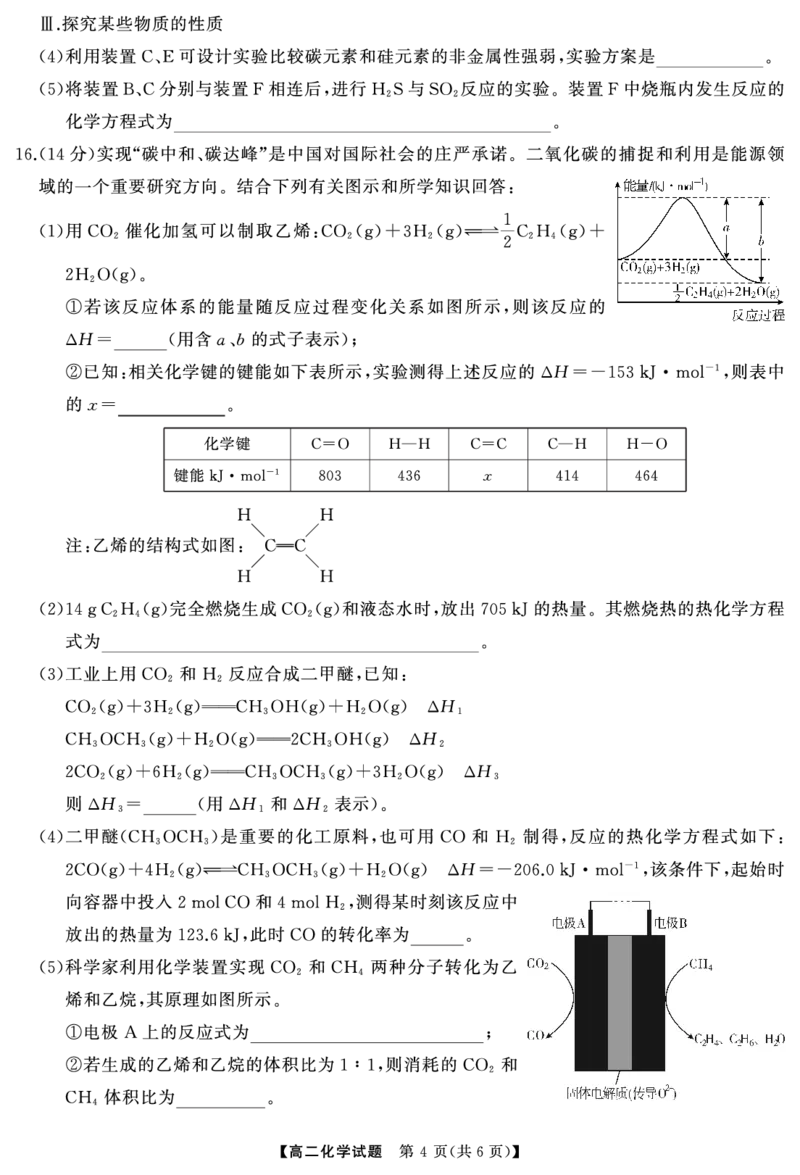
16. ( 2 , 14 )(1)-(- )kJmol 766
H -1
(2)C2H4(g)+3O2(g)2CO2(g)+2H2O(l) Δ =-1410kJmol
H H
(3)2Δ 1-Δ 2
(4)60%
- 2-
(5)CO2+2e CO+O 3∶4
【解析】 由图可知 反应物的总能量高于生成物的总能量 故反应放出热量 H b a -1
(1)① , , Δ =-(- )kJmol ;
根据 H 反应物的总键能 生成物的总键能进行计算 即 1 x
② Δ = - , 803×2+436×3- ( +4×414)-4×464=
2
-1
解得x
-153kJmol , =766;
燃烧的反应 根据题意可知 物质的量为
(2)C2H4 C2H4(g)+3O2(g)2CO2(g)+2H2O(l), 14gC2H4
放出 的热量 则 放出的热量为 燃烧热的热化学方程式为
0.5mol, 705kJ , 1molC2H4 705kJ×2=1410kJ,C2H4
H -1
C2H4(g)+3O2(g)2CO2(g)+2H2O(l) Δ =-1410kJmol ;
根据盖斯定律可知 H H H
(3) ,Δ 3=2Δ 1-Δ 2;
起始时向容器中投入 和 发生反应
(4) 2molCO 4molH2, 2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)
H -1 测得某时刻反应中放出的热量为 此时消耗 为 转化率为1.2mol
Δ =-206.0kJmol , 123.6kJ, CO 1.2mol,
2mol
×100%=60%.
如图所示 电极 为阴极 二氧化碳得电子生成 电极反应式为
- 2-
(5)① , A , CO, :CO2+2e CO+O ;
若生成的乙烯和乙烷均为 根据碳元素守恒 阳极消耗 转移电子的物质的量为
② 1mol, , 4molCH4, :(2×2+2×1)mol
根据阴极的电极式 阴极消耗 相同情况下物质的量之比等于体积比 故消耗的 和
=6mol, , 3molCO2, , CO2 CH4
体积比为
3∶4.
【答案】除特殊标注外 每空 分 共 分
17. ( , 2 , 15 )
高温
Ⅰ:①0.01mol/(Lmin) 100 ② <
增大压强 副反应 逆向移动 被抑制 甲醇脱水反应
Ⅱ:① , CH3OH(g)+H2O(g)CO2(g)+3H2(g) , ;
不受压强影响
2CH3OH(g)CH3OCH3(g)+H2O(g),
甲醇脱水反应 H -1 正向为放热反应 升高
② 2CH3OH(g)CH3OCH3(g)+H2O(g) Δ =-24.0kJmol , ,
温度平衡逆移 甲醚选择性降低 副反应 H -1 正
, ; CH3OH(g)+H2O(g)CO2(g)+3H2(g) Δ =+48.8kJmol ,
向为吸热反应 升高温度平衡正移 副产物增加 甲醚选择性降低
, , ,
分 错选多选 分 少选一个扣 分
Ⅲ:③⑤⑦(3 , 0 , 1 )
【解析】 设转化的甲烷为x 列三段式 则
Ⅰ: mol, ,
高二化学试题参考答案 第 页 共 页
【 4 ( 6 )】
{#{QQABbQyAogAAQIBAAAgCEwGqCAIQkAGAAYgGABAAIAAASAFABCA=}#}CH4(g) + CO2(g) 2CO(g) +2H2(g)
起始
(mol) 1 1 0 0
转移 x x x x
(mol) 2 2
平衡 x x x x
(mol) 1- 1- 2 2
已知平衡时体系压强为初始压强的6 恒温恒容时 体系压强之比等于气体物质的量之比 故列出方程
, , , :
5
x x x x
(1- )+(1- )+2 +2 6 解出x 平衡时体系压强p 终 6 p
= , =0.2, ( )=100kPa× =120kPa, (CH4)=
1+1 5 5
p p p 据此回答
(CO2)=40kPa,(CO)= (H2)=20kPa, .
2 2
v 0.2mol K (20kPa)×(20kPa) 2 中反应吸热熵
① (CH4)= =0.01mol/(Lmin);② p= =100(kPa);③I
1L×20min 40kPa×40kPa
增 高温自发
, ;
2 2 2 2
④
K
=
(0.4)×(0.4)
=0.04;
Q
=
(1.2)×(0.4)
=0.18,
Q
>
K
,
反应逆向进行
,
故v正
<
v逆;
0.8×0.8 1.6×0.8
Ⅲ:①
根据
NH2COONH4(s)2NH3(g)+CO2(g),
v正
(NH3)=2
v逆
(CO2)
说明正逆反应速率相等
,
为平衡状态
,
故 不符合题意 密闭容器中氨气的物质的量不变 说明正 逆反应速率相等 为平衡状态 故 不符合题意
① ;② , 、 , , ② ;
只要反应发生 容器中 与 的物质的量之比就是 保持不变 因此容器中 与 的物质的量
③ , CO2 NH3 2∶1, , NH3 CO2
之比保持不变 不能判断是平衡状态 故 符合题意 密闭容器中总压强保持不变 说明气体的总物质的量不
, , ③ ;④ ,
变 说明反应达平衡状态 故 不符合题意 只要反应发生 容器中 与 的物质的量之比就是
, , ④ ;⑤ , CO2 NH3 2∶1,
的体积分数始终为2 保持不变 因此 的体积分数保持不变 不能判断是平衡状态 故 符合题
CO2(g) , , CO2(g) , , ⑤
3
意 形成 的同时消耗 说明正 逆反应速率相等 是平衡状态 故 不符合题意 只要反
;⑥ 2molNH3 1molCO2, 、 , , ⑥ ;⑦
应发生 容器中 与 的物质的量之比就是 气体的平均相对分子质量就等于17×2+44 保持不变
, CO2 NH3 2∶1, , ,
3
因此气体的平均相对分子质量保持不变 不能判断是平衡状态 故 符合题意 混合气体的密度保持不变 说
, , ⑦ ;⑧ ,
明气体的质量保持不变 说明是平衡状态 故 不符合题意 故答案为
, , ⑧ ; :③⑤⑦.
【答案】除特殊标注外 每空 分 共 分 减小 分
18. ( , 2 , 15 )(1) (1 ) 7.6
- +
(2)4ClO3 +S+4H 4ClO2↑+SO2↑+2H2O
(3)9 0.01
溶液恰好由无色变浅红色 答 浅紫红 也给分
(4) ( “ ” ) 84.4 b
【解析】 当血液中 浓度上升 溶液中c
+
增大 温度不变 碳酸的电离平衡常数不变 血液缓冲体系中
(1) CO2 , (H ) , , ,
c - K
(HCO3) a 减小 故答案为减小 K c + c - c c +
c (H2CO3) =c (H + ) , ; a1(H2CO3)= (H )× (HCO3 )/ (H2CO3)=20 (H )=
-7c + -7 -8 则 c +
4.5×10 ,(H )=4.5×10 /20=9/4×10 , pH=-lg(H )=7.6;
根据所给反应方程式可知双氧水作还原剂 所以用 代替双氧水 作还原剂 题目已知氧化产物为 根
(2) , S ,S , SO2,
据电子守恒可知 和 的系数比为 结合元素守恒可得离子方程式为
- - +
ClO3 S 4∶1, 4ClO3 +S+4H 4ClO2↑
故答案为
- +
+SO2↑+2H2O, :4ClO3 +S+4H 4ClO2↑+SO2↑+2H2O;
x 的摩尔质量为 x 根据固体产物氧化铝的质量为 可知样品中
(3)①Al(NO3)3 H2O (213+18 )g/mol, 1.02g,
n 1.02g 则 7.50g 解得x 故答案为
(Al)= ×2=0.02mol, x =0.02mol, =9, 9;
102g/mol (213+18 )g/mol
高二化学试题参考答案 第 页 共 页
【 5 ( 6 )】
{#{QQABbQyAogAAQIBAAAgCEwGqCAIQkAGAAYgGABAAIAAASAFABCA=}#}气体产物中n 3.06g 由氢原子守恒 则n n
② (H2O)= =0.17mol, , (HNO3)=18 [Al(NO3)39H2O]-
18g/mol
n n n 根据氮
2 (H2O)=0.02×9×2-0.17×2=0.02mol,(N)=3 [Al(NO3)39H2O]=0.02mol×3=0.06mol,
元素守恒n 根据反应电子转移守恒 n 0.04(5-4)
,(NO2)=(0.06-0.02)mol=0.04mol, , (O2)= mol=0.01
4
故答案为
mol, 0.01mol.
采用 酸性 溶液滴定该草酸溶液 滴定终点时溶液会呈现高锰酸钾的颜色 因此当
-1
(4)① 0.100molL KMnO4 , ,
滴入最后半滴酸性高锰酸钾溶液 溶液恰好由无色变浅红色 答 浅紫红 也给分 且半分钟内不变化 说明反
, ( “ ” ), ,
应达到终点
;
三次滴定消耗酸性高锰酸钾的体积分别为 第二次数据偏差太大 舍去 平均
② 20.12mL、21.50mL、20.08mL, , ,
体积为 n -1 滴定过程中涉及的反应为 -
20.10mL,(KMnO4)=0.100molL ×0.0201L=0.00201mol, 2MnO4 +
+ 2+
则 粗草酸 晶 体 中n
5H2C2O4+6H 2Mn +10CO2 ↑ +8H2O, 7.500g (H2C2O4 2H2O)=
0.00201mol×5 250mL 粗草酸中含草酸晶体的质量分数为0.05025mol×126g/mol
× =0.05025mol, ×100%
2 25mL 7.500g
=84.4%;
锥形瓶水洗后未用待测草酸溶液润洗 对实验没有影响 所测结果无影响 故 不符合题意 滴加
③a. , , , a ;b. KMnO4
溶液时 少量液体挂在锥形瓶内壁 未用洗瓶冲下 导致滴入的 溶液体积偏大 结果偏高 故 符合题
, , , KMnO4 , , b
意 如果配制好的溶液未经充分振荡就直接取出上层溶液进行滴定 则液体上面的部分以蒸馏水为主 取出的
;c. , ,
上层溶液浓度偏低 滴定时消耗的高锰酸钾的量偏少 导致测定结果偏低 故 不符合题意 故选
, , , c ; b.
高二化学试题参考答案 第 页 共 页
【 6 ( 6 )】
{#{QQABbQyAogAAQIBAAAgCEwGqCAIQkAGAAYgGABAAIAAASAFABCA=}#}