文档内容
高二化学参考答案 A
命题人:安徽省岳西中学 吴玲燕 王灿红
一、选择题(每小题只有一个正确选项,每小题3分,14小题共42分)。
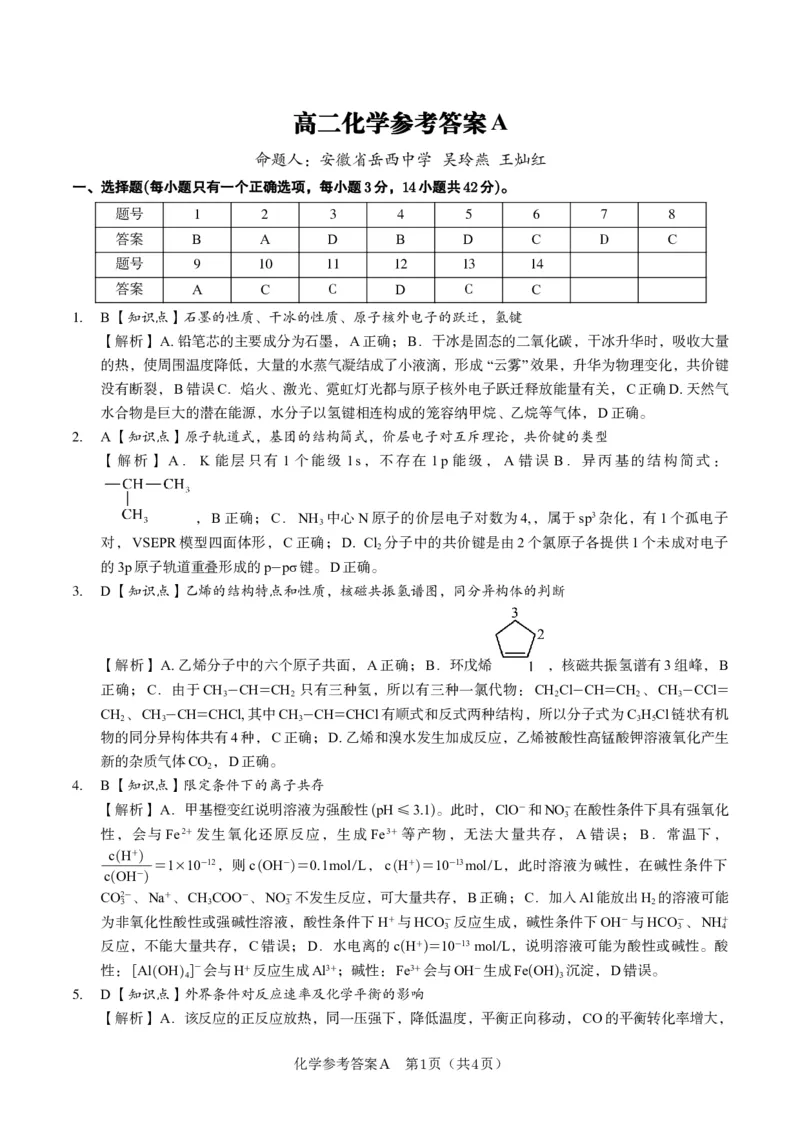
题号 1 2 3 4 5 6 7 8
答案 B A D B D C D C
题号 9 10 11 12 13 14
答案 A C C D C C
1. B【知识点】石墨的性质、干冰的性质、原子核外电子的跃迁,氢键
【解析】A.铅笔芯的主要成分为石墨,A正确;B.干冰是固态的二氧化碳,干冰升华时,吸收大量
的热,使周围温度降低,大量的水蒸气凝结成了小液滴,形成“云雾”效果,升华为物理变化,共价键
没有断裂,B错误C.焰火、激光、霓虹灯光都与原子核外电子跃迁释放能量有关,C正确D.天然气
水合物是巨大的潜在能源,水分子以氢键相连构成的笼容纳甲烷、乙烷等气体,D正确。
2. A【知识点】原子轨道式,基团的结构简式,价层电子对互斥理论,共价键的类型
【解析】 A. K 能层只有 1 个能级 1s,不存在 1p 能级, A 错误 B.异丙基的结构简式:
,B正确;C.NH 中心N原子的价层电子对数为4,,属于sp3杂化,有1个孤电子
3
对,VSEPR模型四面体形,C正确;D. Cl 分子中的共价键是由2个氯原子各提供1个未成对电子
2
的3p原子轨道重叠形成的p-pσ键。D正确。
3. D【知识点】乙烯的结构特点和性质,核磁共振氢谱图,同分异构体的判断
【解析】A.乙烯分子中的六个原子共面,A正确;B.环戊烯 ,核磁共振氢谱有3组峰,B
正确;C.由于CH -CH=CH 只有三种氢,所以有三种一氯代物:CH Cl-CH=CH 、CH -CCl=
3 2 2 2 3
CH 、CH -CH=CHCl,其中CH -CH=CHCl有顺式和反式两种结构,所以分子式为C H Cl链状有机
2 3 3 3 5
物的同分异构体共有4种,C正确;D.乙烯和溴水发生加成反应,乙烯被酸性高锰酸钾溶液氧化产生
新的杂质气体CO ,D正确。
2
4. B【知识点】限定条件下的离子共存
【解析】A.甲基橙变红说明溶液为强酸性(pH≤3.1)。此时,ClO-和NO-在酸性条件下具有强氧化
3
性,会与 Fe2+发生氧化还原反应,生成 Fe3+等产物,无法大量共存, A 错误; B.常温下,
cH+
cOH-
=1×10-12,则cOH- =0.1mol/L,cH+ =10-13mol/L,此时溶液为碱性,在碱性条件下
CO2-、Na+、CH COO-、NO-不发生反应,可大量共存,B正确;C.加入Al能放出H 的溶液可能
3 3 3 2
为非氧化性酸性或强碱性溶液,酸性条件下H+与HCO-反应生成,碱性条件下OH-与HCO-、NH+
3 3 4
反应,不能大量共存,C错误;D.水电离的c(H+)=10-13 mol/L,说明溶液可能为酸性或碱性。酸
性: AlOH 4 -会与H+反应生成Al3+;碱性:Fe3+会与OH-生成Fe(OH) 沉淀,D错误。 3
5. D【知识点】外界条件对反应速率及化学平衡的影响
【解析】A.该反应的正反应放热,同一压强下,降低温度,平衡正向移动,CO的平衡转化率增大,
化学参考答案A 第1页(共4页)所以T>T>T,同一压强下,升高温度,反应速率加快,所以正反应速率:v >v ,A正确;B.平
3 2 1 b a
衡常数只跟温度有关,因T>T,所以从d点到c点,同一压强下温度降低,平衡正向移动,平衡常数
2 1
增大,所以K c >K d ,B正确;C.由CO(g)+2H 2 (g)CH 3 OHg 可知,反应前后均为气体,遵循质
量守恒定律,所以混合气体总质量为定值,混合气体的总物质的量随时间改变,所以混合气体平均摩
尔质量不再随时间而改变时,能说明反应达到平衡,C正确;D.a点时,再向容器中通入一定量的
CO,CO的平衡转化率将减小,D错误。
6. C【知识点】共价键的类型,分子的极性,配位键,相似相溶原理等
【解析】A.CO 是含极性键的非极性分子,C H 是既含极性键又含非极性键的非极性分子,而NH
2 2 2 3
为含极性键的极性分子,A错误;B. CuNH 3 4 2+中N提供孤电子对,Cu2+提供空轨道,形成配位
键, CuH 2 O 4 2+中O提供孤电子对,Cu2+提供空轨道,形成配位键,由于N的孤电子对比O多,
N更易给出孤电子对与Cu2+形成配位键,所以稳定性: CuNH 3 4 2+> CuH 2 O 4 2+,B错误;C.
二硫化碳、硫均为非极性分子,用二硫化碳清洗附着硫的试管,其应用了“相似相溶”规律,C正确;
D. 分子中含有4个手性碳原子,D错误。
7. D【知识点】表示燃烧热的热化学方程式书写、水解的离子方程式书写、沉淀转化、电解池电极反应
式及化学方程式的书写.
【解析】A.甲烷的燃烧热为-890.3kJ/mol,表示1mol甲烷完全燃烧生成二氧化碳和液态水时放出的
热量为890.3kJ,则表示甲烷燃烧热的热化学方程式为:CH 4g +2O 2g CO 2g +2H 2 Ol ΔH
=-890.3kJ⋅mol-1,A错误;B.惰性电极电解氯化镁溶液时,阳极上氯离子失电子生成氯气,阴极
上水得电子生成氢气,同时生成氢氧化镁沉淀,则总反应式为:Mg2++2Cl-+2H
O电解Cl
↑+H ↑+
2 2 2
Mg(OH) ↓,B错误;C.泡沫灭火器灭火的原理:Al3++3HCO-Al(OH) ↓+3CO ↑,C错误;D.
2 3 3 2
用铁氰化钾K [Fe(CN) ]溶液检验Fe2+离子时,产生蓝色沉淀KFe[Fe(CN) ],所给离子方程式正确,
3 6 6
D正确;
8. C【知识点】电子转移计算、化学平衡常数的概念及表达方式、活化能对反应速率的影响等
【解析】A.2C H (g)+6NO(g)+3O (g)4CO (g)+4H O(g)+3N (g)A正确;B.平衡常数等于生
2 4 2 2 2 2
成物的浓度幂之积比上反应物的浓度幂之积,所以K= c4CO 2 c3N 2 c4H 2 O
c2C 2 H 4 c6(NO)c3O 2
,B正确;C.催化剂
降低反应活化能,但不改变焓变,反应过程中,Cu+为催化剂,C错误;D.由反应Ⅲ可知,1mol
Cu+(NO )转化为0.5molN ,转移4mol电子,转移电子数目为4×6.02×1023,D正确。
2 2
9. A【知识点】官能团的名称和性质,同分异构体的判断
【解析】A.该结构中存在碳碳双键、醇羟基结构,都能被高锰酸钾氧化,使高锰酸钾褪色, A正确;
B.醇羟基不与NaOH溶液反应,故B错误;C.鹰爪甲素的分子式为C H O ,故C错误;D.由鹰
15 26 4
爪甲素的结构简式可知,其分子中有过氧键,过氧键热稳定性差,所以不能在120℃条件下干燥样品,
故D错误;
10. C【知识点】中和热的测定、酸碱中和滴定实验相关仪器、盐类水解的应用、沉淀转化
【解析】A.测定中和反应反应热时需用玻璃搅拌器,A错误;B.用盐酸滴定NaOH溶液时眼睛需
紧盯锥形瓶中颜色变化,B错误;C.氯化镁会水解,则在氯化氢的气流中加热可以抑制氯化镁的水
化学参考答案A 第2页(共4页)解从而得到无水氯化镁固体,C正确;D.第一支试管中氢氧化钠剩余,加入氯化铁与氢氧化钠的应
生成沉淀,不能说明沉淀间的相互转化,D错误。
11. C【知识点】原电池正负极判断、原电池电极反应式书写
【解析】A.Pt1是负极、Pt2是正极,正极电势高,故Pt1电极电势低于Pt2电极,A错误;B.SO 中
2
心原子采用sp2杂化,B错误;C.Pt1是负极。电极反应为SO -2e-+2H O4H++SO2-,C正确;
2 2 4
D.总反应方程式为2SO +O +2H O2H SO ,相同条件下,放电过程中消耗的SO 和O 的体积比
2 2 2 2 4 2 2
为2∶1,D错误;
12. D【解析】A.NaF是强碱弱酸盐,F-会有一部分水解,F-+H 2 OHF+OH-,导致cF- <
cNa+ , A 错误; B.加入的 NaF 溶液让镁离子沉淀完全,并且二者恰好完全反应,则
cMg2+ =10-5mol/L,所以cF- = K spMgF 2 5.2×10-11 = = 5.2×10-3mol/L,若加入的NaF溶液
Mg2+ 10-5
过量,F-会有剩余,其浓度会大于 5.2×10-3mol/L,B错误;C.“沉锰”后的滤液中含有Na SO 、
2 4
少量H 2 CO 3 ,存在的电荷守恒关系为:cNa+ +cH+ =cHCO- 3 +cOH- +2cCO2 3 - +2cSO2 4 - +
cF- ,C错误;D. “沉锰”步骤中加入NaHCO 溶液,发生非氧化还原反应,生成碳酸锰、二氧化 3
碳和水,D正确.
13. C【知识点】晶体结构的相关计算
【解析】A.由晶胞结构可知,与Se2-等距且紧邻的Se2-有12个,A正确;B.b点离子的分数坐标
1 1
为(0.25,0.75,0.75),B正确;C.晶胞中含Se2-的个数为8× +6× =4,含Zn2+的个数为4,晶
8 2
胞中含有 4 个 ZnSe,则晶胞中 b 点和 d 点的距离为晶胞面对角线长度的一半,为
2 3 576
×1010pm,C错误;D.由晶胞结构可知Zn2+位于Se2-构成的四面体空隙中,D正确;
2 N ρ
A
14. C【知识点】电离平衡常数及影响因素、盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理、酸
碱中和滴定指示剂的选择
【解析】A.25℃时,pH=4.76,cHA =cA-
cH+
, K = a
⋅cA-
cHA
=cH+ =10-4.76,所以K (HA) a
数量级为10-5,A正确;B.由分析可知,曲线①表示-lgcHA 与溶液pH的关系,B正确;C.a
点对应的溶液中,溶质为等物质的量的NaA和HA的混合溶液,所以溶液中存在两个守恒:物料守恒
cHA +cA- =2cNa+ ,电荷守恒 cNa+ +cH+ =cA- +cOH- ,从而得出: 2cH+ +
cHA =2cOH- +cA- ,C不正确;D.滴定终点溶液显碱性,可选用酚酞溶液作指示剂,D正确。
二、填空题(包括4大题,共58分)
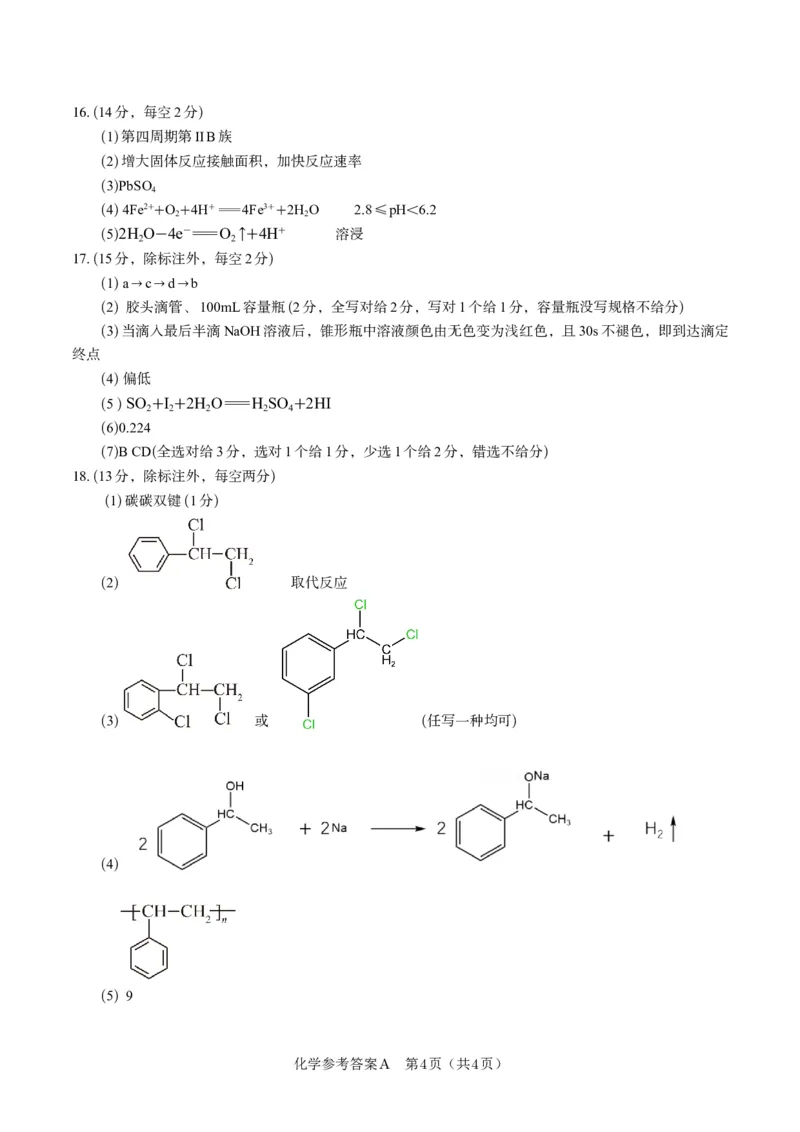
15..(16分,每空2分)
(1) 3d54s1
(2) N>O>C CH