文档内容
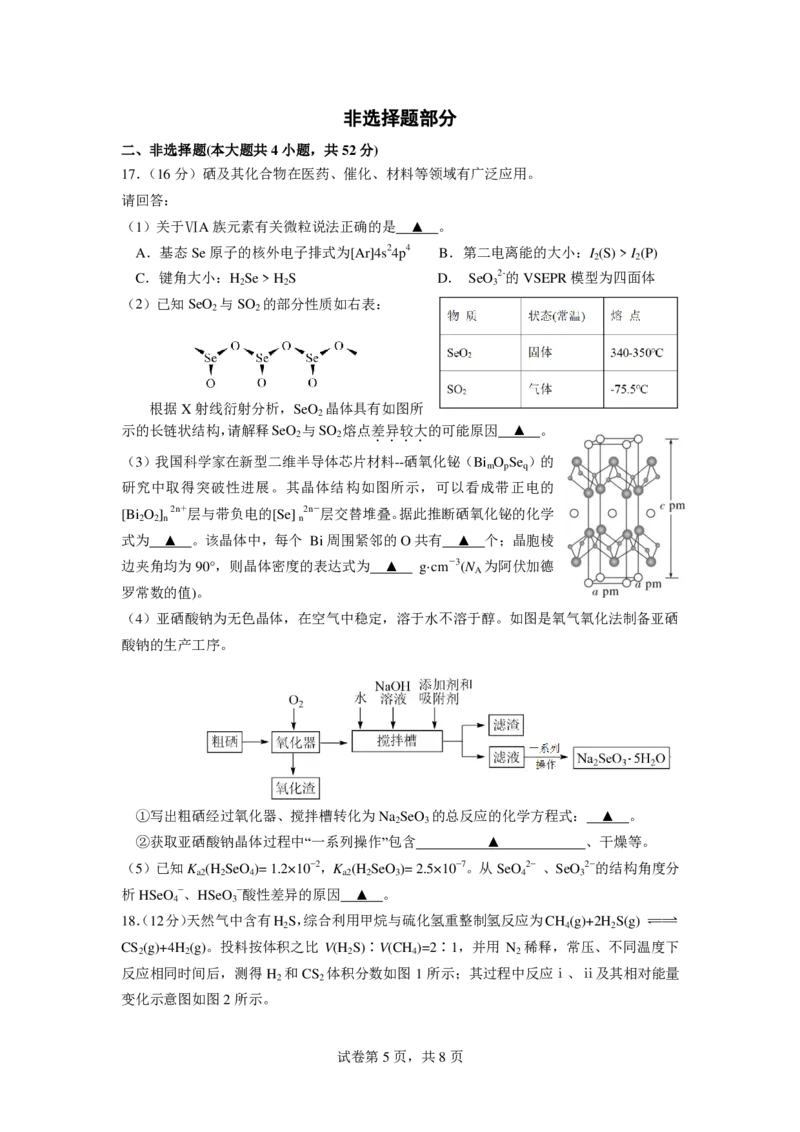
c(OH−) > c(CO 2−) 3 3 3 C.过量CaCO 与水充分混合后的上层清液中 含碳微粒主要以HCO −形式存在 3 , 3 D.过量的CaCO 投入0.1mol/L NaHCO 溶液中,最终溶液中c(Ca2+)>3.4×10−8 mol/L 3 3 16.以铝土矿(主要成分Al O )、CaF 为原料可实现如下转化。已知:AlCl 极易水解,电解 2 3 2 3 NaCl-KCl-AlCl 熔体制铝比电解Al O -Na AlF 熔体制铝节省电能约30%。下列说法不正确 3 2 3 3 6 ... 的是 A.铝土矿可通过碱溶、过滤、酸化和分解等步骤得到Al O 2 3 B.X可以用浓H SO ,不能用浓HNO 2 4 3 C.Na AlF 作助熔剂和提高体系的导电能力 3 6 D.工业上不采用电解NaCl-KCl-AlCl 熔体制铝主要原因是产生有毒气体Cl 3 2 试卷第4页,共8页非选择题部分 二、非选择题(本大题共4小题,共52分) 17.(16分)硒及其化合物在医药、催化、材料等领域有广泛应用。 请回答: (1)关于ⅥA族元素有关微粒说法正确的是 ▲ 。 A.基态Se原子的核外电子排式为[Ar]4s24p4 B.第二电离能的大小:I (S) > I (P) 2 2 C.键角大小:H Se > H S D. SeO 2-的VSEPR模型为四面体 2 2 3 (2)已知SeO 与SO 的部分性质如右表: 2 2 根据X射线衍射分析,SeO 晶体具有如图所 2 示的长链状结构,请解释SeO 与SO 熔点差异较大的可能原因 ▲ 。 2 2 .... (3)我国科学家在新型二维半导体芯片材料--硒氧化铋(Bi O Se )的 m p q 研究中取得突破性进展。其晶体结构如图所示,可以看成带正电的 [Bi O ] 2n+层与带负电的[Se] 2n-层交替堆叠。据此推断硒氧化铋的化学 2 2 n n 式为 ▲ 。该晶体中,每个 Bi周围紧邻的O共有 ▲ 个;晶胞棱 边夹角均为90°,则晶体密度的表达式为 ▲ g·cm-3(N 为阿伏加德 A 罗常数的值)。 (4)亚硒酸钠为无色晶体,在空气中稳定,溶于水不溶于醇。如图是氧气氧化法制备亚硒 酸钠的生产工序。 ①写出粗硒经过氧化器、搅拌槽转化为Na SeO 的总反应的化学方程式: ▲ 。 2 3 ②获取亚硒酸钠晶体过程中“一系列操作”包含 ▲ 、干燥等。 (5)已知K (H SeO )= 1.2×10−2,K (H SeO )= 2.5×10−7。从SeO 2− 、SeO 2−的结构角度分 a2 2 4 a2 2 3 4 3 析HSeO −、HSeO −酸性差异的原因 ▲ 。 4 3 18.(12分)天然气中含有H S,综合利用甲烷与硫化氢重整制氢反应为CH (g)+2H S(g) 2 4 2 CS (g)+4H (g)。投料按体积之比 V(H S)∶V(CH )=2∶1,并用 N 稀释,常压、不同温度下 2 2 2 4 2 反应相同时间后,测得 H 和 CS 体积分数如图 1 所示;其过程中反应ⅰ、ⅱ及其相对能量 2 2 变化示意图如图2所示。 试卷第5页,共8页请回答: (1)反应CH (g)+2H S(g) CS (g)+4H (g)的ΔH= ▲ kJ•mol-1。 4 2 2 2 (2)研究发现,在800~1000℃温度区间内,随温度升高,H S在反应混合物中体积分数 2 不断下降,而CS 的含量几乎为0,其原因可能是 ▲ 。 2 (3)下列说法正确的是 ▲ 。 A.其他条件不变时,温度越高,H S的转化率越大 2 B.恒温恒压下,增加N 的体积分数,H 的浓度变大 2 2 C.1 000 ℃、常压下,保持通入的H S体积分数不变,提高投料比V(H S)∶V(CH ) ,反 2 2 4 应相同时间,H S的转化率减小 2 D.高于1 000 ℃,随温度升高, 反应ⅱ消耗S (g)的速率大于反应ⅰ生成S (g)的速率,S (g) 2 2 2 的体积分数减小 (4)假设反应过程中还可能伴随甲烷的分解,CH (g) C (s)+2H (g) ΔH=+90kJ•mol-1。 4 2 在恒温刚性容器中通入0.3mol CH 和0.15 molH S发生一系列反应,CH 和H S的转化率与 4 2 4 2 时间关系如下图3。则5min时,生成n(H )= ▲ mol。 2 (5)反应的自由能变化量:ΔG=ΔH-TΔS,ΔG<0 时反应自发。反应 CS (g) ⇌C (s)+ S (g) 2 2 的 ΔG随温度变化如图4所示,则该反应的 ΔS ▲ 0(填“>”、“<”或“=”)。 (6)光电催化法可用于脱除H S的原理如图所示。写出该光电催化法过程中脱除H S的离 2 2 子方程式为 ▲ 。 试卷第6页,共8页19.(12分)四氯化钛是生产海绵钛的重要中间原料,某小组同学利用如下装置在实验室制 备TiCl (夹持装置略去)。 4 已知:①CO与PdCl 溶液反应产生黑色金属钯; 2 ②有关物质的性质: 熔点/℃ 沸点/℃ 密度/(g/cm3) 水溶性 TiCl -24 136.4 1.7 能溶于有机溶剂 4 CCl -23 76.8 1.6 难溶于水 4 请问题: (1)仪器a的名称为 ▲ 。 (2)组装好仪器后,部分实验步骤如下:①装入药品;②打开分液漏斗活塞;③检查装置 气密性;④关闭分液漏斗活塞;⑤停止加热,充分冷却;⑥加热装置D中陶瓷管。从上 述步骤中选择合适操作(不重复使用)并排序:③① ▲ → ▲ → ▲ → ▲ (填 序号)。 高温 (3)装置D中发生两个反应,其中副反应为C+2Cl CCl ,主反应中氧化剂与还原剂的 2 4 物质的量相等且只有两种产物,写出主反应化学方程式 ▲ 。 (4)进一步提纯E中产物的方法是 ▲ 。 (5)测定TiCl 的含量:取1.000g产品于烧瓶中,通过安全漏斗加入足量蒸馏水, 4 充分反应后将安全漏斗及烧瓶中的液体转移到容量瓶中配成100mL溶液。 取20.00mL于锥形瓶中,滴加2-3滴K CrO 溶液为指示剂,用0.1000mol•L-1 2 4 的AgNO 标准溶液滴定至终点,消耗溶液40.00mL。 3 ①该产品的纯度为 ▲ %。 ②下列实验操作会导致产品纯度测定结果偏低的有 ▲ 。 A.未用标准液润洗滴定管 B.未将安全漏斗中的液体转移到容量瓶中 C.滴定终点时仰视读数 D.滴加过多的K CrO 溶液 2 4 E.用滴定管量取20.00mL溶液时,先俯视、后仰视读数 试卷第7页,共8页20.(12分)多环氨基甲酰基吡啶酮类似物F,可以作为药物原料或中间体合成新型抗流感 病毒药物,其合成路线如下。 已知: I. (易被氧化) Ⅱ. Ⅲ.ROHRClROR 请回答: (1)化合物A中官能团的名称为 ▲ 。 (2)化合物E的结构简式是 ▲ 。 (3)下列说法正确的是 ▲ 。 A.反应③是还原反应 B.化合物B分子内可形成氢键 C.化合物C与浓硫酸混合共热可生成乙醛 D.F的分子式是C H N O 11 10 2 2 (4)写出D+B→F的化学方程式 ▲ 。 (5)写出3种同时符合下列条件的化合物B的同分异构体。 ①1H-NMR谱和IR谱检测表明:分子中共有5种不同化学环境的氢原子,有N—O键。 ②分子中只含有两个六元环,其中一个为苯环。 (6)设计以HC≡CH为原料合成 的路线 ▲ (用流程图表示,无机 试剂任选)。 试卷第8页,共8页