文档内容
绵阳南山中学 2024 年秋季高二 9 月月考
化学试题
命题人:仲竟之 审题人:刘伟
本试卷分为试题卷和答题卡两部分,其中试题卷由第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)组成,共6页:
答题卡共2页。满分100分,考试时间75分钟。
注意事项:
1.答题前,考生务必将自己的学校、班级、姓名用0.5毫米黑色墨水签字笔填写清楚,同时用
2B 铅笔将考号准确填涂在“考号”栏目内。
2.选择题使用2B 铅笔填涂在答题卡对应题目标号的位置上,如需改动,用橡皮擦擦干净后再
选涂其它答案:非选择题用0.5毫米黑色墨水签字笔书写在答题卡的对应框内,超出答题区域
书写的答案无效;在草稿纸、试题卷上答题无效。
3.考试结束后将答题卡收回。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Ni 59 Cu 64 Zn 65 Ag 108
第Ⅰ卷(选择题,共 42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项最符合题意)
1.2024年巴黎奥运会精彩纷呈,让人目不暇接,在运动员追求“更高,更快,更强”的背后,化学也在扮
演着重要的角色。下列关于巴黎奥运会中蕴含的化学知识说法错误的是( )
A.让跑鞋更加轻盈的聚氨酯材料具有高弹性、耐磨性,是一种力学性能优异的有机高分子材料
B.网球拍主要材料是碳纤维,与石墨烯、碳纳米管、高纯硅同属于新型无机非金属材料
C.镶嵌着埃菲尔铁塔的原铁的巴黎奥运会奖牌属于合金材料,金属铁可以采用热还原法制备
D.火炬燃料丙烷的分子式为C H ,能与氯气发生取代反应,产生的一氯代物只有一种
3 8
2.下列化学用语正确的是( )
A.乙烯的空间填充模型: B.过氧化钠的电子式:Na
:O :O :
2− Na+
C.14C与14N互为同位素 D.一氯甲烷的电子式:
3.以下最符合绿色化学原子经济性要求的是( )
A.苯乙烯聚合生成聚苯乙烯高分子材料 B.用SiO 制备高纯硅
2
C.以铜与稀硝酸为原料制备硝酸铜 D.甲烷与氯气反应制备一氯甲烷
4.N 为阿伏加德罗常数的值。下列说法正确的是( )
A
A.2.2gT O中含有的中子数为N
2 A
B.1molN 与3molH 反应生成的NH 分子数为2N
2 2 3 A
学科网(北京)股份有限公司C.0.1mol/L的NH Cl溶液中的Cl−数目约为0.1N
4 A
D.1.4g的C H 和C H 的混合气体中含有极性共价键数目为0.2N
2 4 3 6 A
5.宏观辨识与微观探析是化学学科核心素养之一,下列物质性质对应的方程式书写错误的是( )
A.酸性KMnO 溶液中加入H O :2MnO− +5H O +6H+ =2Mn2+ +5O ↑+8H O
4 2 2 4 2 2 2 2
B.焦炭制备粗硅:SiO +C=Si+CO ↑
2 2
C.用食醋清洗水垢(( CaCO ))的原理:2CH COOH− +CaCO =CO ↑+Ca2+ +2CH COO− +H O
3 3 3 2 3 2
D.实验室若用磨砂玻璃塞盖在了盛放NaOH溶液的试剂瓶上:SiO +2OH− =SiO2− +H O
2 3 2
6.已知 X、Y、Z、v、R 五种元素为短周期主族元素且原子序数递增,其中 X 是原子序数最小的元素:Y
元素是化合物种类最多的元素:Z元素和W元素同主族:W元素原子K层和M层电子总数等于其L层电
子数。下列说法正确的是( )
A.Z元素和W元素的最高正化合价相同 B简单离子半径:R>W
C.YX 和YR 的球棍模型完全相同 D.W单质易溶于YW
4 4 2
7.在一定温度下的容积不变的封闭容器中发生反应:C H ( g ) C H ( g )+H ( g ) ∆H >0。当达到
2 6 2 4 2
平衡时,下列各项措施中,不能提高乙烷转化率的是( )
A.分离出部分氢气 B.升高反应的温度
C.等容下通入稀有气体 D.增大容器的容积
8.选用下图所示仪器中的两个或几个(内含物质)组装成实验装置,以验证木炭可被浓硫酸氧化成CO ,
2
下列说法中正确的是( )
A.按气流从左向右流向,连接装置的正确顺序是A→F→E→D→C→B
B.丙、丁中溶液都褪色,乙中溶液变浑浊说明甲中生成CO
2
C.丙中溶液颜色变浅,丁中溶液不褪色,乙中溶液变浑浊说明甲中生成CO
2
D.丁中溶液颜色变浅,丙中溶液不褪色,乙中溶液变浑浊说明甲中生成CO
2
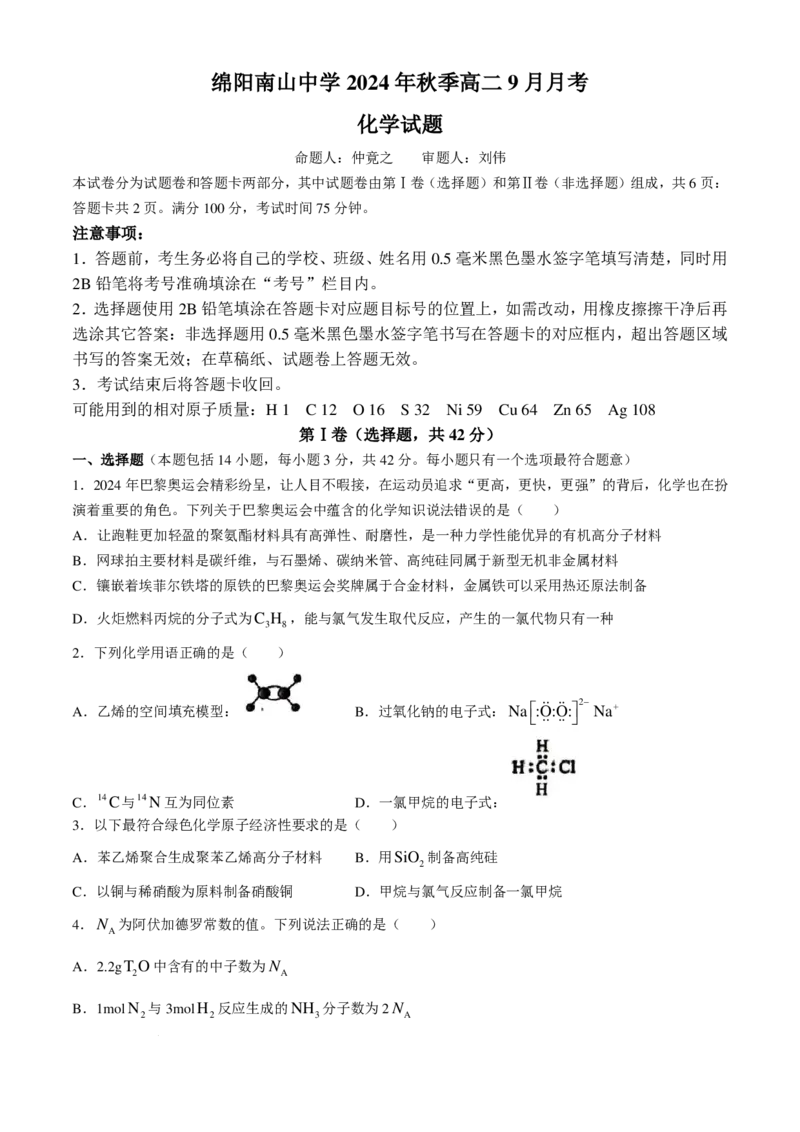
9.如图所示,该装置为Zn-Ag硝酸银溶液原电池,起始时,该电池中两电极的总质量为60g,工作一段时
间后,取出锌片和银片洗净干燥后称重,总质量为75.1g,下列说法错误的是:( )
学科网(北京)股份有限公司A.锌片为负极,电极方程式为Zn−2e− =Zn2+
B.Ag向银电极移动,NO−向锌电极移动
3
C.工作一段时间后,有0.14mol的电子从负极沿导线向正极移动
D.电流方向:Ag→电流表→Zn→硝酸银溶液→Ag
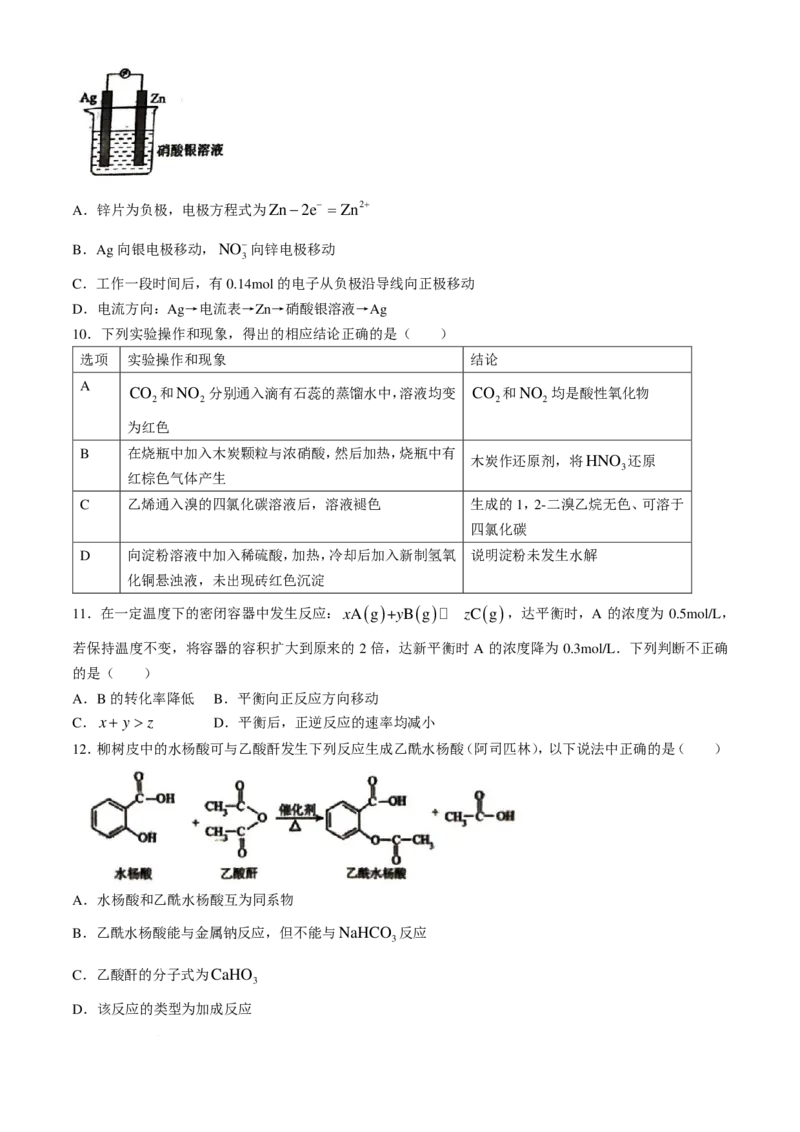
10.下列实验操作和现象,得出的相应结论正确的是( )
选项 实验操作和现象 结论
A
CO 和NO 分别通入滴有石蕊的蒸馏水中,溶液均变 CO 和NO 均是酸性氧化物
2 2 2 2
为红色
B 在烧瓶中加入木炭颗粒与浓硝酸,然后加热,烧瓶中有
木炭作还原剂,将HNO 还原
3
红棕色气体产生
C 乙烯通入溴的四氯化碳溶液后,溶液褪色 生成的1,2-二溴乙烷无色、可溶于
四氯化碳
D 向淀粉溶液中加入稀硫酸,加热,冷却后加入新制氢氧 说明淀粉未发生水解
化铜悬浊液,未出现砖红色沉淀
11.在一定温度下的密闭容器中发生反应:xA ( g ) +yB ( g ) zC ( g ),达平衡时,A 的浓度为 0.5mol/L,
若保持温度不变,将容器的容积扩大到原来的 2 倍,达新平衡时 A 的浓度降为 0.3mol/L.下列判断不正确
的是( )
A.B的转化率降低 B.平衡向正反应方向移动
C.x+ y > z D.平衡后,正逆反应的速率均减小
12.柳树皮中的水杨酸可与乙酸酐发生下列反应生成乙酰水杨酸(阿司匹林),以下说法中正确的是( )
A.水杨酸和乙酰水杨酸互为同系物
B.乙酰水杨酸能与金属钠反应,但不能与NaHCO 反应
3
C.乙酸酐的分子式为CaHO
3
D.该反应的类型为加成反应
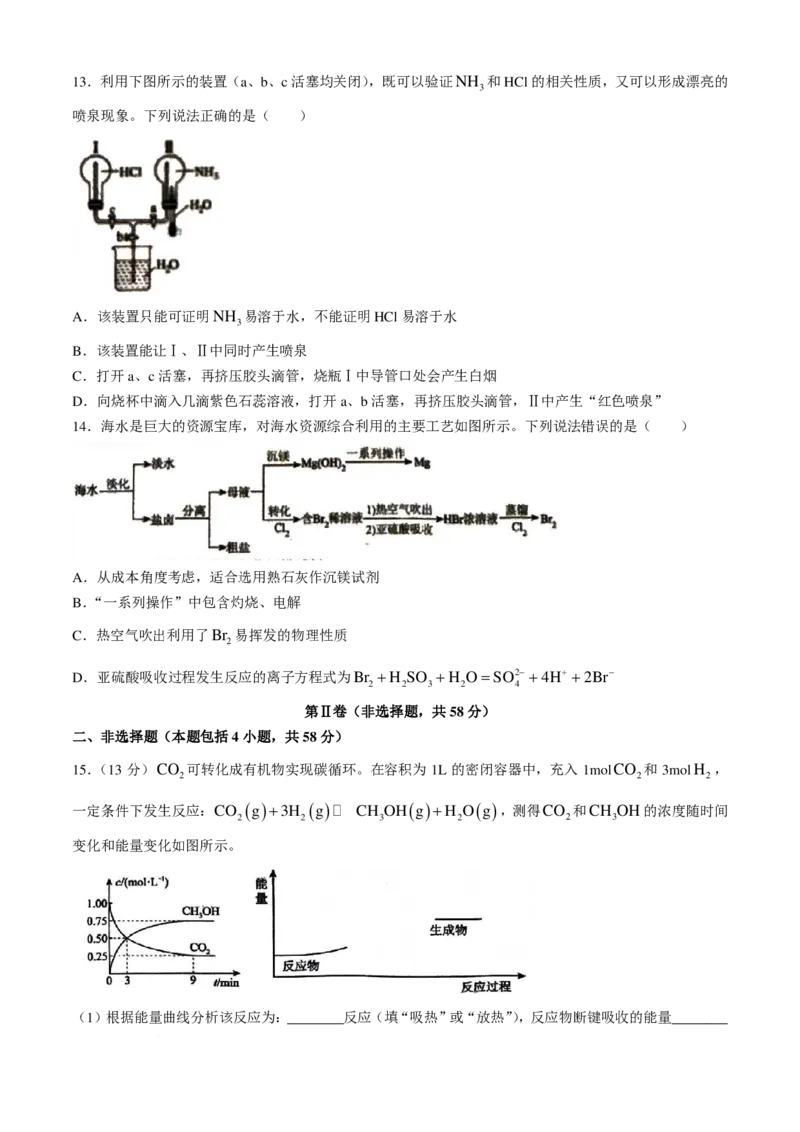
学科网(北京)股份有限公司13.利用下图所示的装置(a、b、c活塞均关闭),既可以验证NH 和HCl的相关性质,又可以形成漂亮的
3
喷泉现象。下列说法正确的是( )
A.该装置只能可证明NH 易溶于水,不能证明HCl易溶于水
3
B.该装置能让Ⅰ、Ⅱ中同时产生喷泉
C.打开a、c活塞,再挤压胶头滴管,烧瓶Ⅰ中导管口处会产生白烟
D.向烧杯中滴入几滴紫色石蕊溶液,打开a、b活塞,再挤压胶头滴管,Ⅱ中产生“红色喷泉”
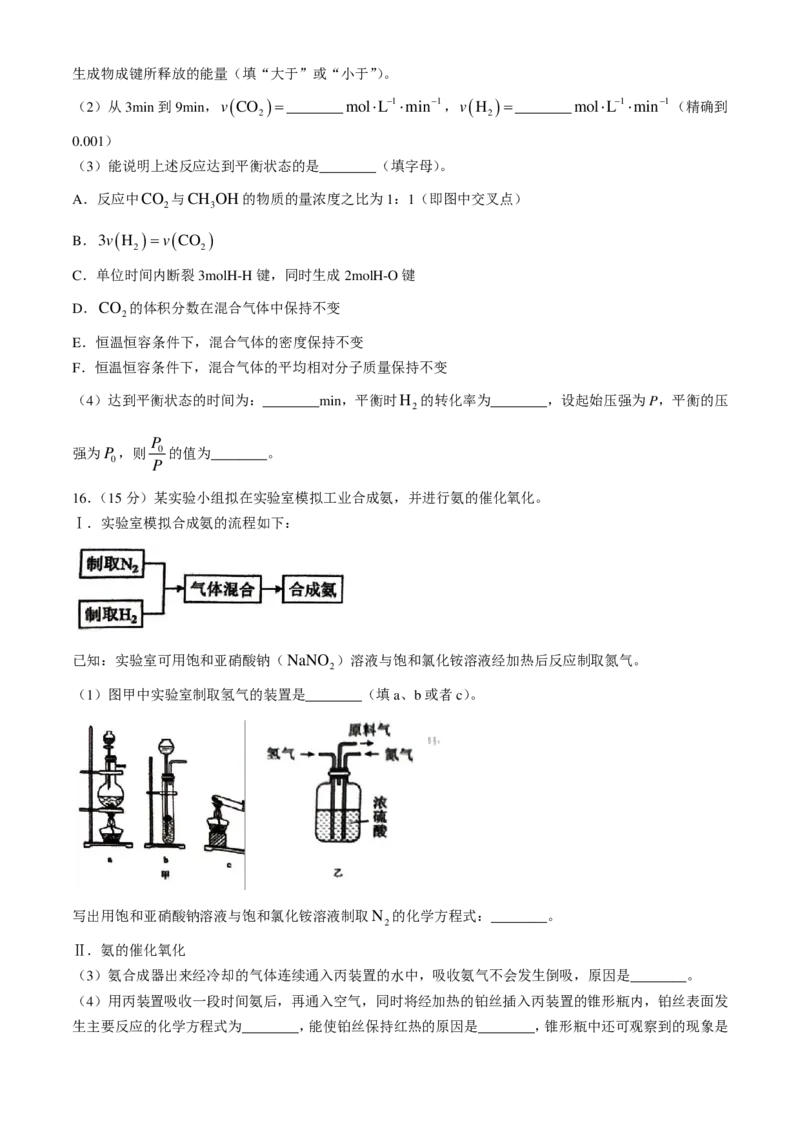
14.海水是巨大的资源宝库,对海水资源综合利用的主要工艺如图所示。下列说法错误的是( )
A.从成本角度考虑,适合选用熟石灰作沉镁试剂
B.“一系列操作”中包含灼烧、电解
C.热空气吹出利用了Br 易挥发的物理性质
2
D.亚硫酸吸收过程发生反应的离子方程式为Br +H SO +H O=SO2− +4H+ +2Br−
2 2 3 2 4
第Ⅱ卷(非选择题,共58分)
二、非选择题(本题包括4小题,共58分)
15.(13 分)CO 可转化成有机物实现碳循环。在容积为 1L 的密闭容器中,充入 1molCO 和 3molH ,
2 2 2
一定条件下发生反应:CO ( g )+3H ( g ) CH OH ( g )+H O ( g ),测得CO 和CH OH的浓度随时间
2 2 3 2 2 3
变化和能量变化如图所示。
(1)根据能量曲线分析该反应为:________反应(填“吸热”或“放热”),反应物断键吸收的能量________
学科网(北京)股份有限公司生成物成键所释放的能量(填“大于”或“小于”)。
(2)从3min到9min,v ( CO )=________mol⋅L−1⋅min−1,v ( H )=________mol⋅L−1⋅min−1(精确到
2 2
0.001)
(3)能说明上述反应达到平衡状态的是________(填字母)。
A.反应中CO 与CH OH的物质的量浓度之比为1:1(即图中交叉点)
2 3
B.3v ( H )=v ( CO )
2 2
C.单位时间内断裂3molH-H键,同时生成2molH-O键
D.CO 的体积分数在混合气体中保持不变
2
E.恒温恒容条件下,混合气体的密度保持不变
F.恒温恒容条件下,混合气体的平均相对分子质量保持不变
(4)达到平衡状态的时间为:________min,平衡时H 的转化率为________,设起始压强为P,平衡的压
2
P
强为P ,则 0 的值为________。
0 P
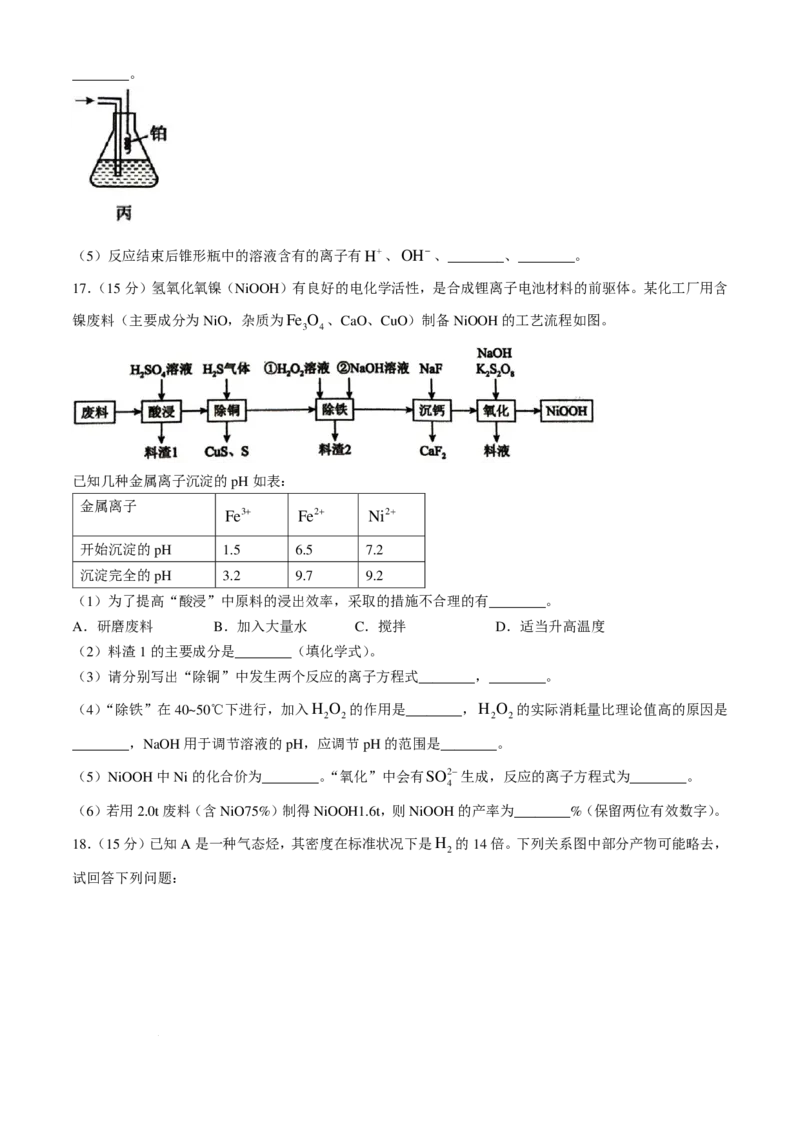
16.(15分)某实验小组拟在实验室模拟工业合成氨,并进行氨的催化氧化。
Ⅰ.实验室模拟合成氨的流程如下:
已知:实验室可用饱和亚硝酸钠(NaNO )溶液与饱和氯化铵溶液经加热后反应制取氮气。
2
(1)图甲中实验室制取氢气的装置是________(填a、b或者c)。
写出用饱和亚硝酸钠溶液与饱和氯化铵溶液制取N 的化学方程式:________。
2
Ⅱ.氨的催化氧化
(3)氨合成器出来经冷却的气体连续通入丙装置的水中,吸收氨气不会发生倒吸,原因是________。
(4)用丙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入丙装置的锥形瓶内,铂丝表面发
生主要反应的化学方程式为________,能使铂丝保持红热的原因是________,锥形瓶中还可观察到的现象是
学科网(北京)股份有限公司________。
(5)反应结束后锥形瓶中的溶液含有的离子有H+、OH−、________、________。
17.(15分)氢氧化氧镍(NiOOH)有良好的电化学活性,是合成锂离子电池材料的前驱体。某化工厂用含
镍废料(主要成分为NiO,杂质为Fe O 、CaO、CuO)制备NiOOH的工艺流程如图。
3 4
已知几种金属离子沉淀的pH如表:
金属离子
Fe3+ Fe2+ Ni2+
开始沉淀的pH 1.5 6.5 7.2
沉淀完全的pH 3.2 9.7 9.2
(1)为了提高“酸浸”中原料的浸出效率,采取的措施不合理的有________。
A.研磨废料 B.加入大量水 C.搅拌 D.适当升高温度
(2)料渣1的主要成分是________(填化学式)。
(3)请分别写出“除铜”中发生两个反应的离子方程式________,________。
(4)“除铁”在40~50℃下进行,加入H O 的作用是________,H O 的实际消耗量比理论值高的原因是
2 2 2 2
________,NaOH用于调节溶液的pH,应调节pH的范围是________。
(5)NiOOH中Ni的化合价为________。“氧化”中会有SO2−生成,反应的离子方程式为________。
4
(6)若用2.0t废料(含NiO75%)制得NiOOH1.6t,则NiOOH的产率为________%(保留两位有效数字)。
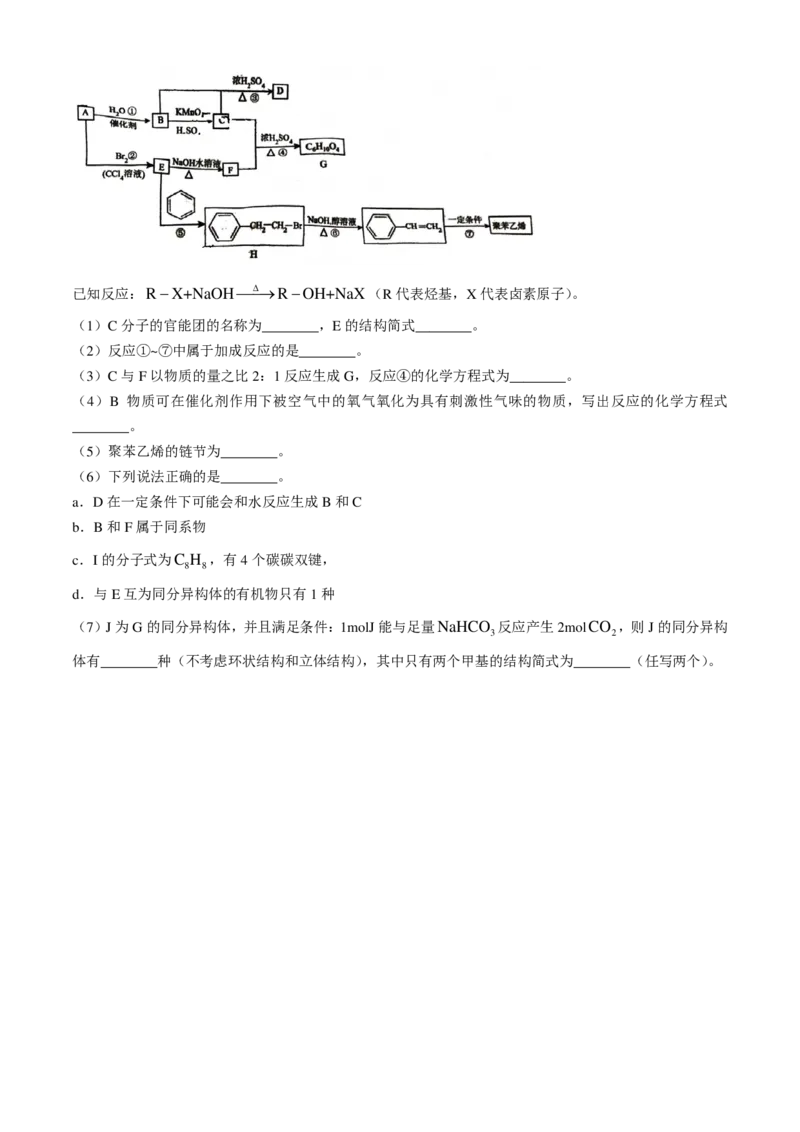
18.(15分)已知A是一种气态烃,其密度在标准状况下是H 的14倍。下列关系图中部分产物可能略去,
2
试回答下列问题:
学科网(北京)股份有限公司已知反应:R−X+NaOH∆→R−OH+NaX(R代表烃基,X代表卤素原子)。
(1)C分子的官能团的名称为________,E的结构简式________。
(2)反应①~⑦中属于加成反应的是________。
(3)C与F以物质的量之比2:1反应生成G,反应④的化学方程式为________。
(4)B 物质可在催化剂作用下被空气中的氧气氧化为具有刺激性气味的物质,写出反应的化学方程式
________。
(5)聚苯乙烯的链节为________。
(6)下列说法正确的是________。
a.D在一定条件下可能会和水反应生成B和C
b.B和F属于同系物
c.I的分子式为C H ,有4个碳碳双键,
8 8
d.与E互为同分异构体的有机物只有1种
(7)J为G的同分异构体,并且满足条件:1molJ能与足量NaHCO 反应产生2molCO ,则J的同分异构
3 2
体有________种(不考虑环状结构和立体结构),其中只有两个甲基的结构简式为________(任写两个)。