文档内容
海淀区 2024 年高二年级学业水平调研
化学
2024.07
本试卷共 8页,共两部分,19道题,满分 100分。考试时长 90分钟。试题答案一律填涂
或书写在答题卡上,在试卷上作答无效。考试结束后,请将答题卡交回。
可能用到的相对原子质量:C12 N14 Na23
第一部分
本部分共 14题,每题 3分,共42分。在每题列出的四个选项中,选出最符合题目要求的
一项。
1.2024年4月24日是第九个中国航天日。在航天事业发展过程中,化学材料发挥着不可替代的作用。下
列材料中.主要成分属于有机物的是( )
A.火箭逃逸塔中使用的高性能树脂材料
B.仪表操作棒中使用的碳纤维材料
C.太阳翼中使用的碳化硅增强铝基复合材料
D.电推进系统中使用的氮化硼陶瓷复合材料
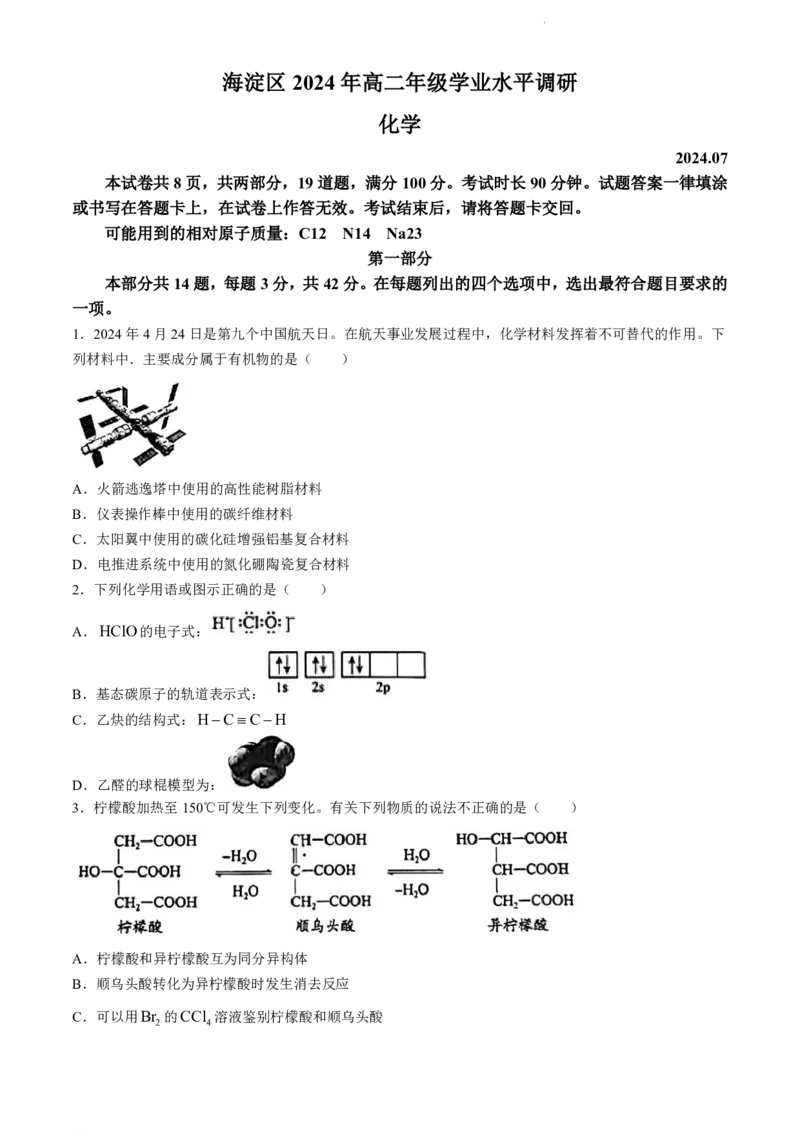
2.下列化学用语或图示正确的是( )
A.HClO的电子式:
B.基态碳原子的轨道表示式:
C.乙炔的结构式:HCCH
D.乙醛的球棍模型为:
3.柠檬酸加热至150℃可发生下列变化。有关下列物质的说法不正确的是( )
A.柠檬酸和异柠檬酸互为同分异构体
B.顺乌头酸转化为异柠檬酸时发生消去反应
C.可以用Br 的CCl 溶液鉴别柠檬酸和顺乌头酸
2 4
学科网(北京)股份有限公司D.上述三种酸均有较好的水溶性
4.下列物质的变化,破坏的作用主要是范德华力的是( )
A.干冰的升华 B.NaCl溶于水 C.冰融化成水 D.H O 受热分解
2 2
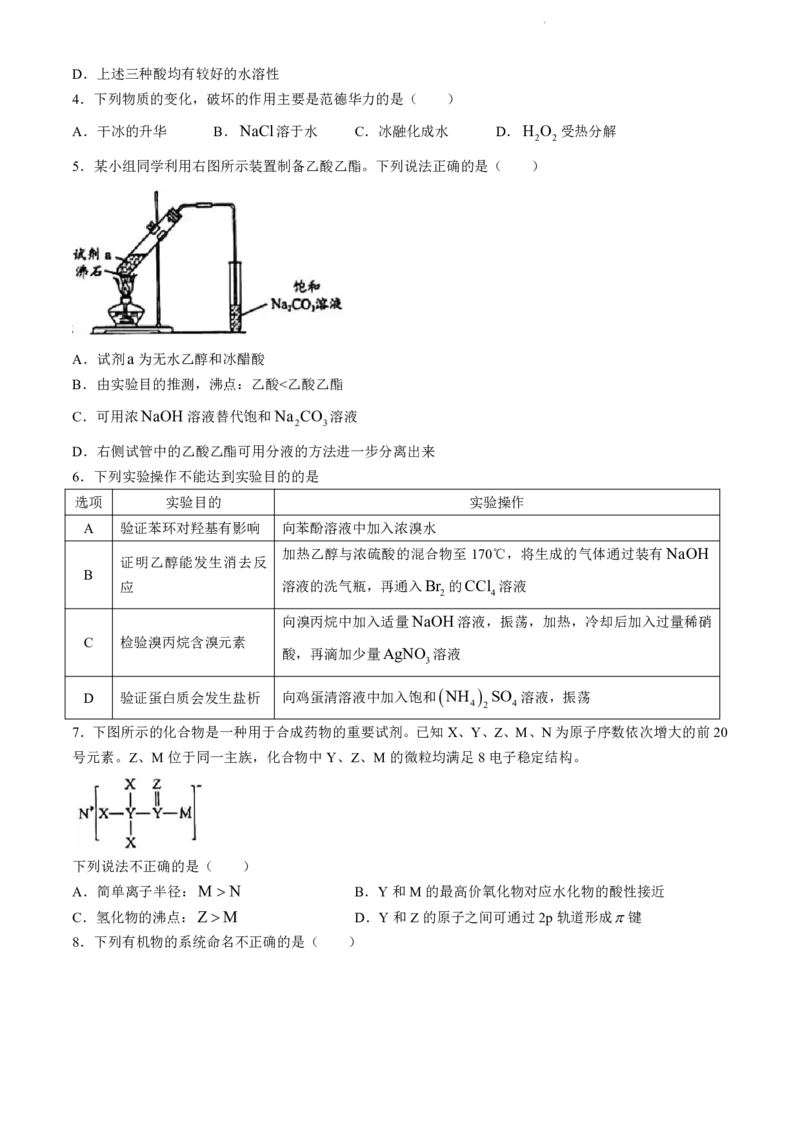
5.某小组同学利用右图所示装置制备乙酸乙酯。下列说法正确的是( )
A.试剂a为无水乙醇和冰醋酸
B.由实验目的推测,沸点:乙酸<乙酸乙酯
C.可用浓NaOH溶液替代饱和Na CO 溶液
2 3
D.右侧试管中的乙酸乙酯可用分液的方法进一步分离出来
6.下列实验操作不能达到实验目的的是
选项 实验目的 实验操作
A 验证苯环对羟基有影响 向苯酚溶液中加入浓溴水
加热乙醇与浓硫酸的混合物至170℃,将生成的气体通过装有NaOH
证明乙醇能发生消去反
B
应 溶液的洗气瓶,再通入Br 的CCl 溶液
2 4
向溴丙烷中加入适量NaOH溶液,振荡,加热,冷却后加入过量稀硝
C 检验溴丙烷含溴元素
酸,再滴加少量AgNO 溶液
3
D 验证蛋白质会发生盐析 向鸡蛋清溶液中加入饱和 NH SO 溶液,振荡
4 2 4
7.下图所示的化合物是一种用于合成药物的重要试剂。已知X、Y、Z、M、N为原子序数依次增大的前20
号元素。Z、M位于同一主族,化合物中Y、Z、M的微粒均满足8电子稳定结构。
下列说法不正确的是( )
A.简单离子半径:M N B.Y和M的最高价氧化物对应水化物的酸性接近
C.氢化物的沸点:ZM D.Y和Z的原子之间可通过2p轨道形成键
8.下列有机物的系统命名不正确的是( )
学科网(北京)股份有限公司CH CHCH CH
2 2
A.1,3-丁二烯 B.二溴乙烷 C.顺-2-戊烯 D.4-甲基-1-戊炔
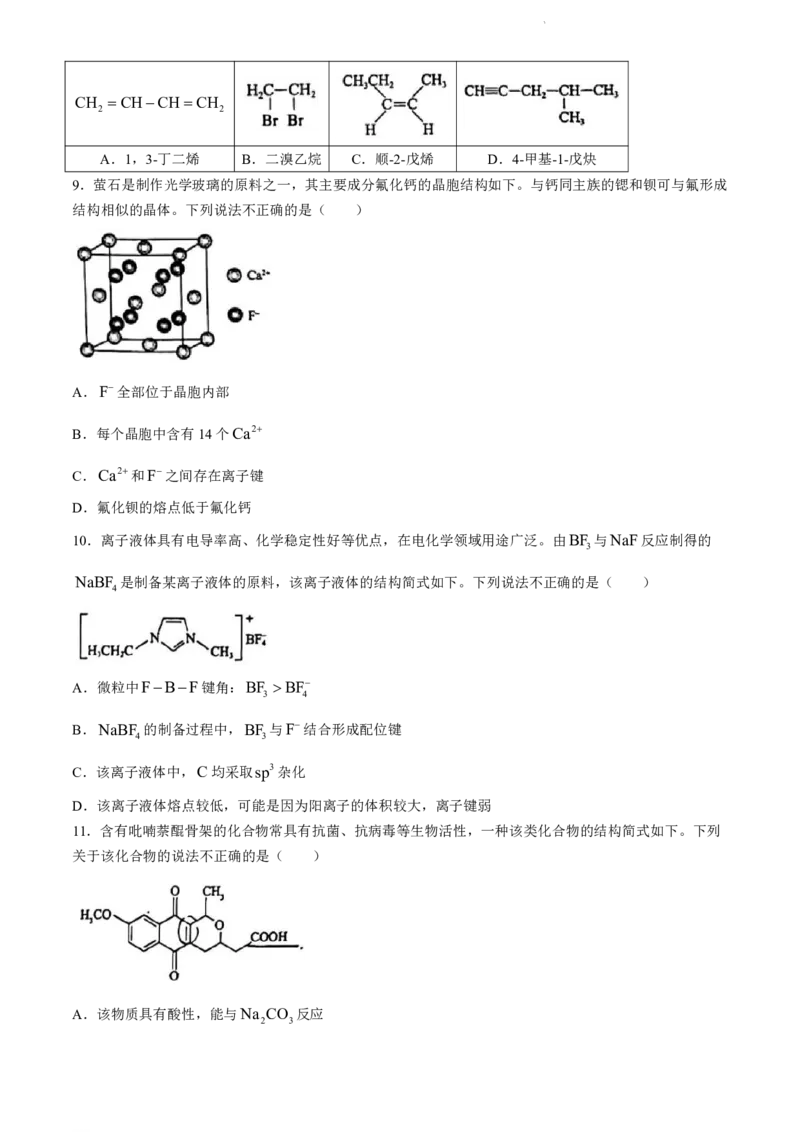
9.萤石是制作光学玻璃的原料之一,其主要成分氟化钙的晶胞结构如下。与钙同主族的锶和钡可与氟形成
结构相似的晶体。下列说法不正确的是( )
A.F全部位于晶胞内部
B.每个晶胞中含有14个Ca2
C.Ca2和F之间存在离子键
D.氟化钡的熔点低于氟化钙
10.离子液体具有电导率高、化学稳定性好等优点,在电化学领域用途广泛。由BF 与NaF反应制得的
3
NaBF 是制备某离子液体的原料,该离子液体的结构简式如下。下列说法不正确的是( )
4
A.微粒中FBF键角:BF BF
3 4
B.NaBF 的制备过程中,BF 与F结合形成配位键
4 3
C.该离子液体中,C均采取sp3杂化
D.该离子液体熔点较低,可能是因为阳离子的体积较大,离子键弱
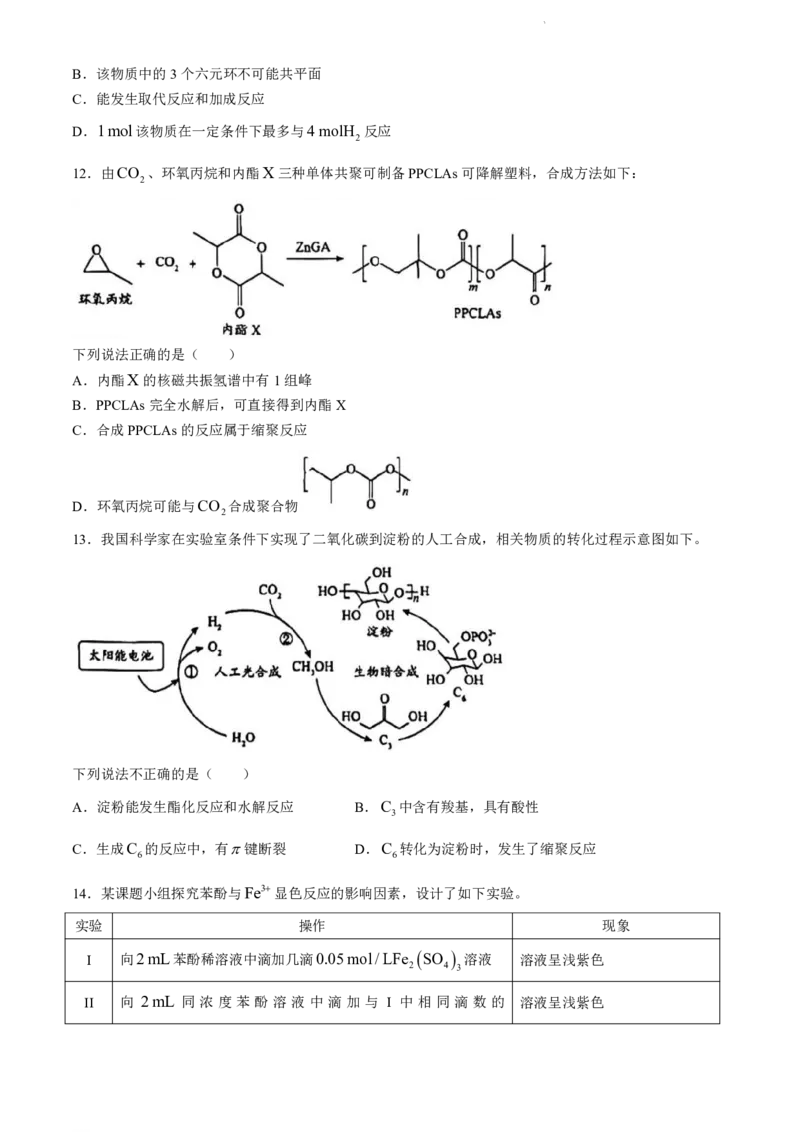
11.含有吡喃萘醌骨架的化合物常具有抗菌、抗病毒等生物活性,一种该类化合物的结构简式如下。下列
关于该化合物的说法不正确的是( )
A.该物质具有酸性,能与Na CO 反应
2 3
学科网(北京)股份有限公司B.该物质中的3个六元环不可能共平面
C.能发生取代反应和加成反应
D.1mol该物质在一定条件下最多与4molH 反应
2
12.由CO 、环氧丙烷和内酯X三种单体共聚可制备PPCLAs可降解塑料,合成方法如下:
2
下列说法正确的是( )
A.内酯X的核磁共振氢谱中有1组峰
B.PPCLAs完全水解后,可直接得到内酯X
C.合成PPCLAs的反应属于缩聚反应
D.环氧丙烷可能与CO 合成聚合物
2
13.我国科学家在实验室条件下实现了二氧化碳到淀粉的人工合成,相关物质的转化过程示意图如下。
下列说法不正确的是( )
A.淀粉能发生酯化反应和水解反应 B.C 中含有羧基,具有酸性
3
C.生成C 的反应中,有键断裂 D.C 转化为淀粉时,发生了缩聚反应
6 6
14.某课题小组探究苯酚与Fe3显色反应的影响因素,设计了如下实验。
实验 操作 现象
I 向2mL苯酚稀溶液中滴加几滴0.05mol/LFe SO 溶液 溶液呈浅紫色
2 4 3
II 向 2mL 同 浓 度 苯 酚 溶 液 中 滴 加 与 I 中 相 同 滴 数 的 溶液呈浅紫色
学科网(北京)股份有限公司0.1mol/LFeCl 溶液
3
向2mL同浓度苯酚溶液(调pH9)中滴加与I中相同滴数
III 生成红褐色沉淀
的0.1mol/LFeCl 溶液
3
沉淀逐渐溶解,溶液变为紫色。
IV 向实验III所得悬浊液中逐滴加入0.1mol/L盐酸
继续滴加盐酸,溶液变为浅黄色
已知:Fe3可发生如下反应。
i.与苯酚发生显色反应:6C
6
H
5
OHFe3
Fe C
6
H
5
O
6
3紫色6H
ii.与Cl发生反应:Fe3 4Cl FeCl (黄色)
4
下列说法不正确的是( )
A.
Fe C
6
H
5
O
6
3 中,C
6
H
5
O提供孤电子对,与Fe3形成配位键
B.实验I和II说明,少量Cl不会干扰苯酚与Fe3的显色反应
C.III中调pH9后,c
C H
O
增大,i中平衡正向移动
6 5
D.溶液pH、阴离子种类和浓度都可能影响苯酚与Fe3的显色反应
第二部分
本部分共 5题,共 58分。
15.(9分)甲醛有毒,能使人体内蛋白质失去活性,损害人体健康。
(1)蛋白质中主要含有C、H、O、N四种元素。
①下列关于C、H、O、N的说法中,正确的是________(填序号)。
a.H的电子云呈球形 b.C、H、O、N中,C的原子半径最大
c.C、H、O、N均位于p区 d.基态O中含有8种不同运动状态的电子
②第一电离能N O,原因是________。
(2)酸性高锰酸钾溶液、新制氧化银等氧化剂能去除甲醛。
基态Mn原子的价电子排布式为________。
①已知基态Ag原子的简化电子排布式为 Kr 4d105s1,银元素在周期表中的位置是________。
②(3)甲醛使蛋白质失活的第一步反应如下,二者遵循“正找负、负找正”的规律发生加成反应。
已知:部分元素电负性:C2.5、H2.1、O3.5、N3.0
结合电负性解释与N相连的H带部分正电荷的原因:________。
①
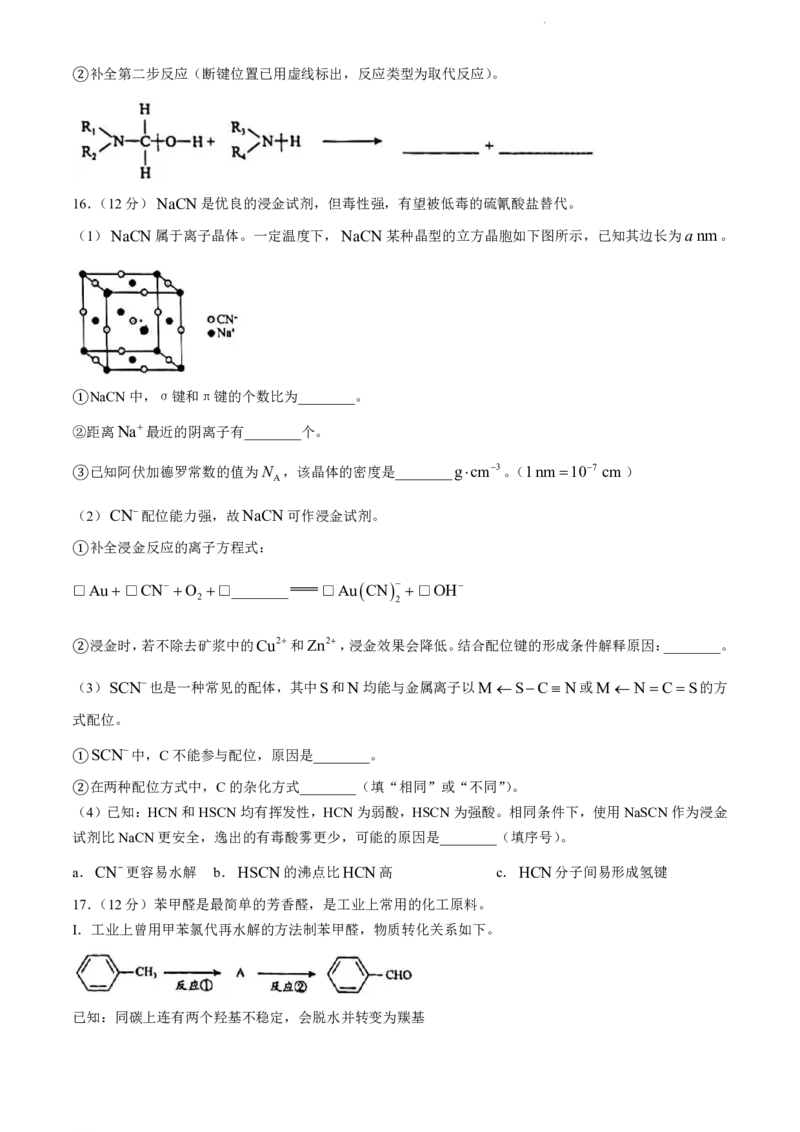
学科网(北京)股份有限公司补全第二步反应(断键位置已用虚线标出,反应类型为取代反应)。
②
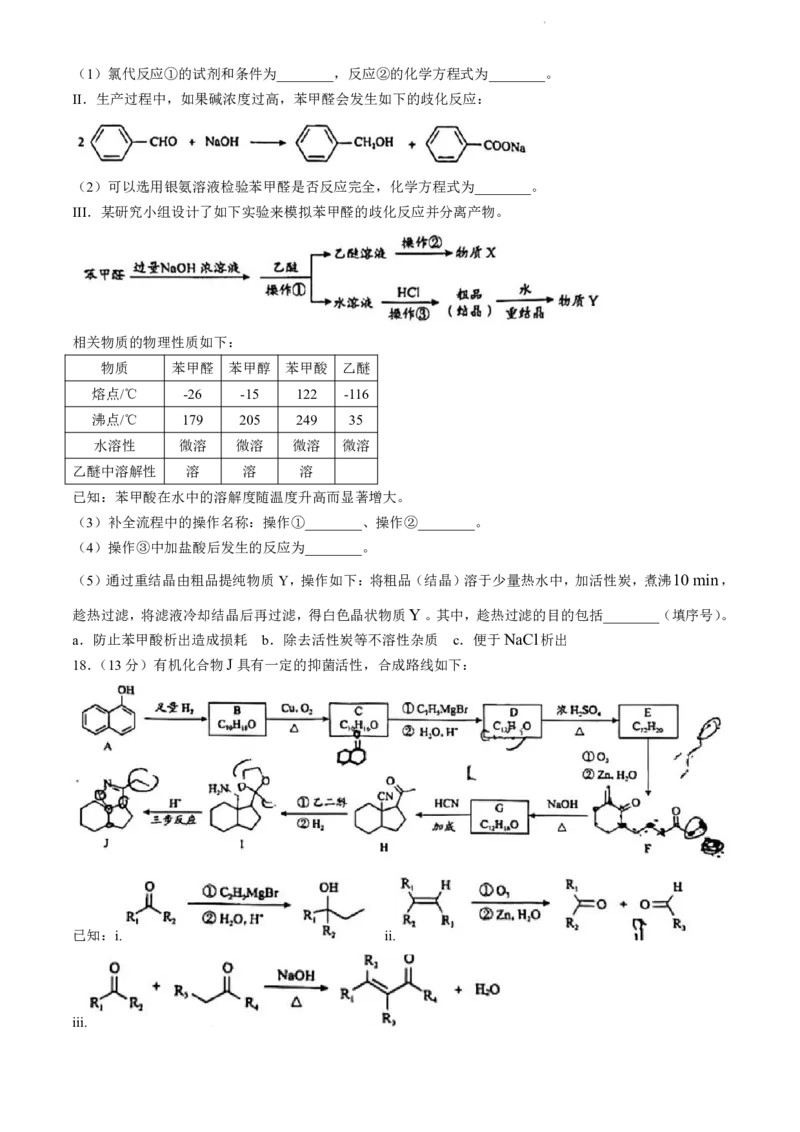
16.(12分)NaCN是优良的浸金试剂,但毒性强,有望被低毒的硫氰酸盐替代。
(1)NaCN属于离子晶体。一定温度下,NaCN某种晶型的立方晶胞如下图所示,已知其边长为anm。
NaCN中,σ键和π键的个数比为________。
①②距离Na最近的阴离子有________个。
已知阿伏加德罗常数的值为N ,该晶体的密度是________gcm3。(1nm107 cm)
A
③
(2)CN配位能力强,故NaCN可作浸金试剂。
补全浸金反应的离子方程式:
①
□Au□CN O □________ □Au CN □OH
2 2
浸金时,若不除去矿浆中的Cu2和Zn2,浸金效果会降低。结合配位键的形成条件解释原因:________。
②
(3)SCN也是一种常见的配体,其中S和N均能与金属离子以MSC N或M N CS的方
式配位。
SCN中,C不能参与配位,原因是________。
①在两种配位方式中,C的杂化方式________(填“相同”或“不同”)。
(4)已知:HCN和HSCN均有挥发性,HCN为弱酸,HSCN为强酸。相同条件下,使用NaSCN作为浸金
②
试剂比NaCN更安全,逸出的有毒酸雾更少,可能的原因是________(填序号)。
a.CN更容易水解 b.HSCN的沸点比HCN高 c.HCN分子间易形成氢键
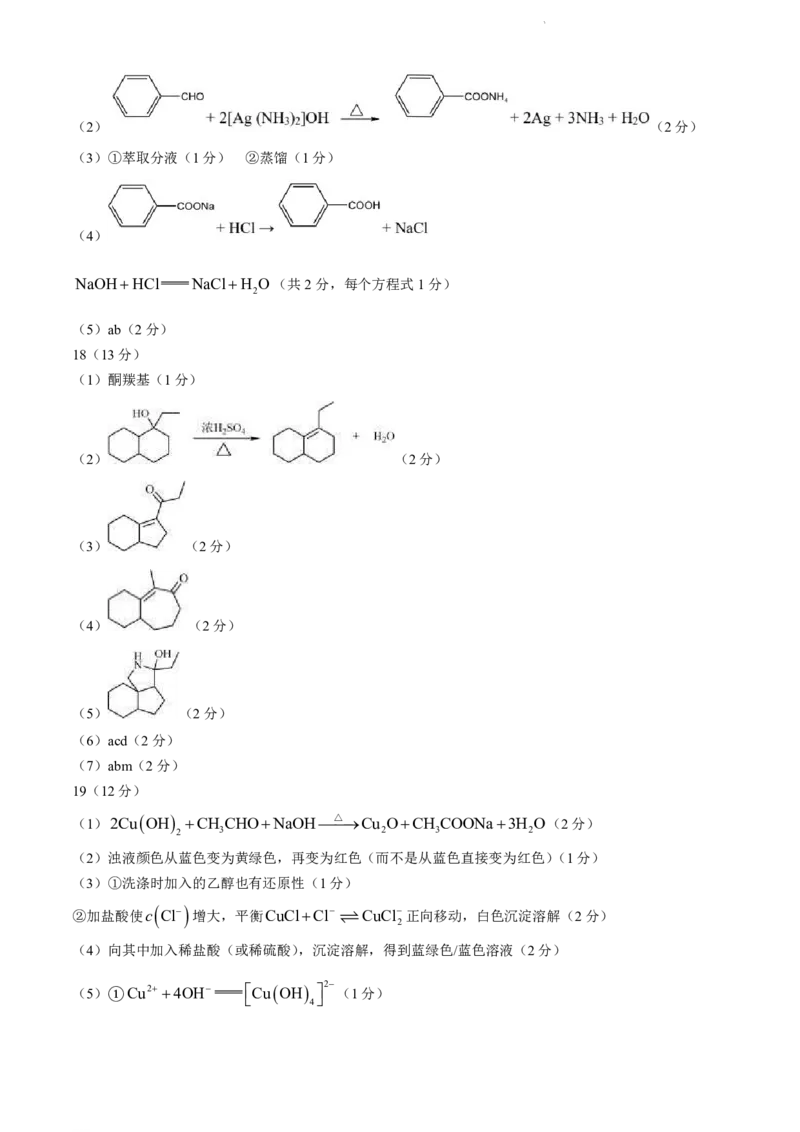
17.(12分)苯甲醛是最简单的芳香醛,是工业上常用的化工原料。
I.工业上曾用甲苯氯代再水解的方法制苯甲醛,物质转化关系如下。
已知:同碳上连有两个羟基不稳定,会脱水并转变为羰基
学科网(北京)股份有限公司(1)氯代反应①的试剂和条件为________,反应②的化学方程式为________。
II.生产过程中,如果碱浓度过高,苯甲醛会发生如下的歧化反应:
(2)可以选用银氨溶液检验苯甲醛是否反应完全,化学方程式为________。
III.某研究小组设计了如下实验来模拟苯甲醛的歧化反应并分离产物。
相关物质的物理性质如下:
物质 苯甲醛 苯甲醇 苯甲酸 乙醚
熔点/℃ -26 -15 122 -116
沸点/℃ 179 205 249 35
水溶性 微溶 微溶 微溶 微溶
乙醚中溶解性 溶 溶 溶
已知:苯甲酸在水中的溶解度随温度升高而显著增大。
(3)补全流程中的操作名称:操作①________、操作②________。
(4)操作③中加盐酸后发生的反应为________。
(5)通过重结晶由粗品提纯物质Y,操作如下:将粗品(结晶)溶于少量热水中,加活性炭,煮沸10min,
趁热过滤,将滤液冷却结晶后再过滤,得白色晶状物质Y。其中,趁热过滤的目的包括________(填序号)。
a.防止苯甲酸析出造成损耗 b.除去活性炭等不溶性杂质 c.便于NaCl析出
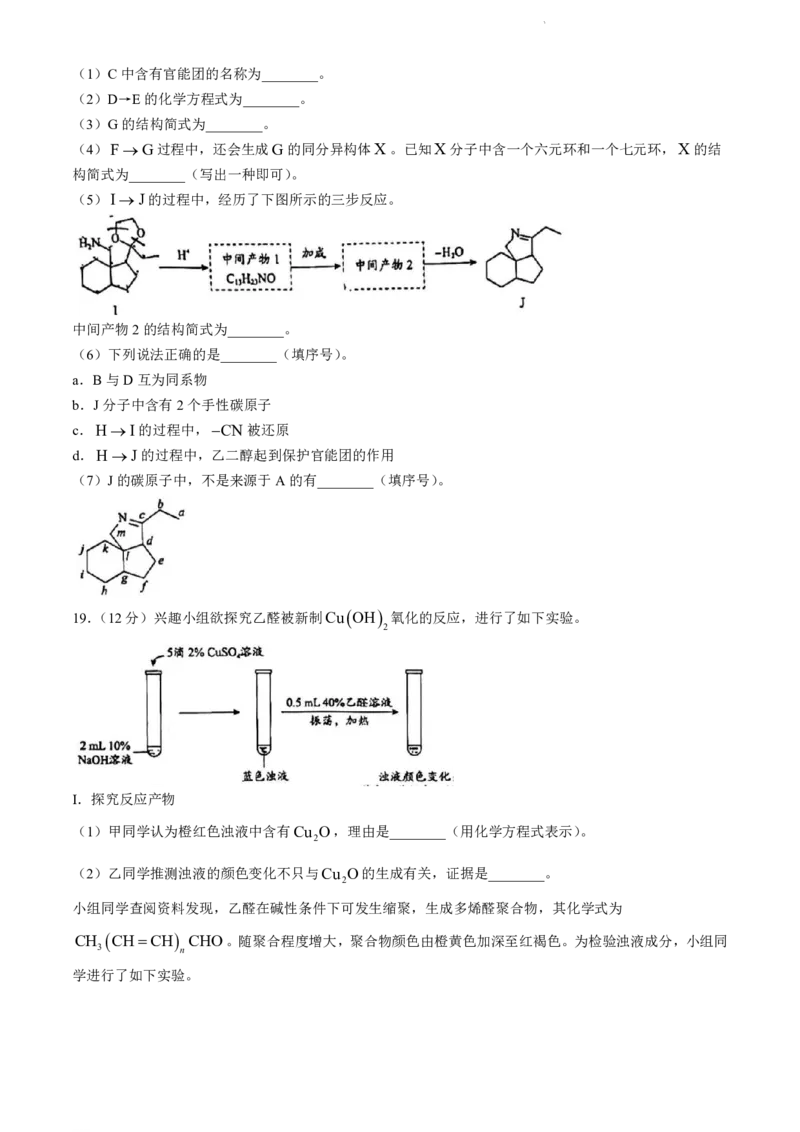
18.(13分)有机化合物J具有一定的抑菌活性,合成路线如下:
已知:i. ii.
iii.
学科网(北京)股份有限公司(1)C中含有官能团的名称为________。
(2)D→E的化学方程式为________。
(3)G的结构简式为________。
(4)FG过程中,还会生成G的同分异构体X。已知X分子中含一个六元环和一个七元环,X的结
构简式为________(写出一种即可)。
(5)IJ的过程中,经历了下图所示的三步反应。
中间产物2的结构简式为________。
(6)下列说法正确的是________(填序号)。
a.B与D互为同系物
b.J分子中含有2个手性碳原子
c.HI的过程中,CN被还原
d.HJ的过程中,乙二醇起到保护官能团的作用
(7)J的碳原子中,不是来源于A的有________(填序号)。
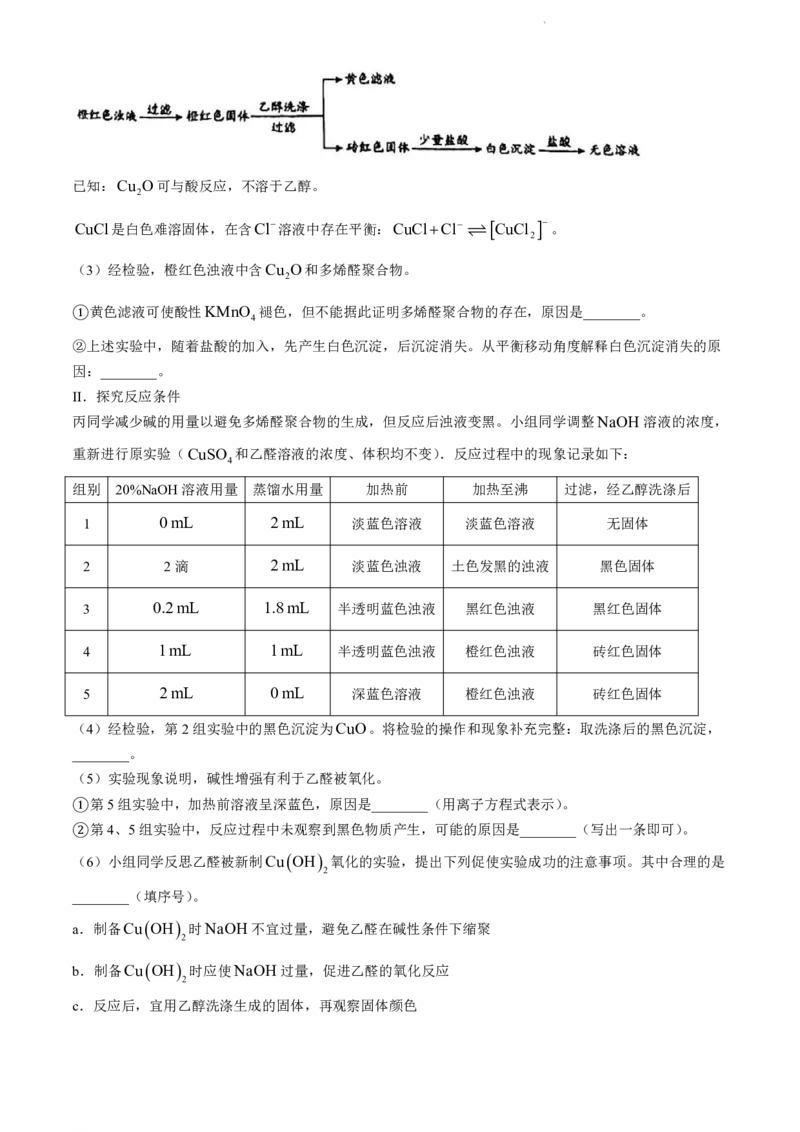
19.(12分)兴趣小组欲探究乙醛被新制Cu OH 氧化的反应,进行了如下实验。
2
I.探究反应产物
(1)甲同学认为橙红色浊液中含有Cu O,理由是________(用化学方程式表示)。
2
(2)乙同学推测浊液的颜色变化不只与Cu O的生成有关,证据是________。
2
小组同学查阅资料发现,乙醛在碱性条件下可发生缩聚,生成多烯醛聚合物,其化学式为
CH CHCH CHO。随聚合程度增大,聚合物颜色由橙黄色加深至红褐色。为检验浊液成分,小组同
3 n
学进行了如下实验。
学科网(北京)股份有限公司已知:Cu O可与酸反应,不溶于乙醇。
2
CuCl是白色难溶固体,在含Cl溶液中存在平衡:CuClCl CuCl 。
2
(3)经检验,橙红色浊液中含Cu O和多烯醛聚合物。
2
黄色滤液可使酸性KMnO 褪色,但不能据此证明多烯醛聚合物的存在,原因是________。
4
①②上述实验中,随着盐酸的加入,先产生白色沉淀,后沉淀消失。从平衡移动角度解释白色沉淀消失的原
因:________。
II.探究反应条件
丙同学减少碱的用量以避免多烯醛聚合物的生成,但反应后浊液变黑。小组同学调整NaOH溶液的浓度,
重新进行原实验(CuSO 和乙醛溶液的浓度、体积均不变).反应过程中的现象记录如下:
4
组别 20%NaOH溶液用量 蒸馏水用量 加热前 加热至沸 过滤,经乙醇洗涤后
1 0mL 2mL 淡蓝色溶液 淡蓝色溶液 无固体
2 2滴 2mL 淡蓝色浊液 土色发黑的浊液 黑色固体
3 0.2mL 1.8mL 半透明蓝色浊液 黑红色浊液 黑红色固体
4 1mL 1mL 半透明蓝色浊液 橙红色浊液 砖红色固体
5 2mL 0mL 深蓝色溶液 橙红色浊液 砖红色固体
(4)经检验,第2组实验中的黑色沉淀为CuO。将检验的操作和现象补充完整:取洗涤后的黑色沉淀,
________。
(5)实验现象说明,碱性增强有利于乙醛被氧化。
第5组实验中,加热前溶液呈深蓝色,原因是________(用离子方程式表示)。
第4、5组实验中,反应过程中未观察到黑色物质产生,可能的原因是________(写出一条即可)。
①
②(6)小组同学反思乙醛被新制Cu OH 氧化的实验,提出下列促使实验成功的注意事项。其中合理的是
2
________(填序号)。
a.制备Cu OH 时NaOH不宜过量,避免乙醛在碱性条件下缩聚
2
b.制备Cu OH 时应使NaOH过量,促进乙醛的氧化反应
2
c.反应后,宜用乙醇洗涤生成的固体,再观察固体颜色
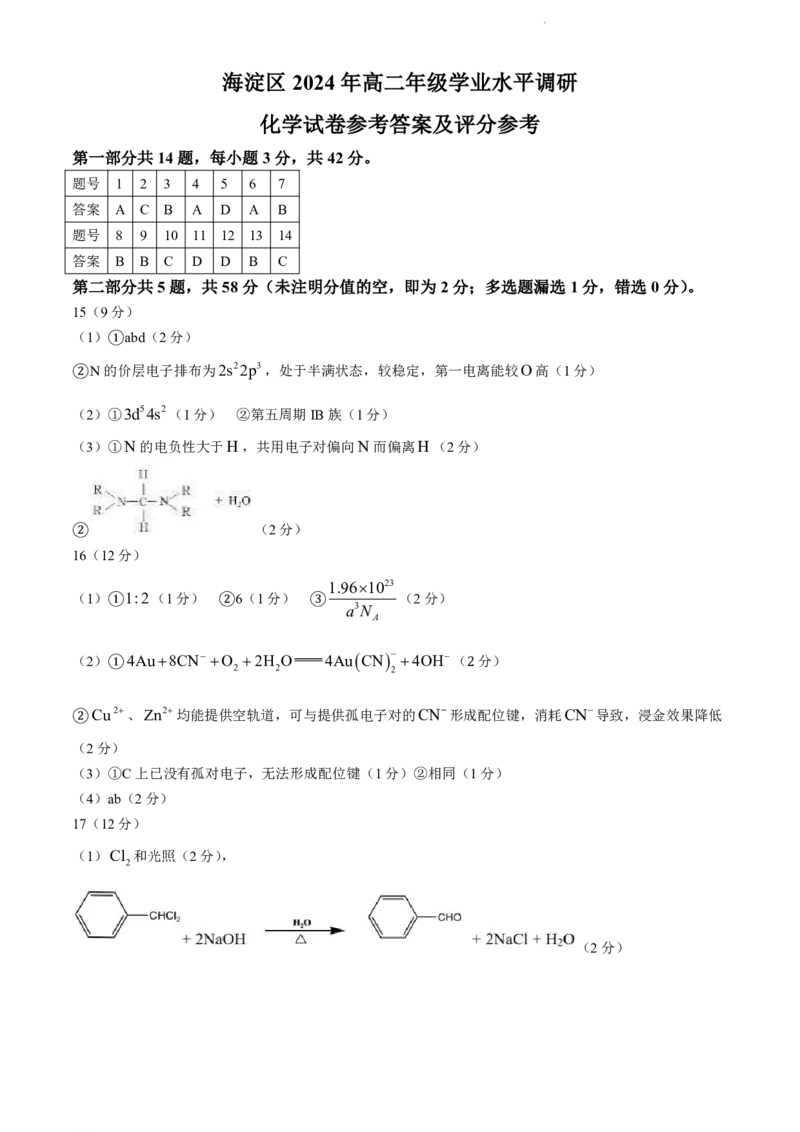
学科网(北京)股份有限公司海淀区 2024 年高二年级学业水平调研
化学试卷参考答案及评分参考
第一部分共14题,每小题 3分,共 42分。
题号 1 2 3 4 5 6 7
答案 A C B A D A B
题号 8 9 10 11 12 13 14
答案 B B C D D B C
第二部分共5题,共 58分(未注明分值的空,即为 2分;多选题漏选 1分,错选 0分)。
15(9分)
(1) abd(2分)
N的①价层电子排布为2s22p3,处于半满状态,较稳定,第一电离能较O高(1分)
②
(2)①3d54s2(1分) ②第五周期IB族(1分)
(3)①N的电负性大于H,共用电子对偏向N而偏离H(2分)
(2分)
16(12分)
②
1.961023
(1) 1:2(1分) 6(1分) (2分)
a3N
A
① ② ③
(2) 4Au8CN O 2H O 4Au CN 4OH( 分)
2 2 2
① 2
Cu2、Zn2均能提供空轨道,可与提供孤电子对的CN形成配位键,消耗CN导致,浸金效果降低
②(2分)
(3)①C上已没有孤对电子,无法形成配位键(1分)②相同(1分)
(4)ab(2分)
17(12分)
(1)Cl 和光照(2分),
2
(2分)
学科网(北京)股份有限公司(2) (2分)
(3)①萃取分液(1分) ②蒸馏(1分)
(4)
NaOHHCl NaClH O(共2分,每个方程式1分)
2
(5)ab(2分)
18(13分)
(1)酮羰基(1分)
(2) (2分)
(3) (2分)
(4) (2分)
(5) (2分)
(6)acd(2分)
(7)abm(2分)
19(12分)
(1)2Cu OH CH CHONaOH△Cu OCH COONa3H O(2分)
2 3 2 3 2
(2)浊液颜色从蓝色变为黄绿色,再变为红色(而不是从蓝色直接变为红色)(1分)
(3)①洗涤时加入的乙醇也有还原性(1分)
②加盐酸使c Cl 增大,平衡CuClCl CuCl正向移动,白色沉淀溶解(2分)
2
(4)向其中加入稀盐酸(或稀硫酸),沉淀溶解,得到蓝绿色/蓝色溶液(2分)
(5) Cu2 4OH
Cu OH
2 (1分)
4
①
学科网(北京)股份有限公司碱性较强时,Cu II 氧化乙醛的速率大于Cu OH 分解速率;或部分Cu OH 转化为Cu OH 2 ,
2 2 4
②不易分解生成CuO(1分,合理即可)
(6)bc(2分)
学科网(北京)股份有限公司