文档内容
吉林省“BEST 合作体”2024-2025 学年度上学期期末考试
高二化学试题
本试卷分选择题和非选择题两部分,共19题,共100分,共6页。考试时间为75分钟。考试结束后,只
交答题卡。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 S:32 Cl:35.5 Cu:64
第Ⅰ卷 客观题
一、单项选择题(15小题,每小题3分,共45分)
1、化学与生产、生活密切相关,下列说法正确的是( )
A.黏土高温烧结制陶瓷的过程中没有形成新的化学键
B.高炉炼铁时可通过增加塔高来降低体系中CO的百分含量
C.将煤气化,有利于提供更多的能量,而且有效地减少温室气体的产生
D.氯化铵溶液显酸性可用作铁制品的除锈剂
2、下列反应既属于氧化还原反应,且能量变化符合如图中曲线的是( )
A.铝热反应 B.硫单质在氧气中燃烧
C.灼热的木炭与 反应 D.碳酸钙的分解
3、一定温度下,在容积恒定的密闭容器中进行反应。 ,下列叙述能表明该反
应已达到平衡状态的是( )
混合气体的密度不变 容器内气体的压强不变
混合气体的总物质的量不变 B的物质的量浓度不变
① ②
③ ④
⑤ ⑥
A. B. C. D.只有
4、 代表阿伏加德罗常数的值,下列说法正确的是( )
②⑤⑥ ①④⑤ ②④⑤⑥ ④
A.室温下, 的 溶液中水电离产生的 数目为
B.1molH 和1molI 反应后气体分子总数为2N
2 2 A
C.氢氧燃料电池工作时,正极消耗 气体,电路中转移电子数为2D.标准状况下, 溶于水,所得溶液中 的微粒数之和为
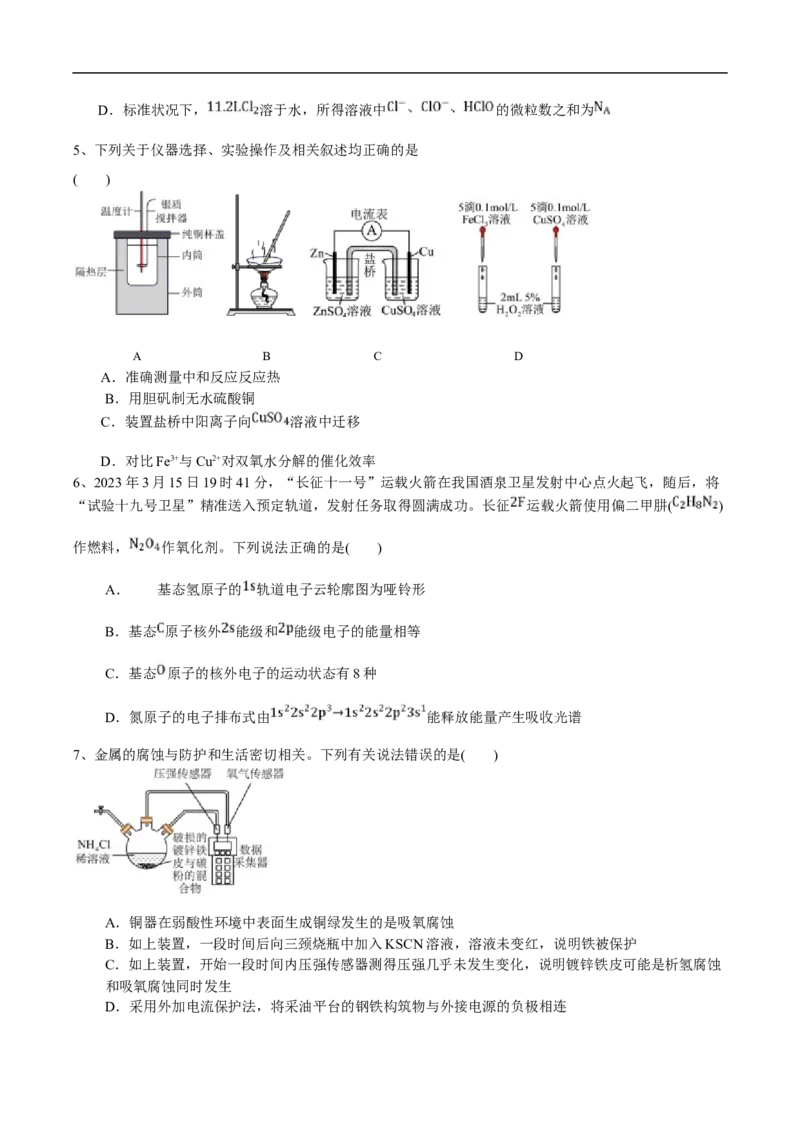
5、下列关于仪器选择、实验操作及相关叙述均正确的是
( )
A B C D
A.准确测量中和反应反应热
B.用胆矾制无水硫酸铜
C.装置盐桥中阳离子向 溶液中迁移
D.对比Fe3+与Cu2+对双氧水分解的催化效率
6、2023年3月15日19时41分,“长征十一号”运载火箭在我国酒泉卫星发射中心点火起飞,随后,将
“试验十九号卫星”精准送入预定轨道,发射任务取得圆满成功。长征 运载火箭使用偏二甲肼( )
作燃料, 作氧化剂。下列说法正确的是( )
A. 基态氢原子的 轨道电子云轮廓图为哑铃形
B.基态 原子核外 能级和 能级电子的能量相等
C.基态 原子的核外电子的运动状态有8种
D.氮原子的电子排布式由 能释放能量产生吸收光谱
7、金属的腐蚀与防护和生活密切相关。下列有关说法错误的是( )
A.铜器在弱酸性环境中表面生成铜绿发生的是吸氧腐蚀
B.如上装置,一段时间后向三颈烧瓶中加入KSCN溶液,溶液未变红,说明铁被保护
C.如上装置,开始一段时间内压强传感器测得压强几乎未发生变化,说明镀锌铁皮可能是析氢腐蚀
和吸氧腐蚀同时发生
D.采用外加电流保护法,将采油平台的钢铁构筑物与外接电源的负极相连8、下列应用中涉及的方程式或离子方程式不正确的是( )
A.使用漂白粉消毒:
B.制备白色颜料 :
C.泡沫灭火器工作原理:
D.使用FeS处理含汞废水:
9、MnO 催化某反应的一种催化机理如图所示。下列叙述正确的是( )
2
A. 使用MnO 催化时,总反应的焓变会发生变化
2
B. HO+O→H++ + ∙OH放出热量
2 2
C.催化过程中,所发生的反应均为氧化还原反应
D.1molHCHO参加反应转移4mol电子
10、下列事实或现象和相应结论均正确的是( )
事实或现象 结论
稀释后, 的水解
A 将 溶液由 稀释到 ,则溶液 变大
程度增大
取 样品,溶解后滴加BaCl 溶液,产生白色沉淀,加入稀硝
B 2 此样品中含有
酸,沉淀不消失
酸性强于
C 分别测定 、 饱和溶液的 ,前者 小
向 溶液中滴加 溶液至不再产生
D
白色沉淀,再滴加几滴 溶液,出现黑色沉淀
A. A B.B C.C D.D
11、氧化亚氮( )是一种强温室气体,且易转换成颗粒污染物。碘蒸气存在能大幅度提高 分解速率,
反应历程为:
第一步: (快反应)
第二步: (慢反应)
第三步: (快反应)实验表明,含碘时 分解速率方程 (k为速率常数)。下列表述正确的是( )
A. 分解反应中, (含碘)> (无碘)
B.第三步对总反应速率起决定作用
C.第二步活化能比第三步小
D. 浓度与 分解速率无关
12、用0.100 的 溶液滴定 的 溶液,测得滴定过程中溶液的 变化
如图所示。下列说法不正确的是( )
A. 点溶液中:
①
B. 点溶液中:
②
C. 点溶液中:
③
D.在相同温度下, 、 、 三点溶液中水电离的 : < <
① ② ③ ③ ② ①
13、氨对发展农业有着重要意义,也是重要的化工原料。合成氨的生产流程示意图如下。
下列有关合成氨说法正确的是( )
A.从合成氨平衡体系中分离出 ,可提高正反应速率,减小逆反应速率,平衡正移
B.热交换的目的是预热原料气,同时对合成的氨气进行降温利于液化分离
C.合成氨一般选择 进行,铁触媒的活性最大,原料气平衡转化率高
D.步骤 均有利于提高原料的平衡转化率
14、水系双离子电池相比于锂电池有安全和成本优势,在储能领域有较好应用。我国最新水系(碱性)双离
④⑤
子电池的工作原理如图所示,下列有关叙述错误的是( )A.放电时,电解质溶液中的Na+由b极区向a极区转移
B. 放电时,若a极得到3.2gCu和 ,则电路中转移的电子的物质的量为0.14mol
C.为消除第一次放电的不可逆,可将Cu (PO ) 彻底放电转化为Cu O后再充电
3 4 2 2
D.第1次放电时,a极的电极反应式为
15、工业上以SrSO (s)为原料生产SrCO (s),对其工艺条件进行研究。现有含SrCO (s)的0.1 mol·L-1NaCO
4 3 3 2 3
溶液和1.0mol·L-1 Na CO 溶液,含 SrSO (s)的0.1 mol·L-1 Na SO 溶液和
2 3 4 2 4
1.0mol·L-1 Na SO 溶液,在一定pH范围内,四种溶液中lgc(Sr2+)随pH的变化关系如图所示。
2 4
下列说法错误的是( )
A.a= -6.5
B.pH相同时,溶液中c( )越大,c(Sr2+ )越小
C.曲线 对应含SrCO (s)的0.1 mol·L-1NaCO 溶液
3 2 3
D.在NaSO 和NaCO 初始浓度均为1.0 mol·L-1的混合溶液中,pH≥7.7时才能实现SrSO (s)转化为
2 4 2 3 4
③
SrCO (s)
3
第Ⅱ卷 主观题
16、化学用语、元素周期律等是学习元素及其化合物知识的重要工具。请回答下列问题:
(1)下列说法正确的是 (填序号)。
s区全部是金属元素
共价化合物中电负性大的成键元素表现为负价
①
两种金属元素第一电离能越小的其金属性越强
②
电负性大于1.8的一定为非金属
③
第四周期元素中未成对电子数最多的元素位于钾元素后面第五位
④
(2) 新型半导体材料如碳化硅(SiC)、氮化镓(GaN)等在航空航天、国防技术及5G技术等领域扮演着重要的
⑤角色。基态Si原子的核外电子空间运动状态共有 种,其核外电子占据最高能级的电子云轮廓
图的形状为 ,基态镓原子的价层电子排布式为 。
(3) 下列不同状态的C+中,电离最外层一个电子所需能量最高的是 。
a.1s22s22p1 b.1s22s22p2 c.1s22s2 d.1s22s12p1
(4) 原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用- 表示,称为电
子的自旋磁量子数。对于基态的磷原子其价电子自旋磁量子数的代数和为 。
(5) N、O、Mg元素的前3级电离能如下表所示:X、Y、Z中为N元素的是 。
元
素
X 738 1451 7733
Y 1314 3388 5301
Z 1402 2856 4578
(6) 已知X、Y和Z三种元素的原子序数之和等于42。 X元素原子的4p轨道上有3个未成对电子,Y元素
原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物XY,Z元素可以形成负一价离子。已知
2 3
检验微量化合物XY 可以用一种称为马氏检验的方法,其原理是:样品在盐酸中可被金属锌还原为XZ 气
2 3 3
体,产物还有氯化锌和HO,该反应的化学方程式是
2
(要用推导出来的元素表达)。
17.镍﹣镉电池是一种非常理想的直流供电电池。废旧镍﹣镉电池中含有镍、镉、铁及少量钴的低价氧化物
和有机质等。回收利用废旧镍﹣镉电池的一种工艺流程如图所示。
请回答下列问题:
(1)流程中将原料“粉碎”的目的是 。
(2)“氧化”工序发生主要反应的离子方程式为 。
(3)已知:Ni(OH) 的溶度积Ksp=2.0×10-15,“调pH”时溶液中c(Ni2+)=0.02mol·L-1,则常温下应控制pH小于
2
。
(4)滤液1经处理之后可循环至 工序中使用。
(5)CdCO 可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的
3
(填“阳极”或“阴极”)产生纯镉。。
(6)一项研究表明,采用溶剂萃取法可将Cd2+、Co2+、Ni2+从混合溶液中有效分离。如图为不同pH下
DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为 。(7)镍镉蓄电池的工作原理为: 。当飞船运行到地影区时,镍
镉蓄电池为飞船供电,此时在正极电极反应方程式是 ,负极附近溶液的碱性 (填
“增强”“减弱”或“不变”)。
18.硫酸铁和硫酸亚铁均为重要的盐。实验室用废铁屑(含油污)制备 和 溶液,并进行相关探
究。回答下列问题:
Ⅰ.制备0.01 mol∙ 溶液和0.04 mol∙ 溶液。
步骤一:将废铁屑(含油污)依次用热纯碱溶液、蒸馏水清洗后,加入足量 溶液,充分反应后过滤;
步骤二:向滤液中分批加入足量双氧水,充分反应后小心煮沸、冷至室温;
步骤三:标定所得 溶液浓度;
步骤四:配制100 mL 0.01 mol∙ 溶液;
步骤五:取部分标定浓度后的 溶液,经转化后配制100 mL 0.04 mol∙ 溶液。
(1)步骤一中用蒸馏水清洗的目的为 ;步骤二中,双氧水需足量并分批加入的原因为
。
(2)步骤三标定 溶液浓度的操作:准确量取10.00 mL 溶液于锥形瓶中,依次加入适当
过量的 、适量的 ,充分反应后用0.1000 mol∙ 标准溶液滴定,达到滴定终点时消耗标
准溶液的体积为20.00 mL(已知:Sn的常见化合价为+2、+4;该实验条件下 不与 反应)。
向 溶液中加入 反应的离子方程式为 ;加入适量 的作用为 。
①
溶液的物质的量浓度为 。
②
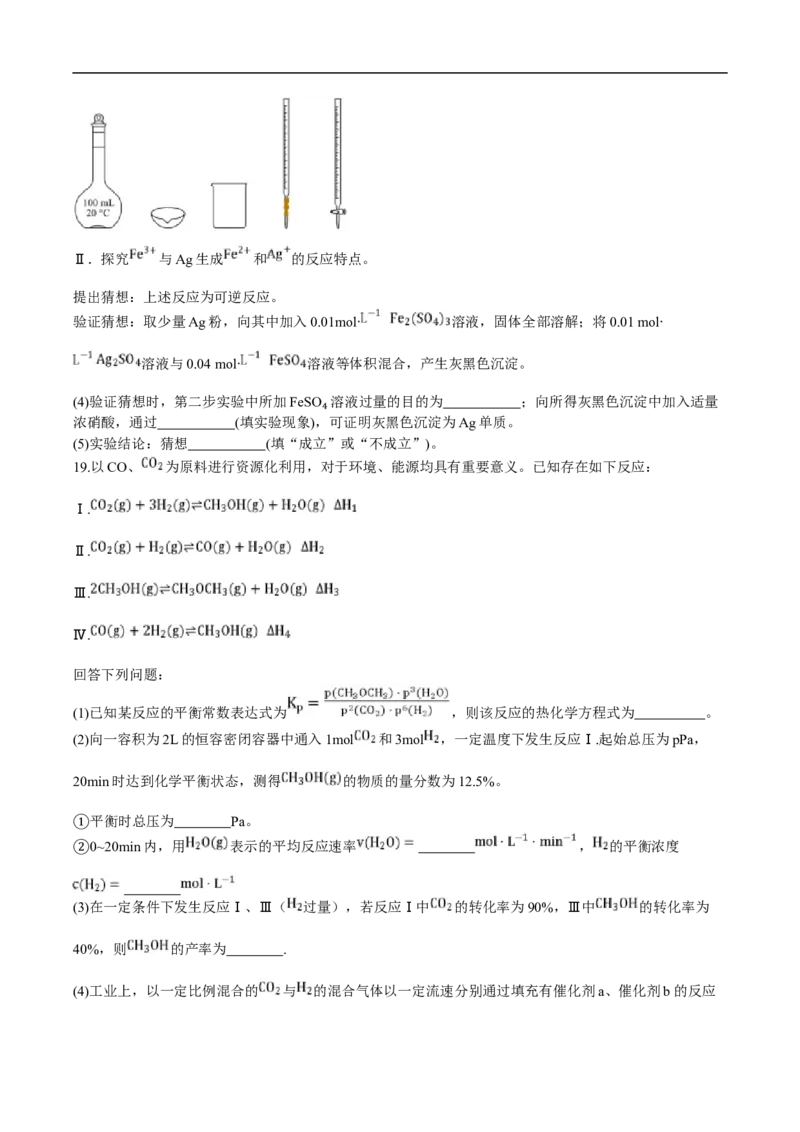
(3)制备0.01 mol∙ 溶液的实验中,如图所示仪器不需要使用的是 (填仪器名称)。Ⅱ.探究 与Ag生成 和 的反应特点。
提出猜想:上述反应为可逆反应。
验证猜想:取少量Ag粉,向其中加入0.01mol∙ 溶液,固体全部溶解;将0.01 mol∙
溶液与0.04 mol∙ 溶液等体积混合,产生灰黑色沉淀。
(4)验证猜想时,第二步实验中所加FeSO 溶液过量的目的为 ;向所得灰黑色沉淀中加入适量
浓硝酸,通过 (填实验现象),可证明灰黑色沉淀为Ag单质。
₄
(5)实验结论:猜想 (填“成立”或“不成立”)。
19.以CO、 为原料进行资源化利用,对于环境、能源均具有重要意义。已知存在如下反应:
Ⅰ.
Ⅱ.
Ⅲ.
Ⅳ.
回答下列问题:
(1)已知某反应的平衡常数表达式为 ,则该反应的热化学方程式为 。
(2)向一容积为2L的恒容密闭容器中通入1mol 和3mol ,一定温度下发生反应Ⅰ.起始总压为pPa,
20min时达到化学平衡状态,测得 的物质的量分数为12.5%。
平衡时总压为 Pa。
0~20min内,用 表示的平均反应速率 , 的平衡浓度
①
②
(3)在一定条件下发生反应Ⅰ、Ⅲ( 过量),若反应Ⅰ中 的转化率为90%,Ⅲ中 的转化率为
40%,则 的产率为 .
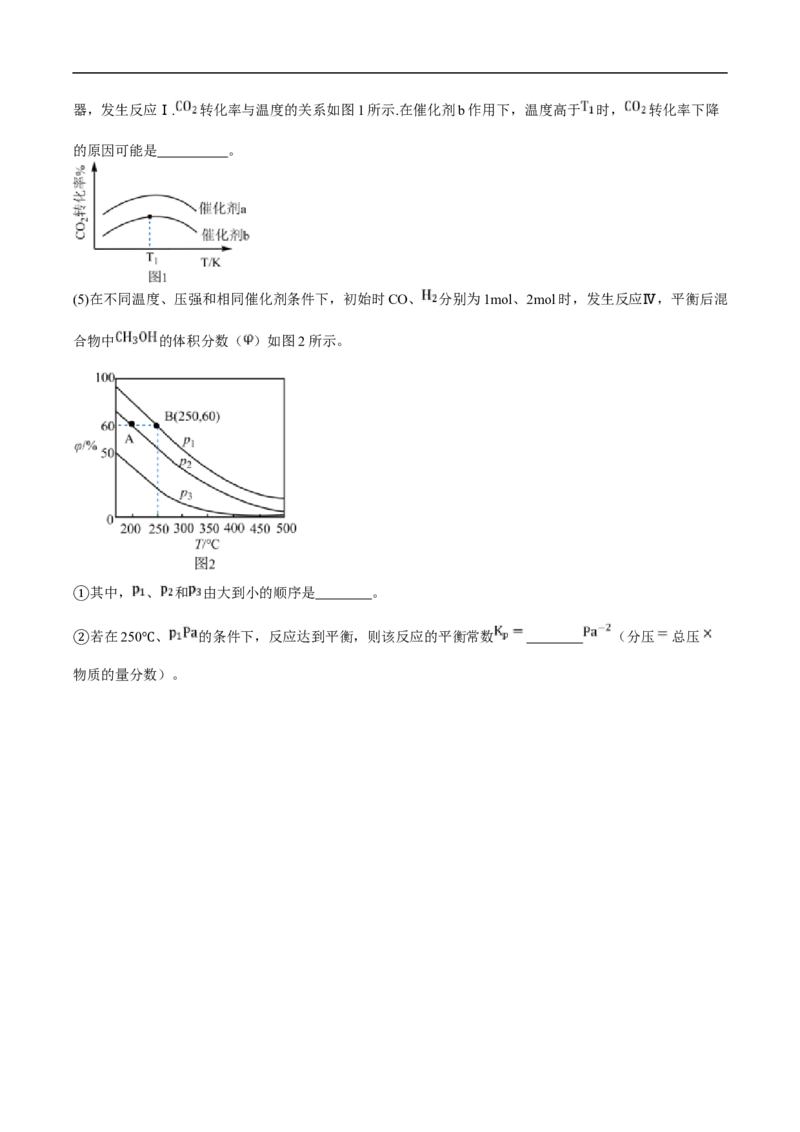
(4)工业上,以一定比例混合的 与 的混合气体以一定流速分别通过填充有催化剂a、催化剂b的反应器,发生反应Ⅰ. 转化率与温度的关系如图1所示.在催化剂b作用下,温度高于 时, 转化率下降
的原因可能是 。
(5)在不同温度、压强和相同催化剂条件下,初始时CO、 分别为1mol、2mol时,发生反应Ⅳ,平衡后混
合物中 的体积分数( )如图2所示。
其中, 、 和 由大到小的顺序是 。
①
若在250 、 的条件下,反应达到平衡,则该反应的平衡常数 (分压 总压
② ℃
物质的量分数)。