文档内容
丰城中学 2024-2025 学年上学期高三创新班段考试卷
化 学
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5 Cu 64 As 75 Ni 59
一.单项选择题(本大题共14小题,每题3分,共42分)
1.化学与社会生活密切相关。下列有关说法错误的是( )
A.菏泽特产牡丹籽油属于高分子化合物 B.燃煤中加入CaO可以减少酸雨的形成
C.亚硝酸钠可用于一些肉制品的加工,发挥防腐作用
D.雾中汽车大灯前明亮的光路与肢体的丁达尔效应有关
2.物质的结构决定物质的性质,下列性质差异与结构因素匹配正确的是( )
性质差异 结构因素
A 溶解度(20℃):NaCO(29g)大于NaHCO (9g) 阴离子电荷数
2 3 3
B 酸性:CHCOOH>C HOH 羟基的极性
3 2 5
C 键角:CH( )大于NH ( ) 中心原子的杂化方式
4 3
D 熔点: 低于 晶体类型
3.下列有关物质的除杂(括号里为杂质),所选试剂和方法都不正确的是( )
A. 固体 (NaHCO ):在试管中用酒精灯加热
3
B.N(O ):将混合气体通过灼热的铜网,再收集起来
2 2
C.Cl(HCl):将混合气体通入 溶液的试剂瓶,再通过碱石灰的干燥管
2
D.Fe O(Al):将混合物加入足量的 溶液中,再过滤,洗涤,干燥
2 3
4.下列实验方案能达到探究目的的是( )
选
实验方案 探究目的
项
A 向2mL5%H O 溶液中滴加几滴FeSO 溶液,观察气泡产生情况 Fe2+能否催化HO 分解
2 2 4 2 2
B 用铂丝蘸取某溶液进行焰色试验,观察火焰颜色 溶液中是否存在钠盐
向某溶液中加入氢氧化钠溶液并加热
C 溶液中是否存在NH +
4
观察产生的气体能否使蓝色石蕊试纸变色
D 向盛有SO 水溶液的试管中滴加石蕊,观察颜色变化 SO 水溶液是否具有酸性
2 2
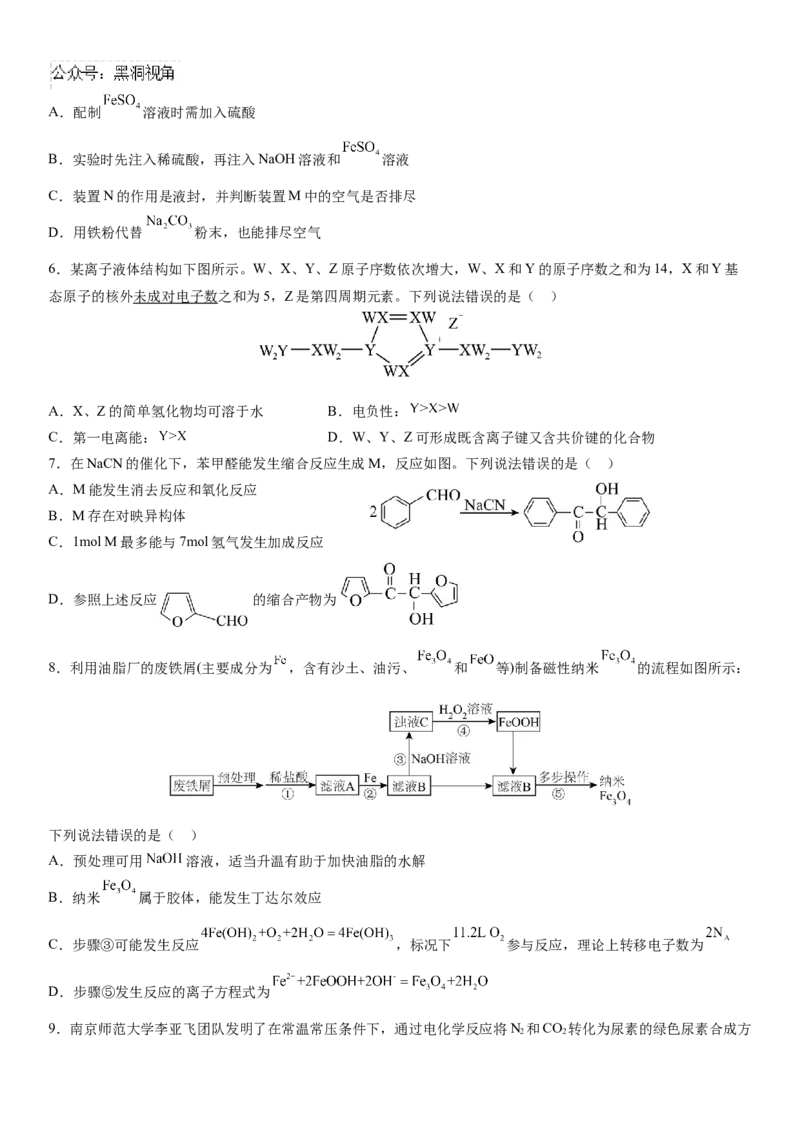
5.一种制备 的改进装置如图所示,下列说法错误的是( )A.配制 溶液时需加入硫酸
B.实验时先注入稀硫酸,再注入NaOH溶液和 溶液
C.装置N的作用是液封,并判断装置M中的空气是否排尽
D.用铁粉代替 粉末,也能排尽空气
6.某离子液体结构如下图所示。W、X、Y、Z原子序数依次增大,W、X和Y的原子序数之和为14,X和Y基
态原子的核外未成对电子数之和为5,Z是第四周期元素。下列说法错误的是( )
A.X、Z的简单氢化物均可溶于水 B.电负性:
C.第一电离能: D.W、Y、Z可形成既含离子键又含共价键的化合物
7.在NaCN的催化下,苯甲醛能发生缩合反应生成M,反应如图。下列说法错误的是( )
A.M能发生消去反应和氧化反应
B.M存在对映异构体
C.1mol M最多能与7mol氢气发生加成反应
D.参照上述反应 的缩合产物为
8.利用油脂厂的废铁屑(主要成分为 ,含有沙土、油污、 和 等)制备磁性纳米 的流程如图所示:
下列说法错误的是( )
A.预处理可用 溶液,适当升温有助于加快油脂的水解
B.纳米 属于胶体,能发生丁达尔效应
C.步骤③可能发生反应 ,标况下 参与反应,理论上转移电子数为
D.步骤⑤发生反应的离子方程式为
9.南京师范大学李亚飞团队发明了在常温常压条件下,通过电化学反应将N 和CO 转化为尿素的绿色尿素合成方
2 2法,反应途径如图所示(图中MB 为二维金属硼化物,M=Mo、Ti、Cr等过渡金属,*代表吸附)。
2 2
下列说法错误的是( )
A.MB 是该反应过程的催化剂 B.反应②的产物*COOH中碳元素的化合价为+4
2 2
C.该过程中有极性键和非极性键的断裂
D.该过程的总反应式为CO+N +6e-+6H+=NHCONH +H O
2 2 2 2 2
10.实验室用以下装置(夹持和水浴加热装置略)制备环己酮缩乙二醇。
实验中利用苯—水的共沸体系带出水分,其反应原理:
下列有关说法错误的是( )
A.以共沸体系带水促使反应正向进行
B.当观察到分水器中苯层液面高于支管口时,必须打开旋塞B将水放出
C.管口A是冷凝水的进水口
D.根据带出水的体积可估算反应进度
11.驱肠虫剂山道年(a)可重排为稳变山道年(b)。
b可发生开环聚合。下列说法错误的是( )
A.a和b互为同分异构体
B.1mola最多可与3mol 发生加成反应
C.类比上述反应, 的重排产物 为
D.b发生开环聚合后的产物为
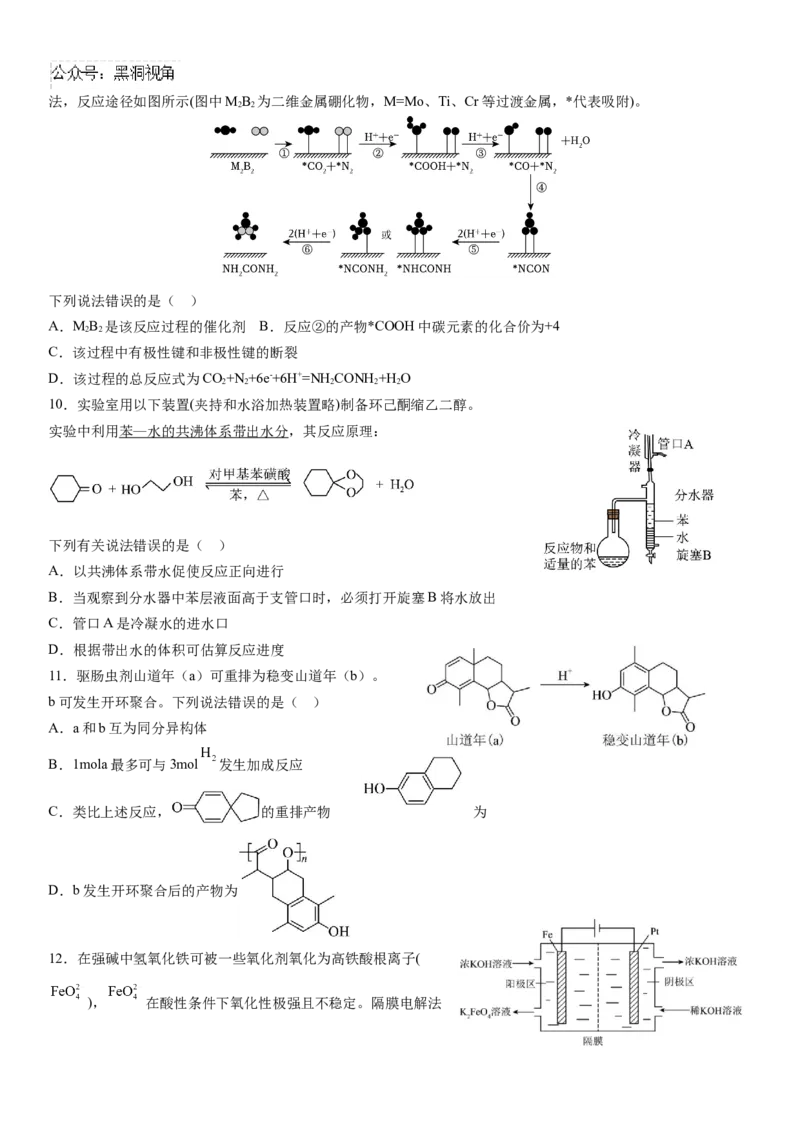
12.在强碱中氢氧化铁可被一些氧化剂氧化为高铁酸根离子(
), 在酸性条件下氧化性极强且不稳定。隔膜电解法制备 的工作原理如图所示。下列说法错误的是( )
A.隔膜为阳离子交换膜 B.由于阴极区产KOH,故电解过程中不需要额外补充
C.Fe电极上的反应为
D.电路中每转移 ,Pt电极上理论上产生2.24L气体(标准状况)
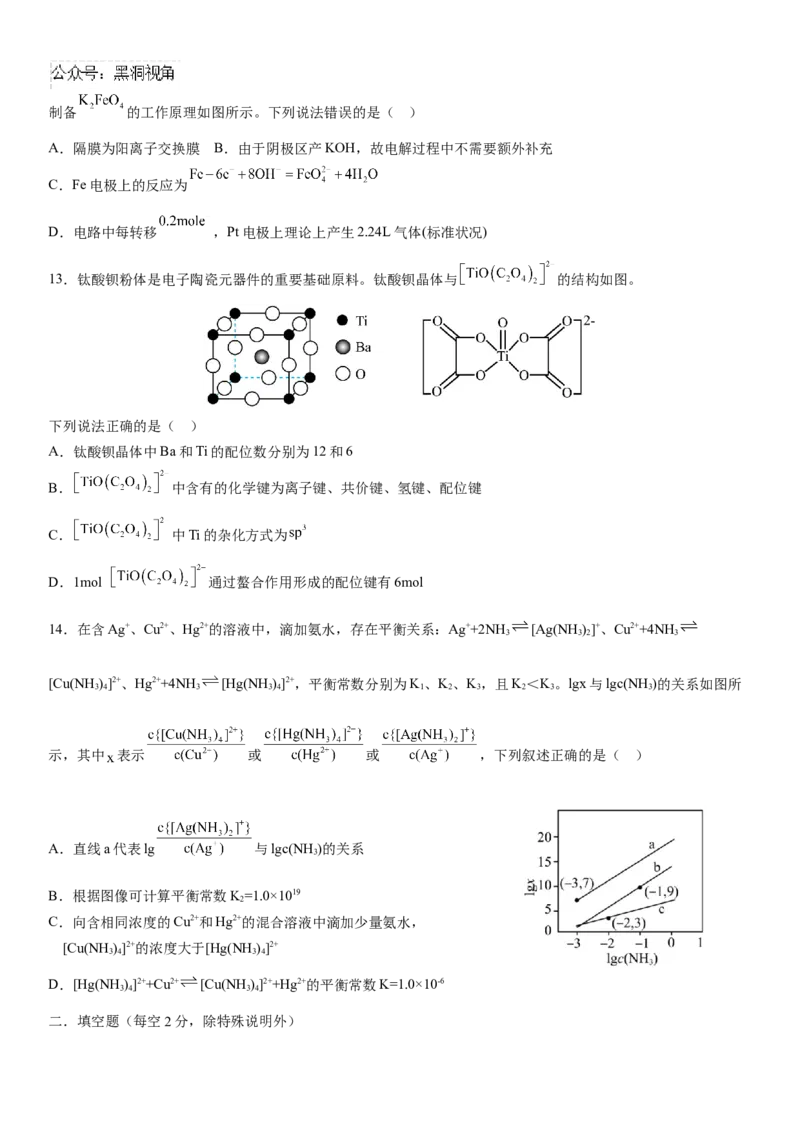
13.钛酸钡粉体是电子陶瓷元器件的重要基础原料。钛酸钡晶体与 的结构如图。
下列说法正确的是( )
A.钛酸钡晶体中Ba和Ti的配位数分别为12和6
B. 中含有的化学键为离子键、共价键、氢键、配位键
C. 中Ti的杂化方式为
D.1mol 通过螯合作用形成的配位键有6mol
14.在含Ag+、Cu2+、Hg2+的溶液中,滴加氨水,存在平衡关系:Ag++2NH [Ag(NH)]+、Cu2++4NH
3 3 2 3
[Cu(NH )]2+、Hg2++4NH [Hg(NH)]2+,平衡常数分别为K、K、K,且K<K。lgx与lgc(NH)的关系如图所
3 4 3 3 4 1 2 3 2 3 3
示,其中 表示 或 或 ,下列叙述正确的是( )
A.直线a代表lg 与lgc(NH)的关系
3
B.根据图像可计算平衡常数K=1.0×1019
2
C.向含相同浓度的Cu2+和Hg2+的混合溶液中滴加少量氨水,
[Cu(NH )]2+的浓度大于[Hg(NH)]2+
3 4 3 4
D.[Hg(NH)]2++Cu2+ [Cu(NH )]2++Hg2+的平衡常数K=1.0×10-6
3 4 3 4
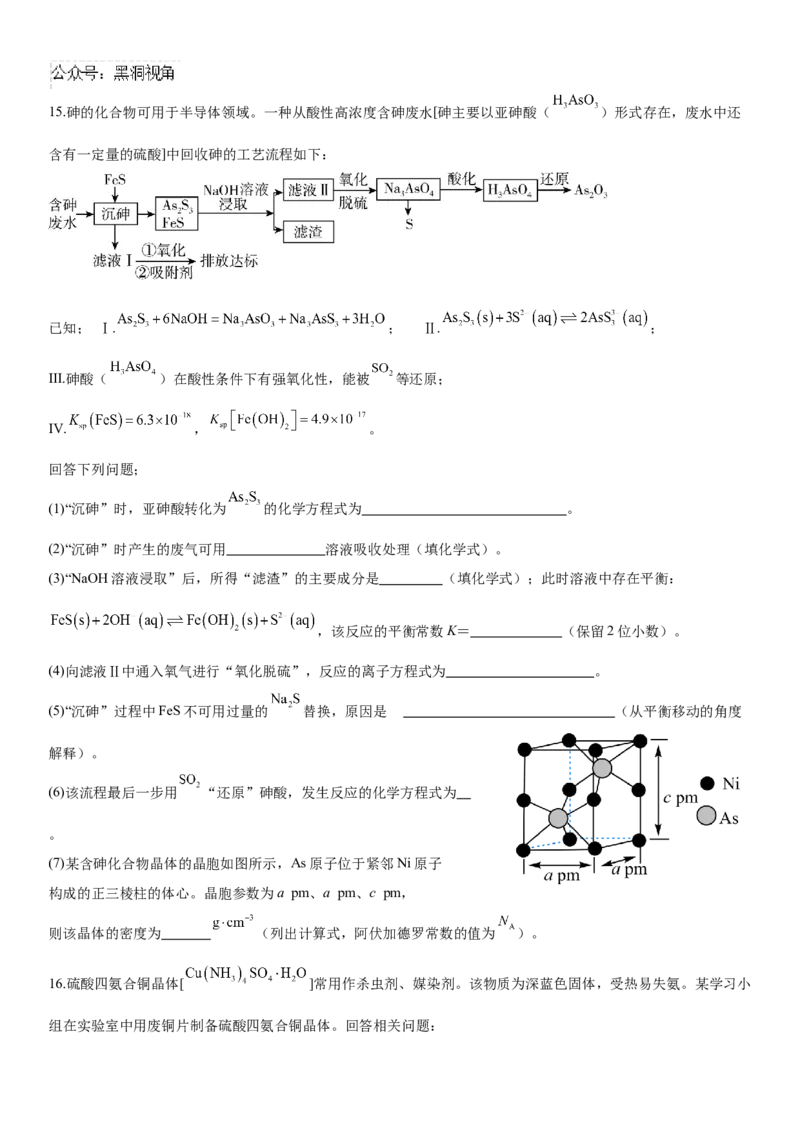
二.填空题(每空2分,除特殊说明外)15.砷的化合物可用于半导体领域。一种从酸性高浓度含砷废水[砷主要以亚砷酸( )形式存在,废水中还
含有一定量的硫酸]中回收砷的工艺流程如下:
已知; Ⅰ. ; Ⅱ. ;
Ⅲ.砷酸( )在酸性条件下有强氧化性,能被 等还原;
Ⅳ. , 。
回答下列问题;
(1)“沉砷”时,亚砷酸转化为 的化学方程式为 。
(2)“沉砷”时产生的废气可用 溶液吸收处理(填化学式)。
(3)“NaOH溶液浸取”后,所得“滤渣”的主要成分是 (填化学式);此时溶液中存在平衡:
,该反应的平衡常数K= (保留2位小数)。
(4)向滤液Ⅱ中通入氧气进行“氧化脱硫”,反应的离子方程式为 。
(5)“沉砷”过程中FeS不可用过量的 替换,原因是 (从平衡移动的角度
解释)。
(6)该流程最后一步用 “还原”砷酸,发生反应的化学方程式为
。
(7)某含砷化合物晶体的晶胞如图所示,As原子位于紧邻Ni原子
构成的正三棱柱的体心。晶胞参数为a pm、a pm、c pm,
则该晶体的密度为 (列出计算式,阿伏加德罗常数的值为 )。
16.硫酸四氨合铜晶体[ ]常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨。某学习小
组在实验室中用废铜片制备硫酸四氨合铜晶体。回答相关问题:Ⅰ.制备 溶液将废铜片在20%的 溶液中加热煮沸,冷却后,取出铜片,用蒸馏水洗涤,然后将铜片置
于适量稀硫酸中,边加热边在铜片表面通入 ,直到铜片完全溶解。
(1) 溶液的作用是 。
(2)若将铜片先在空气中灼烧,使其氧化生成CuO,再溶解在稀硫酸中,产率会降低的原因是: 。
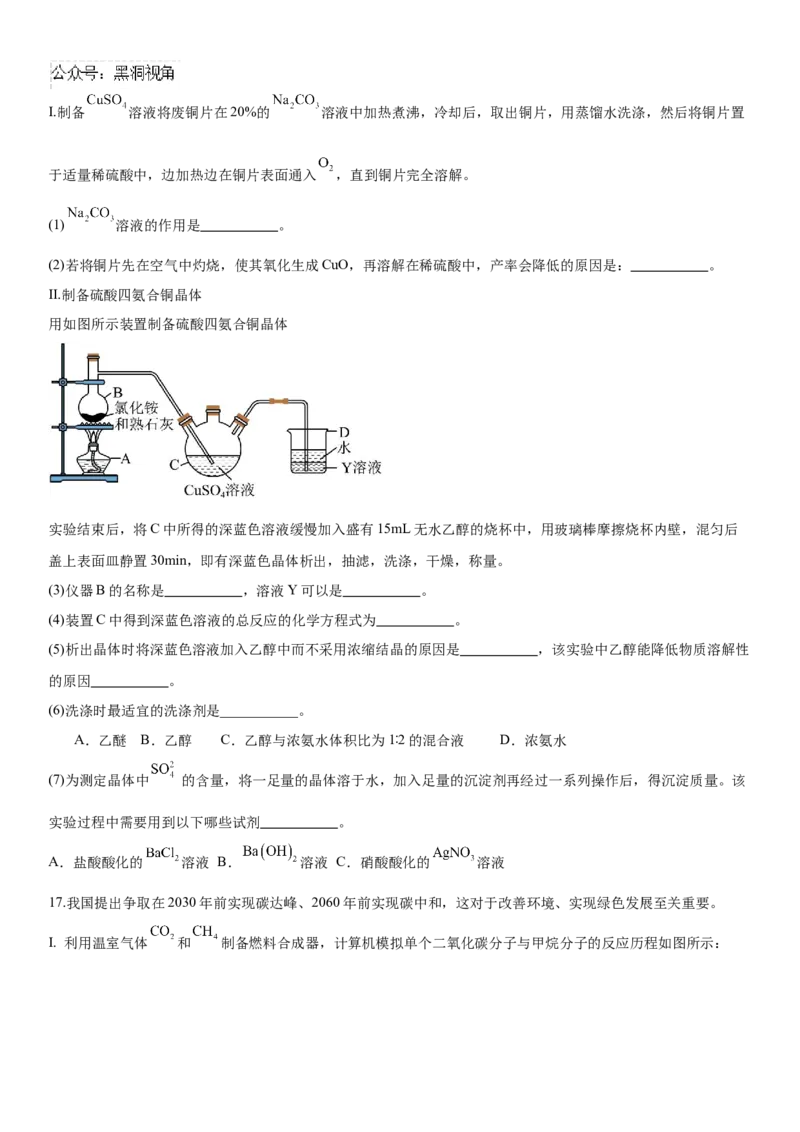
Ⅱ.制备硫酸四氨合铜晶体
用如图所示装置制备硫酸四氨合铜晶体
实验结束后,将C中所得的深蓝色溶液缓慢加入盛有15mL无水乙醇的烧杯中,用玻璃棒摩擦烧杯内壁,混匀后
盖上表面皿静置30min,即有深蓝色晶体析出,抽滤,洗涤,干燥,称量。
(3)仪器B的名称是 ,溶液Y可以是 。
(4)装置C中得到深蓝色溶液的总反应的化学方程式为 。
(5)析出晶体时将深蓝色溶液加入乙醇中而不采用浓缩结晶的原因是 ,该实验中乙醇能降低物质溶解性
的原因 。
(6)洗涤时最适宜的洗涤剂是___________。
A.乙醚 B.乙醇 C.乙醇与浓氨水体积比为1∶2的混合液 D.浓氨水
(7)为测定晶体中 的含量,将一足量的晶体溶于水,加入足量的沉淀剂再经过一系列操作后,得沉淀质量。该
实验过程中需要用到以下哪些试剂 。
A.盐酸酸化的 溶液 B. 溶液 C.硝酸酸化的 溶液
17.我国提出争取在2030年前实现碳达峰、2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。
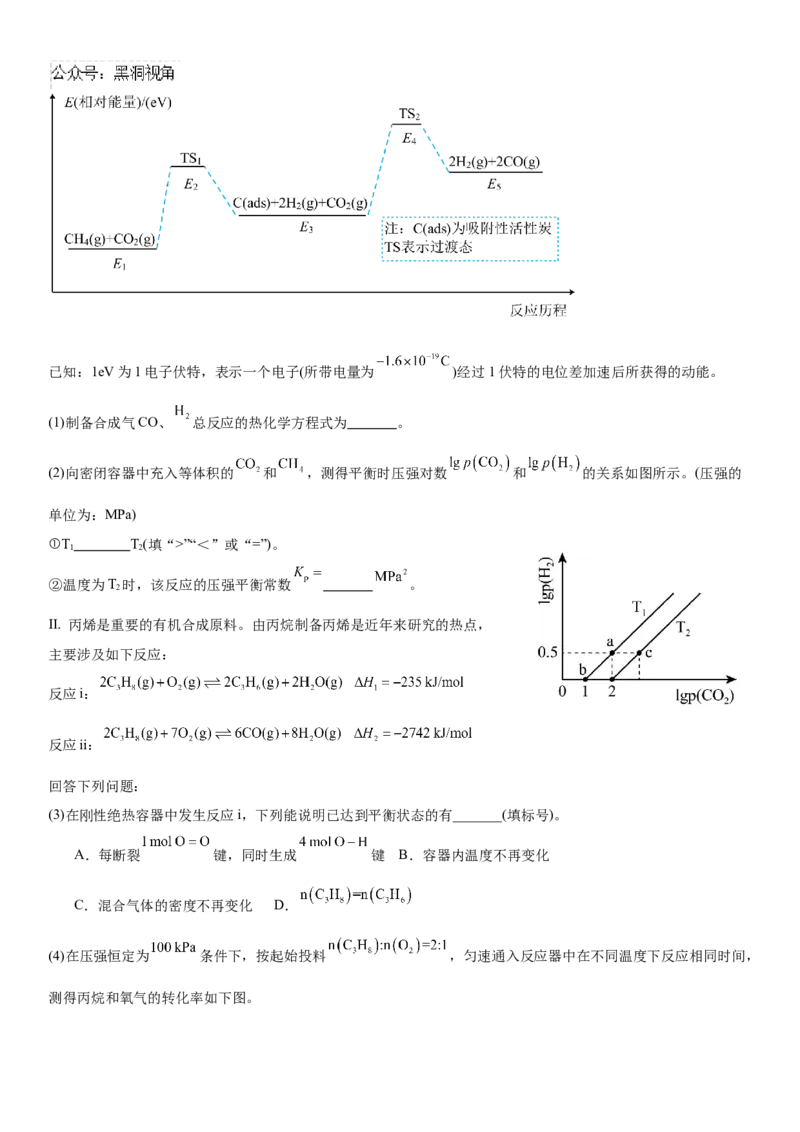
Ⅰ. 利用温室气体 和 制备燃料合成器,计算机模拟单个二氧化碳分子与甲烷分子的反应历程如图所示:已知:1eV为1电子伏特,表示一个电子(所带电量为 )经过1伏特的电位差加速后所获得的动能。
(1)制备合成气CO、 总反应的热化学方程式为 。
(2)向密闭容器中充入等体积的 和 ,测得平衡时压强对数 和 的关系如图所示。(压强的
单位为:MPa)
①T T(填“>”“<”或“=”)。
1 2
②温度为T 时,该反应的压强平衡常数 。
2
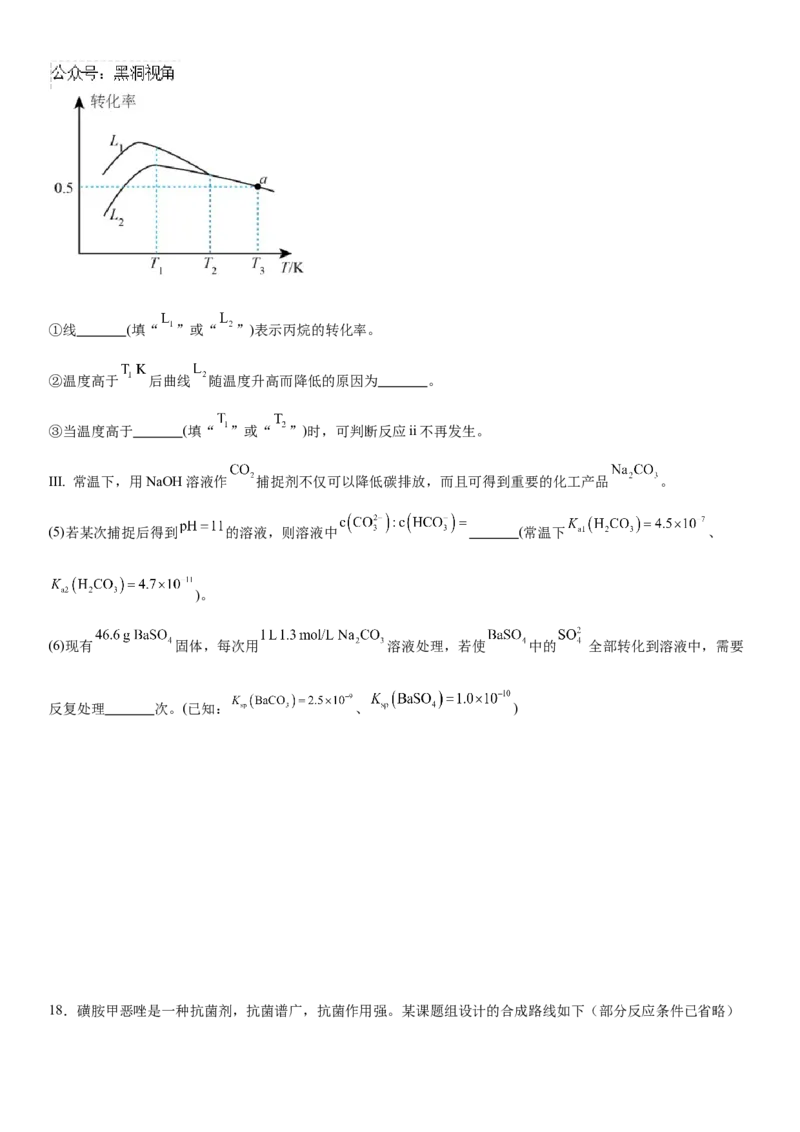
Ⅱ. 丙烯是重要的有机合成原料。由丙烷制备丙烯是近年来研究的热点,
主要涉及如下反应:
反应i:
反应ii:
回答下列问题:
(3)在刚性绝热容器中发生反应i,下列能说明已达到平衡状态的有_______(填标号)。
A.每断裂 键,同时生成 键 B.容器内温度不再变化
C.混合气体的密度不再变化 D.
(4)在压强恒定为 条件下,按起始投料 ,匀速通入反应器中在不同温度下反应相同时间,
测得丙烷和氧气的转化率如下图。①线 (填“ ”或“ ”)表示丙烷的转化率。
②温度高于 后曲线 随温度升高而降低的原因为 。
③当温度高于 (填“ ”或“ ”)时,可判断反应ii不再发生。
Ⅲ. 常温下,用NaOH溶液作 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品 。
(5)若某次捕捉后得到 的溶液,则溶液中 (常温下 、
)。
(6)现有 固体,每次用 溶液处理,若使 中的 全部转化到溶液中,需要
反复处理 次。(已知: 、 )
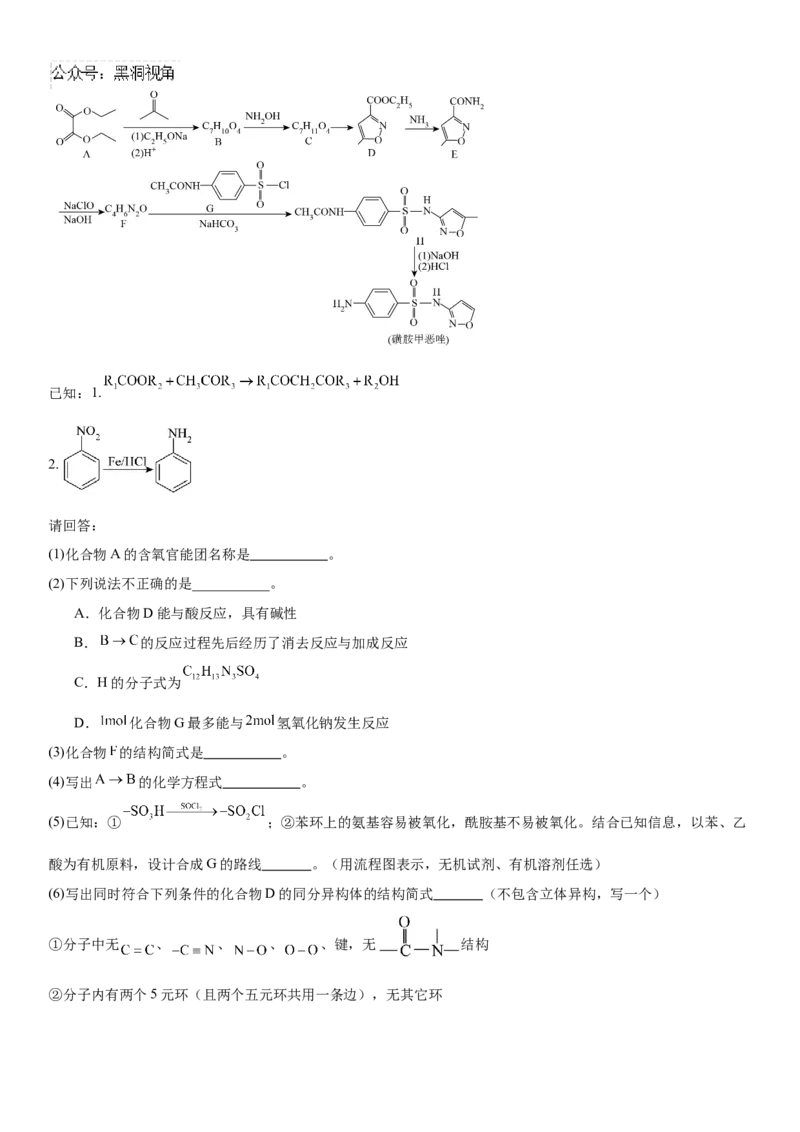
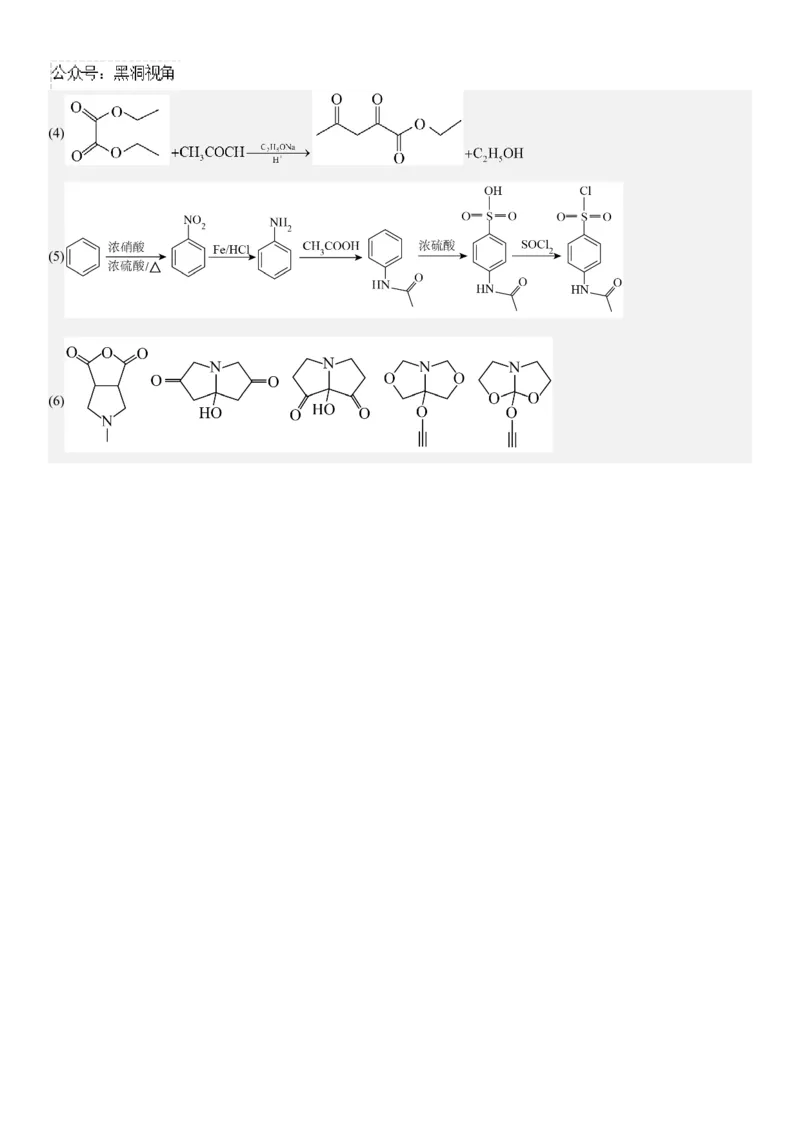
18.磺胺甲恶唑是一种抗菌剂,抗菌谱广,抗菌作用强。某课题组设计的合成路线如下(部分反应条件已省略)已知:1.
2.
请回答:
(1)化合物A的含氧官能团名称是 。
(2)下列说法不正确的是___________。
A.化合物D能与酸反应,具有碱性
B. 的反应过程先后经历了消去反应与加成反应
C.H的分子式为
D. 化合物G最多能与 氢氧化钠发生反应
(3)化合物 的结构简式是 。
(4)写出 的化学方程式 。
(5)已知:① ;②苯环上的氨基容易被氧化,酰胺基不易被氧化。结合已知信息,以苯、乙
酸为有机原料,设计合成G的路线 。(用流程图表示,无机试剂、有机溶剂任选)
(6)写出同时符合下列条件的化合物D的同分异构体的结构简式 (不包含立体异构,写一个)
①分子中无 、 、 、 、键,无 结构
②分子内有两个5元环(且两个五元环共用一条边),无其它环③ 谱表明:分子中共有3种不同化学环境的氢原子
高三创新班段考化学参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14
A B C D D A A B B B D D A D
15【答案】(1) (2) (或NaOH等)1分
(3) FeS 1分 0.13(4)
(5)由于 ,加入过量的 ,溶液中 增大,平衡正向移动,不利于沉砷
(6) (7)
16【答案】(1)除去废铜片表面的油污1分(2)铜片表面形成的氧化膜阻碍了内部的铜进一步氧化
(3) 蒸馏烧瓶 1分 1分等
(4) 或
(5) 硫酸四氨合铜晶体受热易失氨 乙醇能降低溶剂的极性 (6)C 1分 (7)A 1分
17【答案】(1)CO (g)+CH (g)=2CO(g)+2H(g) △H=+(E -E ) N eV/mol(2) > 0.01
2 4 2 5 1 A
(3)B(4) 两个反应均为放热反应,温度升高,化学平衡逆向移动,导致丙烷转化率降低
(5)4.7:1(6)4
18【答案】(1)酯基1分(2)BD(3)(4)
(5)
(6)