文档内容
黑龙江省大庆铁人中学2025-2026学年高二上学期期末考试
化学试题
2026.01
注意事项:
1.答题前,考生先将自己的姓名、班级、考场号/座位号填写在答题卡上,如有条形码,认
真核对条形码上的姓名、准考证号,并将条形码粘贴在答题卡的指定位置上。
2.选择题答案使用2B铅笔填涂,如需改动,用橡皮擦干净后,再选涂其它答案的标号;非
选择题答案使用0.5毫米黑色中性(签字)笔或碳素笔书写,字体工整,笔迹清楚。
3.请按照题号在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效。
4.保持卷面及答题卡清洁,不折叠,不破损,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 K-39 Cr-52 Cu-64
一、选择题(本题共15小题,每小题3分,共45分,在每小题给出的四个选项中,只有一项符
合题目要求。)
1.下列属于极性分子的是
A.HCl B.N C.He D.CH
2 4
2.下列分子或离子的VSEPR模型与其空间结构不一致的是
A. B.CO C.O D.N
NH+ 3
4
3.化学与生产、生活密切相关,下列说法不正确的是
A.氮气可以用作食品保护气与氮氮三键的键能有关
B.可用红外光谱仪鉴别真宝石和玻璃仿造的假宝石
C.LED灯发光与原子核外电子跃迁释放能量有关
D.人体细胞和细胞器的双分子膜体现了超分子的自组装特性
4.下列化学用语表示或说法正确的是
A.用电子云轮廓图表示H-Cl的s-p σ键的形成:
B.用电子式表示CaCl 的形成过程:
2
C.基态原子轨道表示式: 违背了泡利原理
D.Ga的基态原子简化电子排布式:[Ar]4s24p1
5.类比是学习化学的重要方法。下列类比正确的是
A.由单质熔点Cl2< Br2 < I2,类比推理:熔点Li< Na < K
B.由SiCl 是非极性分子,类比推理:SF 是非极性分子
4 4
C.由BF 空间结构为平面三角形,类比推理:NF 空间结构为平面三角形
3 3
D.由酸性CFCOOH > CCl COOH,类比推理:酸性ClCH COOH > BrCHCOOH
3 3 2 2
大庆铁人中学2024级高二年级上学期期末化学试题 第 1 页 共 9 页6.下列有关物质结构与性质说法错误的是
A.“电子气理论”用于描述金属键本质,可用于解释金属晶体的延展性、导电性和导热性
B.二氧化碳晶胞中CO 分子的排列有4种不同的取向
2
C.由于臭氧的极性微弱,它在CCl 中的溶解度高于在水中溶解度
4
D.液晶具有液体的流动性,不能表现出类似晶体的各向异性
7.下表列出了某短周期元素R的各级电离能数据(用I、I……表示)。
1 2
电离能//kJ·mol-1
元素
I I I I ……
1 2 3 4
R 740 1500 7700 10500 ……
关于元素R的下列推断中,错误的是
A.R元素位于元素周期表中第ⅡA族 B.R元素基态原子的电子排布式为1s22s2
C.R元素的最高正化合价为+2价 D.R元素的第一电离能高于同周期相邻元素的
8.物质性质与组成元素的性质有关,下列对物质性质差异解释错误的是
性质差异 主要原因
A 沸点:HO > HS 电离能:O > S
2 2
B 酸性:HClO > HBrO 电负性:Cl > Br
C 硬度:金刚石>晶体硅 原子半径:Si > C
D 熔点:MgO > NaF 离子电荷:Mg2+ > Na+,O2− > F
9.从微观视角探析物质结构及性质是学习化学的有效方法。下列解释与实例不符的是
实例 解释
A 原子光谱是不连续的线状谱线 原子的能级是量子化的
B 王水能溶解金、铂等金属 浓盐酸增强了浓硝酸的酸性
CsCl晶体中Cs+与8个Cl-配位,而NaCl晶体中
C Cs+比Na+的半径大
Na+与6个Cl-配位
D 逐个断开CH 中的C-H键,每步所需能量不同 各步中的C-H键所处化学环境不同
4
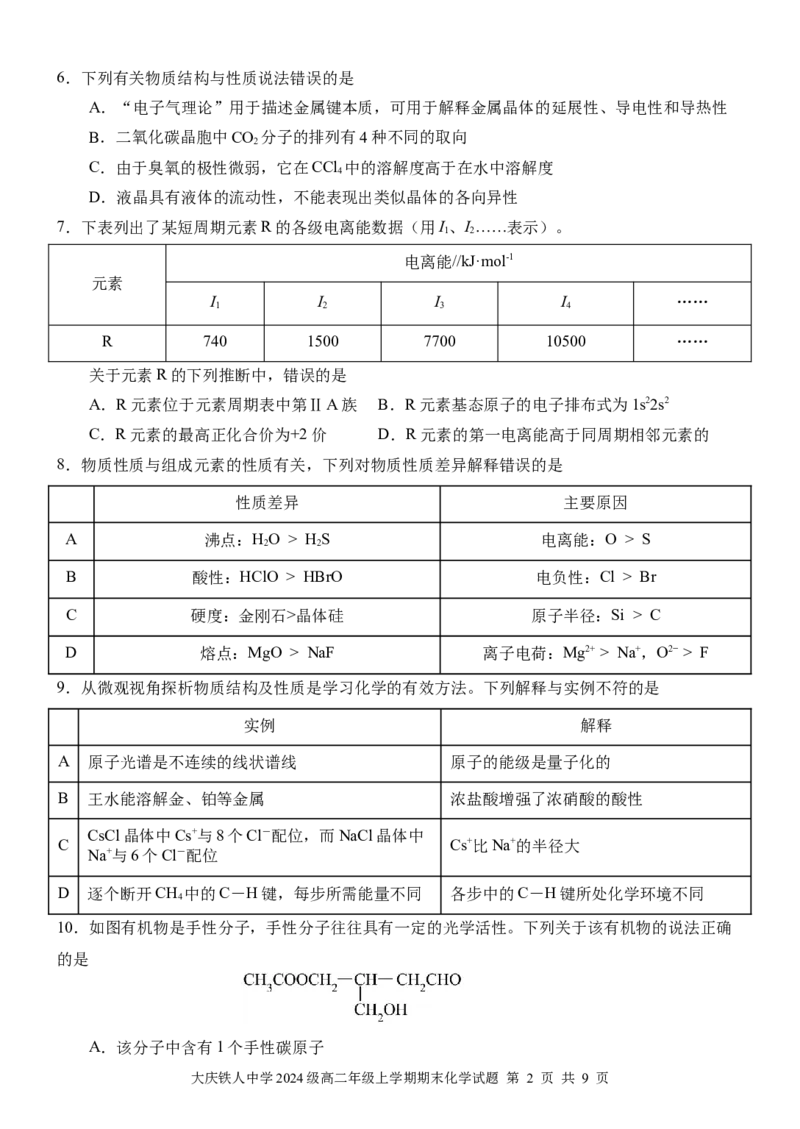
10.如图有机物是手性分子,手性分子往往具有一定的光学活性。下列关于该有机物的说法正确
的是
A.该分子中含有1个手性碳原子
大庆铁人中学2024级高二年级上学期期末化学试题 第 2 页 共 9 页B.该分子中有6个碳原子采用sp3杂化
C.该分子中碳原子的杂化类型有3种
D.该有机物与乙酸发生酯化反应的有机产物也是手性分子
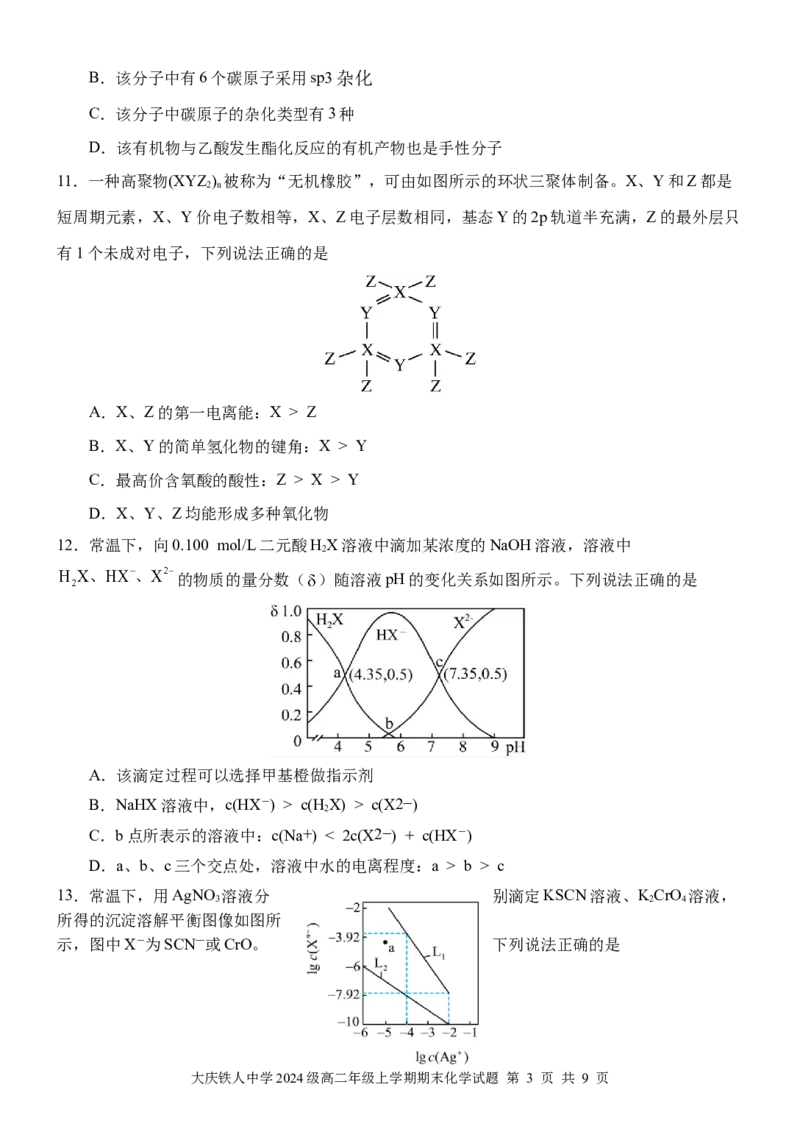
11.一种高聚物(XYZ ) 被称为“无机橡胶”,可由如图所示的环状三聚体制备。X、Y和Z都是
2 n
短周期元素,X、Y价电子数相等,X、Z电子层数相同,基态Y的2p轨道半充满,Z的最外层只
有1个未成对电子,下列说法正确的是
A.X、Z的第一电离能:X > Z
B.X、Y的简单氢化物的键角:X > Y
C.最高价含氧酸的酸性:Z > X > Y
D.X、Y、Z均能形成多种氧化物
12.常温下,向0.100 mol/L二元酸HX溶液中滴加某浓度的NaOH溶液,溶液中
2
的物质的量分数( )随溶液pH的变化关系如图所示。下列说法正确的是
A.该滴定过程可以选择甲基橙做指示剂
B.NaHX溶液中,c(HX-) > c(HX) > c(X2−)
2
C.b点所表示的溶液中:c(Na+) < 2c(X2−) + c(HX-)
D.a、b、c三个交点处,溶液中水的电离程度:a > b > c
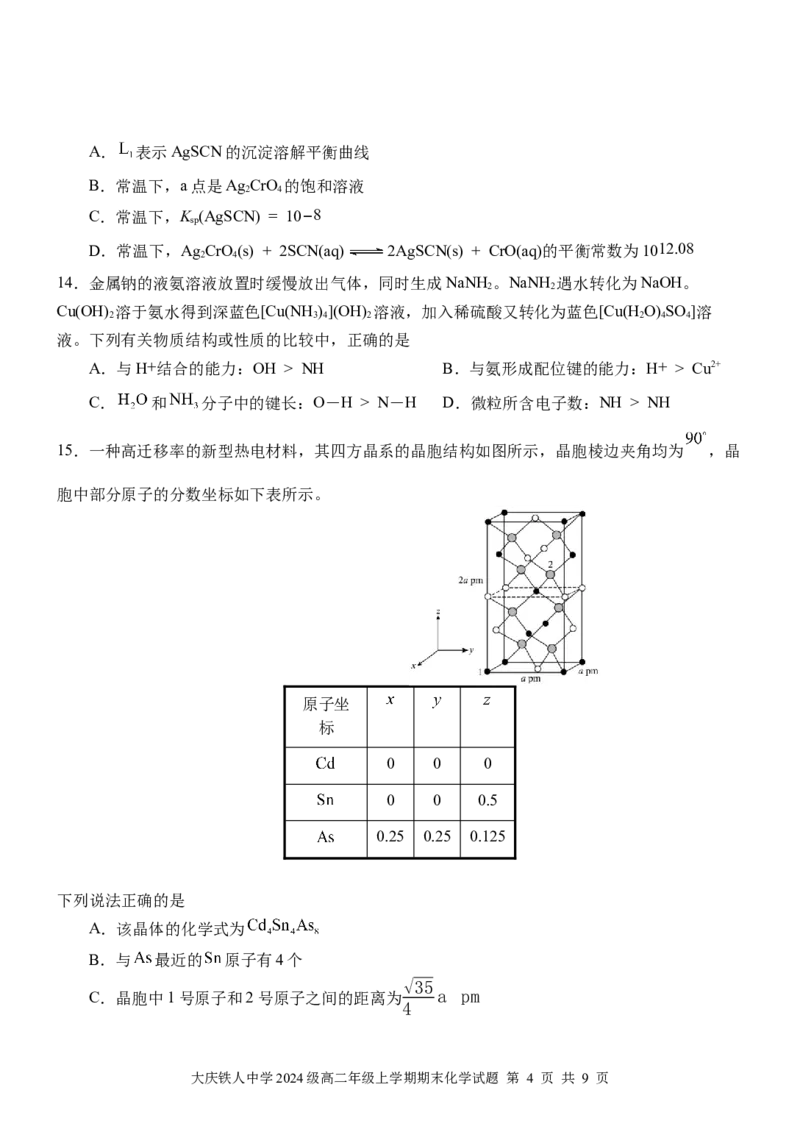
13.常温下,用AgNO 溶液分 别滴定KSCN溶液、KCrO 溶液,
3 2 4
所得的沉淀溶解平衡图像如图所
示,图中X-为SCN—或CrO。 下列说法正确的是
大庆铁人中学2024级高二年级上学期期末化学试题 第 3 页 共 9 页A. 表示AgSCN的沉淀溶解平衡曲线
B.常温下,a点是Ag CrO 的饱和溶液
2 4
C.常温下,K (AgSCN) = 10−8
sp
D.常温下,Ag CrO(s) + 2SCN(aq) 2AgSCN(s) + CrO(aq)的平衡常数为1012.08
2 4
14.金属钠的液氨溶液放置时缓慢放出气体,同时生成NaNH 。NaNH 遇水转化为NaOH。
2 2
Cu(OH) 溶于氨水得到深蓝色[Cu(NH )](OH) 溶液,加入稀硫酸又转化为蓝色[Cu(H O)SO ]溶
2 3 4 2 2 4 4
液。下列有关物质结构或性质的比较中,正确的是
A.与H+结合的能力:OH > NH B.与氨形成配位键的能力:H+ > Cu2+
C. 和 分子中的键长:O-H > N-H D.微粒所含电子数:NH > NH
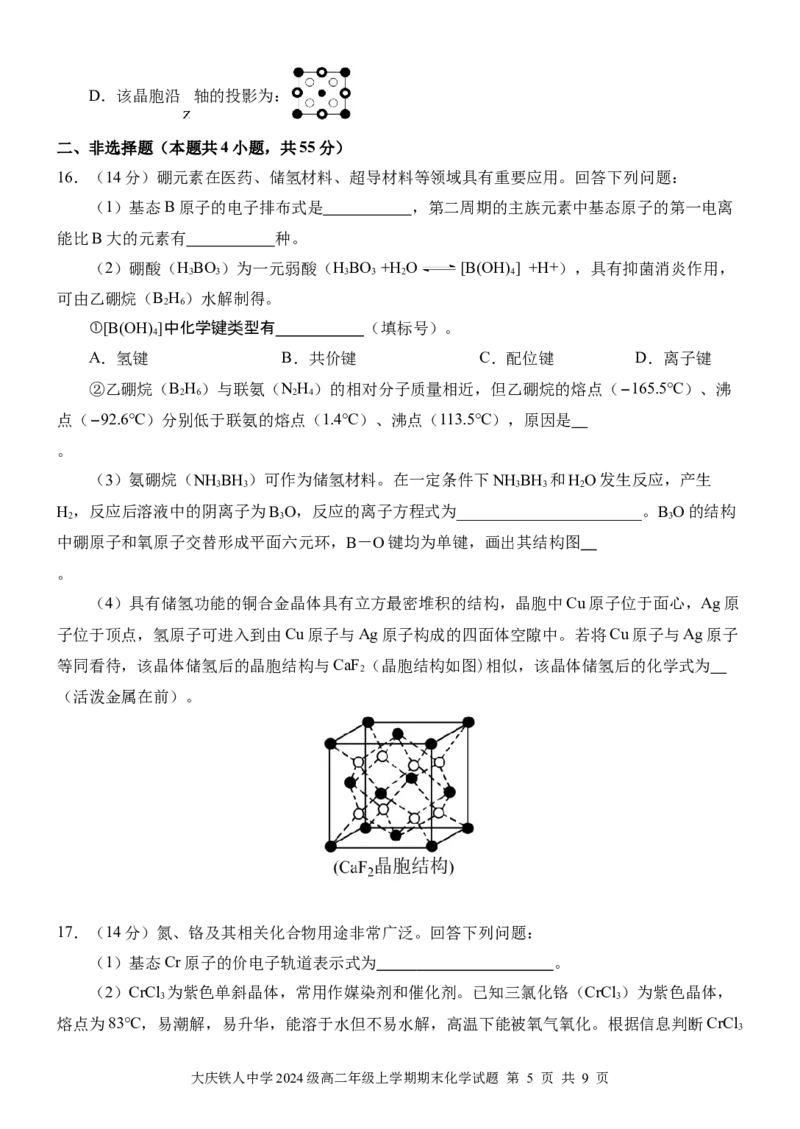
15.一种高迁移率的新型热电材料,其四方晶系的晶胞结构如图所示,晶胞棱边夹角均为 ,晶
胞中部分原子的分数坐标如下表所示。
原子坐
标
0 0 0
0 0 0.5
0.25 0.25 0.125
下列说法正确的是
A.该晶体的化学式为
B.与 最近的 原子有4个
√35
C.晶胞中1号原子和2号原子之间的距离为 a pm
4
大庆铁人中学2024级高二年级上学期期末化学试题 第 4 页 共 9 页D.该晶胞沿 轴的投影为:
二、非选择题(本题共4小题,共55分)
16.(14分)硼元素在医药、储氢材料、超导材料等领域具有重要应用。回答下列问题:
(1)基态B原子的电子排布式是 ,第二周期的主族元素中基态原子的第一电离
能比B大的元素有 种。
(2)硼酸(HBO)为一元弱酸(HBO +HO [B(OH) ] +H+),具有抑菌消炎作用,
3 3 3 3 2 4
可由乙硼烷(B H)水解制得。
2 6
①[B(OH) ]中化学键类型有 (填标号)。
4
A.氢键 B.共价键 C.配位键 D.离子键
②乙硼烷(B H)与联氨(NH)的相对分子质量相近,但乙硼烷的熔点(−165.5℃)、沸
2 6 2 4
点(−92.6℃)分别低于联氨的熔点(1.4℃)、沸点(113.5℃),原因是
。
(3)氨硼烷(NH BH)可作为储氢材料。在一定条件下NH BH 和HO发生反应,产生
3 3 3 3 2
H,反应后溶液中的阴离子为B O,反应的离子方程式为_______________________。B O的结构
2 3 3
中硼原子和氧原子交替形成平面六元环,B-O键均为单键,画出其结构图
。
(4)具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子位于面心,Ag原
子位于顶点,氢原子可进入到由Cu原子与Ag原子构成的四面体空隙中。若将Cu原子与Ag原子
等同看待,该晶体储氢后的晶胞结构与CaF (晶胞结构如图)相似,该晶体储氢后的化学式为
2
(活泼金属在前)。
17.(14分)氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态Cr原子的价电子轨道表示式为 。
(2)CrCl 为紫色单斜晶体,常用作媒染剂和催化剂。已知三氯化铬(CrCl )为紫色晶体,
3 3
熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化。根据信息判断CrCl
3
大庆铁人中学2024级高二年级上学期期末化学试题 第 5 页 共 9 页中的化学键为 (填“共价键”或“离子键”)。
(3)实验室常用含氮微粒 与 形成稳定的红色物质 来检验 的存在。
中原子均满足8电子稳定结构,推测其空间构型为 。
(4)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电
子可在多个原子间运动,形成“离域 键”(或大 键)。大 键可用 表示,其中m、n分别
代表参与形成大 键的原子个数和电子数。下列微粒中存在“离域 键”的是 (填标
号)。
A.CH = CH-CH = CH B.CCl C.HO D.SO
2 2 4 2 2
(5)[Zn(IMI) ](ClO) 是Zn2+的一种配合物,IMI的结构为 ,存在离域 键Π,
4 4 2
则IMI中N的杂化方式是 ,IMI的某种衍生物与甘氨酸形成的离子化合物
在常温下为液态而非固态,原因是
。
(6)某铜铬合金的立方晶胞结构如图所示,阿伏加德罗常数的值用N 表示,若合金的密度
A
为d g·cm−3,晶胞参数(a)的表达式为_________________nm(化为最简形式)。
18.(13分)缺铜会造成一系列的严重后果。一种有机补铜剂二甘氨酸合铜
的制备过程如下:
大庆铁人中学2024级高二年级上学期期末化学试题 第 6 页 共 9 页回答下列问题:
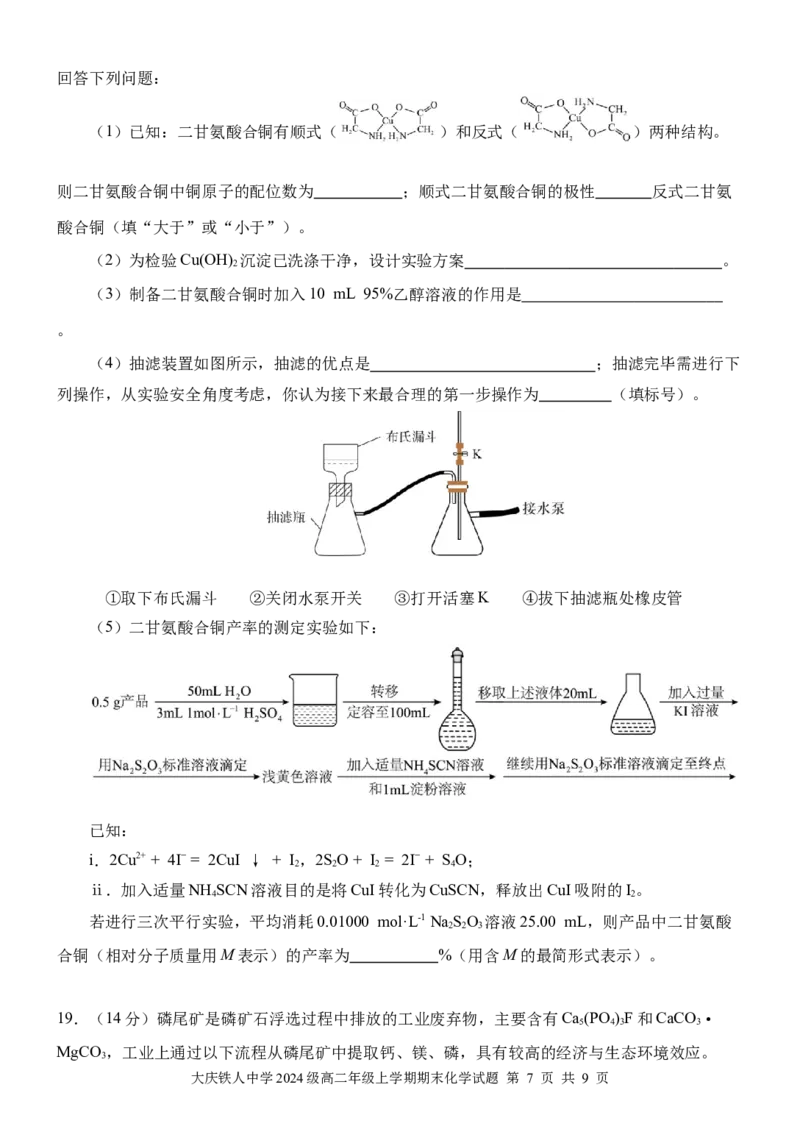
(1)已知:二甘氨酸合铜有顺式( )和反式( )两种结构。
则二甘氨酸合铜中铜原子的配位数为 ;顺式二甘氨酸合铜的极性 反式二甘氨
酸合铜(填“大于”或“小于”)。
(2)为检验Cu(OH) 沉淀已洗涤干净,设计实验方案 。
2
(3)制备二甘氨酸合铜时加入10 mL 95%乙醇溶液的作用是
。
(4)抽滤装置如图所示,抽滤的优点是 ;抽滤完毕需进行下
列操作,从实验安全角度考虑,你认为接下来最合理的第一步操作为 (填标号)。
①取下布氏漏斗 ②关闭水泵开关 ③打开活塞K ④拔下抽滤瓶处橡皮管
(5)二甘氨酸合铜产率的测定实验如下:
已知:
i.2Cu2+ + 4I− = 2CuI ↓ + I,2SO + I = 2I− + SO;
2 2 2 4
ⅱ.加入适量NH SCN溶液目的是将CuI转化为CuSCN,释放出CuI吸附的I。
4 2
若进行三次平行实验,平均消耗0.01000 mol·L-1 NaSO 溶液25.00 mL,则产品中二甘氨酸
2 2 3
合铜(相对分子质量用M表示)的产率为 %(用含M的最简形式表示)。
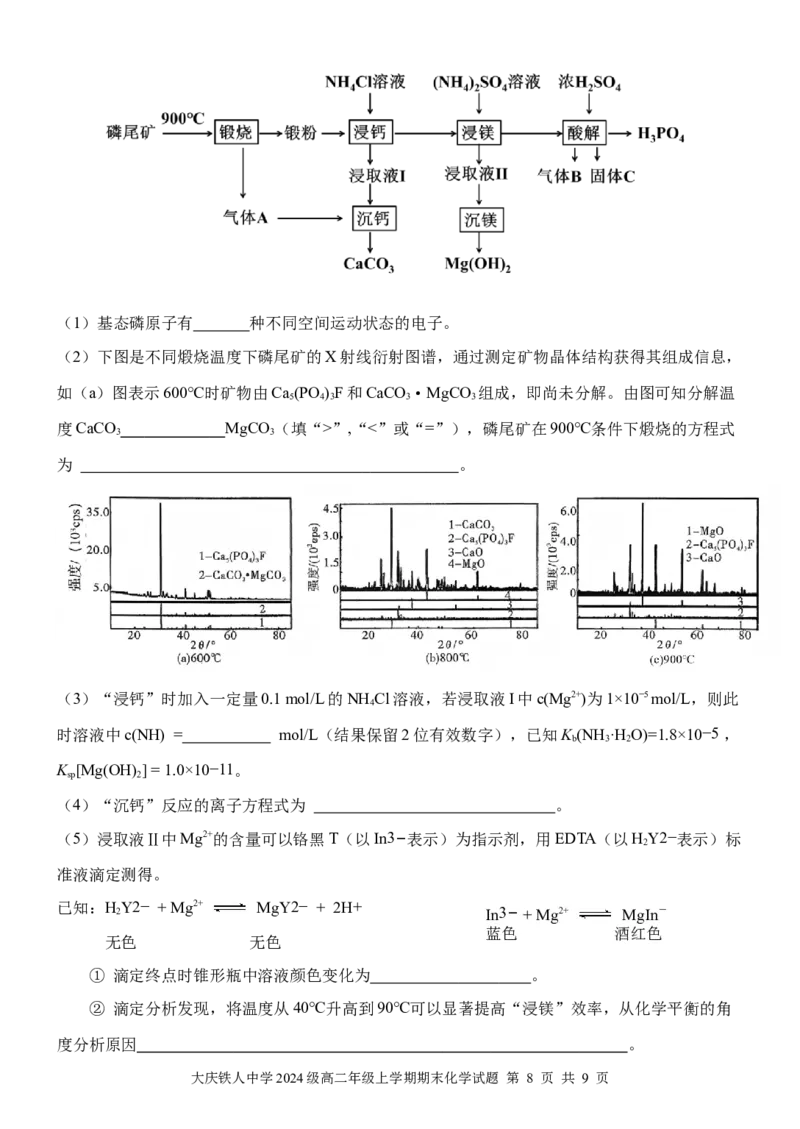
19.(14分)磷尾矿是磷矿石浮选过程中排放的工业废弃物,主要含有Ca (PO )F和CaCO ·
5 4 3 3
MgCO ,工业上通过以下流程从磷尾矿中提取钙、镁、磷,具有较高的经济与生态环境效应。
3
大庆铁人中学2024级高二年级上学期期末化学试题 第 7 页 共 9 页(1)基态磷原子有 种不同空间运动状态的电子。
(2)下图是不同煅烧温度下磷尾矿的X射线衍射图谱,通过测定矿物晶体结构获得其组成信息,
如(a)图表示600℃时矿物由Ca (PO )F和CaCO ·MgCO 组成,即尚未分解。由图可知分解温
5 4 3 3 3
度CaCO MgCO (填“>”,“<”或“=”),磷尾矿在900℃条件下煅烧的方程式
3 3
为 。
(3)“浸钙”时加入一定量0.1 mol/L的NH Cl溶液,若浸取液I中c(Mg2+)为1×10−5 mol/L,则此
4
时溶液中c(NH) = mol/L(结果保留2位有效数字),已知K (NH ·H O)=1.8×10−5 ,
b 3 2
K [Mg(OH) ] = 1.0×10−11。
sp 2
(4)“沉钙”反应的离子方程式为 。
(5)浸取液Ⅱ中Mg2+的含量可以铬黑T(以In3−表示)为指示剂,用EDTA(以HY2−表示)标
2
准液滴定测得。
已知:HY2− + Mg2+ MgY2− + 2H+
2 In3− + Mg2+ MgIn-
蓝色 酒红色
无色 无色
① 滴定终点时锥形瓶中溶液颜色变化为 。
② 滴定分析发现,将温度从40℃升高到90℃可以显著提高“浸镁”效率,从化学平衡的角
度分析原因 。
大庆铁人中学2024级高二年级上学期期末化学试题 第 8 页 共 9 页(6)“酸解”反应制备HPO 的化学方程式为 。
3 4
大庆铁人中学2024级高二年级上学期期末化学试题 第 9 页 共 9 页