文档内容
静海一中2024-2025第二学期高二化学(3月)
学生学业能力调研试卷
考生注意:
本试卷分第Ⅰ卷基础题(80分)和第Ⅱ卷提高题(17分)两部分,共97分。
3分卷面分
知 识 与 技 能 学习能力(学法)
内容 原子结构 分子结构 晶体结构 有机 方法归纳 易混易错 学习习惯
分数 17 34 35 11 9 12 9
可能用到的相对原子质量:H:1 C:12 O:16 Si:28
第Ⅰ卷 基础题(共80分)
一、选择题: 每小题3分,共36分。
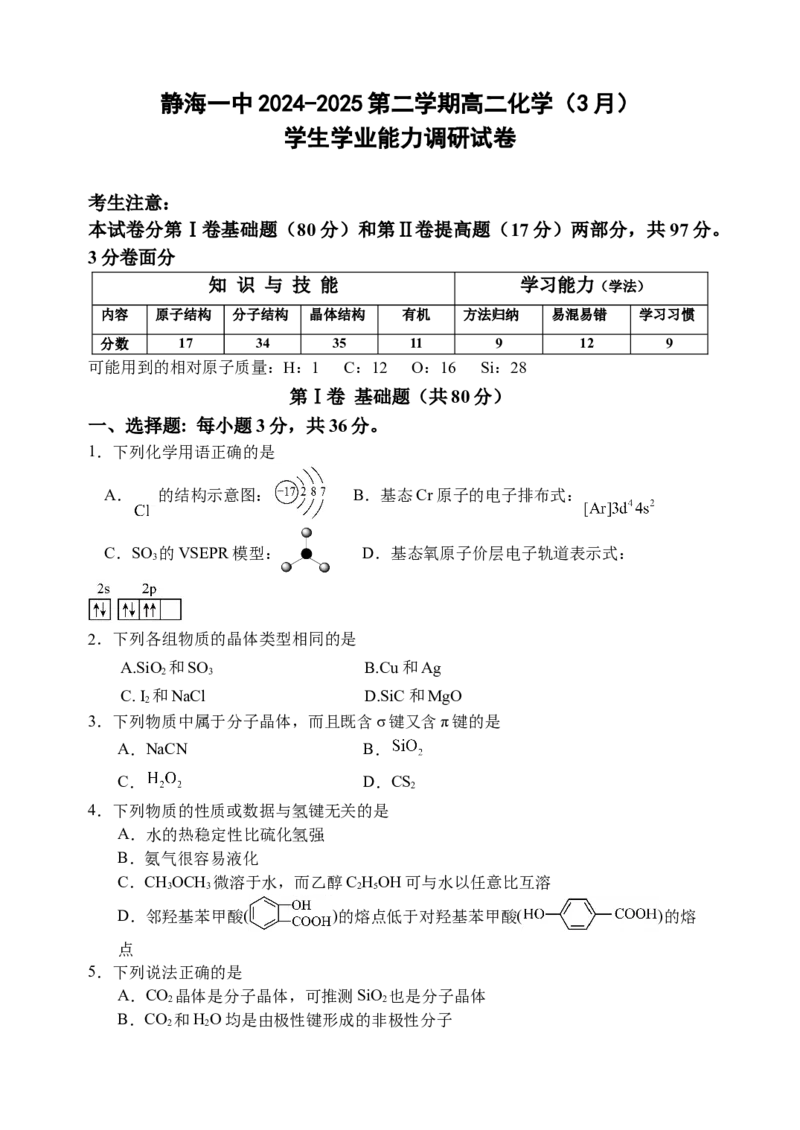
1.下列化学用语正确的是
A. 的结构示意图: B.基态Cr原子的电子排布式:
C.SO 的VSEPR模型: D.基态氧原子价层电子轨道表示式:
3
2.下列各组物质的晶体类型相同的是
A.SiO 和SO B.Cu和Ag
2 3
C. I 和NaCl D.SiC和MgO
2
3.下列物质中属于分子晶体,而且既含σ键又含π键的是
A.NaCN B.
C. D.CS
2
4.下列物质的性质或数据与氢键无关的是
A.水的热稳定性比硫化氢强
B.氨气很容易液化
C.CHOCH 微溶于水,而乙醇C HOH可与水以任意比互溶
3 3 2 5
D.邻羟基苯甲酸( )的熔点低于对羟基苯甲酸( )的熔
点
5.下列说法正确的是
A.CO 晶体是分子晶体,可推测SiO 也是分子晶体
2 2
B.CO 和HO均是由极性键形成的非极性分子
2 2C.分子晶体中一定存在分子间作用力,不一定存在共价键
D.HF、HCl、HBr、HI的熔沸点随着相对分子质量的增加依次升高
6.下列有关官能团和物质类别的关系说法正确的是
A.含 的有机物一定是烯烃
B. 和 官能团均为 ,二者互为同系物
C. 和 分子中都含有 ,两者同属于醛类
D. 可以看作乙烷中的一个H被溴原子取代后的产物,属于烃的衍生物
7.维生素C,别称L-抗坏血酸,具有抗氧化的作用。其结构如下图所示,下列关于维
生素C叙述不正确的是
A.分子中含有2个手性碳原子
B.分子中碳原子的杂化轨道类型为sp3和sp2
C.维生素C结构中的含氧官能团为酮羰基和羟基
D.该分子易溶于水
8.下列说法不正确的是
A.杂化轨道只能用于形成σ键或容纳孤电子对
B.某元素气态基态原子的逐级电离能(kJ•mol﹣1)分别为 496、4562、6912、9543,
可推测该原子最外层电子数为2
C.等离子体是整体上呈电中性的气态物质,其中含有带电粒子
D.金属具有良好导电性,是因为金属晶体中“电子气”在电场作用下作定向移动
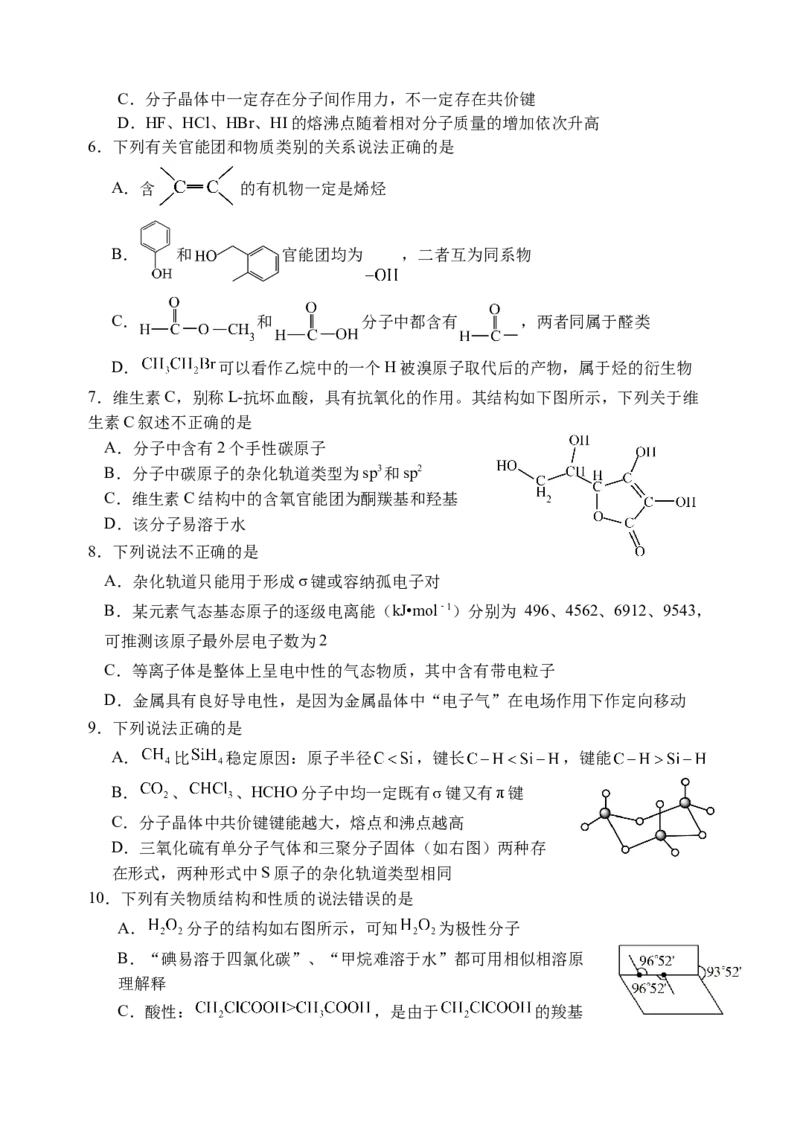
9.下列说法正确的是
A. 比 稳定原因:原子半径 ,键长 ,键能
B. 、 、HCHO分子中均一定既有 键又有 键
C.分子晶体中共价键键能越大,熔点和沸点越高
D.三氧化硫有单分子气体和三聚分子固体(如右图)两种存
在形式,两种形式中S原子的杂化轨道类型相同
10.下列有关物质结构和性质的说法错误的是
A. 分子的结构如右图所示,可知 为极性分子
B.“碘易溶于四氯化碳”、“甲烷难溶于水”都可用相似相溶原
理解释
C.酸性: ,是由于 的羧基中羟基极性更小
D.HO和 中心原子均为 杂化,前者空间结构为 形,后者为正四面体形
2
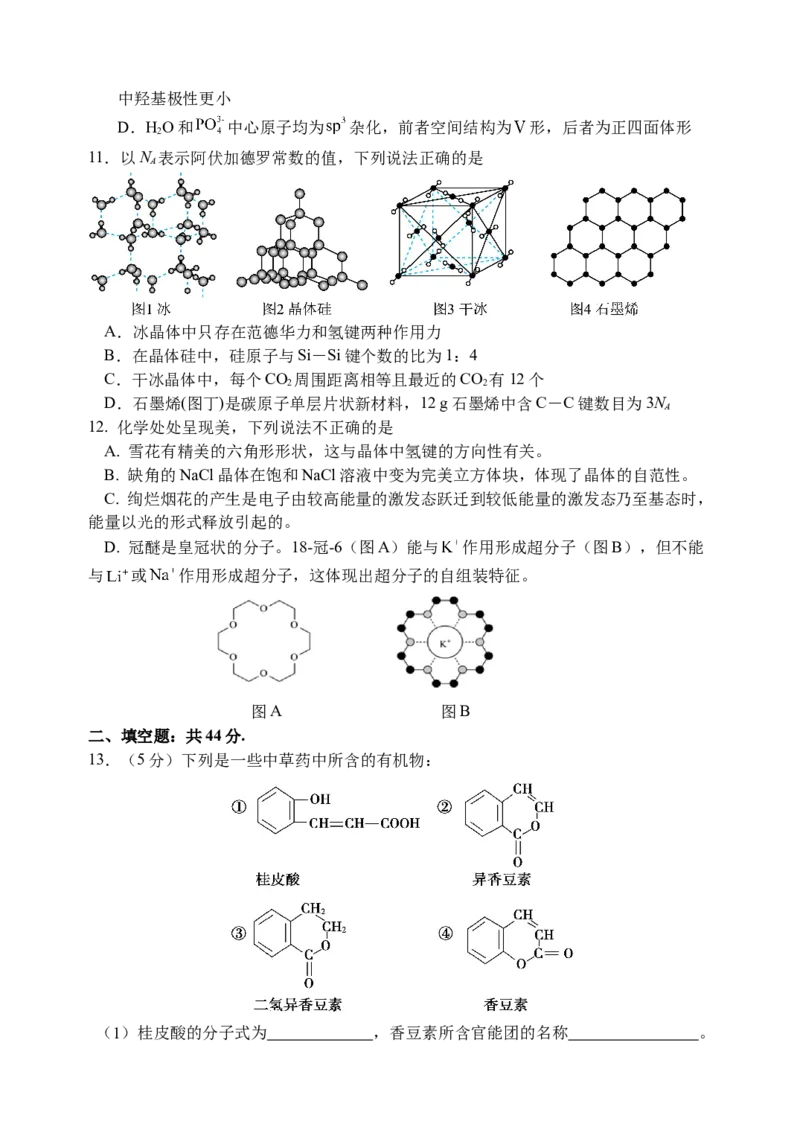
11.以N 表示阿伏加德罗常数的值,下列说法正确的是
A
A.冰晶体中只存在范德华力和氢键两种作用力
B.在晶体硅中,硅原子与Si-Si键个数的比为1:4
C.干冰晶体中,每个CO 周围距离相等且最近的CO 有12个
2 2
D.石墨烯(图丁)是碳原子单层片状新材料,12 g石墨烯中含C-C键数目为3N
A
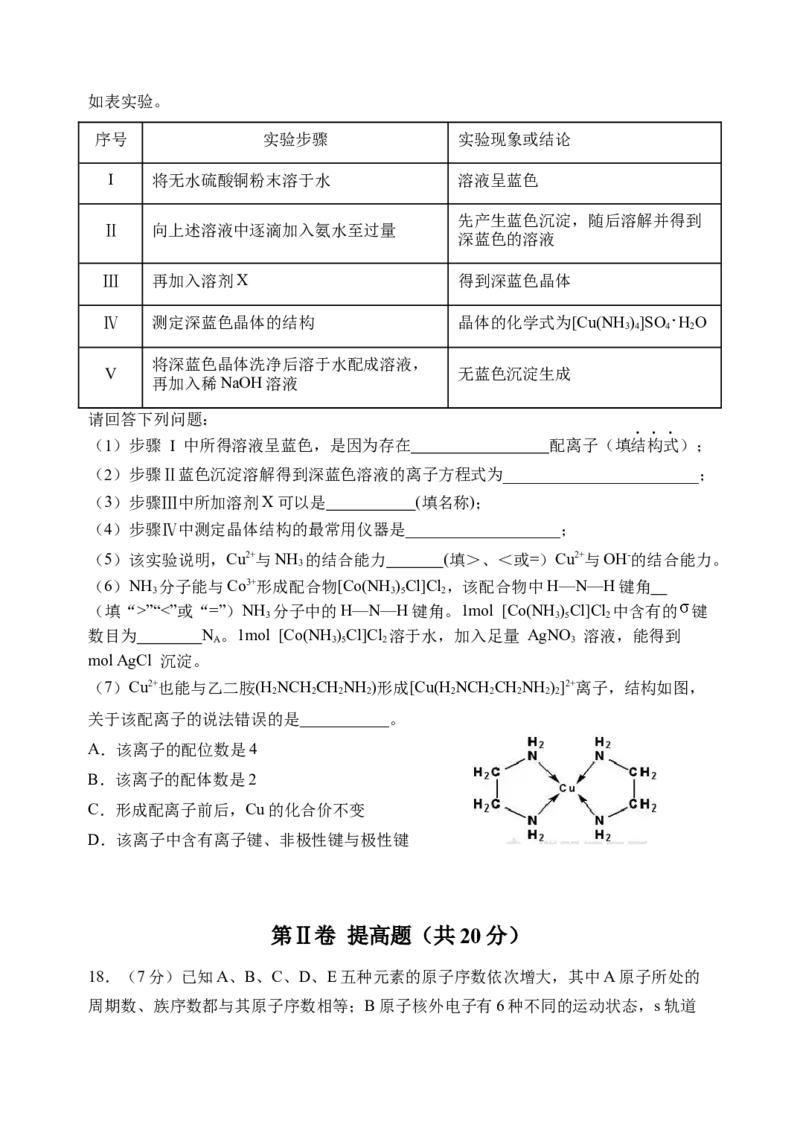
12. 化学处处呈现美,下列说法不正确的是
A. 雪花有精美的六角形形状,这与晶体中氢键的方向性有关。
B. 缺角的NaCl晶体在饱和NaCl溶液中变为完美立方体块,体现了晶体的自范性。
C. 绚烂烟花的产生是电子由较高能量的激发态跃迁到较低能量的激发态乃至基态时,
能量以光的形式释放引起的。
D. 冠醚是皇冠状的分子。18-冠-6(图A)能与 作用形成超分子(图B),但不能
与 或 作用形成超分子,这体现出超分子的自组装特征。
图A 图B
二、填空题:共44分.
13.(5分)下列是一些中草药中所含的有机物:
(1)桂皮酸的分子式为 ,香豆素所含官能团的名称 。(2)以上4种有机物中互为同分异构体的是: (填序号)
14.概念辨析(6分)
判断下列说法是否正确(正确的打“√”,不正确的打“×”)若不正确请说明理由。
(1)所有共价键都有方向性。( )
理由:
(2)氢键的存在一定使物质的熔沸点升高。( )
理由:
(3)晶体中,若含有阳离子就一定有阴离子。( )
理由:
15.方法归纳(9分)
(1) OF 的空间结构为_____________,其中氧原子的杂化类型为____________。
2
(2)硫可以形成SOCl 化合物,则该化合物的空间结构为______________。
2
(3)除了氮的氧化物之外,氮还可以形成NO + 。请写出氮原子杂化类型____________。
2
(4)下列4种分子,其VSEPR模型与其空间结构一致的是 (填编号)
① ② ③CO ④HClO
2
(5)布洛芬是一种解热镇痛药,可用于感冒引起的发热,其结构简式如图所示。
i. 该分子中碳原子的杂化类型有____________种
ii. 布洛芬是手性分子,请用*标出布洛芬分子中的手性碳原子。
【学法题】确定中心原子杂化类型的方法
16.易混易错(12分)
(1)氯酸钾熔化,粒子间克服了________(填字母,下同)的作用力;二氧化硅熔化,
粒子间克服了________的作用力;碘的升华,粒子间克服了________的作用力。
a.共价键 b.范德华力 c.氢键 d.金属键 e.离子键
氯酸钾、二氧化硅、碘三种晶体,熔点最高是__________________。
(2)比较下列分子晶体的熔沸点高低:(填>、<或=)
CO________CS, HF________HI, CO________N
2 2 2
【学法题】比较分子晶体熔沸点需要关注哪些方面
(3)下列5种分子,属于含极性键的非极性分子的有 (填编号)。
①SO ② ③PH ④ ⑤P
2 3 4
(4)下列5种微粒,键角由大到小顺序排列为____________________(用编号表示)。
①CO ②CO ③SO ④SiCl ⑤HO+
2 2 4 3
【学法题】请说明键角大小比较的一般方法 。
17.(12分)Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如表实验。
序号 实验步骤 实验现象或结论
I 将无水硫酸铜粉末溶于水 溶液呈蓝色
先产生蓝色沉淀,随后溶解并得到
Ⅱ 向上述溶液中逐滴加入氨水至过量
深蓝色的溶液
Ⅲ 再加入溶剂X 得到深蓝色晶体
Ⅳ 测定深蓝色晶体的结构 晶体的化学式为[Cu(NH )]SO HO
3 4 4 2
将深蓝色晶体洗净后溶于水配成溶液,
V 无蓝色沉淀生成
再加入稀NaOH溶液
请回答下列问题:
(1)步骤 I 中所得溶液呈蓝色,是因为存在 配离子(填结构式);
(2)步骤Ⅱ蓝色沉淀溶解得到深蓝色溶液的离子方程式为________________________;
(3)步骤Ⅲ中所加溶剂X可以是 (填名称);
(4)步骤Ⅳ中测定晶体结构的最常用仪器是___________________;
(5)该实验说明,Cu2+与NH 的结合能力 (填>、<或=)Cu2+与OH-的结合能力。
3
(6)NH 分子能与Co3+形成配合物[Co(NH )Cl]Cl ,该配合物中H—N—H键角
3 3 5 2
(填“>”“<”或“=”)NH 分子中的H—N—H键角。1mol [Co(NH )Cl]Cl 中含有的 键
3 3 5 2
数目为 N 。1mol [Co(NH )Cl]Cl 溶于水,加入足量 AgNO 溶液,能得到
A 3 5 2 3
mol AgCl 沉淀。
(7)Cu2+也能与乙二胺(H NCH CHNH )形成[Cu(H NCH CHNH )]2+离子,结构如图,
2 2 2 2 2 2 2 2 2
关于该配离子的说法错误的是___________。
A.该离子的配位数是4
B.该离子的配体数是2
C.形成配离子前后,Cu的化合价不变
D.该离子中含有离子键、非极性键与极性键
第Ⅱ卷 提高题(共20分)
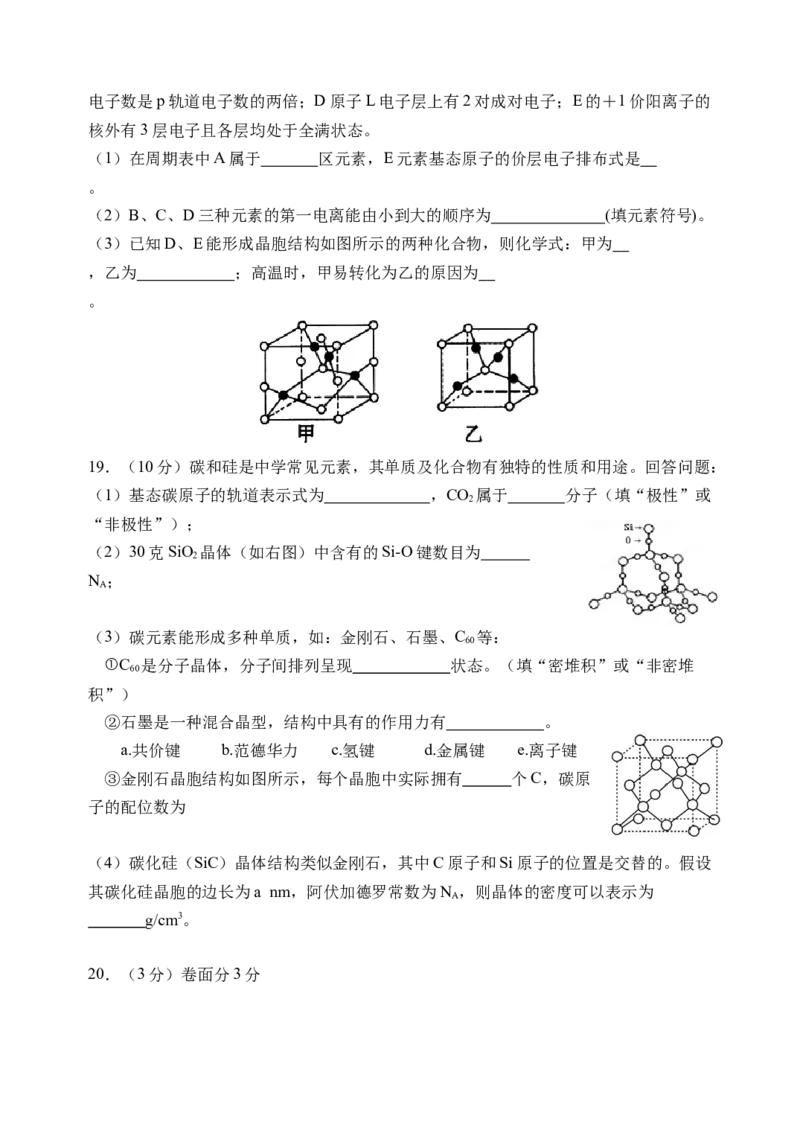
18.(7分)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的
周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的
核外有3层电子且各层均处于全满状态。
(1)在周期表中A属于 区元素,E元素基态原子的价层电子排布式是
。
(2)B、C、D三种元素的第一电离能由小到大的顺序为 (填元素符号)。
(3)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为
,乙为 ;高温时,甲易转化为乙的原因为
。
19.(10分)碳和硅是中学常见元素,其单质及化合物有独特的性质和用途。回答问题:
(1)基态碳原子的轨道表示式为 ,CO 属于 分子(填“极性”或
2
“非极性”);
(2)30克SiO 晶体(如右图)中含有的Si-O键数目为
2
N ;
A
(3)碳元素能形成多种单质,如:金刚石、石墨、C 等:
60
①C 是分子晶体,分子间排列呈现 状态。(填“密堆积”或“非密堆
60
积”)
②石墨是一种混合晶型,结构中具有的作用力有 。
a.共价键 b.范德华力 c.氢键 d.金属键 e.离子键
③金刚石晶胞结构如图所示,每个晶胞中实际拥有 个C,碳原
子的配位数为
(4)碳化硅(SiC)晶体结构类似金刚石,其中C原子和Si原子的位置是交替的。假设
其碳化硅晶胞的边长为a nm,阿伏加德罗常数为N ,则晶体的密度可以表示为
A
g/cm3。
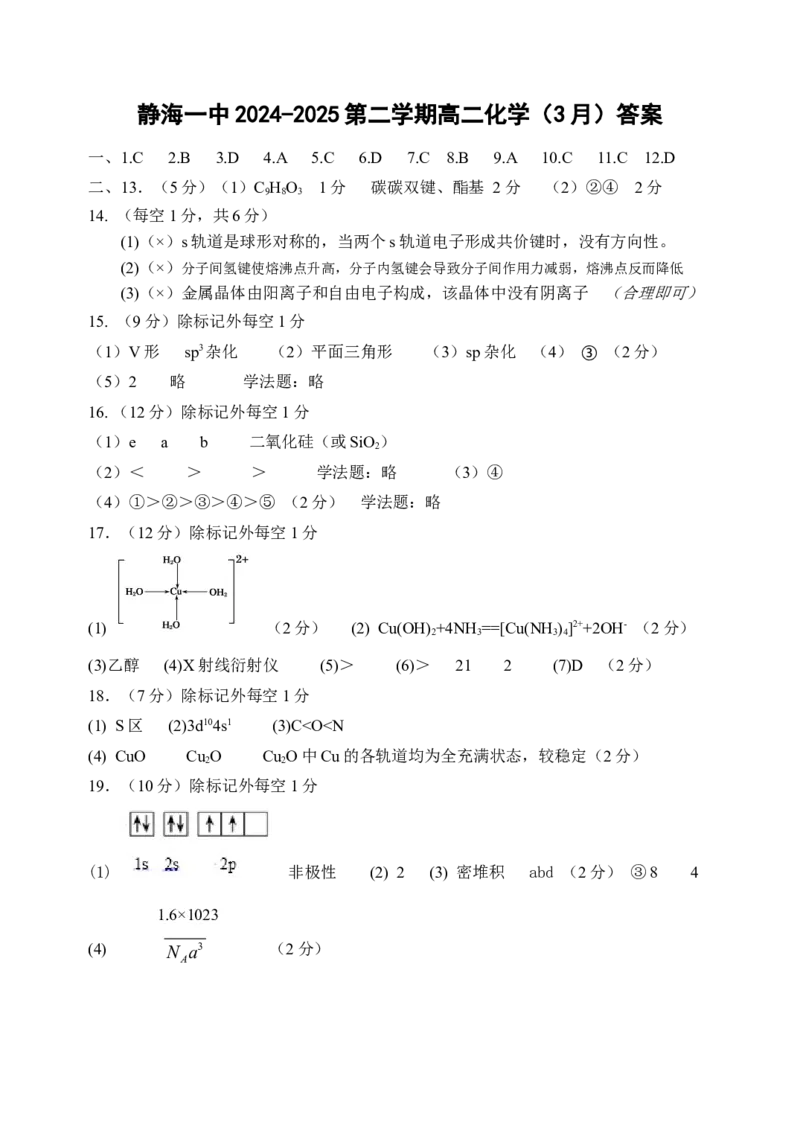
20.(3分)卷面分3分静海一中2024-2025第二学期高二化学(3月)答案
一、1.C 2.B 3.D 4.A 5.C 6.D 7.C 8.B 9.A 10.C 11.C 12.D
二、13.(5分)(1)C HO 1分 碳碳双键、酯基 2分 (2)②④ 2分
9 8 3
14. (每空1分,共6分)
(1)(×)s轨道是球形对称的,当两个s轨道电子形成共价键时,没有方向性。
(2)(×)分子间氢键使熔沸点升高,分子内氢键会导致分子间作用力减弱,熔沸点反而降低
(3)(×)金属晶体由阳离子和自由电子构成,该晶体中没有阴离子 (合理即可)
15. (9分)除标记外每空1分
(1)V形 sp3杂化 (2)平面三角形 (3)sp杂化 (4) ③ (2分)
(5)2 略 学法题:略
16.(12分)除标记外每空1分
(1)e a b 二氧化硅(或SiO)
2
(2)< > > 学法题:略 (3)④
(4)①>②>③>④>⑤ (2分) 学法题:略
17.(12分)除标记外每空1分
(1) (2分) (2) Cu(OH) +4NH==[Cu(NH )]2++2OH- (2分)
2 3 3 4
(3)乙醇 (4)X射线衍射仪 (5)> (6)> 21 2 (7)D (2分)
18.(7分)除标记外每空1分
(1) S区 (2)3d104s1 (3)C