文档内容
银川一中2024/2025 学年度(上)高二期中考试
C.25°C时,将pH=4的盐酸稀释1000倍后,溶液的pH< 7
D.25°C时,900mL pH=5的盐酸和100mL pH=1的硫酸混合(忽略体积变化),该混
化 学 试 卷 合
溶液的pH约为1.7
命题教师:马旻 6、某温度下,在体积一定的密闭容器中进行如下反应:2X(g)+Y(g)⇌Z(g)+W(s) ΔH>0,
一、选择题(每题2分,共40分)
下列叙述正确的是
1、下列属于吸热反应的是
A.将容器的体积压缩,可增大活化分子的百分数,有效碰撞次数增大
①冰雪融化 ②KMnO 分解制O ③铝与氧化铁的反应 ④NaHSO 在水中电离
4 2 4 B.在容器中加入氦气,压强增大,反应速率增大
⑤二氧化碳与灼热木炭反应 ⑥碘的升华 ⑦Ba(OH) •8H O和NH Cl反应
2 2 4 C.平衡后向体系内加一定量Z(g),再次平衡Z(g)的体积分数增大
A.②⑥⑦ B.②⑤⑦ C.①②⑤⑥⑦ D.③④
D.若10s内,v(X)=0.01mol.L-1.s-1,则v(W)=0.005mol.L-1.s-1
2、在马拉松比赛中设置了很多补水点,在跑步过程中适量补充弱碱水更符合人的机理特
7、下列说法正确的是
征。
A.已知甲烷的燃烧热 ΔH =−890.3 kJ∙mol−1 ,则CH(g)+2O(g)=CO (g)+2HO(g) ΔH <
4 2 2 2
下列溶液呈碱性说法正确的是
−890.3 kJ∙mol−1
A.碱性溶液中不含有H+
B.已知: ; ,则
B.碱性溶液中pH一定大于7
C.碱性溶液中OH-浓度一定大于H+浓度 C.已知:500℃、30MPa下, N 2 (g)+3H 2 (g)⇌2NH 3 (g) Δ H=-92.4kJ·mol⁻¹,将0.5mol
N
D.补给点所提供的碱性饮料溶质中含有NaOH 2
和过量的H 在此条件下充分反应,放出热量46.2kJ
3、下列说法不正确的是 2
D.已知稀溶液中,H+(aq)+OH-(aq)=H O(l) ΔH=−57.3 kJ∙mol−1,稀醋酸和稀氢氧化钠
2 1
A.用托盘天平称得0.10g HC O·2H O固体
2 2 4 2
溶液反应生成1mol水时的反应热为ΔH,则ΔH<ΔH
2 1 2
B.滴定时眼睛时刻注视锥形瓶中颜色变化
8、常温下,下列溶液中的微粒浓度关系正确的是
C.容量瓶、分液漏斗、滴定管使用前均要检漏
A . pH=3的 盐 酸 和 pH=11的 氨 水 等 体 积 混 合 :
D.滴定实验中,锥形瓶可以不用干燥
c(N H+ )=c(Cl− )>c(H+ )=c(OH− )
4、化学与人类生产、生活密切相关,下列叙述中正确的是 4
B.0.2mol/LCH COOH溶液与0.1mol/LNaOH溶液等体积混合:
A.明矾主要成分为 ,在净水中作絮凝剂和消毒剂 3
2c(H+ )−c(OH− )=c(CH❑ COO❑ − )−c(CH❑ COOH)
B.CO 水溶液可以导电,但是CO 不是电解质 3 3
2 2
C.pH=8.3的NaHCO 溶液:c(Na+ )>c(HCO− )>c(CO2− )>c(H CO )
C.草木灰(主要成分 )与氯化铵混合存放后使用,肥效更强 3 3 3 2 3
D.含等物质的量的NaHC O 和Na C O 混合溶液中:
D.用NaCO 与Al (SO ) 两种溶液可作泡沫灭火剂 2 4 2 2 4
2 3 2 4 3
5、下列说法正确的是 2c(Na+ )=3[c(HC 2 O− 4 )+c(C 2 O2 4 − )+c(H 2 C 2 O 4 )]
A.313K时,K =2.9×10−14,则pH=7的溶液呈酸性
w
B . 25℃pH=5的 氯 化 铵 溶 液 , c(H+ )=10−5mol/L, 由 水 电 离 出
c(OH− )=10−9mol/L9、室温下,下列实验方案能达到相应目的的是
酚酞溶液
实验
方案
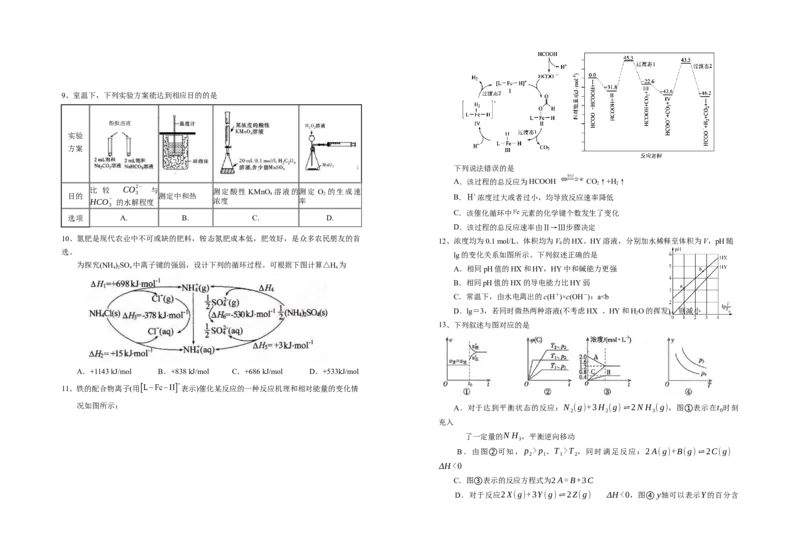
下列说法错误的是
A.该过程的总反应为HCOOH CO↑+H↑
2 2
目的 比 较 CO 3 2− 与 测定中和热 测定酸性 KMnO 4 溶液的测定 O 2 的生成速 B. 浓度过大或者过小,均导致反应速率降低
HCO− 的水解程度 浓度 率
3
C.该催化循环中 元素的化学键个数发生了变化
选项 A. B. C. D.
D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定
10、氮肥是现代农业中不可或缺的肥料,铵态氮肥成本低,肥效好,是众多农民朋友的首
12、浓度均为0.1 mol/L、体积均为V 的HX、HY溶液,分别加水稀释至体积为V,pH随
0
选。
lg的变化关系如图所示。下列叙述正确的是
为探究(NH )SO 中离子键的强弱,设计下列的循环过程。可根据下图计算△H 为
4 2 4 4 A.相同pH值的HX和HY,HY中和碱能力更强
B.相同pH值的HX的导电能力比HY弱
C.常温下,由水电离出的c(H+)×c(OH-):ap 、T >T ,同时满足反应:2A(g)+B(g)⇌2C(g)
2 1 1 2
ΔH<0
C.图③表示的反应方程式为2A=B+3C
D.对于反应2X(g)+3Y(g)⇌2Z(g) ΔH<0,图④ y轴可以表示Y的百分含量 反应Ⅰ 反应Ⅱ
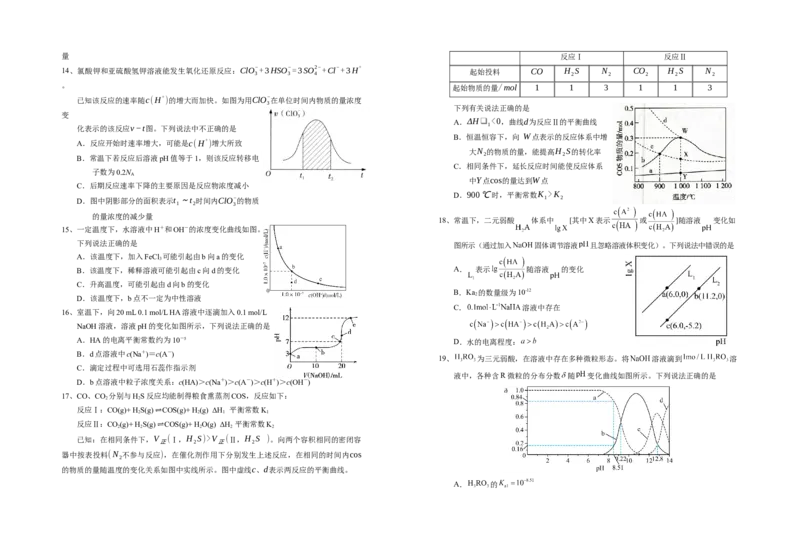
14、氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO−+3HSO−=3SO2−+Cl−+3H+
起始投料 CO H S N CO H S N
3 3 4 2 2 2 2 2
。 起始物质的量/mol 1 1 3 1 1 3
已知该反应的速率随c(H+ )的增大而加快。如图为用ClO−
在单位时间内物质的量浓度
3
下列有关说法正确的是
变
A.ΔH❑ <0,曲线d为反应Ⅱ的平衡曲线
1
化表示的该反应v−t图。下列说法中不正确的是
B.恒温恒容下,向 W点表示的反应体系中增
A.反应开始时速率增大,可能是c(H+ )增大所致
大N 的物质的量,能提高H S的转化率
2 2
B.常温下若反应后溶液pH值等于1,则该反应转移电
C.相同条件下,延长反应时间能使反应体系
子数为0.2N
A
中Y点cos的量达到W点
C.后期反应速率下降的主要原因是反应物浓度减小
D.900℃时,平衡常数K >K
D.图中阴影部分的面积表示t ~t 时间内ClO−的物质 1 2
1 2 3
的量浓度的减少量
18、常温下,二元弱酸 体系中 [其中X表示 或 ]随溶液 变化如
15、一定温度下,水溶液中H+和OH-的浓度变化曲线如图。
下列说法正确的是 图所示(通过加入 固体调节溶液 且忽略溶液体积变化)。下列说法中错误的是
A.该温度下,加入FeCl 可能引起由b向a的变化
3
B.该温度下,稀释溶液可能引起由c向d的变化 A. 表示 随溶液 的变化
C.升高温度,可能引起由d向b的变化
B.Ka 的数量级为10-12
2
D.该温度下,b点不一定为中性溶液
C. 溶液中存在
16、室温下,向20 mL 0.1 mol/L HA溶液中逐滴加入0.1 mol/L
NaOH溶液,溶液pH的变化如图所示,下列说法正确的是
A.HA的电离平衡常数约为10-5
D.水的电离程度:
B.d点溶液中c(Na+)=c(A-)
19、 为三元弱酸,在溶液中存在多种微粒形态。将 溶液滴到 溶
C.滴定过程中可选用石蕊作指示剂
液中,各种含R微粒的分布分数 随 变化曲线如图所示。下列说法正确的是
D.b点溶液中粒子浓度关系:c(HA)>c(Na+)>c(A-)>c(H+)>c(OH-)
17、CO、CO 分别与HS反应均能制得粮食熏蒸剂COS,反应如下:
2 2
反应Ⅰ:CO(g)+ H
2
S(g)⇌COS(g)+ H
2
(g) ΔH
1
平衡常数K
1
反应Ⅱ:CO
2
(g)+ H
2
S(g)⇌COS(g)+ H
2
O(g) ΔH
2
平衡常数K
2
已知:在相同条件下,V (Ⅰ,H S)>V (Ⅱ,H S )。向两个容积相同的密闭容
正 2 正 2
器中按表投料(N 不参与反应),在催化剂作用下分别发生上述反应,在相同的时间内cos
2
的物质的量随温度的变化关系如图中实线所示。图中虚线c、d表示两反应的平衡曲线。
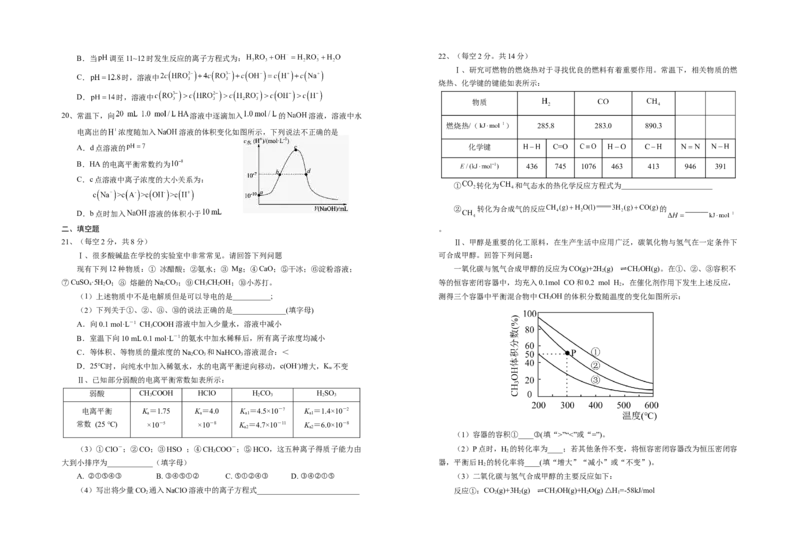
A. 的B.当 调至11~12时发生反应的离子方程式为:
22、(每空2分。共14分)
Ⅰ、研究可燃物的燃烧热对于寻找优良的燃料有着重要作用。常温下,相关物质的燃
C. 时,溶液中
烧热、化学键的键能如表所示:
D. 时,溶液中
物质
20、常温下,向 溶液中逐滴加入 的 溶液,溶液中水
燃烧热/( ) 285.8 283.0 890.3
电离出的 浓度随加入 溶液的体积变化如图所示,下列说法不正确的是
A.d点溶液的 化学键 C=O
B.HA的电离平衡常数约为
436 745 1076 463 413 946 391
C.c点溶液中离子浓度的大小关系为:
① 转化为 和气态水的热化学反应方程式为________________________
② 转化为合成气的反应 的
D.b点时加入 溶液的体积小于
二、填空题 。
21、(每空2分,共8分) Ⅱ、甲醇是重要的化工原料,在生产生活中应用广泛,碳氧化物与氢气在一定条件下
Ⅰ、很多酸碱盐在学校的实验室中非常常见。请回答下列问题 可合成甲醇。回答下列问题:
现有下列12种物质:① 冰醋酸;②氨水;③ Mg;④CaO;⑤干冰;⑥淀粉溶液; 一氧化碳与氢气合成甲醇的反应为CO(g)+2H
2
(g) ⇌CH
3
OH(g)。在①、②、③容积不
⑦CuSO ·5H O;⑧ 熔融的NaCO;⑨CHCHOH;⑩小苏打。 等的恒容密闭容器中,均充入0.1mol CO和0.2 mol H,在催化剂作用下发生上述反应,
4 2 2 3 3 2 2
(1)上述物质中不是电解质但是可以导电的是__________; 测得三个容器中平衡混合物中CHOH的体积分数随温度的变化如图所示:
3
(2)下列关于①、②、⑧、⑩的说法正确的是______________(填字母)
A.向0.1 mol·L-1 CHCOOH溶液中加入少量水,溶液中减小
3
B.室温下向10 mL 0.1 mol·L-1的氨水中加水稀释后,所有离子浓度均减小
C.等体积、等物质的量浓度的NaCO 和NaHCO 溶液混合:<
2 3 3
D.25℃时,向纯水中加入稀氨水,水的电离平衡逆向移动,c(OH-)增大,K 不变
w
Ⅱ、已知部分弱酸的电离平衡常数如表所示:
弱酸 CHCOOH HClO HCO HSO
3 2 3 2 3
电离平衡 K=1.75 K=4.0 K =4.5×10-7 K =1.4×10-2
a a a1 a1
常数 (25 ℃) ×10-5 ×10-8 K =4.7×10-11 K =6.0×10-8
a2 a2
(1)容器的容积①____③(填“>”“<”或“=”)。
(3)①ClO-;②CO;③HSO ;④CHCOO-;⑤HCO,这五种离子得质子能力由 (2)P点时,H 的转化率为____;若其他条件不变,将恒容密闭容器改为恒压密闭容
3 2
大到小排序为____________(填字母) 器,平衡后H 的转化率将____(填“增大”“减小”或“不变”)。
2
A. ②①⑤④③ B. ③④⑤①② C. ⑤①②④③ D. ③④②①⑤ (3)二氧化碳与氢气合成甲醇的主要反应如下:
(4)写出将少量CO
2
通入NaClO溶液中的离子方程式___________________________ 反应①:CO
2
(g)+3H
2
(g) ⇌CH
3
OH(g)+H
2
O(g) △H
1
=-58kJ/mol反应②:CO 2 (g)+H 2 (g) ⇌CO(g)+H 2 O(g) △H 2 =+41kJ/mol 液的pH=10,则 的值为___________
反应时温度控制在230~280℃之间,温度不能过高的原因是
(5)将等体积、等物质的量浓度B和C混合后溶液,升
______________________。
高温度(溶质不会分解)溶液pH随温度变化如图中_______曲
(4)一定条件下,向刚性容器中充入物质的量之比为1:3的CO(g)和H(g)发生上述
2 2 线(填写序号)。
反应。达到平衡时CO 的转化率为20%,CHOH的选择性为75%[CH OH的选择性=
2 3 3 (6)若F溶液为CHCOONa,现有25 ℃时,浓度均
3
为0.10 mol/L的E和F混合溶液,pH=4.76,请计算该温度下K (CHCOO-)= (保留
×100%],则反应②的平衡常数K=____。(K 为以分压表示的平衡常数) h 3
p p
三位有效数字);
Ⅱ、氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的
还原剂溶液或反之)。为测定所得水体中ClO 的含量,进行了以下实验:
2
步骤1:准确量取ClO 溶液10.00 mL,稀释成100 mL试样。
2
23、(每空2分,共18分)
步骤2:量取V mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶
1
Ⅰ、A、B、C、D、E五种溶液分别是NaOH、NH ·H O、CHCOOH、HCl、NH HSO
3 2 3 4 4 体,摇匀,在暗处静置30分钟。(已知2ClO +10I-+8H+===5I +2Cl-+4HO)
2 2 2
中的一种。李华同学写完英语作业后通过实验已经证明C为NH HSO ,E为CHCOOH。
4 4 3 步骤3:以淀粉溶液作指示剂,用c mol·L-1NaSO 溶液滴定至终点,消耗NaSO 溶
2 2 3 2 2 3
其余溶液李华同学请汪路斌老师在常温下做下列实验进一步判断:
液V mL。(已知:I+2SO===2I-+SO)
2 2 2 4
①pH=1的A溶液稀释1000倍后测得溶液pH= 4;
(7)滴定终点的现象为______________________;
②B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反
(8)若实验中使用的 NaSO 标准溶液部分因被氧气氧化而变质,则实验结果
2 2 3
应后得到的溶液前者呈酸性,后者呈中性。
________(填“偏高”、“偏低”或“无影响”)。
已知信息:25 ℃时,K (CHCOOH)=1.75×10-5
a 3
(9)根据上述步骤可计算出原ClO 溶液的浓度为________ mol·L-1(用含字母的代数
2
回答下列问题:
式表示)。
(1)D是________(填化学式);
(2)用水稀释0.1 mol·L-1B溶液时,溶液中随着水量的增加而减小的是________(填
写序号)。
a. b. c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中
存在镁粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)。
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E
d.E溶液里有镁粉剩余
(4)某温度时,纯水中水电离的C(H+)=10-6 mol/L,V mL pH=11的D稀溶液与V
1 2
mL pH=2的A稀溶液充分反应(混合后的体积变化忽略不计),恢复原温度,测得混合溶2024/2025高二期中化学试卷答案
一、选择题
1 2 3 4 5 6 7 8 9 10
B C A B C C D D C B
11 12 13 14 15 16 17 18 19 20
D C B B A A D D C A
二、填空题
21、(每空2分,共8分)
(1)②③
(2) D
(3)A
(4)CO +HO+ClO-=== HCO+HClO
2 2
22、(每空2分,共14分)
Ⅰ、 -270
Ⅱ、(1) <
(2) 75% 增大
(3) 温度过高,反应①逆向移动,反应②正向移动,CH OH产率(选择性)低
3
(4)5×10-3
23、(每空2分,共18分)
Ⅰ(1) NaOH
(2)a
(3)c
(4) 2∶9
(5)④
(6) 5.71×10-10
Ⅱ.(7)蓝色变为无色,半分钟不恢复
(8)偏高
(9)