文档内容
玉溪一中 2024-2025 学年上学期高三年级期中考
化学试卷
总分:100分,考试时间:75分钟 命题人和审题人:张淑 余思贤 胡明祥
请将所有题目的答案填、涂到答题卡上,可能用到的相对原子质量:H 1 C 12 O 16
第I卷(选择题,共42分)
一、单项选择题:本题共14小题,每小题3分,共42分,在每小题给出的四个选项中,
只有一个选项正确。
1.化学与生活、生产、科技密切相关。下列说法错误的是( )
A.天问一号探测器着陆火星过程中使用了芳纶制作的降落伞,芳纶是高分子材料
B.2023年诺贝尔化学奖授予“发现和合成量子点”的研究者,纳米量子点分散到溶
剂中形成的分散系可能具有丁达尔效应
C.实施 的海底封存,需要将 进行液化,液化过程中 的共价键不会被破
坏
D.Nature在线发表了同济大学材料科学与工程学院精准合成的芳香型碳环 和 ,
两者互为同系物
2.下列化学用语表述正确的是( )
A.2-乙基-1,3-丁二烯的键线式: B.聚丙烯的链节为:
C. 分子的空间填充模型: D.二氯化二硫 的电子式:
3.下列有关离子方程式正确的是( )
A.向饱和碳酸钠溶液中通入足量的CO :2Na++CO 2-+H O+CO = 2NaHCO ↓
2 3 2 2 3
B.向 溶液中滴加少量 :
C. 溶液与少量 溶液反应:
D.电解 溶液:
试卷第1页,共3页4.设 为阿伏加德罗常数的值。下列有关描述正确的是( )
A.将0.3mol 水解形成 胶体粒子数为0.3
B. 和 在一定条件下充分反应后,混合物的分子数大于
C.分别由 和 制备等量的氧气转移的电子数目相等
D.32 g甲醇分子中含有 C-H键的数目为4N
A
5.用如图实验装置和操作不能达到实验目的的是( )
A.利用装置甲制备溴苯并验证有HBr生成 B.利用装置乙证明酸性:硫酸>碳酸>苯酚
C.利用装置丙制备无水MgCl D.利用装置丁分离碘单质和NaCl
2
6.下列性质的比较正确的是( )
A.第一电离能: B.键角:
C.熔点: D.酸性:
7.为了达到实验目的,下列设计方案、现象及结论均正确的是( )
选项 实验目的 方案设计 现象 结论
A 证明 具 向紫色石蕊溶液中通入 先变红,后褪色 具有漂
有漂白性 白性
证明 Cl 与 前者产生白色沉 Cl₂ 与 HO
2 向盛有 AgNO 溶液和淀粉-KI 2
B HO 的反 3 淀,后者溶液变 的反应存在
2 溶液的试管中分别滴加新制氯水
应存在限度 蓝 限度
可以氧
探究 上层呈紫红色,
向 溶液中加入KI溶液, 化 ,白色
C 的氧化性及 下层有白色沉淀
还原产物 再加入苯,振荡后静置 生成 沉淀可能为
CuI
检验蔗糖的 向蔗糖溶液中滴加稀硫酸,水浴 无砖红色沉淀产 蔗糖未发生
D
水解程度 加热一段时间后,加入少量新制 生 水解
试卷第2页,共3页的 悬浊液,煮沸
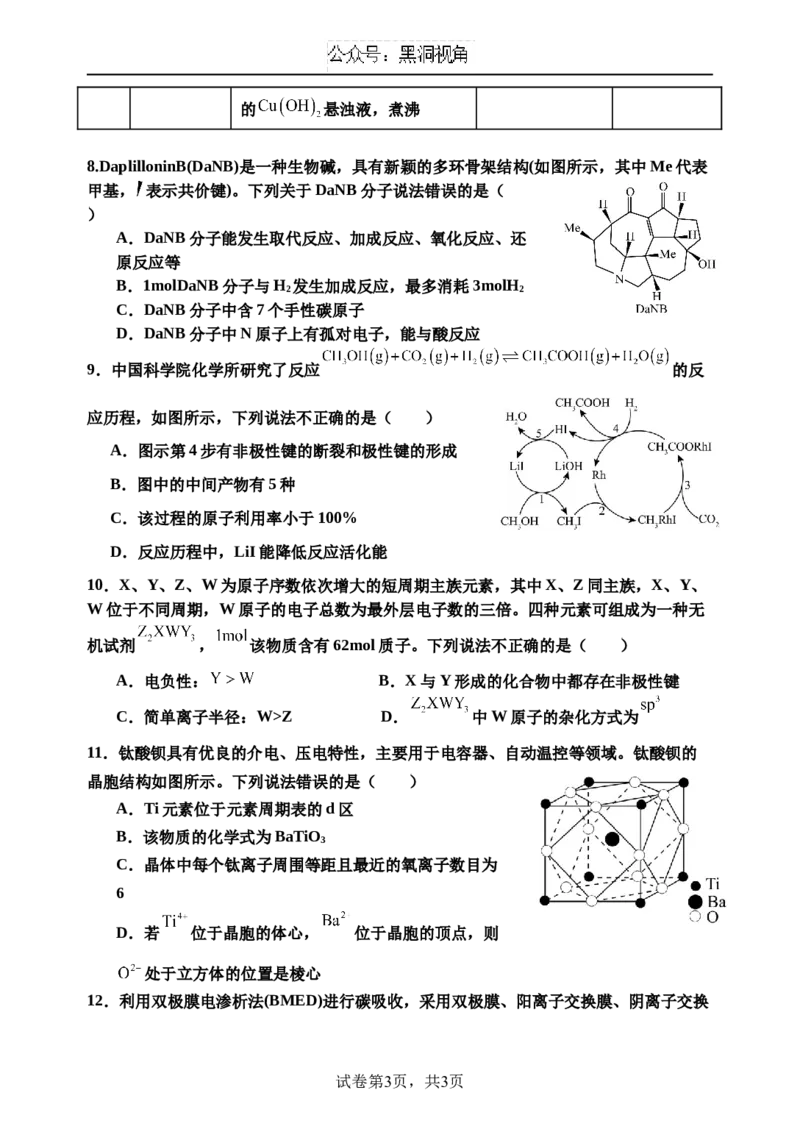
8.DaplilloninB(DaNB)是一种生物碱,具有新颖的多环骨架结构(如图所示,其中Me代表
甲基, 表示共价键)。下列关于DaNB分子说法错误的是(
)
A.DaNB分子能发生取代反应、加成反应、氧化反应、还
原反应等
B.1molDaNB分子与H 发生加成反应,最多消耗3molH
2 2
C.DaNB分子中含7个手性碳原子
D.DaNB分子中N原子上有孤对电子,能与酸反应
9.中国科学院化学所研究了反应 的反
应历程,如图所示,下列说法不正确的是( )
A.图示第4步有非极性键的断裂和极性键的形成
B.图中的中间产物有5种
C.该过程的原子利用率小于100%
D.反应历程中,LiI能降低反应活化能
10.X、Y、Z、W为原子序数依次增大的短周期主族元素,其中X、Z同主族,X、Y、
W位于不同周期,W原子的电子总数为最外层电子数的三倍。四种元素可组成为一种无
机试剂 , 该物质含有62mol质子。下列说法不正确的是( )
A.电负性: B.X与Y形成的化合物中都存在非极性键
C.简单离子半径:W>Z D. 中W原子的杂化方式为
11.钛酸钡具有优良的介电、压电特性,主要用于电容器、自动温控等领域。钛酸钡的
晶胞结构如图所示。下列说法错误的是( )
A.Ti元素位于元素周期表的d区
B.该物质的化学式为BaTiO
3
C.晶体中每个钛离子周围等距且最近的氧离子数目为
6
D.若 位于晶胞的体心, 位于晶胞的顶点,则
处于立方体的位置是棱心
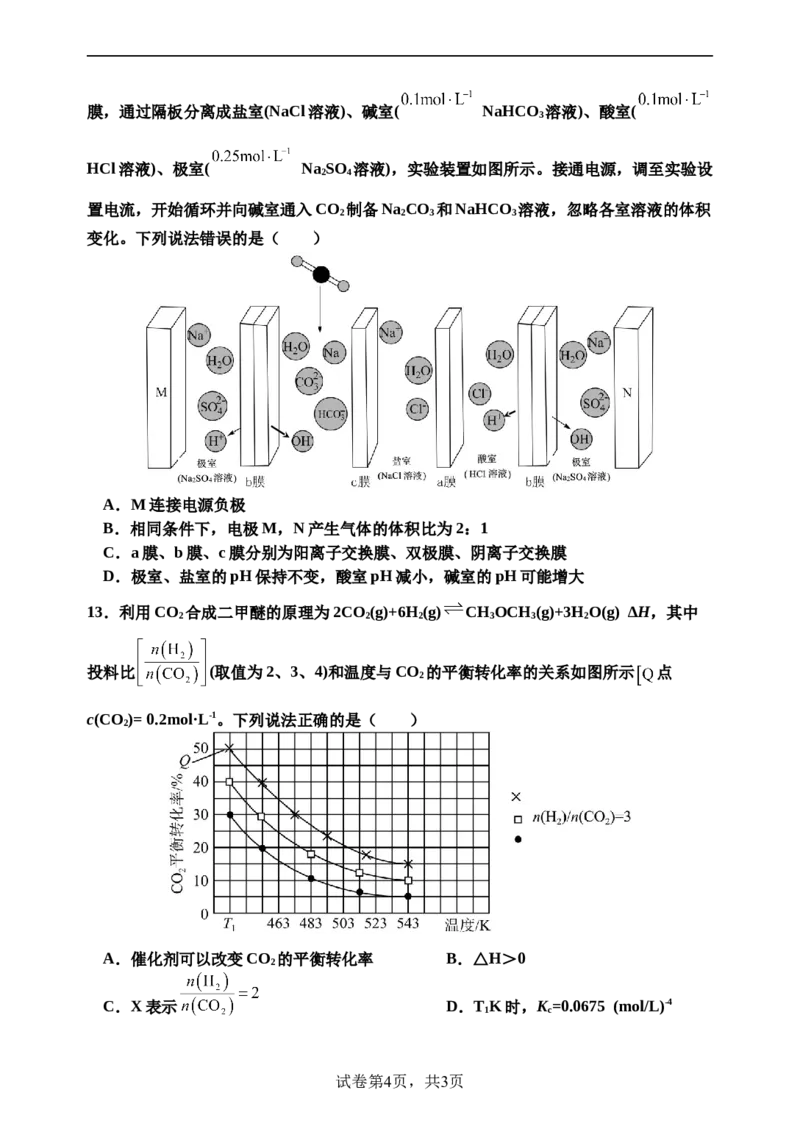
12.利用双极膜电渗析法(BMED)进行碳吸收,采用双极膜、阳离子交换膜、阴离子交换
试卷第3页,共3页膜,通过隔板分离成盐室(NaCl溶液)、碱室( NaHCO 溶液)、酸室(
3
HCl溶液)、极室( NaSO 溶液),实验装置如图所示。接通电源,调至实验设
2 4
置电流,开始循环并向碱室通入CO 制备Na CO 和NaHCO 溶液,忽略各室溶液的体积
2 2 3 3
变化。下列说法错误的是( )
A.M连接电源负极
B.相同条件下,电极M,N产生气体的体积比为2:1
C.a膜、b膜、c膜分别为阳离子交换膜、双极膜、阴离子交换膜
D.极室、盐室的pH保持不变,酸室pH减小,碱室的pH可能增大
13.利用CO 合成二甲醚的原理为2CO (g)+6H (g) CH OCH (g)+3H O(g) ∆H,其中
2 2 2 3 3 2
投料比 (取值为2、3、4)和温度与CO 的平衡转化率的关系如图所示 点
2
c(CO)= 0.2mol·L-1。下列说法正确的是( )
2
A.催化剂可以改变CO 的平衡转化率 B.△H>0
2
C.X表示 D.T K时,K=0.0675 (mol/L)-4
1 c
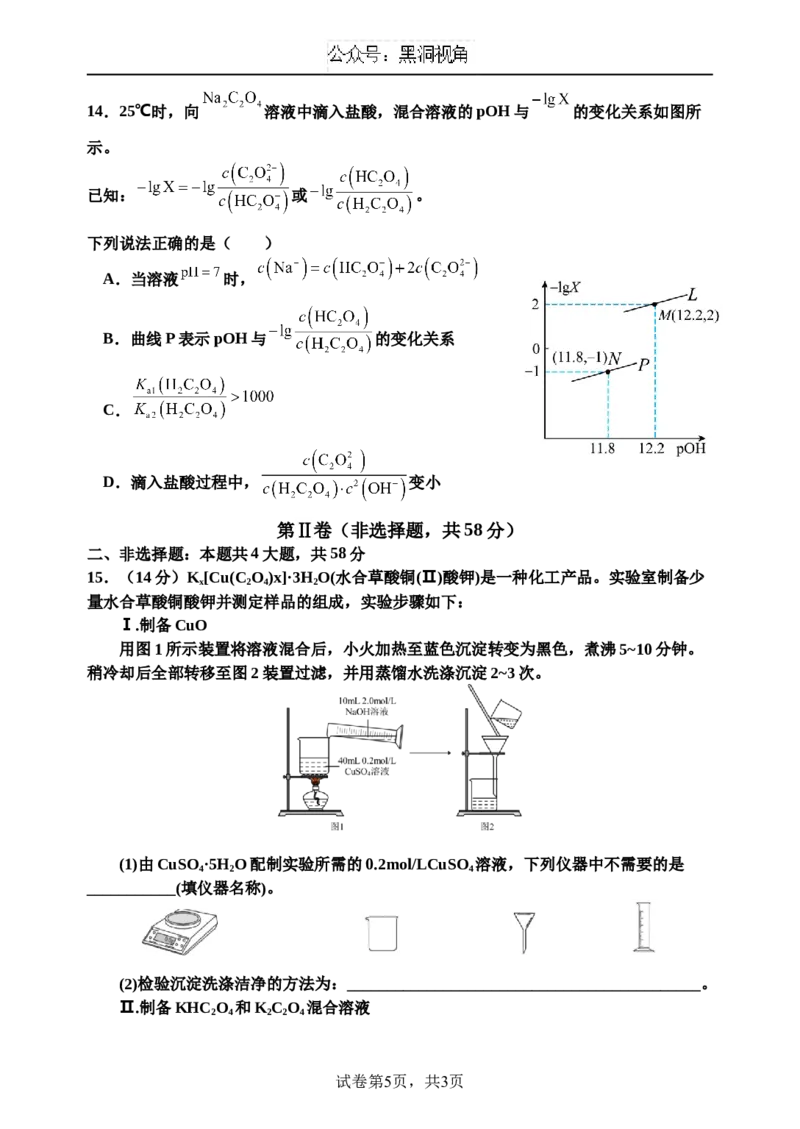
试卷第4页,共3页14.25℃时,向 溶液中滴入盐酸,混合溶液的pOH与 的变化关系如图所
示。
已知: 或 。
下列说法正确的是( )
A.当溶液 时,
B.曲线P表示pOH与 的变化关系
C.
D.滴入盐酸过程中, 变小
第Ⅱ卷(非选择题,共58分)
二、非选择题:本题共4大题,共58分
15.(14分)K[Cu(CO)x]·3H O(水合草酸铜(Ⅱ)酸钾)是一种化工产品。实验室制备少
x 2 4 2
量水合草酸铜酸钾并测定样品的组成,实验步骤如下:
Ⅰ.制备CuO
用图1所示装置将溶液混合后,小火加热至蓝色沉淀转变为黑色,煮沸5~10分钟。
稍冷却后全部转移至图2装置过滤,并用蒸馏水洗涤沉淀2~3次。
(1)由CuSO ·5HO配制实验所需的0.2mol/LCuSO 溶液,下列仪器中不需要的是
4 2 4
___________(填仪器名称)。
(2)检验沉淀洗涤洁净的方法为:____________________________________________。
Ⅱ.制备KHC O 和KCO 混合溶液
2 4 2 2 4
试卷第5页,共3页称取一定质量HCO·2HO放入250mL烧杯中,加入40mL蒸馏水,微热(温度低于
2 2 4 2
80℃)溶解。稍冷后加入一定量无水KCO ,充分反应后生成含KHC O 和KCO 的混合
2 3 2 4 2 2 4
物。
(3)该步骤中若原料HCO·2HO和KCO 的物质的量之比为3∶2,则所得产物中
2 2 4 2 2 3
n(KHC O):n(K CO)= 。
2 4 2 2 4
(4)为防止反应过于剧烈而引起喷溅,加入KCO 应采取 的方
2 3
法。
Ⅲ.制备水合草酸铜酸钾晶体
将KHC O 和KCO 混合溶液加热至80-85℃,再将CuO连同滤纸一起加入到该溶
2 4 2 2 4
液中,充分反应至CuO沉淀全部溶解,取出滤纸后,加热浓缩、冷却结晶、过滤,淋洗,
自然晾干,称量。
(5) 淋洗时,下列溶剂最适合作洗涤溶剂的时( )
A.浓盐酸 B.无水乙醇 C.K CO 溶液
2 2 4
Ⅳ.测定水合草酸铜酸钾晶体的成分
取少量制得的样品配成溶液。用标准酸性高锰酸钾溶液滴定 、用标准EDTA溶
液滴定Cu2+,经计算样品中n(Cu2+):n( )=1∶2,假设制备的过程中Cu2+无损耗。
(6)标准酸性高锰酸钾与CO 反应的离子方程式为 _ 。
2
(7)水合草酸合铜(Ⅱ)酸钾晶体的化学式为 。
16.(14分)碱式碳酸镍 在工业上可作为制备其他含镍化合物
的原料。工业上以某含镍废渣(主要成分为 )为原料制备碱式
碳酸镍的流程如图所示。
已知:①25℃时,相关离子开始沉淀和完全沉淀的pH如下表所示,当金属离子浓度等
于10-5 mol/L时可以认为沉淀完全。
离子
开始沉淀时的pH 6.4 2.2 4.4
完全沉淀时的pH 8.4 3.5 6.7
②25℃时, 。
回答下列问题:
(1)“滤渣1”的主要成分为 (填化学式)。Ni原子的价层电子排布式为
。
试卷第6页,共3页(2)“除杂1”时,加入 溶液调节溶液pH的范围为 ≤ pH < 。
(3)“除杂2”时,加入NiS的作用是除去溶液中的 ,发生反应的离子方程式为
,该反应的化学平衡常数 (保留两位有效数
字)。
(4)“萃取”和“反萃取”的最终目的是富集获得含有 (填化学式)的水溶
液。
(5)“沉镍”时,应控制温度为95℃,反应除生成碱式碳酸镍晶体外,还有一种无色气
体,请写出该反应的离子方程式
。
(6)K [ Cu(OH) ] = 。
sp 2
17.(15分)二氧化碳催化加氢制甲醇,能助力“碳达峰”,涉及反应有:
反应①
反应②
反应③
(1) 反应②自发进行的条件是 (填“高温”、“低温”或“任意温度”),反应③
。
(2)反应③在热力学上趋势大于反应①,其原因是 。
(3)向恒温恒压的密闭容器中通入1 mol CO 和3 mol H 进行上述反应,能证明反应达到平
2 2
衡状态的是__________。
A.容器内压强不变 B.c(HO)不变
2
C.容器内密度不变 D.v(CO):v(H O)=1:1
2
(4)反应③有催化剂(乙)和无催化剂(甲)作用下的反应机理如图所示(其中标有*的为
吸附在催化剂表面上的物种,TS为过渡态),催化剂可使反应历程中决速步骤的活化能降
低
eV(eV为能量单位)。
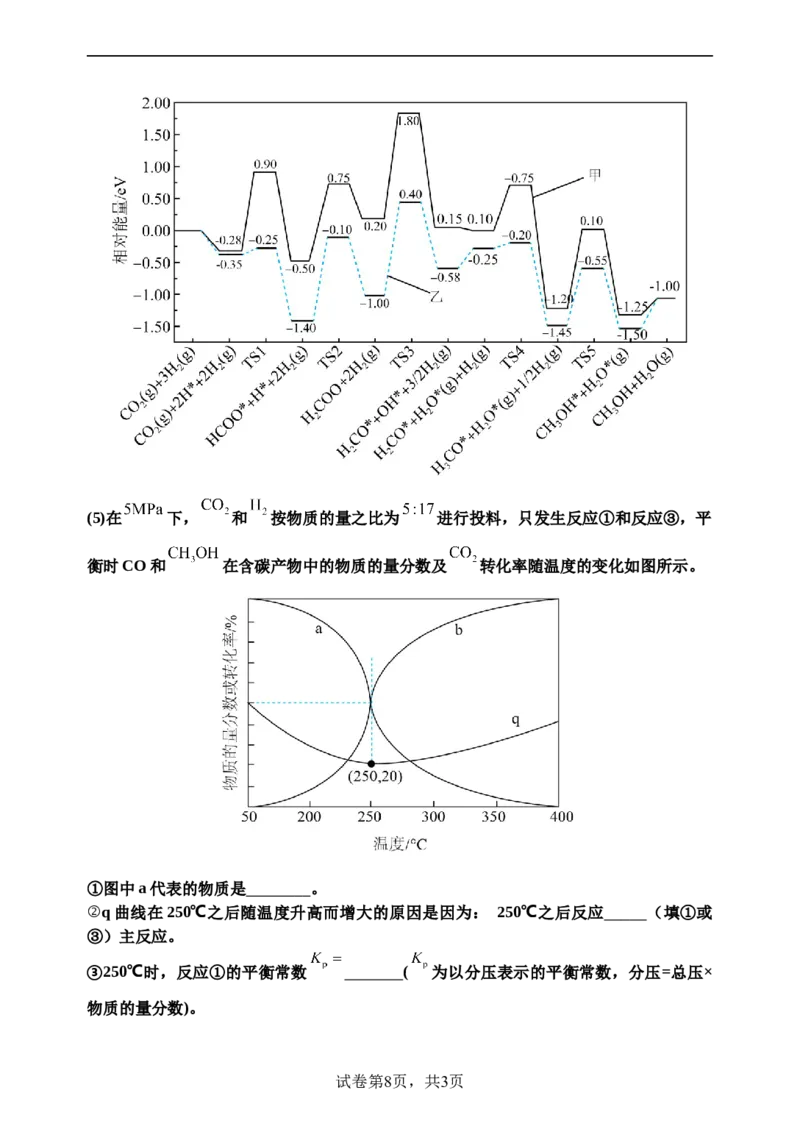
试卷第7页,共3页(5)在 下, 和 按物质的量之比为 进行投料,只发生反应①和反应③,平
衡时CO和 在含碳产物中的物质的量分数及 转化率随温度的变化如图所示。
①图中a代表的物质是 。
②q曲线在250℃之后随温度升高而增大的原因是因为: 250℃之后反应 (填①或
③)主反应。
③250℃时,反应①的平衡常数 ( 为以分压表示的平衡常数,分压=总压×
物质的量分数)。
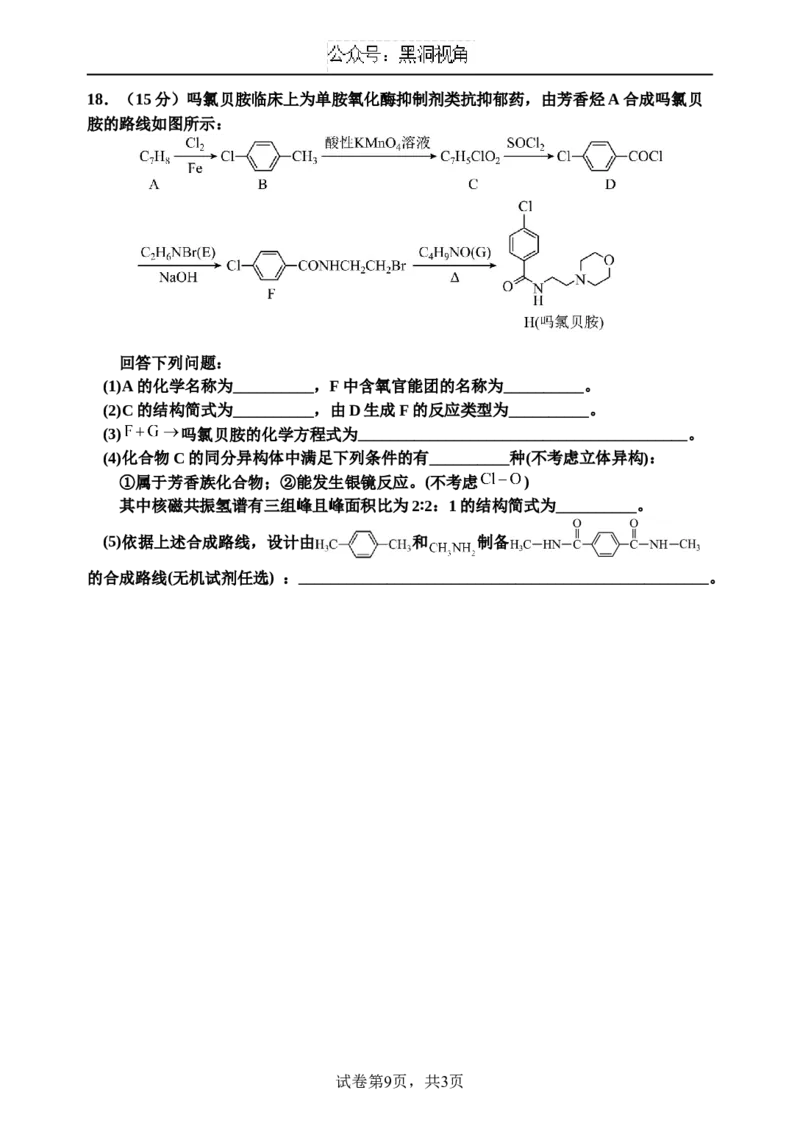
试卷第8页,共3页18.(15分)吗氯贝胺临床上为单胺氧化酶抑制剂类抗抑郁药,由芳香烃A合成吗氯贝
胺的路线如图所示:
回答下列问题:
(1)A的化学名称为__________,F中含氧官能团的名称为__________。
(2)C的结构简式为__________,由D生成F的反应类型为__________。
(3) 吗氯贝胺的化学方程式为_________________________________________。
(4)化合物C的同分异构体中满足下列条件的有__________种(不考虑立体异构):
①属于芳香族化合物;②能发生银镜反应。(不考虑 )
其中核磁共振氢谱有三组峰且峰面积比为2∶2:1的结构简式为__________。
(5)依据上述合成路线,设计由 和 制备
的合成路线(无机试剂任选) :___________________________________________________。
试卷第9页,共3页玉溪一中2024-2025学年上学期高三年级期中考
化学参考答案
一、单项选择题:每小题3分,共42分
1D 2A 3A 4B 5A 6D 7C 8C 9B 10B 11D 12C 13D 14B
二、非选择题:本题共4大题,共58分
15.(共14分,每空2分)
(1)(普通)漏斗 (2) 取少量最后一次洗涤液于试管中 ,先加盐酸酸化,再滴入氯
化钡溶液, 若无白色沉淀生成,则沉淀已洗净 (3)2∶1 (4)分批加入并搅拌
(5)B
(6) (7)K [Cu(CO)]•3H O
2 2 4 2 2
16. (共14分)
(1) (1分)、 3d8s2 (2) 3.5 (1分) 4.4 (1分)
(3) (或 ) (2分)
(2分) (4) (2分)
(5) 3Ni2+ +3CO 2-- + 4HO = NiCO ·2Ni(OH)·2HO + 2CO ↑(2分) (6 ) 1 x 10--19.6
3 2 3 2 2 2
17. (共15分)(1)低温(1分) -49(2分)
(2)反应③是放热反应,反应①为吸热反应(2分) (3)BC(2分) (4)0.20(2分)
(5) (2分) ①(2分) (2分)
18.(共15分)
(1)甲苯(1分)酰胺基(1分)(2) (2分)取代反应(2分)(3)
+ +HBr (2分)
(4) 13 (2分) (2分) (5)
答案第1页,共3页(3分)
试卷第2页,共3页