文档内容
2025 年春高河中学高二第一次月考化学试题 C.Zn、C、O的第一电离能:Zn>C>O D. 中的化学键有离子键、非极性键和极性键
12.美国科学家合成了含有的盐类,含有该离子的盐是高能爆炸物质,该
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Br 80 Ce 140 Mg-24 Fe-56
离子的结构呈“V”形,如图所示(图中箭头代表单键)。以下有关该离子的说
法中正确的是 ( )
一、选择题:本题共16小题,每小题3分,共48分。每小题只有一个选项符合题意。
1. 下列分子中,只有σ键而没有π键的是( )
A.每个N
5
+中含有35 个质子和36 个电子 B.该离子中只含有非
极性键
A. N B. CH C. CH =CH D. CH≡CH
2 4 2 2 C.1 个该离子中含有2 个π键 D.N
5
+与P4所含电子数相同
—1
2. 某原子的轨道表示式如下 ,从中得到的信息错误的是( ) 13.根据下列五种元素的电离能数据(单位:kJ .mol ),判断下列说法不正确的是 ()
A. 有2个电子层 B. 有3种能量不同的电子 元素代号 I1 I2 I3 I4
C. 最外层有3个电子 D. 有7种运动状态不同的电子 Q 2080 4000 6100 9400
3.下列说法正确的是( ) R 500 4600 6900 9500
S 740 1500 7700 10500
A. 的电子排布式 的电子排布式,违反了泡利不相容原理
T 580 1800 2700 11600
B.因硫元素核电荷数比磷元素大,故硫元素第一电离能比磷元素大
U 420 3100 4400 5900
C.电子排布式 违反了洪特规则 A.Q 元素可能是0 族元素 B.R和S均可能与U在同一主族
2 1
D. 电子的能量一般低于 电子的能量 C.U 元素可能在元素周期表的s区 D.原子的外围电子排布式为 ns np 的可能是T元
4.已知基态 R2+的核外电子排布式为[Ar]3d7 ,则有关 R 元素的说法错误的是( ) 素
A.质子数为 27 B.在周期表中位于 IIB 族 14. 一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素
C.在周期表中处于 d 区 D.属于过渡金属元素 的原子序数依次增大、且总和为24.下列有关叙述错误的是
5.下列物质变化,只与范德华力有关的是( )
A. 分子中Y原子采用 杂化B. 简单离子半径:Y>Z
C. 中并非所有原子均为8电子稳定结构
D. 第二周期中,第一电离能介于元素之间的元素共有2种
A.干冰熔化 B.乙酸汽化 C.乙醇与水混溶 D. 溶于水
15.某催化剂结构简式如图所示。下列说法错误的是 ( )
6.下列电子排布式中,表示的是激发态原子的是( )
A. 该物质中Ni为+2价
2 2 6 2 2 6 2 6 10 2
A.1s 2s 2p B.1s 2s 2p 3s 3p 3d 4s B.基态原子的第一电离能:Cl>P
2 2 3 1 2 2 6 2 6 5 1
C.1s 2s 2p 3s D.1s 2s 2p 3s 3p 3d 4s 2
C. 该物质中C 和P 均采取sp 杂化
7.下列有关共价键参数的比较中,不正确的是( )
8 2
A.键能:C -NBr-Br >Cl-Cl D. 基态Ni原子价电子排布式为3d 4s
C.分子中的键角:H2O >CH4 D.乙烯分子中碳碳键的键能:σ 键>π键 16.已知某晶体的晶胞如图所示,晶胞参数为 a nm,摩尔质 量 为 M
g·mol-1。下列说法正确的是
8. HCHO与[Zn(CN)4]2-在水溶液中发生反应,下列有关说法正确的是
A. [Zn(CN) ]2-中存在共价键和离子键 B. HCHO中碳原子以sp2的形式杂化
4
C. CN-中的σ键和π键数目相同 D. Zn 原子的3d能级中有空轨道
9.配合物Na [Fe(CN) ]可用于离子检验,下列说法不正确的是
3 6
A. 该配合物中存在离子键、配位键、极性键、非极性键
B. 配离子为[Fe(CN)6]3-,中心离子为Fe3+,配位数为6
C. 该配合物可以用于检验溶液中的Fe2+ A. 离A微粒距离最近且相等的B微粒的个数为6
D. 该配合物为离子化合物
10.Q、W、X、Y、Z是元素周期表中原子序数依次增大的前四周期元素,Q是宇宙中含量最多的 B. 若m的坐标为(0,0,0),则p的坐标为( ,1)
元素;W与X同周期,W基态原子有3个未成对电子,X元素原子的价层电子排布为 ;Y C. 相邻两个C微粒最近距离为a nm
元素的原子半径在同周期中最大(稀有气体除外);Z元素最高能层只有1个电子,其余能层均充满 D. 该晶胞的密度为×1021 g·cm-3
电子。下列说法错误的是( )
二、填空题(52分)
A.电负性: B.第一电离能:
17.(1)基态Cu原子的价层电子排布式为___________;位于元素周期表__________区。
C.Z原子核外有7种能量不同的电子 D. 是含有极性键和非极性键的非极性分子 (2)已知电负性H 2.1、Si 1.8,则SiH 中Si的化合价为__________。
4
11.《本草纲目》中记载炉甘石(主要成分为)可止血、消肿、生肌、明目等。下列说法正确的是( (3)基态Ge原子有___________种不同能量的电子。
) (4)基态原子核外电子填充在5个轨道中的元素有_____________(填元素符号)。
A.Zn元素位于元素周期表第四周期第IIB族、d区 B.Zn、C、O的电负性:O>C>Zn18.配合物在许多方面有着广泛的用途,目前我国科学家利用配合物在能源转化与储存方面有着
杰出的贡献,请根据题意回答下列问题:(已知:在溶液中为橙色,在溶液中为黄色)
(1)下列反应曾用于检测司机是否酒后驾驶:
2 + 3CH CH OH + 16H+ + 13H O → 4[Cr(H O) ]3+ + 3CH COOH
3 2 2 2 6 3
①基态Cr原子价层电子排布图为_____________;配合物[Cr(H O) ]3+中与Cr3+形成配位键的原子是
2 6 ①BI 的空间结构为______________。
______________(填元素符号)。 3
②CH CH OH与H O可以任意比例互溶,除因为它们都是极性分子外,还因为____________。 ②BAs的晶胞结构如图2所示,该晶胞中As的配位数为___________。
3 2 2
(2)有下列实验:
20.卤素钙钛矿已经被广泛应用于太阳能电池、发光二极体等领域,其中合成二维/三维(2D/3D)的钙
钛矿异质结是提升器件稳定性和转换效率的一个策略,近期化学工作者在气相合成的单晶三维钙
钛矿CsPbBr3上合成外延生长的水平和垂直的二维钙钛矿
+
(PEA)2PbBr4(PEA 代表 )异质结构。回答下列问题:
(1)基态Br原子的价电子排布式为______________________。
①呈天 蓝
色的离子的化学式为__________,溶剂X可以是__________(填名称),继续添加氨水,沉淀溶解的
(2)PEA
+
中N的价层电子对数为_________,杂化轨道类型为___________,PEA
+
中涉及元素
离子方程式为___________________。
②该实验能说明NH 、H O与Cu2+结合的能力由强到弱的顺序是________________。
的电负性由大到小的顺序为______________
3 2
③下列有关化学实验的“操作→现象→解释”均正确的是___________。 2- 2- 2-
(3)已知铅卤化合物中存在正四面体构型的[PbCl4] 、[PbBr4] 、[PbI4] ,已知[Pb2I6]2-中每个
选项 操作 现象 解释 Pb 均采用四配位模式,则[Pb2I6]2-的结构式为______________。
A 向某溶液中滴加KSCN溶液 产生红色沉淀 Fe3++3SCN-=Fe(SCN) ↓ (4)Br2和碱金属单质形成的MBr熔点如表:
3
已知Cr3+的配位数为6,则 MBr NaBr KBr RbBr CsBr
向由0.1molCrCl ·6H O配成 产生0.2mol沉
B 3 2 CrCl ·6H O的化学式可表示为
的溶液加入足量AgNO 溶液 淀 3 2 熔点/℃ 747 734 693 636
3 [Cr(H O) Cl]Cl ·H O
2 5 2 2
向溶液K Cr O 溶液中先滴加 溶液先橙色加
2 2 7 溶液中存在 +H O 2
C 3滴浓硫酸,再改加10滴浓 深,后变为黄 2 等量NaBr、KBr、RbBr、CsBr同时开始加热优先导电的是_____________(填化学式)
NaOH 色 +2H+
AgCl不溶于水,但溶于氨水,重新电离
D 向AgCl悬浊液中滴加氨水 沉淀溶解
成Ag+和Cl-
19. 砷的利用是一把锋利的双刃剑,砷是制造新型半导体的材料,但砷的化合物具有较强毒性。
(1)利用反应C H +AsCl CHCl=CHAsCl 可以制造毒气。
2 2 3 2
①As原子核外未成对电子数为___________。
② C H 分子中 N(π 键)∶N(σ 键)=___________。写出一种与 AsCl 分子空间结构相同的物质:
2 2 3
___________(填化学式)。
(2)二苯氰胂(分子结构如图1所示)是战争中的一种化学武器。二苯氰胂分子中 sp杂化的碳原子
个数与sp2杂化的碳原子个数之比为___________。
(3)通过反应4BI +As 4BAs+6I ,可合成具有极高导热性的半导体新材料BAs。
3 4 2
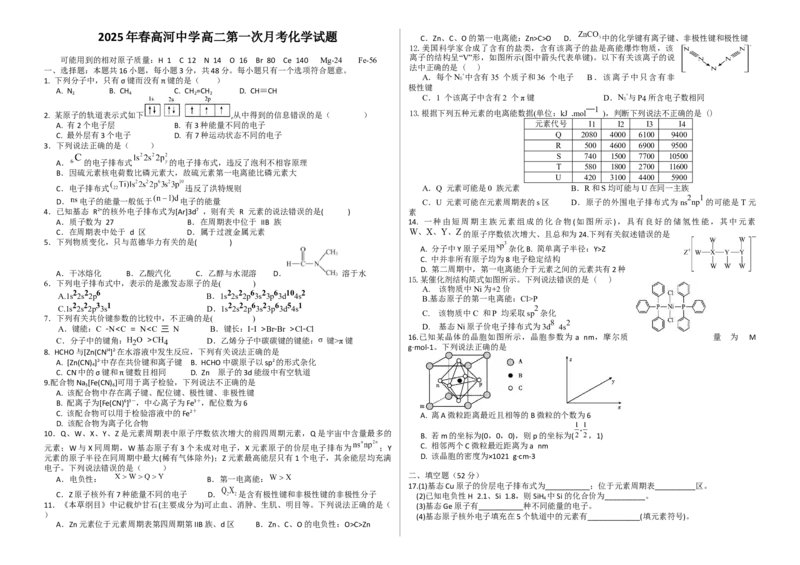
高二月考化学答案1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
B C D B A C A B A D B B B D C D
17.(10分每空2分)(1) 3d 10 4s 1 ds
(2)+4 (3)8 (4)N、O、F、Ne
18.(18分每空2分) O H O与CH CH OH分子间能形成氢键
2 3 2
[Cu(H O) ]2+乙醇Cu(OH) +4NH =[Cu(NH ) ]2++2OH-NH >H O BC
2 4 2 3 3 4 3 2
19.(12分每空2分)(1) ①. 3 ②. 2 ∶ 3 ③. NH 3
(2) 1 ∶ 12 (3) ①. 平面三角形 ②. 4
2 5 3
20.(12分每空2分)(1)4s 4p (2)4sp N>C>H
( 3 ) (4) CsBr