文档内容
2025 届高三第四阶段模拟考试化学试卷答案与解析
1.答案 B
解析 A.墨的主要成分炭黑是一种无定形碳,炭黑与金刚石均是由碳元素组成的
两种不同的单质,互为同素异形体,故A正确;B.我国古代绘画所用的“绢”是丝
织品,是天然高分子,故B 错误;C.雾属于胶体,有丁达尔效应是因为胶体粒子
对光有散射作用,故C 正确;D.白铜是铜与镍的合金,比纯铜硬度大,熔点低,
故D正确。
2.答案 D
解析 二氧化硅是共价晶体,无分子式,A 错误;SO 中S 的价层电子对数为 2
2
1
+ ×(6-2×2)=3,VSEPR模型为平面三角形,C 项错误,基态Fe2+的价层电子
2
中 3d 轨道上有 6 个电子,4s 轨道上没有电子,其价层电子轨道表示式为
。
3.答案 D
解析 A.制备普通玻璃的原料是纯碱、石灰石和石英砂,与 Na CO 溶液呈碱性
2 3
无关,A错误;B.熔化状态下的氧化铝能导电,且自然界中铝以铝土矿的形式存
在,故氧化铝可用于电解铝,B 错误;C.氢氧化铝具有弱碱性,可用于治疗胃酸
过多,C 错误;D.铁粉具有还原性,可用于食品袋中的抗氧化剂,D正确。
4.答案 A
解析 F 原子半径小,电子云密度大,两个原子间的斥力较强,F—F 不稳定,
因此F—F 的键能小于Cl—Cl 的键能,与电负性无关,A 符合题意;氟的电负性
大于氯的电负性,F—C 的极性大于Cl—C 的极性,使 F C—的极性大于 Cl C—
3 3
的极性,导致三氟乙酸的羧基中的羟基的极性更大,更容易电离出氢离子,酸性
更强,B不符合题意;氟的电负性大于氯的电负性,F—H的极性大于Cl—H 的
极性,导致HF 分子极性强于HCl,C不符合题意;氟的电负性大于氯的电负性,
与氟原子相连的氢原子可以与另外的氟原子形成分子间氢键,因此气态氟化氢中
存在(HF) ,D不符合题意。
2
5.答案 D
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}解析 A项,根据图中信息可知,NO 被氧气氧化得到硝酸盐,氮元素被氧化,
x
硝酸盐被还原产生氮气,氮元素被还原,错误;B项,催化剂参与储存和还原过
程,但反应前后质量和
化学性质不变,错误;C项,还原过程中氮元素从+5价降为0价,故生成0.1mol
N ,转移电子数为 N ,错误;D 项,三效催化剂能有效实现汽车尾气中 CO、
2 A
C H 、NO 三种成分的净化,将其转化为无污染的气体再排放,正确。
x y x
6.答案 D
解析 该有机物存在碳碳双键,且双键两端的碳原子分别连有互不相同的原子或
原子团,故该有机物存在顺反异构,A正确;该有机物含有羟基、羧基、碳碳双
键、醚键和酰胺基5种官能团,B 正确;该有机物中含有羧基、羟基,可形成
分子内氢键和分子间氢键,C 正确;1mol该有机物含有羧基和酰胺基各1mol,
这两种官能团都能与强碱反应,故 1 mol 该物质最多可与 2 mol NaOH 反应,D
错误。
7.答案 D
解析 ①中碱石灰可吸收 Cl ,b 常用于防倒吸,A 项能达到实验目的;②关闭
2
止水夹时,产生的 CO 将盐酸压入左侧,大理石与盐酸分离,反应停止,打开
2
止水夹时,CO 气体排出,压强减小,盐酸又流回右侧与大理石反应产生CO ,
2 2
B 项能达到实验目的;③中大试管中 Cu 与浓硫酸反应生成SO 气体,若小试管
2
中酸性KMnO 溶液褪色,则证明SO 具有还原性,C 项能达到实验目的;④中
4 2
KHCO 受热不稳定,X中应放的物质是KHCO ,D项不能达到实验目的。
3 3
8.C
解析 乙二胺的结构式为 ,所以1mol 乙二胺分子中含有11N
A
个σ键,A 正确;乙二胺分子中氮原子有3个σ键,还有一个孤电子对,轨道的杂
化类型为 sp3,B 正确;Cu2+与乙二胺形成的配离子内部含有 H—N 等极性键、
C—C非极性键、配位键,但不含有离子键,C 错误。
9. C
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}解析 短周期元素 X、Y、Z、W 的原子序数依次增大,其中 Z 原子 S 轨道上的
电子和 P 轨道上的电子数相等,化合物 A 中Z 形成 2个共价键,可知 Z 为O,
W的单质常温下是黄绿色气体,W为Cl;化合物A中X形成4个共价键,Y 与
X形成共价三键,结合原子序数大小可知X为C,Y为N。工业上可采用电解饱
和食盐水的方法制备氯气,同时生成氢气和氢氧化钠,故A正确;第一电力能Y
(N)>Z(O)>X(C),正确;N、O、H组成的化合物硝酸铵为离子化合物,
是离子晶体,故C错误;化合物B 中含有酚羟基,化合物A中没有,则可用FeCl3
溶液鉴别化合物A和B,D正确。
10. D
解析 工业上的氯碱工业(制备烧碱和氯气)用的是阳离子交换膜,故A 错误;
通入空气的目的是稀释 ClO ,防止 ClO 浓度过高而分解爆炸,故 B 错误;“吸
2 2
收塔”内发生反应的化学方程式为 2NaOH+2ClO +H O ==2NaClO +2H O+O ,故
2 2 2 2 2 2
C错误;含NaClO 的滤液通过蒸发浓缩、冷却结晶、过滤得到粗晶体NaClO ·3H O,
2 2 2
得到的粗晶体经过重结晶可得到纯度更高的晶体,故D正确。
11. C
1 1
解析 根据均摊法,Fe N 的晶胞中Fe 原子数是8× +6× =4,N 原子数是1,
x y
8 2
该Fe N 的化学式为 Fe N,故 A 错误;N 原子位于晶胞体心,与 N 等距且最近
x y 4
的N为6个,故B错误;两个a位置Fe 的最近距离为面对角线的一半,面对角
2
线为 2a pm,所以两个 a 位置Fe 的最近距离为 apm,故C 正确;能量越低
2
越稳定,Cu完全替代该晶体中b位置Fe 形成的物质能量低,稳定性强,晶胞中
1 1
铜原子数是8× =1,铁原子数是6× =3,N 原子数是1,化学式为Fe CuN,故
3
8 2
D错误。
12.B
解析 由题图可知,a极为负极,b极为正极,则隔膜1为阴离子交换膜,隔膜
2为阳离子交换膜,才能使模拟海水中的氯离子移向负极,钠离子移向正极,达
到海水淡化的目的,B项错误;电路中有1mol 电子通过时,则电解质溶液中有
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}1mol钠离子移向正极,1mol 氯离子移向负极,C项正确;负极反应:CH COO
3
-+2H O-8e-===2CO ↑+7H+,正极反应:2H++2e-===H ↑,根据电荷守恒,
2 2 2
正、负极产生气体的物质的量之比为2∶1,A、D项正确。
13.C
解析 中环上由5个原子参与成键,与乙基相连的N 原子提供2
个电子,每个碳原子提供 1 个电子,与甲基相连的 N 原子提供 1 个电子,故该
大π键应表示为Π6,A正确;Al Cl -中每个Al 原子周围形成4个共用电子对,则
5 2 7
其结构式为 ,各原子最外层均达到8电子稳定结构,
B 正确;单键为σ键,一个双键中含有一个σ键和1个π键,1mol EMIM+中所含σ
键数为19N ,C 错误;氮原子上连 H原子易形成分子间氢键,为防止离子间形
A
成氢键而发生聚沉,使该离子不易以单个形式存在,所以与N 原子相连的—CH 、
3
—C H 不能被氢原子替换,D正确。
2 5
14. B
解析 根据图示可知,P 时c(NH+)=c(NH ·H O)=0.05mol·L-1,溶液中存在电荷
1 4 3 2
守恒:c(H+)+c(NH+)=c(OH-)+c(Cl-),P 点溶液pH=9.25,则c(OH-)>c(H+),
4 1
因此c(Cl-)<0.05mol·L-1,A错误;根据电荷守恒:c(H+)+c(NH+)=c(OH-)+c(Cl
4
-),根据图示可知,P 时c(NH+)>c(NH ·H O),则c(H+)+c(NH+)>c(NH ·H O),
2 4 3 2 4 3 2
n HCl
所以c(NH ·H O)<c(OH-)+c(Cl-),B正确;根据图示可知,P 时t=
3 2 3
n NH ·H O
3 2
=1.0,溶液的溶质为NH Cl,根据元素质量守恒可得c(Cl-)=c(NH+)+c(NH ·H O),
4 4 3 2
所以 c(NH+)+c(NH ·H O)<c(Cl-)+c(H+),C 错误;25℃时,NH ·H O的电离
4 3 2 3 2
c NH+ ·c OH-
平衡常数K = 4 ,当溶液中c(NH+)=c(NH ·H O)时,pH=9.25,
b 4 3 2
c NH ·H O
3 2
则K =c(OH-)=10-4.75,D 错误。
b
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}15.【答案】(1)ClO H OOH HClO
2
(2)ClO 2I H OI Cl 2OH
2 2
(3)向pH10的NaOH 溶液中加入少量滴有淀粉溶液的碘水,振荡,蓝色褪去
(4) ①. 溶液中的Cl 或HClO也可将 I氧化为I ,使溶液变蓝
2 2
②. 加热pH 2的溶液至无色,使黄绿色气体(或Cl )充分逸出,使HClO完全分
2
解,冷却后再加入KI溶液 ③. 3ClO I 3Cl IO
3
【解析】
【分析】题给信息酸性条件下IO不能氧化Cl,可以氧化 I,取实验Ⅱ所得溶
3
液,滴加稀硫酸至过量,整个过程均未出现蓝色,说明没有生成碘,一段时间后
有黄绿色刺激性气味的气体产生,应生成Cl ,由ClO和氯离子在酸性条件下反
2
应生成,测得溶液的pH 2。此时应加热,除去氯气和HClO,再加入KI 溶液,
溶液变蓝,说明实验Ⅱ所得溶液中存在IO。
3
【小问1详解】
0.5mol⋅ L-1NaClO溶液的pH 11显碱性,原因是ClO-发生水解反应生成HClO
和OH-,反应的离子方程式为:ClO H OOH HClO;
2
【小问2详解】
实验I中溶液变为浅黄色,说明有碘单质生成,NaClO氧化KI 生成I ,自身被
2
还原为NaCl,反应的离子方程式为:ClO 2I H OI Cl 2OH ;
2 2
【小问3详解】
证明I 在碱性溶液中不能存在,可向NaOH 溶液中滴加滴有淀粉溶液的碘水,观
2
察溶液是否褪色,实验Ⅲ的操作及现象是:向pH10的NaOH 溶液中加入少量
滴有淀粉溶液的碘水,振荡,蓝色褪去;
【小问4详解】
①因溶液中的Cl 或HClO 也可将 I氧化为I ,使溶液变蓝,则此实验不能说明
2 2
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}实验Ⅱ所得溶液中存在IO。
3
②欲证明实验Ⅱ所得溶液中存在IO,改进的实验方案是加热pH 2的溶液至无
3
色,使黄绿色气体(或Cl )充分逸出,使HClO完全分解,冷却后再加入KI 溶液;
2
③实验Ⅱ中ClO和 Cl-发生氧化还原反应生成 Cl-和IO,反应的离子方程式是
3
3ClO I 3Cl IO。
3
16.【答案】(1)CuO+H SO =CuSO +H O
2 4 4 2
(2)2Cu2++2Cl-+SO +2H O=2CuCl↓+ SO 2-+4H+
2 2 4
(3)KSCN溶液或硫氰化钾溶液
(4)43.5
(5)若继续通入 CO ,则会生成 KHCO ,由于与碳酸钾相比,碳酸氢钾溶解
2 3
度与高锰酸钾溶解度相差不是很大,会使得到的高锰酸钾粗品中含有较多的杂质
KHCO 稀醋酸
3
63.2
(6)
m
【解析】混合氧化物加 NaOH 碱浸,由题干信息可知 ZnO 溶于 NaOH,其
他固体不溶,过滤得滤渣,将滤渣溶于硫酸,其中CuO、Fe O 溶于硫酸生成硫
2 3
酸铜和硫酸铁,二氧化锰不溶于硫酸,过滤后滤液中通入二氧化硫再加NaCl 将
铜还原为CuCl沉淀,同时硫酸铁被还原为硫酸亚铁,硫酸亚铁溶于经浓缩结晶
得到晶体;二氧化锰固体加KOH 熔融通空气,生成K MnO ,K MnO 溶液中通
2 4 2 4
二氧化碳调节pH值10-11发生歧化反应得到高锰酸钾。(1)Cu 为29号元素,基
态Cu 原子核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;(2)酸浸时氧化
铜与稀硫酸反应生成硫酸铜和水,反应方程式为:CuO+H SO =CuSO +H O,故
2 4 4 2
答案为:CuO+H SO =CuSO +H O;(3)“去铜”时,除了生成CuCl 外,还有SO 2-、
2 4 4 2 4
H+生成,可知 1mol 铜离子得 1mol 电子生成 CuCl,1mol 二氧化硫失 2mol 电子
生 成 SO 2- , 根 据 得 失 电 子 守 恒 及 元 素 守 恒 得 反 应 离 子 方 程 式 :
4
2Cu2++2Cl-+SO +2H O=2CuCl↓+SO 2-+4H+;(4)检验三价铁离子可用 KSCN 溶液
2 2 4
或 硫 氰 化 钾 溶 液 ; (5)“ 熔 融 ” 时 MnO 转 化 为 K MnO , 反 应 为 :
2 2 4
MnO +O +4KOH=2K MnO +2H O,该反应中每转移1mol电子,消耗0.5molMnO ,
2 2 2 4 2 2
质量为 43.5g;(6)通入 CO 至溶液pH 达10~11时,应停止通入,若继续通入会
2
使碱性减弱,生成 KHCO ,与碳酸钾相比,碳酸氢钾溶解度与高锰酸钾溶解度
3
相差不是很大,会使得到的高锰酸钾粗品中含有较多的杂质;可以替代 CO 的
2
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}试剂应选弱酸醋酸,弱酸便于控制溶液pH值;(7)酸性条件下KMnO 与Na C O
4 2 2 4
反应,生成 Mn2+和CO 。根据得失电子守恒可得关系式:2KMnO ~5Na C O ,
2 4 2 2 4
2
n(Na C O )=0.5mol/L×0.02L=0.01mol , 则 n(KMnO )= n(Na C O )=
2 2 4 4 2 2 4
5
2 0.004mol158g/mol 63.2
×0.01mol=0.004mol,KMnO 样品的纯度为 100% %。
4
5 mg m
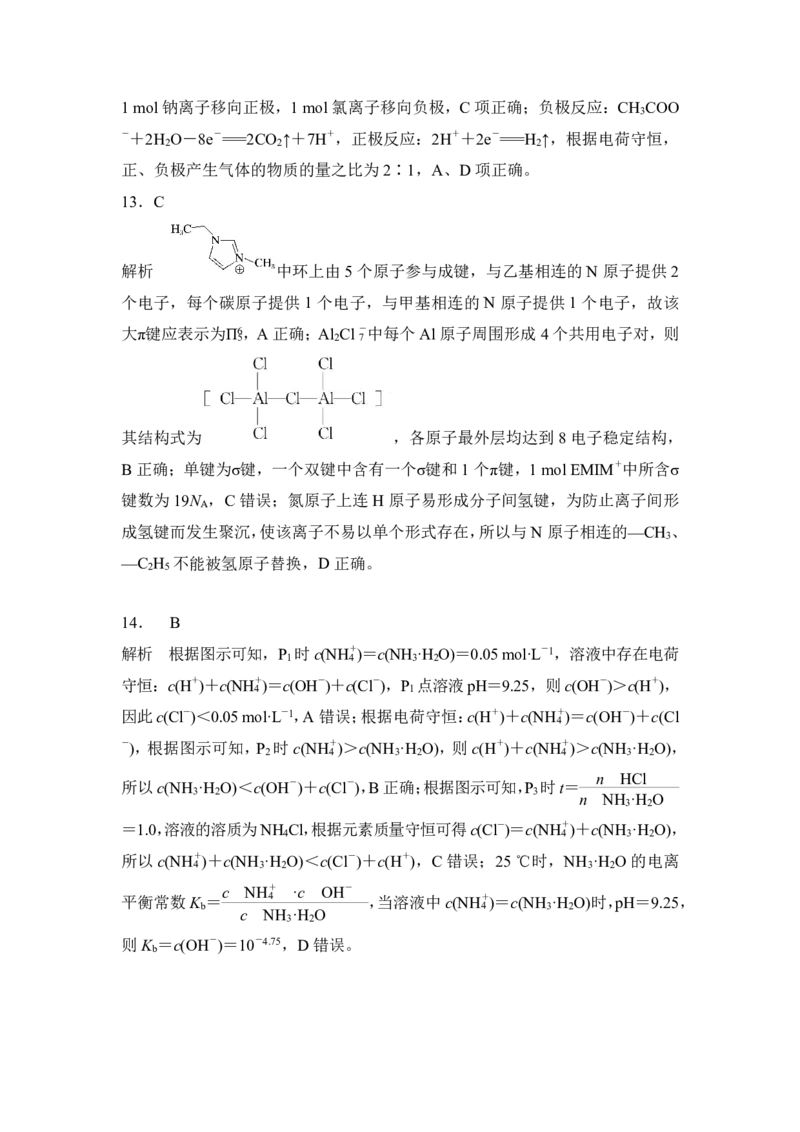
17.评分细则:第1空1分,其他每空2分,合成路线3分,共16分。
(1) 取代反应或酯化反应
(2) 丙酮 4
(3)cd
(4)
(5)乙二胺分子间存在氢键,沸点高
(6)
(7)
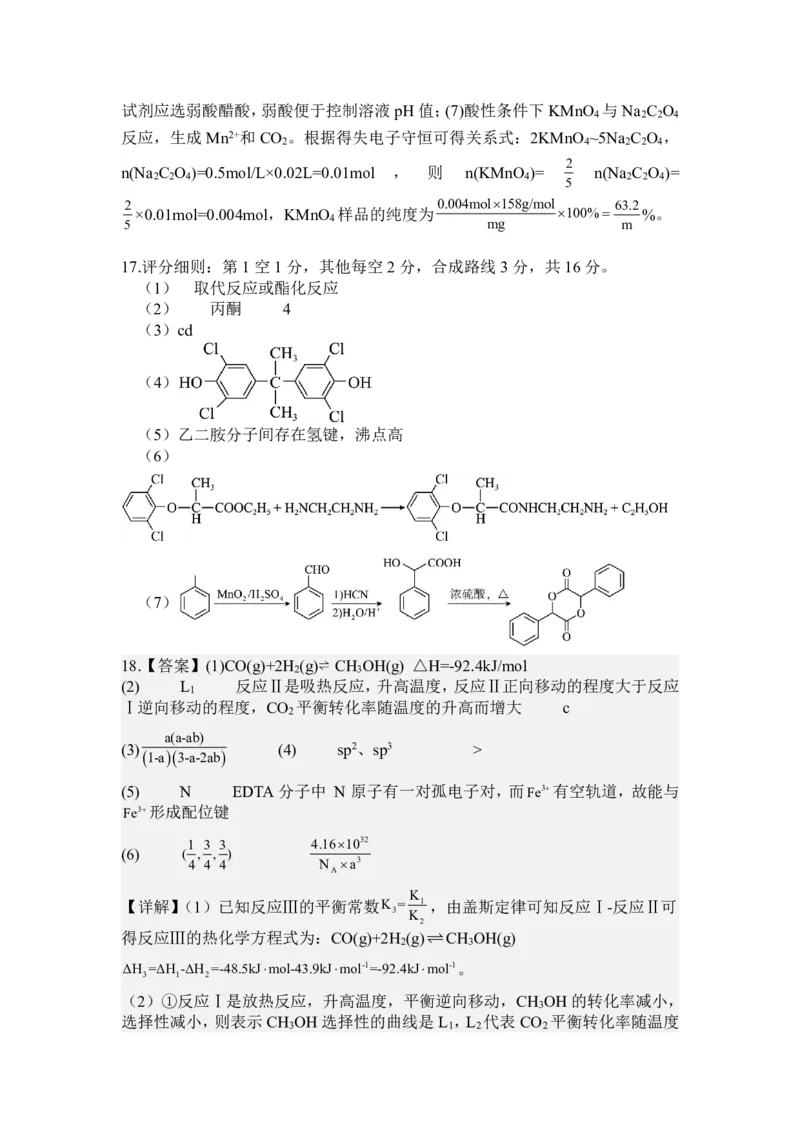
18.【答案】(1)CO(g)+2H (g)⇌ CH OH(g) △H=-92.4kJ/mol
2 3
(2) L 反应Ⅱ是吸热反应,升高温度,反应Ⅱ正向移动的程度大于反应
1
Ⅰ逆向移动的程度,CO 平衡转化率随温度的升高而增大 c
2
a(a-ab)
(3) (4) sp2、sp3 >
1-a3-a-2ab
(5) N EDTA分子中 N 原子有一对孤电子对,而 Fe3有空轨道,故能与
Fe3形成配位键
1 3 3 4.161032
(6) ( , , )
4 4 4 N a3
A
K
【详解】(1)已知反应Ⅲ的平衡常数K = 1 ,由盖斯定律可知反应Ⅰ-反应Ⅱ可
3 K
2
得反应Ⅲ的热化学方程式为:CO(g)+2H (g)CH OH(g)
2 3
ΔH =ΔH -ΔH =-48.5kJmol-43.9kJmol-1=-92.4kJmol-1。
3 1 2
(2)①反应Ⅰ是放热反应,升高温度,平衡逆向移动,CH OH的转化率减小,
3
选择性减小,则表示CH OH 选择性的曲线是L ,L 代表CO 平衡转化率随温度
3 1 2 2
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}变化的曲线,反应Ⅱ是吸热反应,升高温度,反应Ⅱ正向移动的程度大于反应Ⅰ
逆向移动的程度,CO 平衡转化率随温度的升高而增大;
2
②由图可知,320°C ,nCO :nH =1:4时,CH OH选择性较大,同时CO 的转
2 2 3 2
化率也较大,故选c。
(3)根据已知条件列出“三段式”
CO g + 3H g CH OH g + H O g
2 2 3 2
起始mol
1 3 0 0
转化mol
x 3x x x
平衡mol
1-x 3-3x x x
CO g + H g COg + H Og
2 2 2
起始mol
1-x 3-3x 0 x
转化mol
y y y y
平衡mol
1-x-y 3-3x-y y x+y
xy x
充分反应后,测得CO 平衡转化率为 =a,CH OH选择性为 =b,解得
2 1 3 xy
x=abmol,y=(a-ab)mol,平衡时n(CO )=(1-a)mol,n(H )=(3-a-2ab)mol,
2 2
n(CO)=(a-ab)mol,n(H O)=amol,n(CH OH)=abmol,则该温度下反应Ⅰ的平衡常
2 3
a a-ab
p p
数K = 4-2ab 4-2ab = a(a-ab) 。
p 1-a 3-a-2ab 1-a3-a-2ab
p p
4-2ab 4-2ab
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}