文档内容
友好学校第七十六届期末联考
高三化学
说明:本试卷共19题,满分100分,共8页。考试用时90分钟。
注意事项:
1.答题前,考生先将自己的姓名、准考证号填写清楚,将条形码粘贴到条形码区域内。
2.选择题必须用2B铅笔填涂;非选择题必须用0.5mm黑色中性笔书写,字体工整,笔迹清
楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效,在草
纸、试题卷上答题无效。
4.保持卡面清洁,不要折叠,不要弄破、弄皱、不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:H-1O-16N-14C-12Na-23Fe-56
第I卷(选择题 共45分)
一、选择题:(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1. 化学与生产、生活密切相关。下列做法或说法错误的是
A. 将煤气中毒患者移至空气流通处进行救治
B. 医用药品常在低温、干燥的环境中密封保存
C. 农业生产中草木灰和铵态氮肥混合使用以增加肥效
D. 和 溶液可作为焊接除锈剂
的
2. 下列过程中,涉及化学变化 是( )
A. 用黏土制作陶坯 B. 甘油加水作护肤剂
C. 用熟苹果催熟猕猴桃 D. 用四氯化碳擦去圆珠笔油渍
3. 下列说法不正确的是
A. 浙糯4号糯米或赤霞珠葡萄都可以用来酿酒
B. 福尔马林能使蛋白质变性,常用于浸制生物标本
C. 油脂属于高分子化合物,可用于制造肥皂和油漆
D. 食物中的纤维素能刺激肠道蠕动,有助于消化,但不能为运动时提供能量
4. 下列化学反应的离子方程式正确的是
A. 在H18O中投入NaO 固体:2 H 18O+2Na O=4Na+ +4OH-+18O↑
2 2 2 2 2 2 2
第1页/共9页
学科网(北京)股份有限公司B. 向AlCl 溶液中加入过量的浓氨水: Al3++4NH·H O = AlO +4 +2H O
3 3 2 2
C. 向FeI 溶液中通入少量Cl:2Fe2++ Cl =2Cl-+2Fe3+
2 2 2
D. Fe O 溶于稀硝酸的反应:3Fe O+28H++ =9Fe3++NO↑+14H O
3 4 3 4 2
的
5. 向下列溶液中逐渐通入 至过量,最终体系中无沉淀 是
A. B.
C. D.
6. 为阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,4.48LCO中含有的分子数为
B. 稀盐酸中,氢原子的数目为0.05
C. 在足量 中燃烧,消耗 时,转移的电子数为2
D. 标准状况下,22.4L 含有的原子数为3
7. 下列表示不正确的是
A. 羟基的电子式: B. 氯乙烯的结构简式:
C. 基态亚铁离子的电子排布式: D. 分子的球棍模型:
8. 不能说明氯的非金属性强于溴的事实是( )
A. HClO 酸性强于HBrO B. HBr的分解温度低于HCl
4 4
C. FeBr 溶液中滴少量氯水,溶液变黄 D. BrCl中氯为﹣1价
2
的
9. 目前人工固氮普遍采用 是氨的工业合成。氢气与氮气在固体催化剂表面合成氨的过程如下图所示。
下列说法错误的是
A. ②→③释放能量
第2页/共9页
学科网(北京)股份有限公司B. 为了提高氨的脱附速率,应适时地将氨从反应后的混合气体中分离出来
C. 该过程中包含旧化学键的断裂和新化学键的生成
D. 该催化剂可提高单位时间生成物的产率
10. 下列实验操作,现象与结论匹配的是
选
操作 现象 结论
项
将缠绕铜丝灼烧后反复插入盛乙醇的试管,然后滴入酸 酸性高锰酸钾溶 乙醇催化氧化生成乙
A
性高锰酸钾溶液 液褪色 醛
2NO (g) NO(g)Δ
B 将装有NO 的平衡球放入热水中 颜色加深 2 2 4
2
H>0
向含0.1mol的FeI 溶液中通入0.1molCl ,再滴加淀粉
C 2 2 溶液变蓝色 还原性:I->Fe2+
溶液
向碳酸钠溶液中加入稀硫酸,反应产生的气体通入苯酚
D 溶液变浑浊 酸性:碳酸>苯酚
钠溶液中
A. A B. B C. C D. D
11. 下列叙述正确的是
A. 常温下,将pH=1的稀盐酸与pH=13的BOH溶液等体积混合,所得溶液pH一定为7
B. 常温下,将pH=9的 溶液与pH=9的NaOH溶液混合,混合溶液pH一定为9
C. 常温时, , ,等浓度的上述两种酸分别与NaOH固
体反应后呈中性,忽略溶液体积变化则溶液中:
D. 已知 ,向盛有 溶液的试管中加入适量 ,振荡静置后 层显紫红色,说明
在 中的溶解度比在水中的大
12. 高铁酸钠( )是一种绿色消毒剂,可用于饮用水处理。制备高铁酸钠的离子方程式为
,则下列说法不正确的是
A. 在反应中 被还原,发生氧化反应
第3页/共9页
学科网(北京)股份有限公司B. 氧化剂与还原剂的物质的量之比为3:2
C. 上述反应生成1mol高铁酸根离子,转移3mol电子
D. 高铁酸根离子具有强氧化性,溶于水能生成氢氧化铁胶体和氧气
13. 五种短周期主族元素X、Y、Z、M、Q的原子序数依次增大,X的2p轨道半充满,Y的s能级电子数
和p能级电子数相等, Z是至今发现的电负性最大的元素,M在元素周期表中处于周期序数等于族序数的
位置,Q的单质被广泛用作半导体材料。下列叙述中不正确的是
A. 元素的第一电离能:XX>Y
D. 最高价氧化物对应的水化物的酸性:X>Q>M
14. 一种新型的锂—空气二次电池的工作原理如图所示。下列说法中错误的是
A. 电路中有2mol电子通过时,水性电解液的质量增加16g
B. 催化剂可以吸附氧气,促进氧气得电子发生还原反应
C. 电池充电时,电子从电源负极流向锂电极,锂电极作阴极
D. 固体电解质既可以传递离子又可以起到隔膜的作用
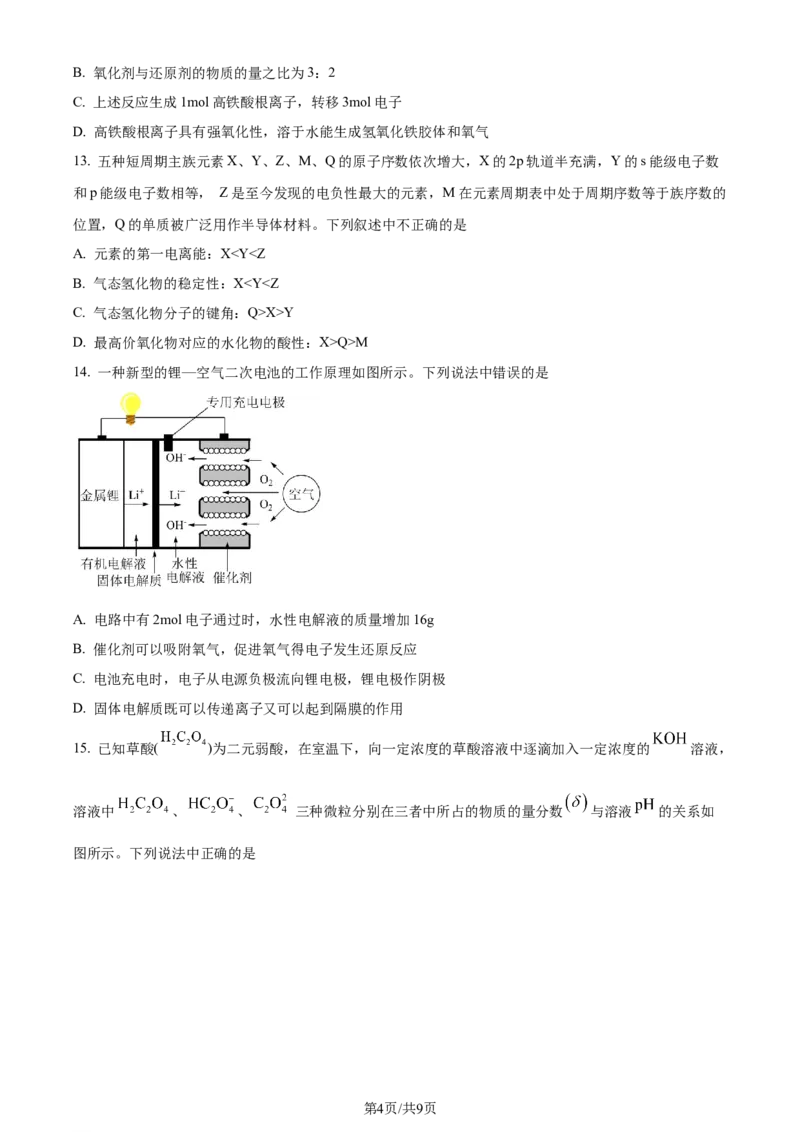
15. 已知草酸( )为二元弱酸,在室温下,向一定浓度的草酸溶液中逐滴加入一定浓度的 溶液,
溶液中 、 、 三种微粒分别在三者中所占的物质的量分数 与溶液 的关系如
图所示。下列说法中正确的是
第4页/共9页
学科网(北京)股份有限公司A. 室温时, 的水解平衡常数
B. 当溶液 时,
C. 当溶液 时,
D. A点溶液加水稀释,则水的电离程度减小
第II卷 非选择题(共55分)
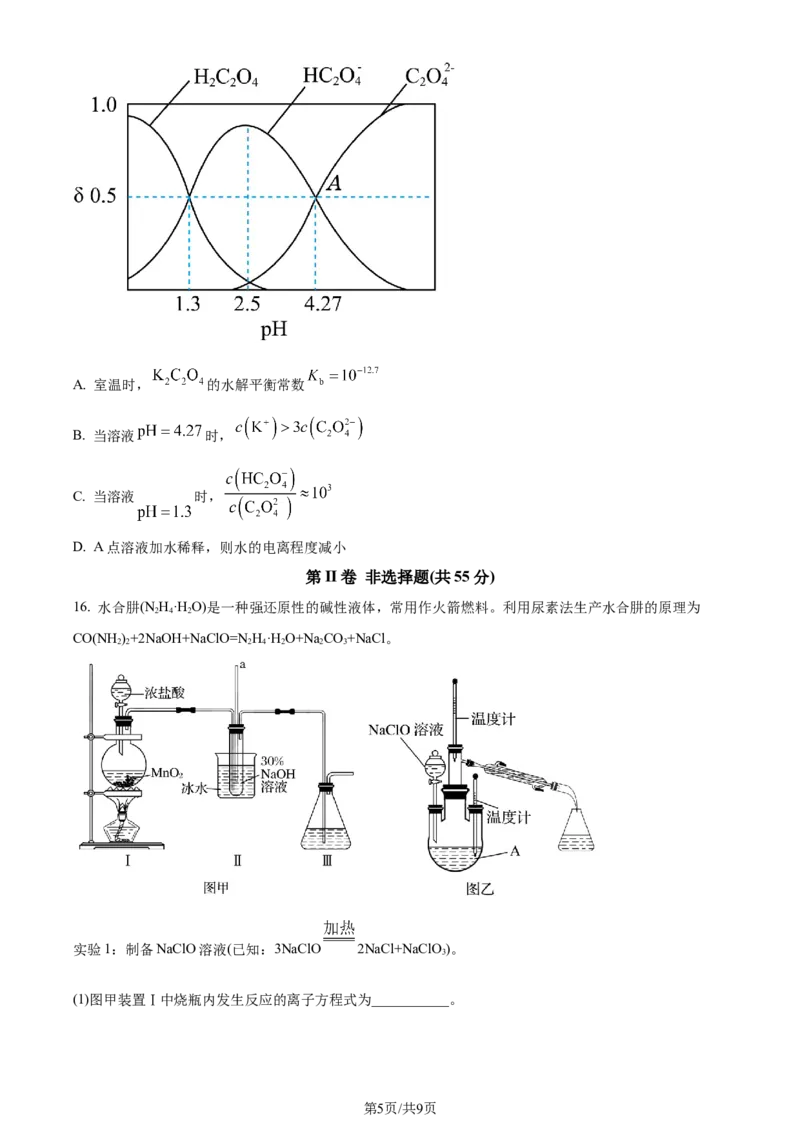
16. 水合肼(N H·H O)是一种强还原性的碱性液体,常用作火箭燃料。利用尿素法生产水合肼的原理为
2 4 2
CO(NH)+2NaOH+NaClO=N H·H O+Na CO+NaCl。
2 2 2 4 2 2 3
实验1:制备NaClO溶液(已知:3NaClO 2NaCl+NaClO )。
3
(1)图甲装置Ⅰ中烧瓶内发生反应的离子方程式为___________。
第5页/共9页
学科网(北京)股份有限公司(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器有___________。
(3)图甲装置Ⅱ中用冰水浴控制温度的目的是___________。
实验2:制取水合肼
(4)图乙中若分液漏斗滴液速度过快,部分NH·H O会参与A中反应并产生大量氮气,降低产品产率,该
2 4 2
过程中反应生成氮气的化学方程式为___________。充分反应后,蒸馏A中溶液即可得到水合肼的粗产品。
实验3:测定馏分中水合肼的含量
(5)称取馏分3.0g,加入适量NaHCO 固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL
3
溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液。用0.15mol·L-1的碘的标准溶液滴定。(已知:
NH·H O+2I =N ↑+4HI+H O)
2 4 2 2 2 2
①该实验滴定终点的判断:___________
②滴定操作中若不加入适量NaHCO 固体,则测量结果会___________(填“偏大”“偏小”“无影响”)。
3
的
③下列能导致馏分中水合肼 含量测定结果偏高的是___________(填字母)。
a.锥形瓶清洗干净后未干燥 b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视 d.盛标准液的滴定管水洗后,直接装标准液
④实验测得消耗I 溶液的平均值为20.00mL,馏分中水合肼(N H·H O)的质量分数为___________。
2 2 4 2
17. 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、
Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+
开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2 6.9
沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9
(1)为了加快溶浸效果,可采取的措施有_______(任写一条);写出“溶浸”中二氧化锰与硫化锰反应的化
学方程式_______。
(2)“氧化”中添加适量的MnO 的作用是将Fe2+氧化为Fe3+,写出该反应的离子方程式_______。
2
(3)滤渣2除了含有Al(OH) 还含有_______。
3
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是_______。
第6页/共9页
学科网(北京)股份有限公司(5)写出“沉锰”的离子方程式_______。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNiCo MnO,其中Ni、Co、Mn的
x y z 2
化合价分别为+2、+3、+4。当x=y= 时,z=_______。
18. NO 是形成雾霾天气的主要原因之一,以NO 为主的污染综合治理是当前重要的研究课题。
x x
(1)通常可采用氢气进行催化还原,消除NO造成的污染。
已知:①N(g)+O(g)=2NO(g) H=akJ·mol-1;
2 2
②2H
2
(g)+O
2
(g)=2H
2
O(1) H=b△kJ·mol-1;
③H
2
O(g)=H
2
O(1) H=ck△J·mol-1。
则催化还原反应2H△2 (g)+2NO(g)=2H
2
O(g)+N
2
(g) ΔH=____。
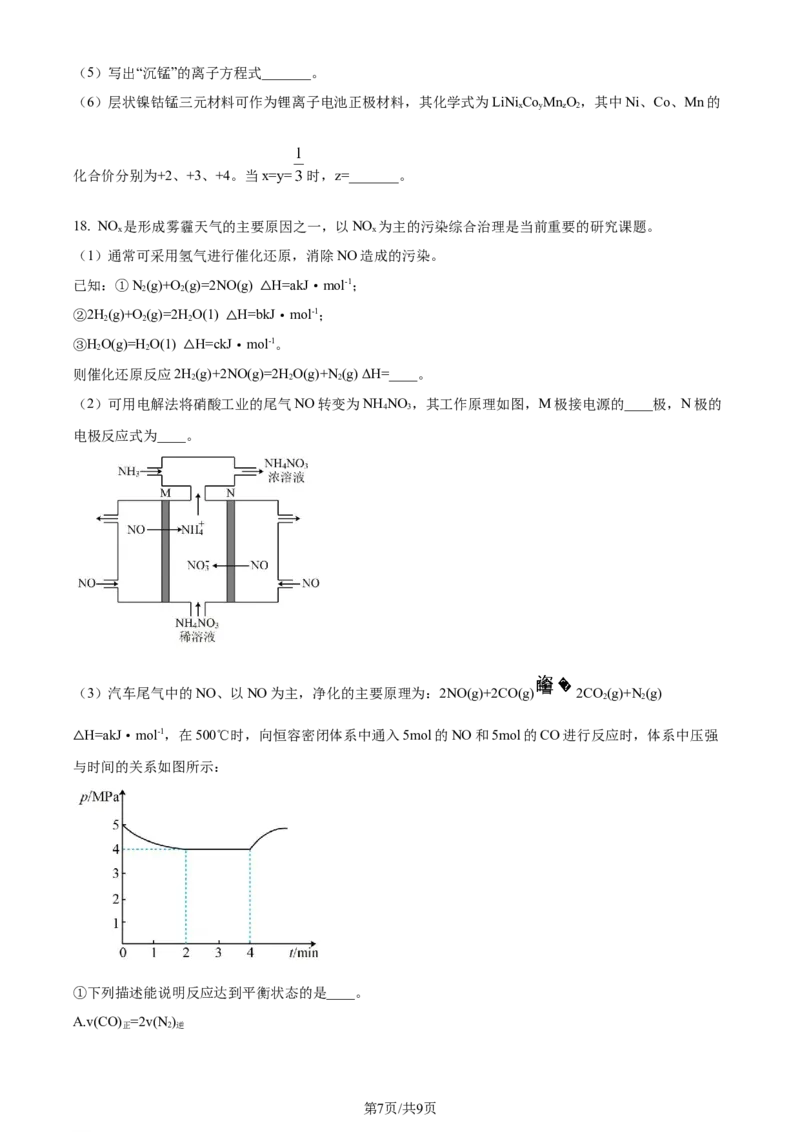
(2)可用电解法将硝酸工业的尾气NO转变为NH NO ,其工作原理如图,M极接电源的____极,N极的
4 3
电极反应式为____。
(3)汽车尾气中的NO、以NO为主,净化的主要原理为:2NO(g)+2CO(g) 2CO(g)+N(g)
2 2
H=akJ·mol-1,在500℃时,向恒容密闭体系中通入5mol的NO和5mol的CO进行反应时,体系中压强
△与时间的关系如图所示:
①下列描述能说明反应达到平衡状态的是____。
A.v(CO) =2v(N )
正 2 逆
第7页/共9页
学科网(北京)股份有限公司B.体系中混合气体密度不变
C.体系中NO、CO的浓度相等
D.混合气体的平均相对分子质量不变
E.单位时间内消耗nmol的NO同时消耗nmol的N
2
②2min时NO的转化率为____。
③500℃时的平衡常数K=____Mpa-1.(K 为以平衡分压表示的平衡常数,平衡分压=总压×物质的量分数)。
p p
若在4min改变的条件为升高温度,K 减小,则a____0(填“大于”“小于”或“等于”)。
p
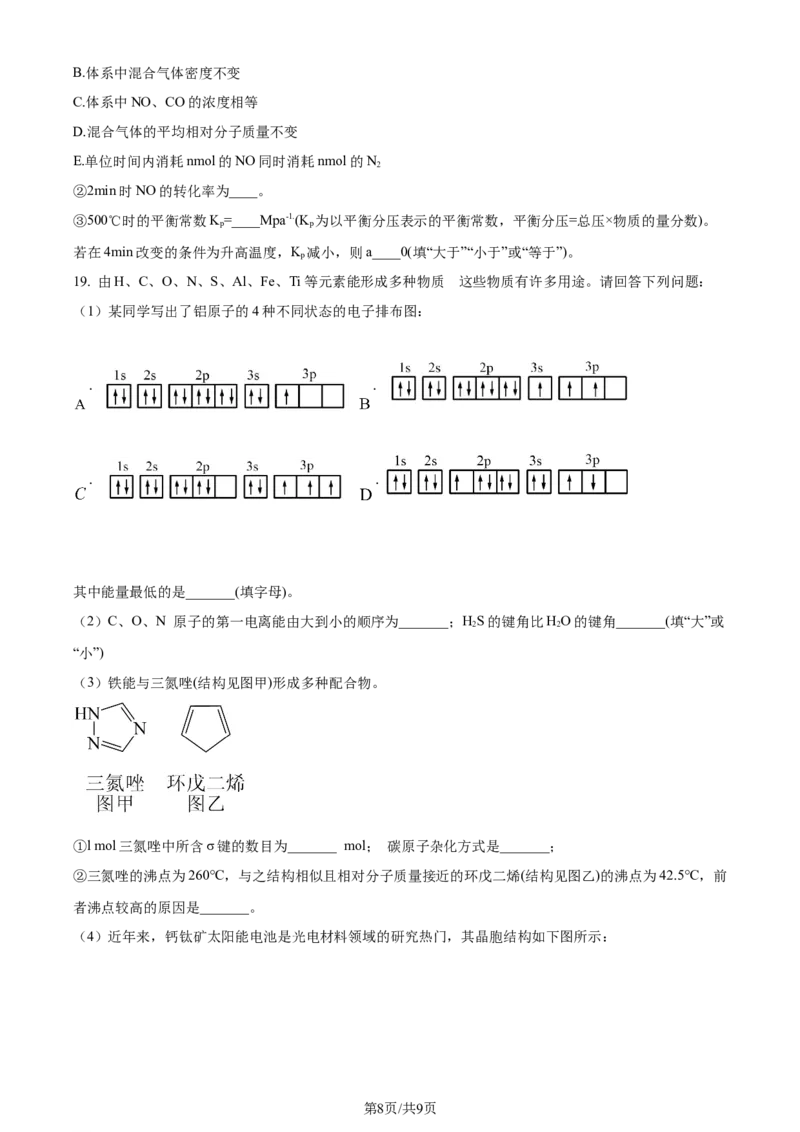
19. 由H、C、O、N、S、Al、Fe、Ti等元素能形成多种物质 这。些物质有许多用途。请回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图:
. .
. .
其中能量最低的是_______(填字母)。
(2)C、O、N 原子的第一电离能由大到小的顺序为_______;HS的键角比HO的键角_______(填“大”或
2 2
“小”)
(3)铁能与三氮唑(结构见图甲)形成多种配合物。
①l mol三氮唑中所含σ键的数目为_______ mol; 碳原子杂化方式是_______;
②三氮唑的沸点为260℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前
者沸点较高的原因是_______。
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:
第8页/共9页
学科网(北京)股份有限公司钙钛矿的化学式为_______,该晶胞中Ca2+与O2-的最短距离是_______cm(已知晶胞参数为anm)。
第9页/共9页
学科网(北京)股份有限公司