文档内容
公众号:高中试卷君
毕节市 2024 届高三年级第三次诊断性考试
化学
注意事项:
1.本试卷满分100分,考试用时75分钟。答卷前,考生务必将自己的姓名、准考证号填写
在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改
动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写在
本试卷上无效。
3.考试结束后,将答题卡交回。
供参考的相对原子质量:Li7 O16 Na23 P31 S32 Cu64
一、选择题:本题共 14小题,每小题3分,共42分。在每个小题给出的四个选项中,只有
一项符合题目要求。
1. 化学服务人类的衣食住行。下列涉及的化学知识错误的是
A. 衣物生产常以合成纤维为原料,合成纤维属于多糖
B. 食盐是重要的食品添加剂,食盐主要成分属于离子晶体
C. 住房建造需使用水泥、陶瓷和玻璃,水泥、陶瓷和玻璃均为无机非金属材料
D. 乘坐汽车须系好安全带,制造安全带卡扣的合金硬度比其成分金属的大
【答案】A
【解析】
【详解】A.合成纤维种类包括涤纶、锦纶、腈纶、氯纶、维纶、氨纶和聚烯烃弹力丝等,这些纤维是通
过化学和物理方法,利用小分子的有机化合物为原料,经过加聚反应或缩聚反应合成的线型有机高分子化
合物,不属于多糖,A错误;
B.食盐是重要的食品添加剂,食盐主要成分氯化钠属于离子晶体,B正确;
C.住房建造需使用水泥、陶瓷和玻璃,水泥、陶瓷和玻璃均为传统无机非金属材料,C正确;
D.合金硬度比其成分金属的大,熔点比成分金属要低,D正确;
故选A。
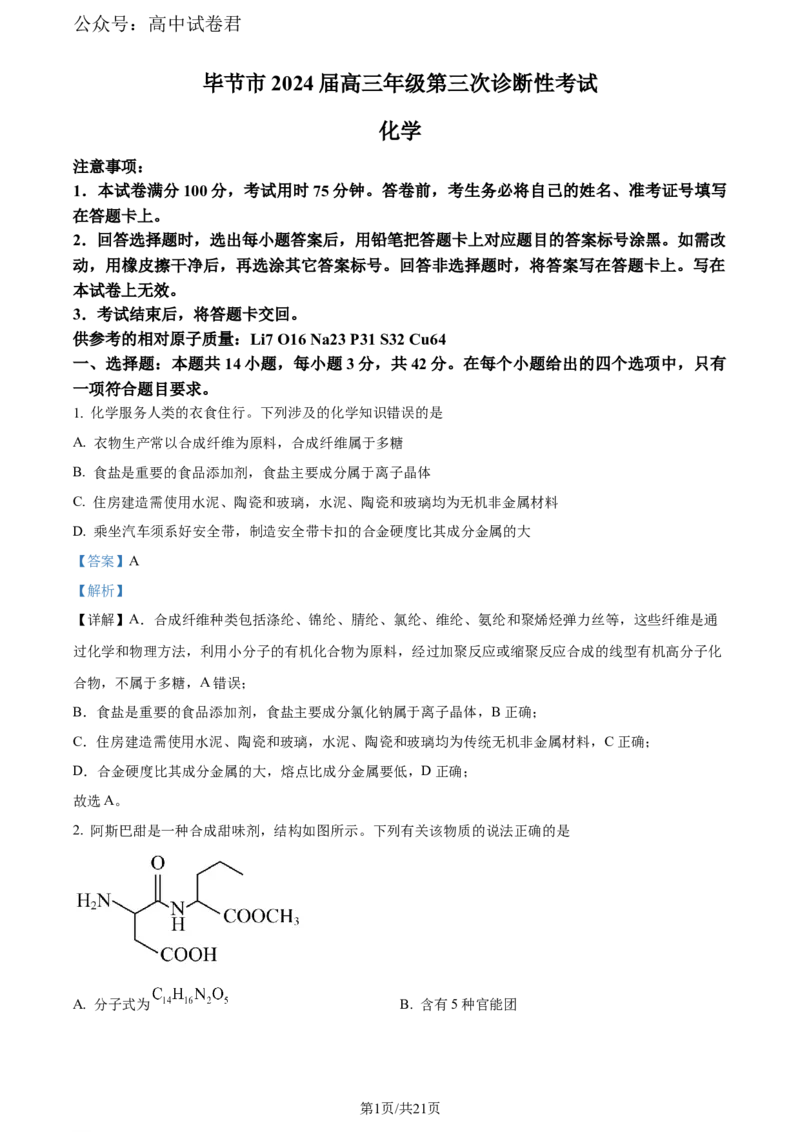
2. 阿斯巴甜是一种合成甜味剂,结构如图所示。下列有关该物质的说法正确的是
A. 分子式为 B. 含有5种官能团
第1页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
C. 1mol该物质可与3molNaOH反应 D. 1mol该物质中含有4mol碳氧 键
【答案】C
【解析】
【详解】A.该有机物的分子式为:C H ON,A错误;
10 18 5 2
B.该有机物中含有氨基、酯基、羧基、酰胺基共4种官能团,B错误;
C.该有机物中含有酯基、羧基、酰胺可以和NaOH反应,1mol该物质可与3molNaOH反应,C正确;
D.该有机物中含有酯基、羧基、酰胺,1mol该物质中含有3mol碳氧 键,D错误;
故选C。
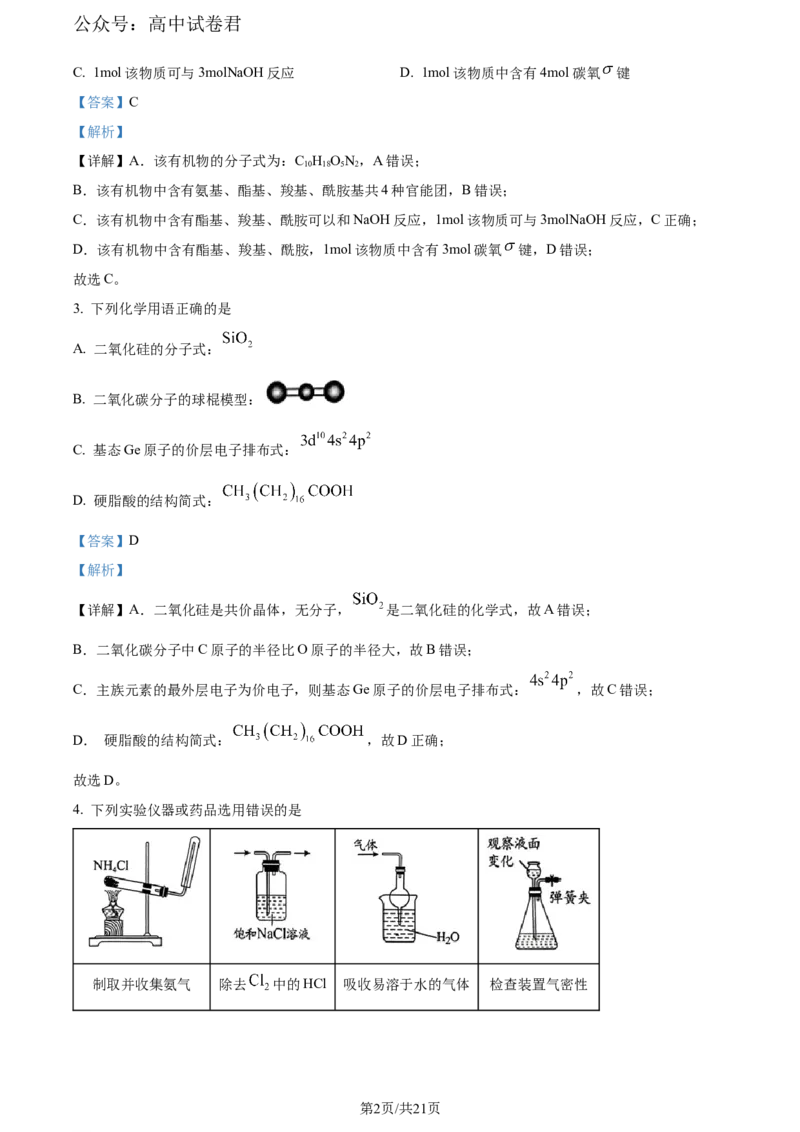
3. 下列化学用语正确的是
A. 二氧化硅的分子式:
B. 二氧化碳分子的球棍模型:
C. 基态Ge原子的价层电子排布式:
D. 硬脂酸的结构简式:
【答案】D
【解析】
【详解】A.二氧化硅是共价晶体,无分子, 是二氧化硅的化学式,故A错误;
B.二氧化碳分子中C原子的半径比O原子的半径大,故B错误;
C.主族元素的最外层电子为价电子,则基态Ge原子的价层电子排布式: ,故C错误;
D. 硬脂酸的结构简式: ,故D正确;
故选D。
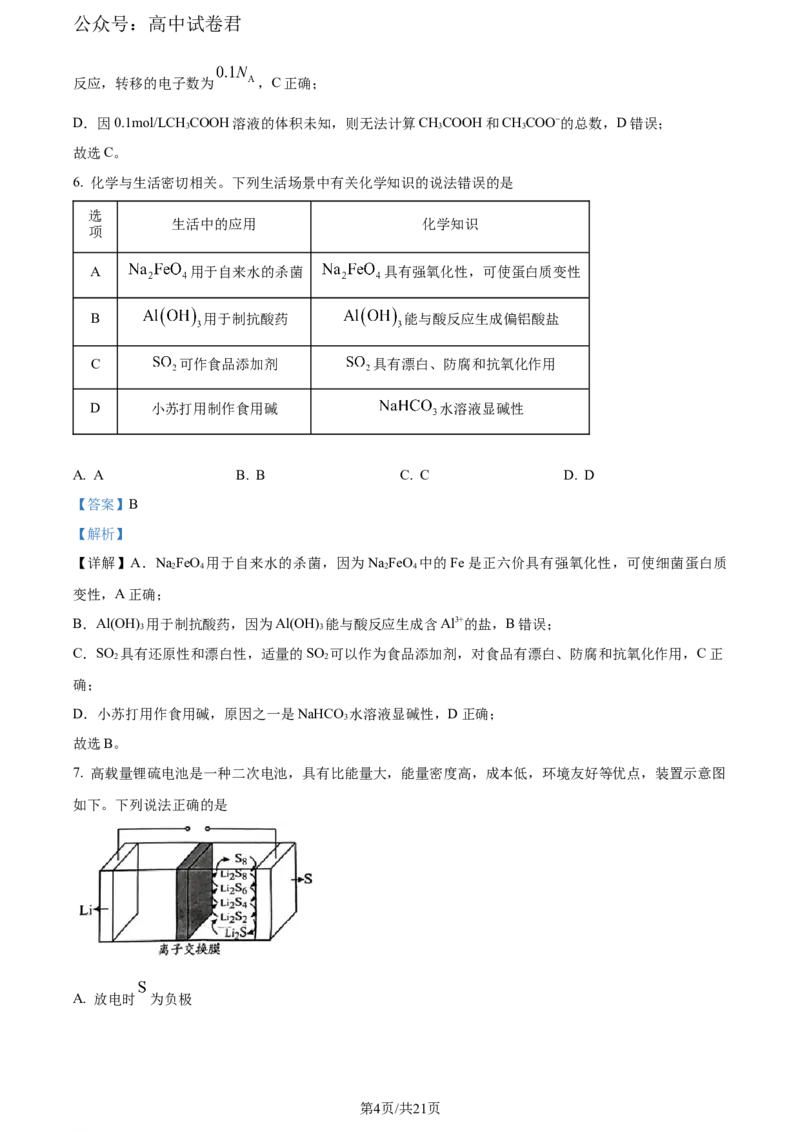
4. 下列实验仪器或药品选用错误的是
制取并收集氨气 除去 中的HCl 吸收易溶于水的气体 检查装置气密性
第2页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
A B C D
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.NH Cl受热分解生成氨气和氯化氢,在导管口遇冷又化合生成NH Cl,不能用加热NH Cl的
4 4 4
方法制取氨气,故A错误;
B.除去Cl 中的HCl用饱和氯化钠溶液,导气管长进短出,故B正确;
2
C.吸收易溶于水的气体时应注意防倒吸,球形干燥管可以起到防倒吸的作用,故C正确;
D.关闭弹簧夹,从长颈漏斗向锥形瓶中加水至浸没长颈漏斗下端管口,使长颈漏斗内液面高于锥形瓶内
液面,且高度差保持不变,即可证明装置气密性良好,故D正确;
故选A。
5. 为阿伏伽德罗常数的值,下列说法正确的是
A. 中共价键数为
B. 标准状况下, 中氧原子数为
C. 与足量 充分反应,转移的电子数为
D. 溶液中, 和 的总数为
【答案】C
【解析】
【详解】A. 的物质的量为0.1mol,1个P 分子中含有6个共价键,则12.4gP 中共价键数为
4 4
,A错误;
B.标准状况下, 为固体,无法计算4.48LSO 中的氧原子数,B错误;
3
C. 的物质的量为0.1mol,与足量 充分反应的化学方程式为:
,即每消耗2molNa O,转移2mol电子,则7.8gNaO 与足量CO 充分
2 2 2 2 2
第3页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
反应,转移的电子数为 ,C正确;
D.因0.1mol/LCH COOH溶液的体积未知,则无法计算CHCOOH和CHCOO−的总数,D错误;
3 3 3
故选C。
6. 化学与生活密切相关。下列生活场景中有关化学知识的说法错误的是
选
生活中的应用 化学知识
项
A 用于自来水的杀菌 具有强氧化性,可使蛋白质变性
B 用于制抗酸药 能与酸反应生成偏铝酸盐
C 可作食品添加剂 具有漂白、防腐和抗氧化作用
D 小苏打用制作食用碱 水溶液显碱性
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.NaFeO 用于自来水的杀菌,因为NaFeO 中的Fe是正六价具有强氧化性,可使细菌蛋白质
2 4 2 4
变性,A正确;
B.Al(OH) 用于制抗酸药,因为Al(OH) 能与酸反应生成含Al3+的盐,B错误;
3 3
C.SO 具有还原性和漂白性,适量的SO 可以作为食品添加剂,对食品有漂白、防腐和抗氧化作用,C正
2 2
确;
D.小苏打用作食用碱,原因之一是NaHCO 水溶液显碱性,D正确;
3
故选B。
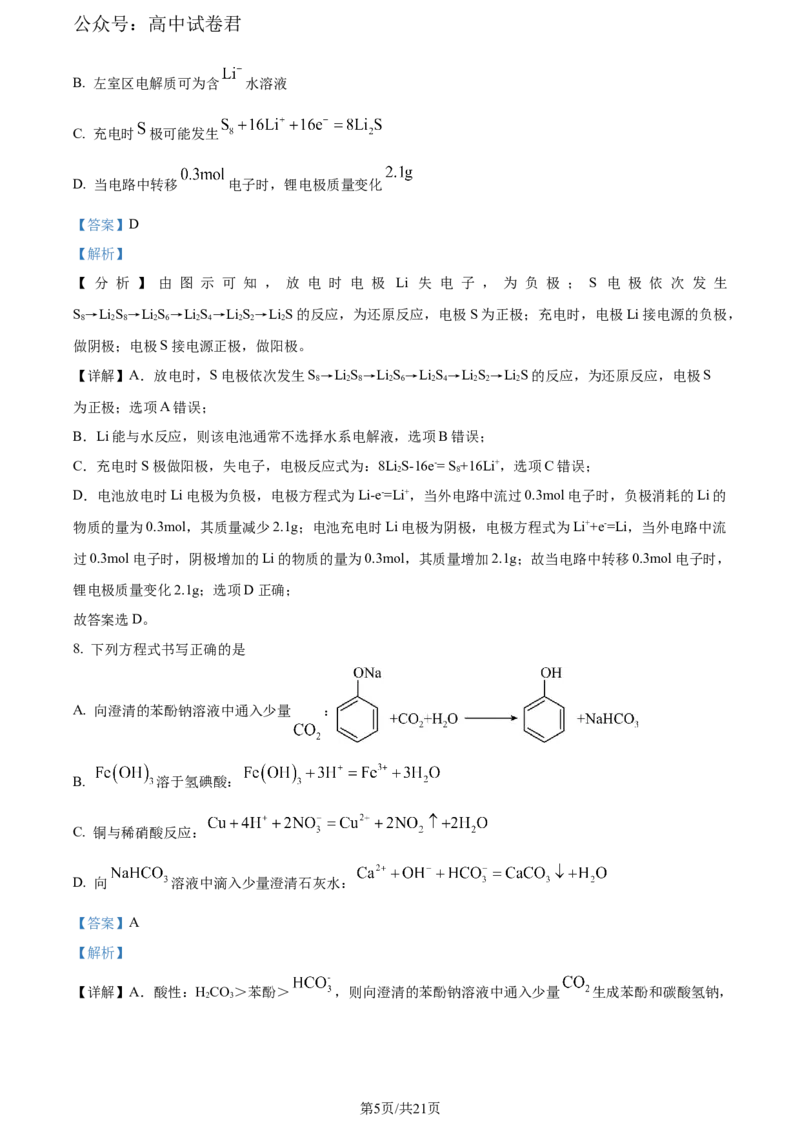
7. 高载量锂硫电池是一种二次电池,具有比能量大,能量密度高,成本低,环境友好等优点,装置示意图
如下。下列说法正确的是
A. 放电时 为负极
第4页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
B. 左室区电解质可为含 水溶液
C. 充电时 极可能发生
D. 当电路中转移 电子时,锂电极质量变化
【答案】D
【解析】
【 分 析 】 由 图 示 可 知 , 放 电 时 电 极 Li 失 电 子 , 为 负 极 ; S 电 极 依 次 发 生
S→LiS→LiS→LiS→LiS→LiS的反应,为还原反应,电极S为正极;充电时,电极Li接电源的负极,
8 2 8 2 6 2 4 2 2 2
做阴极;电极S接电源正极,做阳极。
【详解】A.放电时,S电极依次发生S→LiS→LiS→LiS→LiS→LiS的反应,为还原反应,电极S
8 2 8 2 6 2 4 2 2 2
为正极;选项A错误;
B.Li能与水反应,则该电池通常不选择水系电解液,选项B错误;
C.充电时S极做阳极,失电子,电极反应式为:8LiS-16e-= S +16Li+,选项C错误;
2 8
D.电池放电时Li电极为负极,电极方程式为Li-e-=Li+,当外电路中流过0.3mol电子时,负极消耗的Li的
物质的量为0.3mol,其质量减少2.1g;电池充电时Li电极为阴极,电极方程式为Li++e-=Li,当外电路中流
过0.3mol电子时,阴极增加的Li的物质的量为0.3mol,其质量增加2.1g;故当电路中转移0.3mol电子时,
锂电极质量变化2.1g;选项D正确;
故答案选D。
8. 下列方程式书写正确的是
A. 向澄清的苯酚钠溶液中通入少量 :
B. 溶于氢碘酸:
C. 铜与稀硝酸反应:
D. 向 溶液中滴入少量澄清石灰水:
【答案】A
【解析】
【详解】A.酸性:HCO>苯酚> ,则向澄清的苯酚钠溶液中通入少量 生成苯酚和碳酸氢钠,
2 3
第5页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
方程式正确,故A正确;
B.碘离子具有还原性,能被Fe3+氧化生成碘单质: ,故B
错误;
C.铜和稀硝酸反应生成硝酸铜、一氧化氮和水: ,故C
错误;
D.少量澄清石灰水与足量碳酸氢钠溶液反应,根据“少定多变”的原则可知,反应的离子方程式为:
,故D错误;
故选A。
9. 下列实验操作、现象和结论均正确的是
选
实验操作及现象 实验结论
项
A 向待测液中滴入氯水,再滴入KSCN溶液,溶液变红 待测液中含有
室温下,用pH计分别测定等浓度的NaCN溶液和 溶液的 酸性:
B
pH,前者pH较大
向少量脱脂棉中加入几滴蒸馏水和几滴浓 ,搅拌成糊状。再加入
脱脂棉水解产物无葡萄
C
糖
几滴 溶液,加热,无明显现象
向液态卤代烃中加足量NaOH溶液,振荡、加热、充分反应,冷却后滴
该卤代烃中不含有溴元
D
入2滴 溶液,未产生黄色沉淀 素
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.先滴加氯水,再加入KSCN溶液,溶液变红,说明加入KSCN溶液前溶液中存在Fe3+,而此
时的Fe3+是全由原溶液中的Fe2+氧化而来还是原溶液中本来就有Fe3+是不能确定的,所以结论中一定含有
Fe2+是错误的,A错误;
B.用pH计分别测定等浓度的NaCN溶液和CHCOONa溶液的pH,前者pH较大,根据越弱越水解,对
3
应盐碱性越强可知,酸性:HCNH O,C正确;
2 2
第9页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
D.基态N、O原子的核外价电子排布为2s2p3和2s22p4,未成对电子数分别为3和2,N、O原子未成对电
子数之比为3:2,D正确;
故选B。
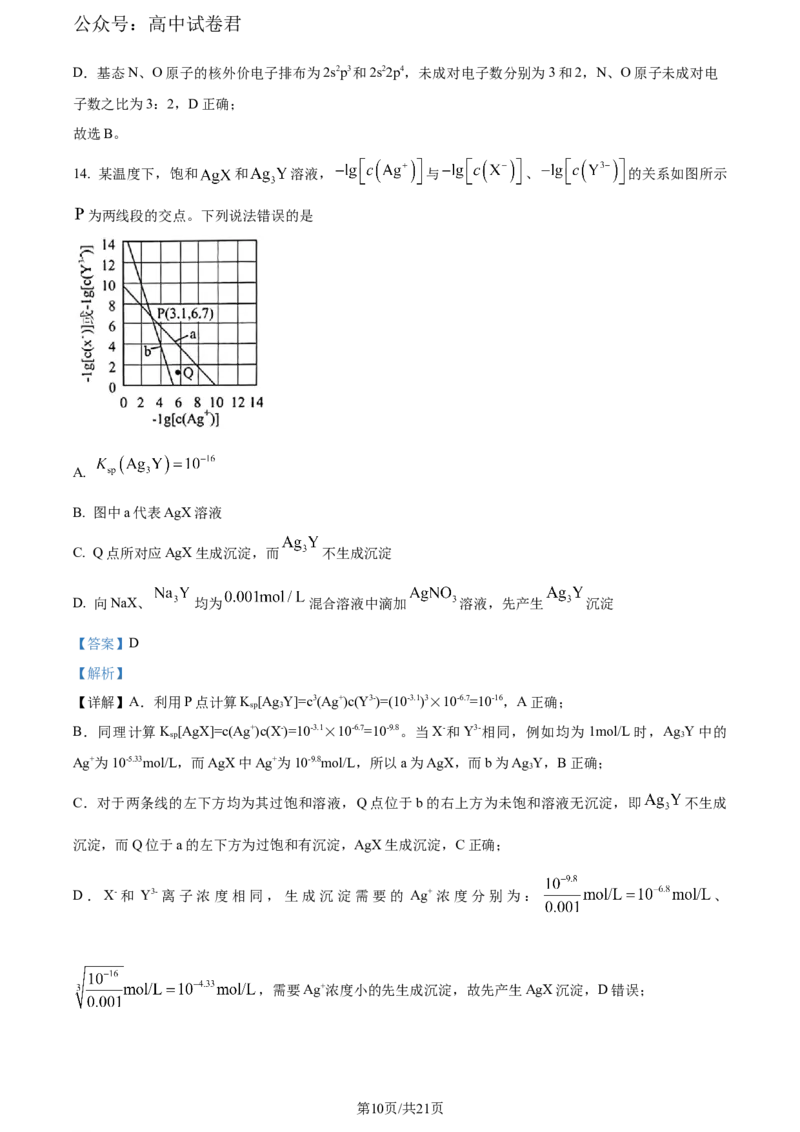
14. 某温度下,饱和 和 溶液, 与 、 的关系如图所示
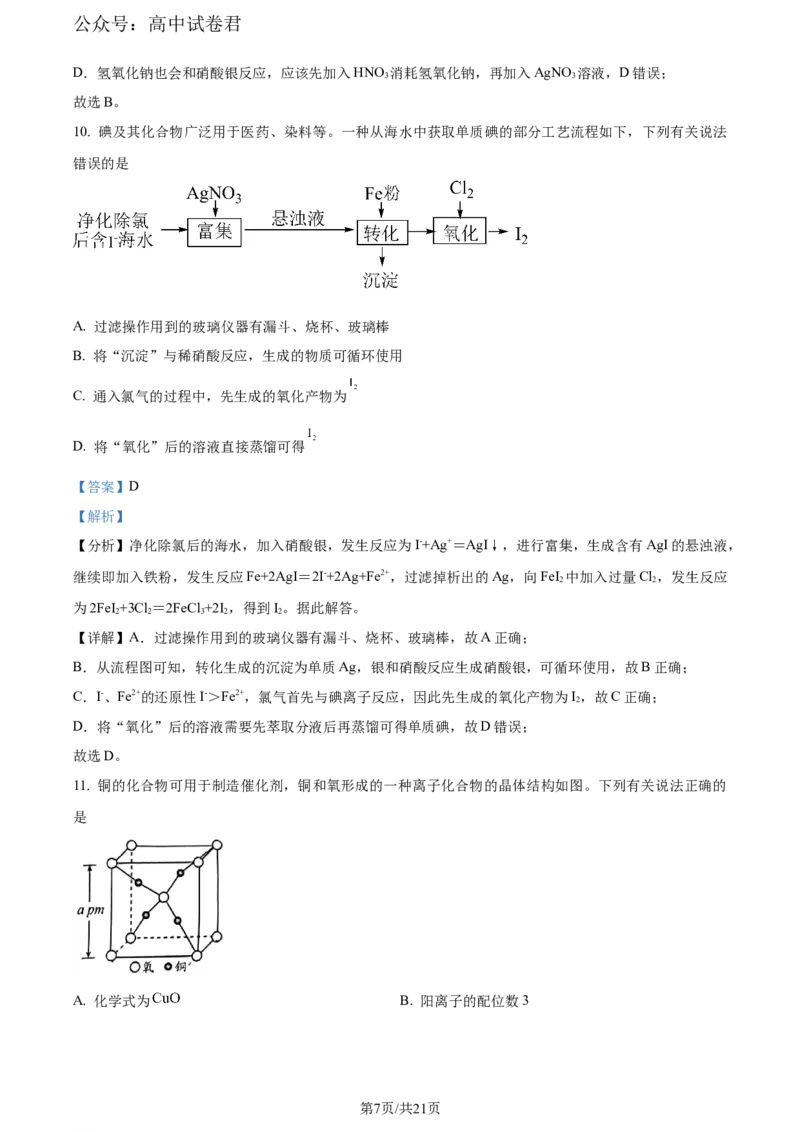
为两线段的交点。下列说法错误的是
A.
B. 图中a代表AgX溶液
C. Q点所对应AgX生成沉淀,而 不生成沉淀
D. 向NaX、 均为 混合溶液中滴加 溶液,先产生 沉淀
【答案】D
【解析】
【详解】A.利用P点计算K [Ag Y]=c3(Ag+)c(Y3-)=(10-3.1)3×10-6.7=10-16,A正确;
sp 3
B.同理计算K [AgX]=c(Ag+)c(X-)=10-3.1×10-6.7=10-9.8。当X-和Y3-相同,例如均为1mol/L时,Ag Y中的
sp 3
Ag+为10-5.33mol/L,而AgX中Ag+为10-9.8mol/L,所以a为AgX,而b为Ag Y,B正确;
3
C.对于两条线的左下方均为其过饱和溶液,Q点位于b的右上方为未饱和溶液无沉淀,即 不生成
沉淀,而Q位于a的左下方为过饱和有沉淀,AgX生成沉淀,C正确;
D.X-和 Y3-离子浓度相同,生成沉淀需要的 Ag+浓度分别为: 、
,需要Ag+浓度小的先生成沉淀,故先产生AgX沉淀,D错误;
第10页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
故选D。
二、非选择题:本题共4小题,共58分。
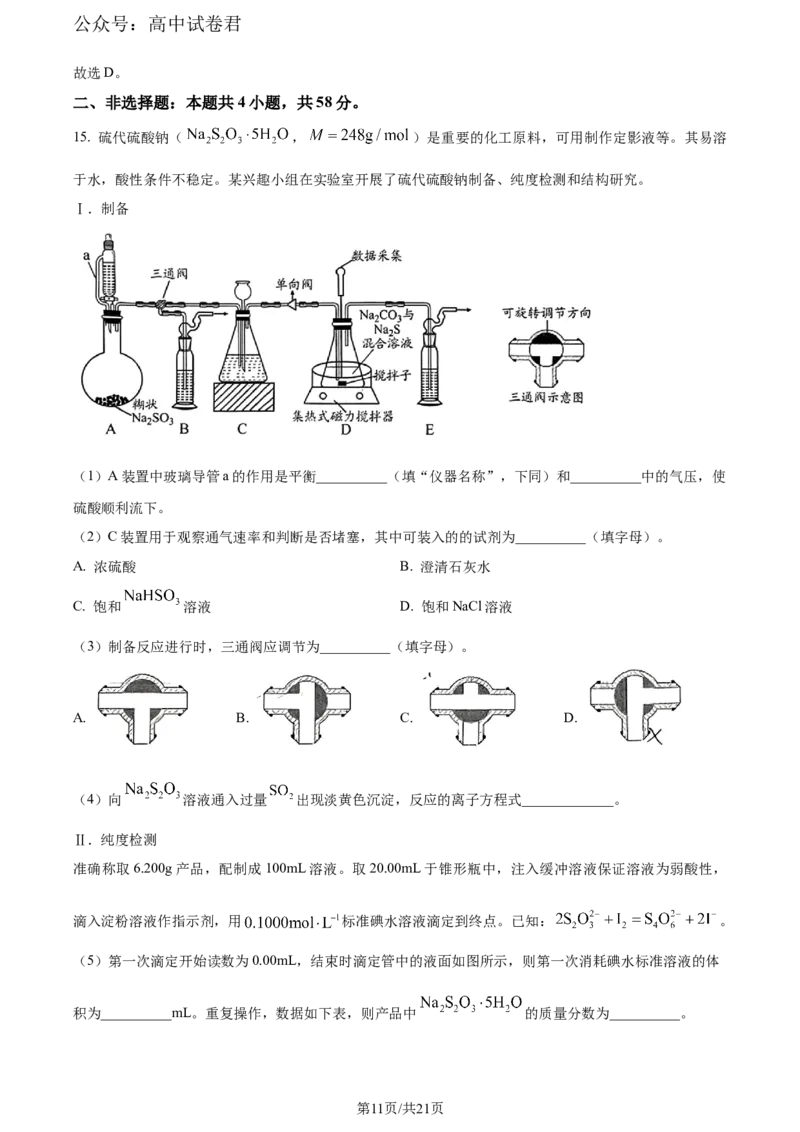
15. 硫代硫酸钠( , )是重要的化工原料,可用制作定影液等。其易溶
于水,酸性条件不稳定。某兴趣小组在实验室开展了硫代硫酸钠制备、纯度检测和结构研究。
Ⅰ.制备
(1)A装置中玻璃导管a的作用是平衡__________(填“仪器名称”,下同)和__________中的气压,使
硫酸顺利流下。
(2)C装置用于观察通气速率和判断是否堵塞,其中可装入的的试剂为__________(填字母)。
A. 浓硫酸 B. 澄清石灰水
C. 饱和 溶液 D. 饱和NaCl溶液
(3)制备反应进行时,三通阀应调节为__________(填字母)。
A. B. C. D.
(4)向 溶液通入过量 出现淡黄色沉淀,反应的离子方程式_____________。
Ⅱ.纯度检测
准确称取6.200g产品,配制成100mL溶液。取20.00mL于锥形瓶中,注入缓冲溶液保证溶液为弱酸性,
滴入淀粉溶液作指示剂,用 标准碘水溶液滴定到终点。已知: 。
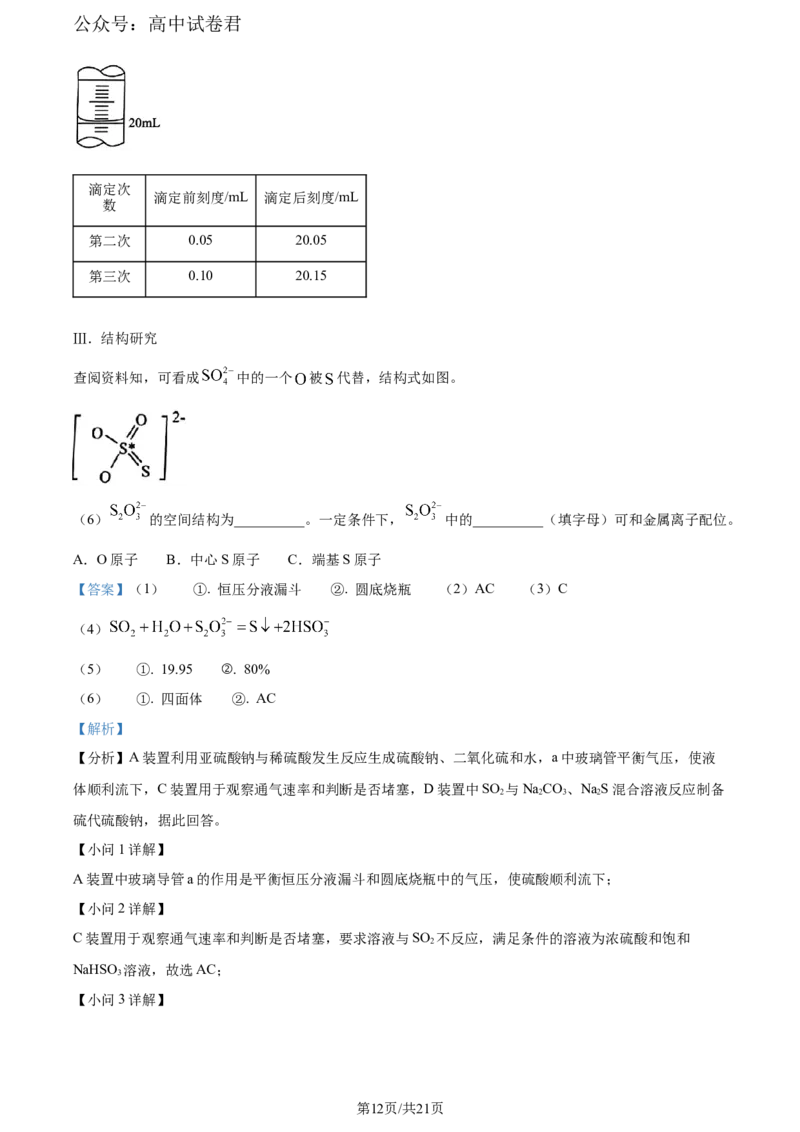
(5)第一次滴定开始读数为0.00mL,结束时滴定管中的液面如图所示,则第一次消耗碘水标准溶液的体
积为__________mL。重复操作,数据如下表,则产品中 的质量分数为__________。
第11页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
滴定次
滴定前刻度/mL 滴定后刻度/mL
数
第二次 0.05 20.05
第三次 0.10 20.15
Ⅲ.结构研究
查阅资料知,可看成 中的一个 被 代替,结构式如图。
(6) 的空间结构为__________。一定条件下, 中的__________(填字母)可和金属离子配位。
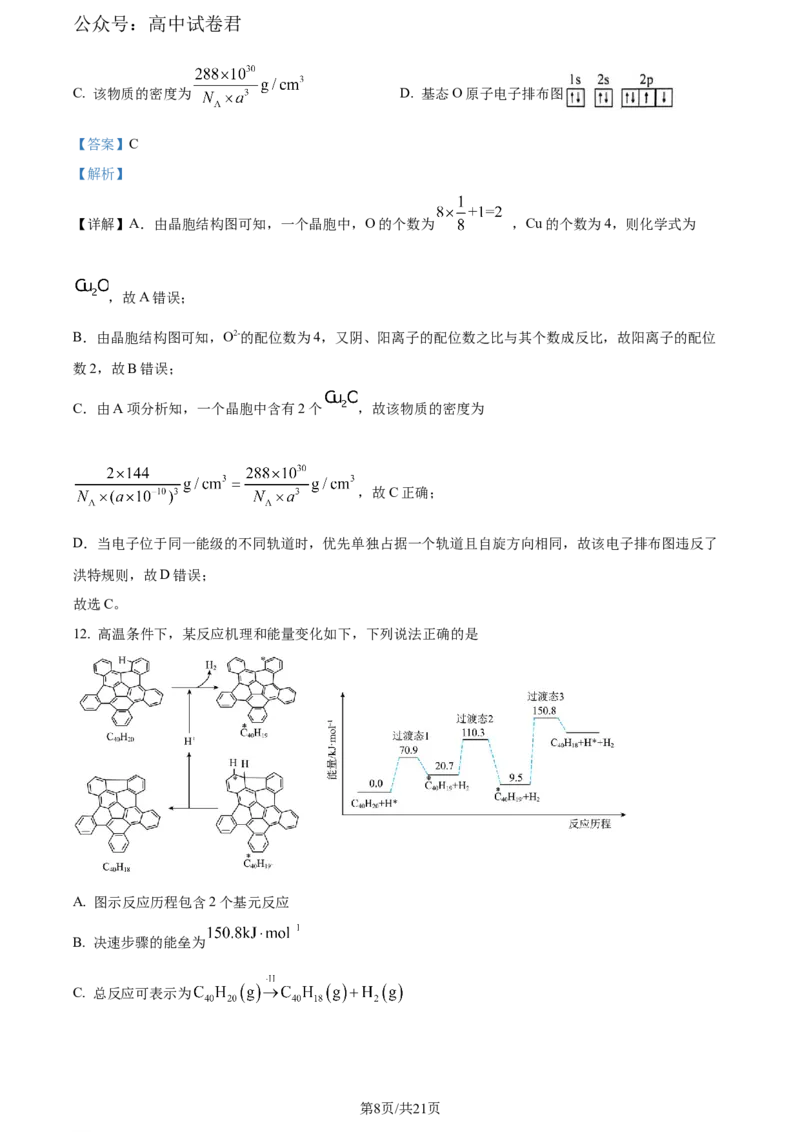
A.O原子 B.中心S原子 C.端基S原子
【答案】(1) ①. 恒压分液漏斗 ②. 圆底烧瓶 (2)AC (3)C
(4)
(5) ①. 19.95 ②. 80%
(6) ①. 四面体 ②. AC
【解析】
【分析】A装置利用亚硫酸钠与稀硫酸发生反应生成硫酸钠、二氧化硫和水,a中玻璃管平衡气压,使液
体顺利流下,C装置用于观察通气速率和判断是否堵塞,D装置中SO 与NaCO、NaS混合溶液反应制备
2 2 3 2
硫代硫酸钠,据此回答。
【小问1详解】
A装置中玻璃导管a的作用是平衡恒压分液漏斗和圆底烧瓶中的气压,使硫酸顺利流下;
【小问2详解】
C装置用于观察通气速率和判断是否堵塞,要求溶液与SO 不反应,满足条件的溶液为浓硫酸和饱和
2
NaHSO 溶液,故选AC;
3
【小问3详解】
第12页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
制备反应进行时,SO 需要经过C来到D处反应,不能通过B装置,所以三通阀应调节为 ,故
2
选C;
【
小问4详解】
向NaSO 溶液通入过量SO 出现淡黄色沉淀硫单质,反应的离子方程式为:
2 2 3 2
;
【小问5详解】
第一次滴定开始读数为0.00mL,结束时滴定管中的液面如图所示,则第一次消耗碘水标准溶液的体积为
19.95mL;在20mL溶液中,n(Na SO)=2n( )=2×0.1000mol⋅L−1×20.02×10-3L=4.005×10-3mol,所以100mL
2 2 3
溶液n(Na SO)=2.0025×10-2mol,产品中NaSO⋅5HO的质量分数为=
2 2 3 2 2 3 2
=80%。
【小问6详解】
与 互为等电子体,则空间结构为四面体; 中的中心S原子没有孤电子对,不能形成配位
键,O原子与端基S原子有孤电子对,可与金属离子配位,故选AC。
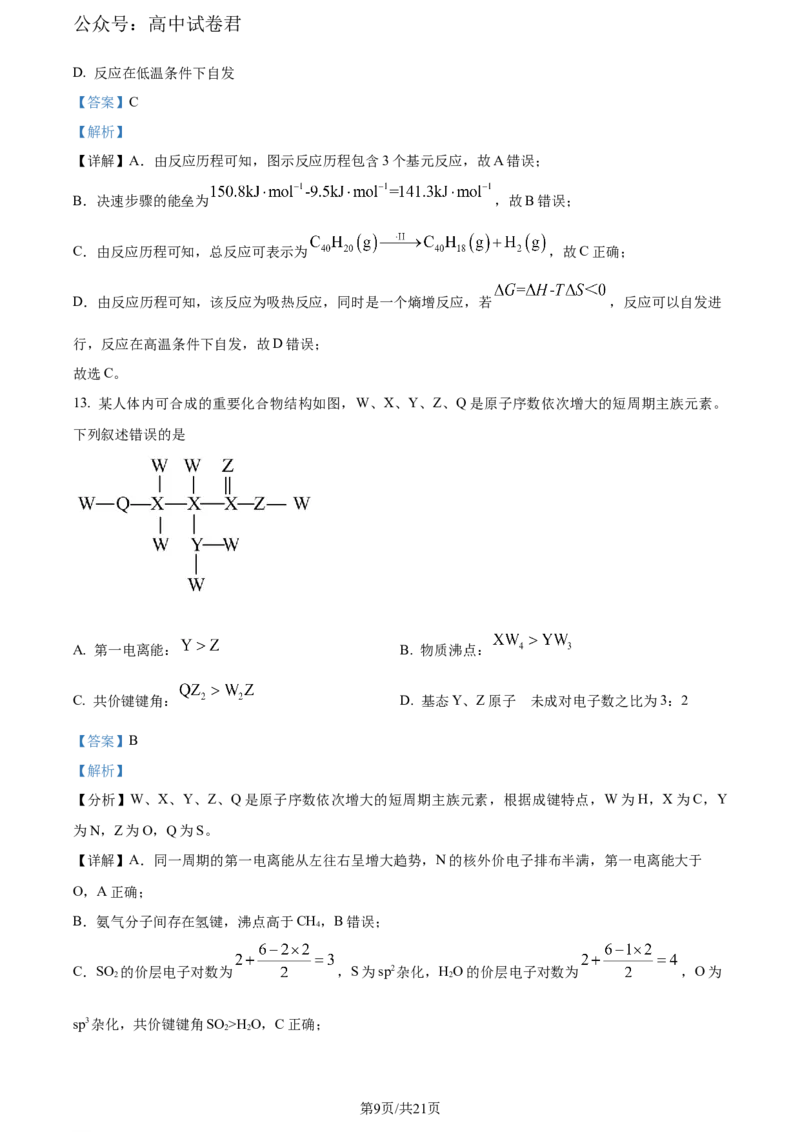
16. 工业合成氨是人类科学技术上的一项重大突破,是化学对社会发展的巨大贡献之一。在催化剂作用下
发生 ,回答下列问题:
化学键
键能(kJ/mol) 946 436 391
(1)依据键能信息, __________ 。
(2)其他条件不变,下列能加快反应速率,并提高 的平衡转化率的是__________(填字母)。
A. 固定体系体积,加大 投料量 B. 升高反应体系的温度
第13页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
C. 降低平衡体系的压强 D. 改用效果更好的催化剂
(3)恒温恒容条件下,下列能说明该反应已达到平衡状态的是____(填字母)
A. 气体的密度保持不变 B. 、 、 的物质的量之比为
C. 气体的平均摩尔质量保持不变 D. 消耗 ,同时消耗
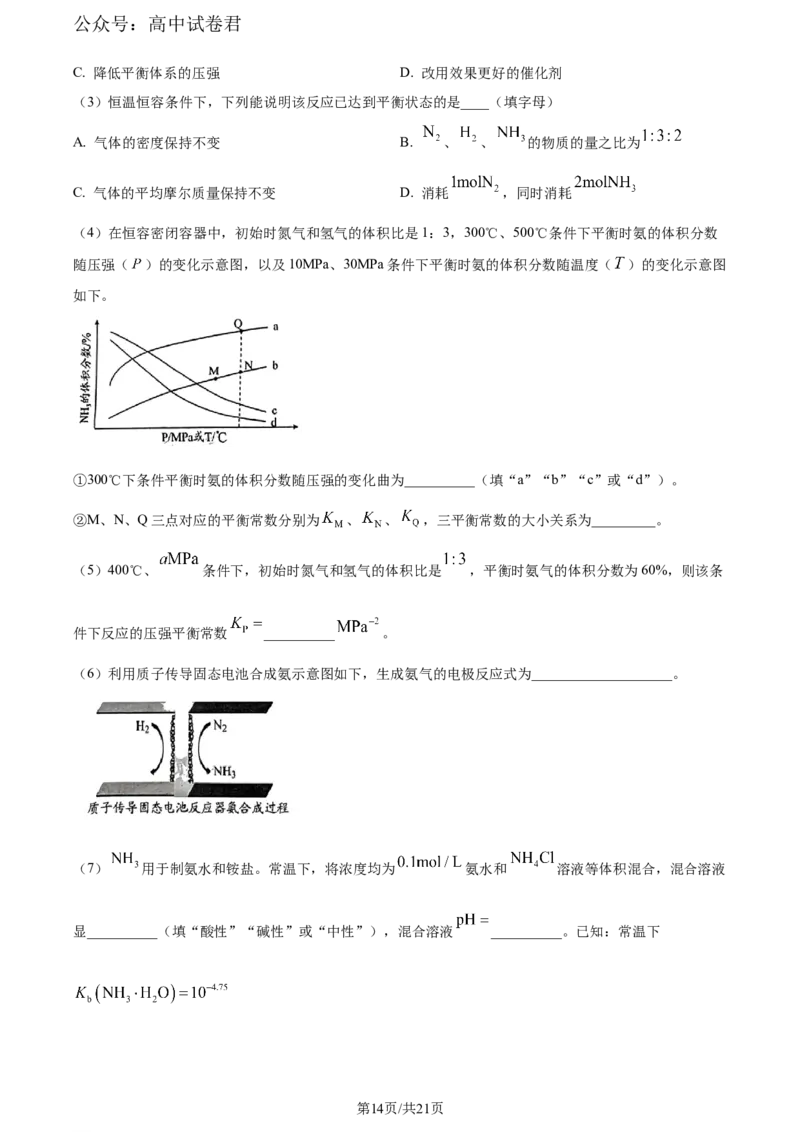
(4)在恒容密闭容器中,初始时氮气和氢气的体积比是1:3,300℃、500℃条件下平衡时氨的体积分数
随压强( )的变化示意图,以及10MPa、30MPa条件下平衡时氨的体积分数随温度( )的变化示意图
如下。
①300℃下条件平衡时氨的体积分数随压强的变化曲为__________(填“a”“b”“c”或“d”)。
②M、N、Q三点对应的平衡常数分别为 、 、 ,三平衡常数的大小关系为_________。
(5)400℃、 条件下,初始时氮气和氢气的体积比是 ,平衡时氨气的体积分数为60%,则该条
件下反应的压强平衡常数 __________ 。
(6)利用质子传导固态电池合成氨示意图如下,生成氨气的电极反应式为____________________。
(7) 用于制氨水和铵盐。常温下,将浓度均为 氨水和 溶液等体积混合,混合溶液
显__________(填“酸性”“碱性”或“中性”),混合溶液 __________。已知:常温下
第14页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
【答案】(1)-92 (2)A (3)CD
(4) ①. a ②.
(5)
(6)
(7) ①. 碱性 ②. 9.25
【解析】
【小问1详解】
反应物键能和-生成物键能和= -92 。
【小问2详解】
提高浓度,升温,加压,使用适当催化剂可加快反应速率,加大 投料量可提高 的平衡转化率,升高
温度平衡逆向进行降低 的平衡转化率,催化剂不影响平衡,故选A
【小问3详解】
恒温恒容条件下,反应前后质量不变则密度不变,A不选; 、 、 的物质的量成比例无法确定
是否平衡,B不选;反应前后气体的质量不变,物质的量是可变量,当气体的平均摩尔质量保持不变时即
气体的物质的量不变,可确认是平衡状态,C选;消耗 表示正向反应,同时消耗 表示逆
向反应,且与化学计量数成比例,D选,故选CD;
【小问4详解】
① 当温度不变时,反应前后气体体积减小的反应,体
系的压强增大,平衡正向移动,氨的体积分数增大,相同压强下,温度升高平衡逆向移动,氨的体积分数
减小,故300℃下条件平衡时氨的体积分数随压强的变化曲为a;②K为化学平衡常数,只受温度影响,
合成氨为放热反应,温度升高K减小,曲线a是300℃、曲线b是500℃,Q点对应平衡常数大,N、M为
同温平衡常数相同,故 ;
【小问5详解】
第15页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
设初始氮气和氢气的物质的量分别是bmol、3bmol,根据平衡列三段式得:
平衡时氨气的体积分数为60%可得 ,反应后总物质的量为2.5amol,
=
【小问6详解】
N 气得电子被还原成氨气,电极反应式为:
2
【小问7详解】
因 , ,可知电离大于水解,溶液显碱性;0.1mol/
lNHCl和0.1mol/lNH HO等体积相混显然是缓冲溶液,NH 的水解和NH ·H O 的电离都受到抑制则:c(NH
4 3 2 3 2
)=0.05mol/L , c(NH ·H O)=0.05mol/L ,
3 2
,可得 9.25
17. 某地区原生钴矿,杂质主要含铁、硫、砷、碳等元素及石英。近年我国科技工作者提出一种用该矿石
制备 的新方法,该方法具有回收率高、污染小、成本低等优点。其工艺流程如下:
第16页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
已知:①在酸性水溶液中因 具有强氧化性,在水溶液中易转化为 ;
② 易溶于水,难溶于乙醇。
回答下列问题:
(1)“磨细”的目的是____________________。
(2)“焙烧”时加入石灰石,以防止产生的硫、砷氧化物气体污染环境。写出该过程中 与石灰石反
应的化学方程式____________________。
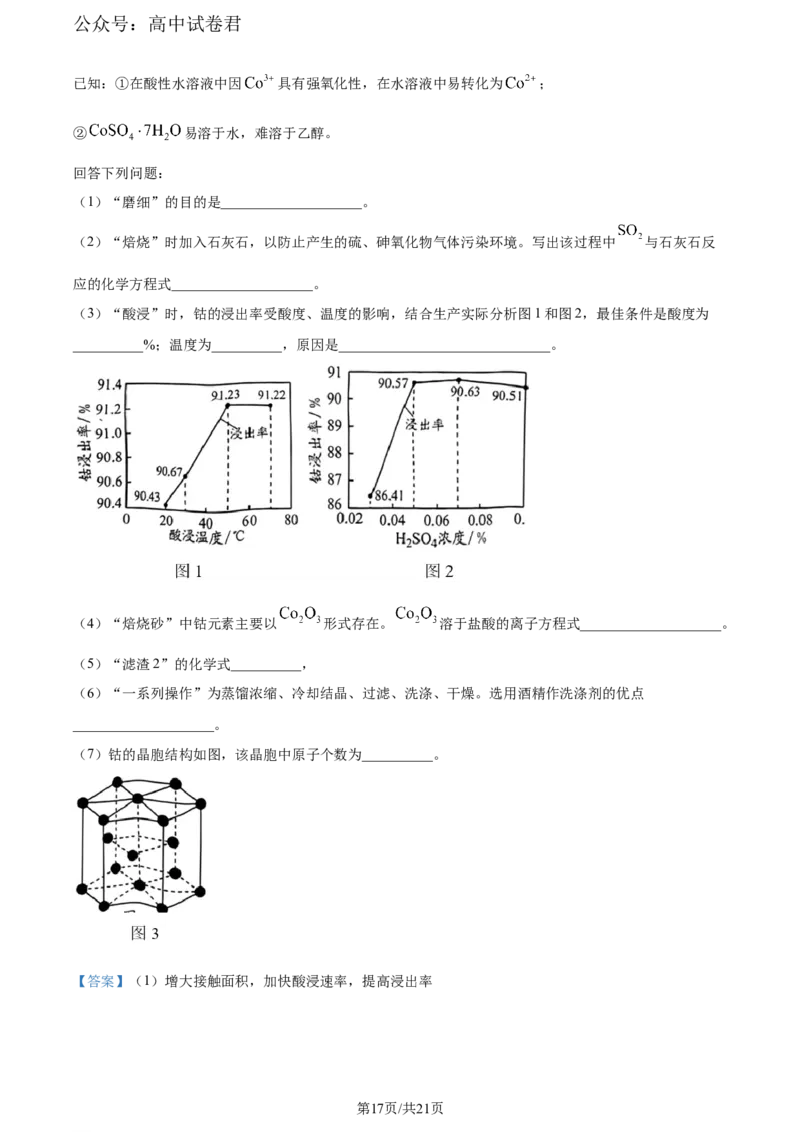
(3)“酸浸”时,钴的浸出率受酸度、温度的影响,结合生产实际分析图1和图2,最佳条件是酸度为
__________%;温度为__________,原因是______________________________。
(4)“焙烧砂”中钴元素主要以 形式存在。 溶于盐酸的离子方程式____________________。
(5)“滤渣2”的化学式__________,
(6)“一系列操作”为蒸馏浓缩、冷却结晶、过滤、洗涤、干燥。选用酒精作洗涤剂的优点
____________________。
(7)钴的晶胞结构如图,该晶胞中原子个数为__________。
【答案】(1)增大接触面积,加快酸浸速率,提高浸出率
第17页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
(2)
(3) ①. 0.05 ②. 20℃ ③. 20℃时钻 的浸除率已很高,升高温度浸出率增幅不大,而成本增加
(4)
(5)
(6)除去固体表面的水分,减少 因溶于水而损耗,易于后续干燥。(其他合理答案酌情给分)
(7)6
【解析】
【分析】钴矿石加入石灰石焙烧,防止生成的硫、砷氧化物污染环境,焙烧砂中钴元素以Co O 形式存在,
2 3
磨细后进行酸浸,Co O 转化为Co3+,Fe转化为Fe2+,随后Co3+将Fe2+氧化为Fe3+,自身被还原为Co2+,
2 3
SiO 、C不溶于酸,形成滤渣1。酸浸液调节pH使铁离子转化为氢氧化铁沉淀,滤渣2为氢氧化铁,最后
2
滤液中含有硫酸钴,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作得到CoSO ·7HO。
4 2
【小问1详解】
磨细可以增大固体与酸液的接触面积,加快酸浸速率,提高浸取率。
【小问2详解】
焙烧时二氧化硫与碳酸钙、氧气反应生成硫酸钙和二氧化碳,化学方程式为
。
【小问3详解】
从图中可知,当硫酸浓度为0.05%时钴浸出率已经很高,再增加硫酸浓度,对钴浸出率提升不大,因此最
佳酸度为0.05%。温度为20℃时,钴浸出率也已经很高,再升高温度,钴的浸出率提升也不大,而成本却
增加很多,因此最佳温度为20℃。
【小问4详解】
从题干可知,Co3+具有强氧化性,在水溶液中易转化为Co2+,故Co O 能与盐酸反应生成Co2+、氯气和水,
2 3
离子方程式为 。
【小问5详解】
根据分析可知,滤渣2的化学式为Fe(OH) 。
3
【小问6详解】
从题干信息可知,CoSO ·7HO易溶于水难溶于酒精,用酒精做洗涤剂,可利用酒精挥发带走固体表面的
4 2
第18页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
水分,同时减少CoSO 因溶于水而损耗,易于后续干燥。
4
【小问7详解】
根据钴的晶胞结构可知,其中原子个数为 =6。
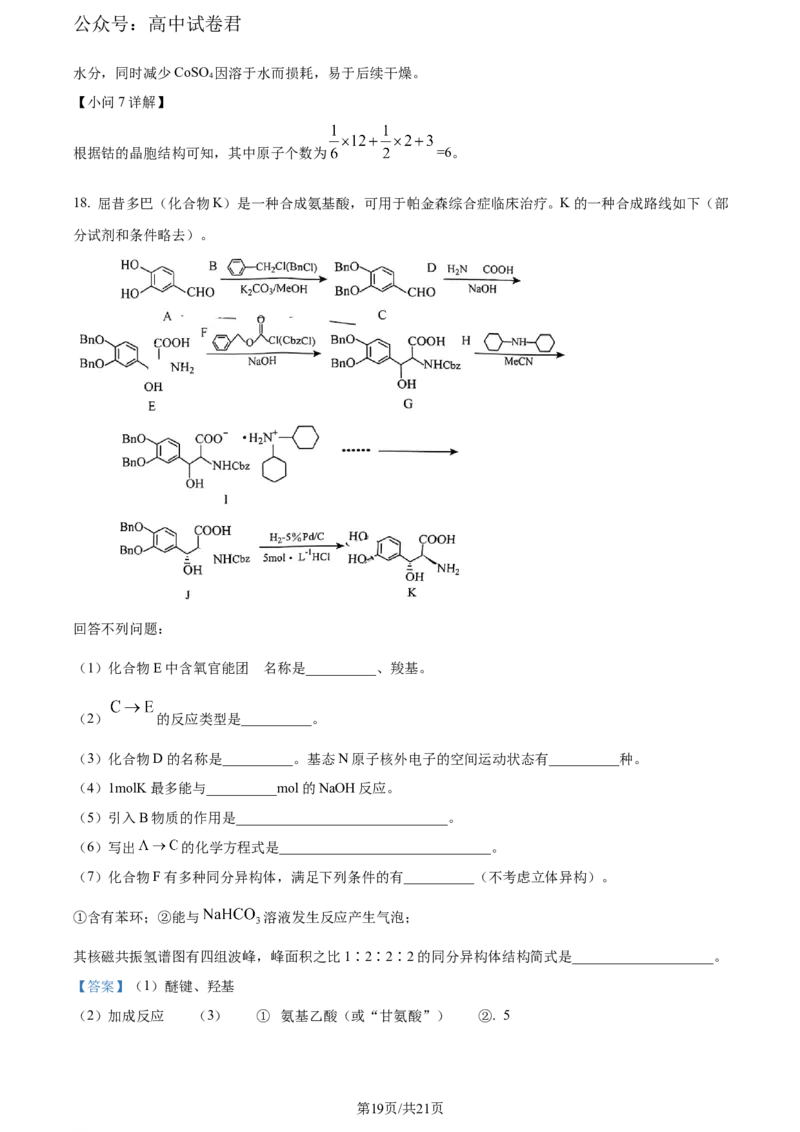
18. 屈昔多巴(化合物K)是一种合成氨基酸,可用于帕金森综合症临床治疗。K的一种合成路线如下(部
分试剂和条件略去)。
回答不列问题:
的
(1)化合物E中含氧官能团 名称是__________、羧基。
(2) 的反应类型是__________。
(3)化合物D的名称是__________。基态N原子核外电子的空间运动状态有__________种。
(4)1molK最多能与__________mol的NaOH反应。
(5)引入B物质的作用是______________________________。
(6)写出 的化学方程式是______________________________。
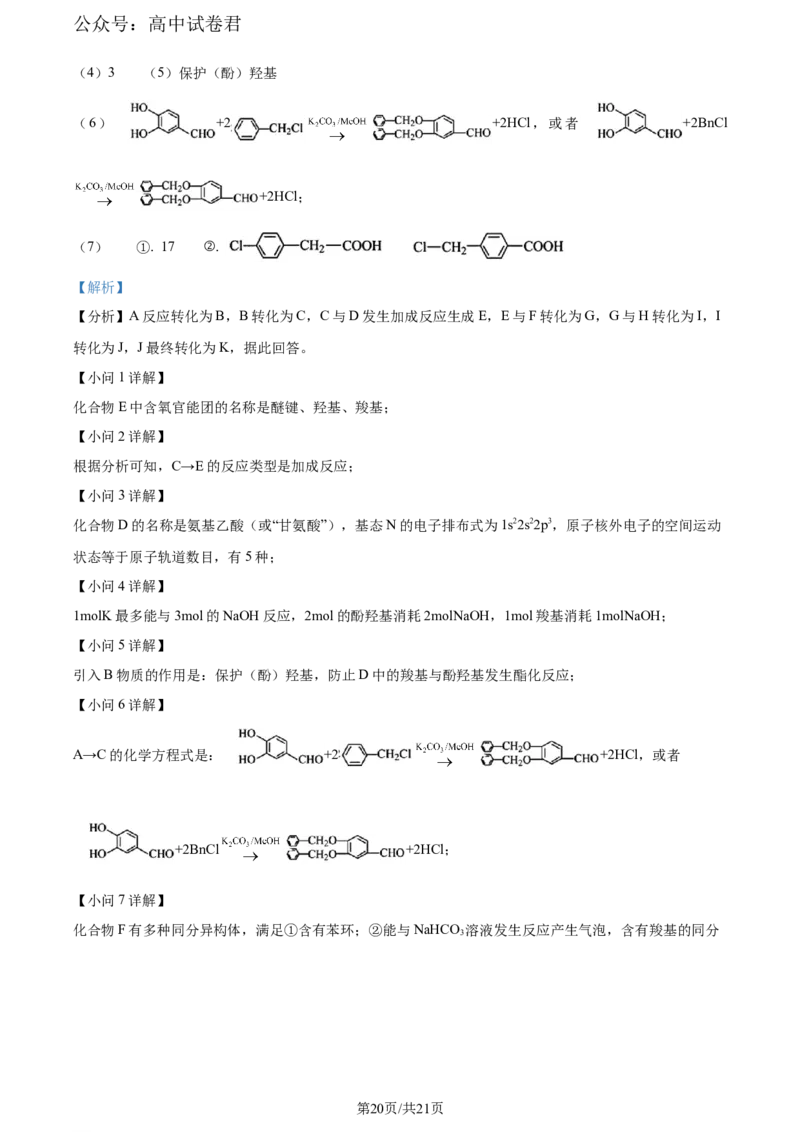
(7)化合物F有多种同分异构体,满足下列条件的有__________(不考虑立体异构)。
①含有苯环;②能与 溶液发生反应产生气泡;
其核磁共振氢谱图有四组波峰,峰面积之比1∶2∶2∶2的同分异构体结构简式是____________________。
【答案】(1)醚键、羟基
.
(2)加成反应 (3) ① 氨基乙酸(或“甘氨酸”) ②. 5
第19页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
(4)3 (5)保护(酚)羟基
(6) +2 +2HCl,或者 +2BnCl
+2HCl;
(7) ①. 17 ②.
【解析】
【分析】A反应转化为B,B转化为C,C与D发生加成反应生成E,E与F转化为G,G与H转化为I,I
转化为J,J最终转化为K,据此回答。
【小问1详解】
化合物E中含氧官能团的名称是醚键、羟基、羧基;
【小问2详解】
根据分析可知,C→E的反应类型是加成反应;
【小问3详解】
化合物D的名称是氨基乙酸(或“甘氨酸”),基态N的电子排布式为1s22s22p3,原子核外电子的空间运动
状态等于原子轨道数目,有5种;
【小问4详解】
1molK最多能与3mol的NaOH反应,2mol的酚羟基消耗2molNaOH,1mol羧基消耗1molNaOH;
【小问5详解】
引入B物质的作用是:保护(酚)羟基,防止D中的羧基与酚羟基发生酯化反应;
【小问6详解】
A→C的化学方程式是: +2 +2HCl,或者
+2BnCl +2HCl;
【小问7详解】
化合物F有多种同分异构体,满足①含有苯环;②能与NaHCO 溶液发生反应产生气泡,含有羧基的同分
3
第20页/共21页
学科网(北京)股份有限公司公众号:高中试卷君
异构体有17种,分别为:
,其核磁共振氢谱图有
四组波峰,峰面积之比1∶2∶2∶2的同分异构体结构简式是
。
第21页/共21页
学科网(北京)股份有限公司