文档内容
高三化学
一、本卷共14题,每题3分,共42分。每题只有一个选项最符合题意。
1. “中国制造”中航天、军事、天文、医学等领域的发展受到世界瞩目,它们与化学有着密切的联
系。下列说法正确的是
A. 纳米铁粉主要通过物理吸附作用除去污水中的Cu2+、Ag+、Hg2+
B. 城市柏油路面使用到的沥青可以通过石油分馏得到
C. “歼-20”飞机上大量使用的碳纤维是一种新型有机高分子材料
D. SiO 可用于制作光导纤维和光感电池
2
2.下列化学用语表示正确的是
A.邻羟基苯甲醛分子内氢键示意图为 B.SO 的空间填充模型为
2
C.基态Cu+的价电子排布式为3d10 D.NH 的电子式为
2 4
3.某化学实验小组制备KClO 并探究其性质的过程如图:
3
下列说法不正确的是( )
A.87 gMnO 与足量浓盐酸加热充分反应,理论上可以制得1 mol Cl
2 2
B.在反应KClO+6HCl=3Cl ↑+KCl+3H O中生成3 mol Cl,则转移电子数目为6N
3 2 2 2 A
C.上述实验说明氧化性:碱性条件Cl> KClO,酸性条件Cl< KClO
2 3 2 3
D.取少量a溶液于试管中,滴加稀HSO 后溶液呈现黄色原因是:IO -+5I-+6H+=3I +3H O
2 4 3 2 2
4. 下列离子方程式正确的是
A. 用FeS除去工业废水中的Hg2+:Hg2++S2-=HgS↓
B. 用SO 的水溶液吸收溴蒸气:Br +SO+2H O=2HBr+SO 2-+2H+
2 2 2 2 4
C. 硫代硫酸钠溶液中加入浓硝酸:SO2-+2H+=S↓+SO ↑+H O
2 3 2 2
D. 将Ba(OH) 和NH HSO 溶液以物质的量之比1∶2混合:
2 4 4
Ba2++2OH-+2H++SO2-=BaSO ↓+2HO
4 4 2
5.用N 代表阿伏加德罗常数的值。下列说法正确的是
A
A.13g苯和苯乙烯的混合物中所含的原子总数为2 N
A
B.1 mol聚氯乙烯含有原子数目为6N
A
C.标准状况下,22.4LNO和11.2LO 在密闭容器中混合,容器内分子数目为N
2 A
D.常温下,22.4 L HF中含有的极性共价键数目为N
A
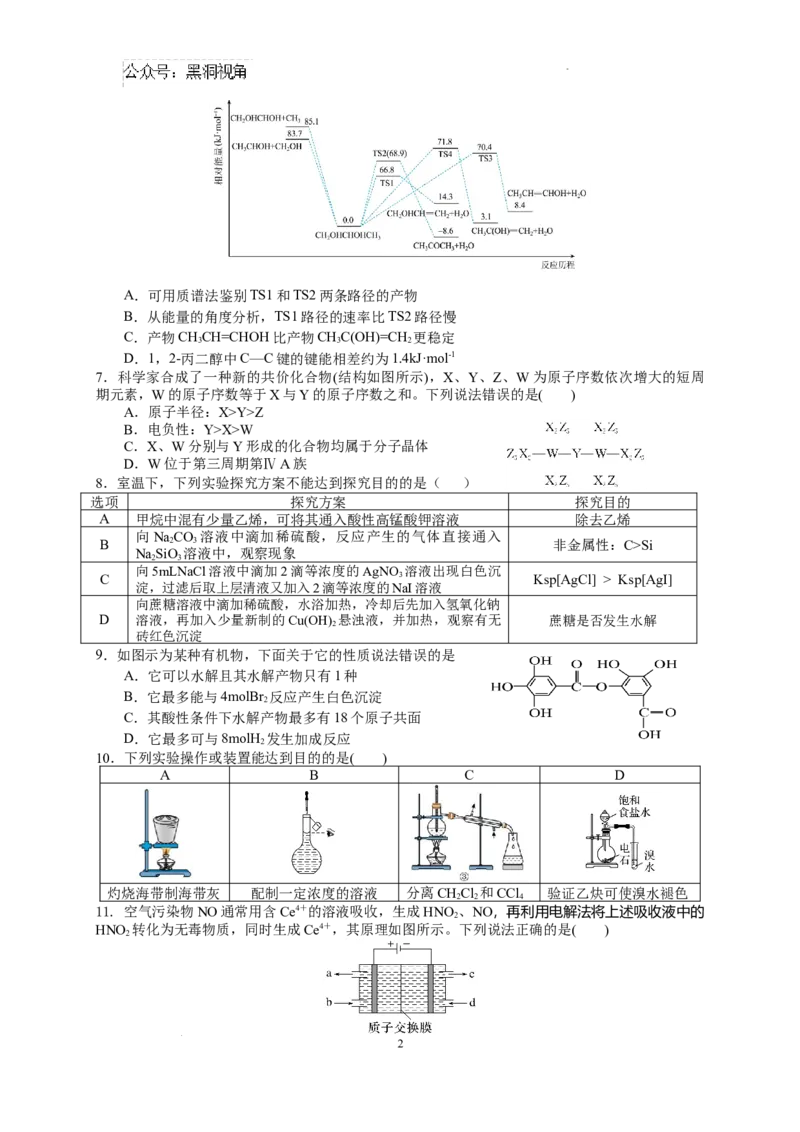
6.1,2-丙二醇(CHOHCHOHCH )单分子解离可以得到多种不同的产物或自由基,反应相对能量随
2 3
反应历程的部分变化如图所示。解离路径包括碳碳键断裂解离和脱水过程。下列说法正确的是
1
学科网(北京)股份有限公司A.可用质谱法鉴别TS1和TS2两条路径的产物
B.从能量的角度分析,TS1路径的速率比TS2路径慢
C.产物CHCH=CHOH比产物CHC(OH)=CH 更稳定
3 3 2
D.1,2-丙二醇中C—C键的键能相差约为1.4kJ·mol-1
7.科学家合成了一种新的共价化合物(结构如图所示),X、Y、Z、W为原子序数依次增大的短周
期元素,W的原子序数等于X与Y的原子序数之和。下列说法错误的是( )
A.原子半径:X>Y>Z
B.电负性:Y>X>W
C.X、W分别与Y形成的化合物均属于分子晶体
D.W位于第三周期第ⅣA族
8.室温下,下列实验探究方案不能达到探究目的的是( )
选项 探究方案 探究目的
A 甲烷中混有少量乙烯,可将其通入酸性高锰酸钾溶液 除去乙烯
向NaCO 溶液中滴加稀硫酸,反应产生的气体直接通入
B 2 3 非金属性:C>Si
NaSiO 溶液中,观察现象
2 3
向5mLNaCl溶液中滴加2滴等浓度的AgNO 溶液出现白色沉
C 3 Ksp[AgCl] > Ksp[AgI]
淀,过滤后取上层清液又加入2滴等浓度的NaI溶液
向蔗糖溶液中滴加稀硫酸,水浴加热,冷却后先加入氢氧化钠
D 溶液,再加入少量新制的Cu(OH) 悬浊液,并加热,观察有无 蔗糖是否发生水解
2
砖红色沉淀
9.如图示为某种有机物,下面关于它的性质说法错误的是
A.它可以水解且其水解产物只有1种
B.它最多能与4molBr 反应产生白色沉淀
2
C.其酸性条件下水解产物最多有18个原子共面
D.它最多可与8molH 发生加成反应
2
10.下列实验操作或装置能达到目的的是( )
A B C D
灼烧海带制海带灰 配制一定浓度的溶液 分离CHCl 和CCl 验证乙炔可使溴水褪色
2 2 4
11. 空气污染物NO通常用含Ce4+的溶液吸收,生成HNO、NO,再利用电解法将上述吸收液中的
2
HNO 转化为无毒物质,同时生成Ce4+,其原理如图所示。下列说法正确的是( )
2
2
学科网(北京)股份有限公司A.H+由右室进入左室
B.Ce4+从电解槽的c口流出,且可循环使用
C.阴极的电极反应式:2HNO+6H++6e-===N↑+4HO
2 2 2
D.若用甲烷燃料电池作为电源,当消耗33.6 L甲烷时,理论上可转化2 mol HNO
2
12.硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,已知该晶体密度为ρg/cm3,
设阿伏加德罗常数的值为N 。下列说法不正确的是( )
A
A.Se位于元素周期表的p区
B.基态Zn原子核外有15种不同空间运动状态的电子
C.该晶胞中Zn与Se之间的最短距离
为 nm
D.若A点原子的坐标为 ,则B点原子的坐标为
13. 化合物X( )是一种治疗神经类疾病的药物,下列说法错误的是
A.化合物X的分子式为C H O NBr
15 18 6
B.化合物X分子中含有2个手性碳原子
C.化合物X既能与盐酸反应,又能与甲醛发生缩聚反应
D.化合物X能与NaOH溶液反应,且1 mol X最多能与5 mol NaOH反应
14.常温下,将一定浓度的AgNO 溶液分别滴加到浓度均为0.1mol·L—1的KCl、KCrO 溶液中,生
3 2 4
成沉淀的溶解平衡曲线如图所示(Xn—表示Cl—或CrO2—)。下列叙述正确的是
4
A.①、②分别代表AgCl、Ag CrO
2 4
B. Ksp[Ag CrO]=1×10—9
2 4
C.Ksp[Ag CrO]< Ksp[AgCl],说明Ag CrO 的溶解度更小
2 4 2 4
D.Ag CrO (s)+2Cl—(aq) 2AgCl (s)+ CrO2—(aq)的
2 4 4
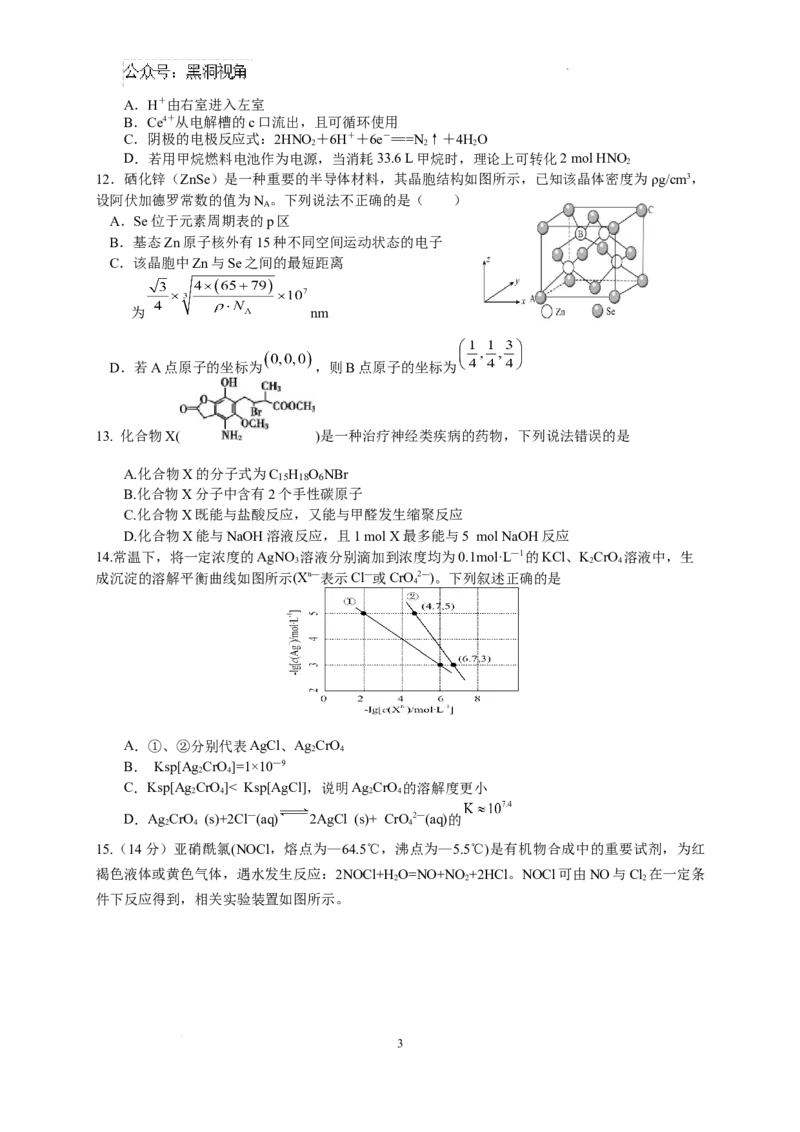
15.(14分)亚硝酰氯(NOCl,熔点为—64.5℃,沸点为—5.5℃)是有机物合成中的重要试剂,为红
褐色液体或黄色气体,遇水发生反应:2NOCl+HO=NO+NO +2HCl。NOCl可由NO与Cl 在一定条
2 2 2
件下反应得到,相关实验装置如图所示。
3
学科网(北京)股份有限公司(1)装置Ⅰ中装铜屑的仪器名称为 ,装置Ⅱ中试剂为 ,
装置的连接顺序为 。
(2)实验时先打开分液漏斗活塞滴入稀硝酸,发生反应的离子方程式为
,当观察到Ⅴ中 时,开始向装置中通入Cl。
2
(3)装置Ⅵ中KMnO 溶液用于吸收NO气体,已知该反应氧化剂和还原剂的物质的量之比为1:1,反
4
应产生了一种黑色沉淀,其化学式是 。
(4)通过以下实验步骤测定制得NOCl样品纯度(杂质不参与以下反应):
a.将Ⅴ中所得液体2.0g溶于水,配制成250mL溶液;取出25.00mL于锥形瓶中;
b.加入 溶液(过量),使Cl—完全转化为AgCl沉淀;
c.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
d.加入指示剂,用 标准溶液滴定过量的 溶液,重复实验操作三次,消
耗标准溶液的体积平均为25.00mL。[已知 , ]
①滴定选用的误差最小的指示剂是 (填序号)。
A.(NH )Fe(SO ) B.NH Fe(SO ) C.FeCl D. FeCl
4 2 4 2 4 4 2 3 2
②NOCl 的纯度为 。(用百分数表示,保留两位小数)
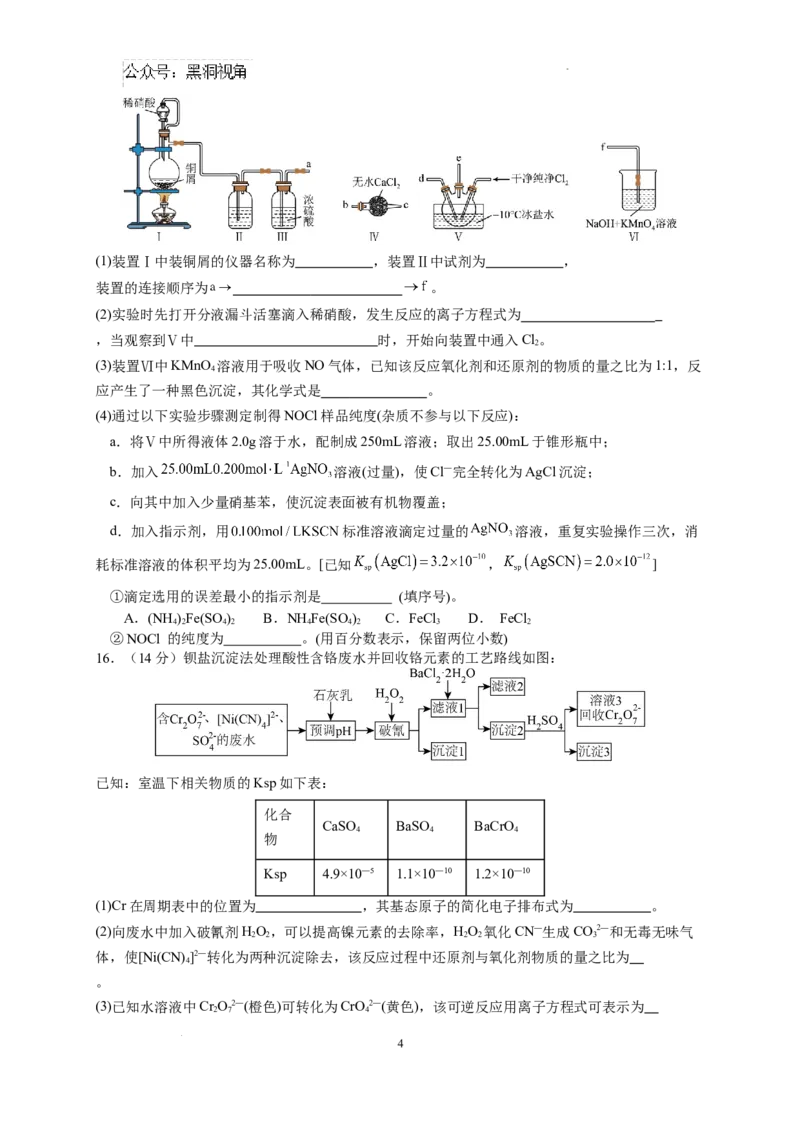
16.(14分)钡盐沉淀法处理酸性含铬废水并回收铬元素的工艺路线如图:
已知:室温下相关物质的Ksp如下表:
化合
CaSO BaSO BaCrO
4 4 4
物
Ksp 4.9×10—5 1.1×10—10 1.2×10—10
(1)Cr在周期表中的位置为 ,其基态原子的简化电子排布式为 。
(2)向废水中加入破氰剂HO,可以提高镍元素的去除率,HO 氧化CN—生成CO2—和无毒无味气
2 2 2 2 3
体,使[Ni(CN) ]2—转化为两种沉淀除去,该反应过程中还原剂与氧化剂物质的量之比为
4
。
(3)已知水溶液中Cr O2—(橙色)可转化为CrO2—(黄色),该可逆反应用离子方程式可表示为
2 7 4
4
学科网(北京)股份有限公司;
(4)沉淀2的主要成分是 ,沉淀2与足量HSO 反应的离子方程式为
2 4
。
(5)根据国家标准,含CrO2—的浓度降至5.0×10—7 mol·L—1以下才能排放,则加入可溶性钡盐后的废
4
水中应使Ba2+的浓度不小于 mol·L—1。
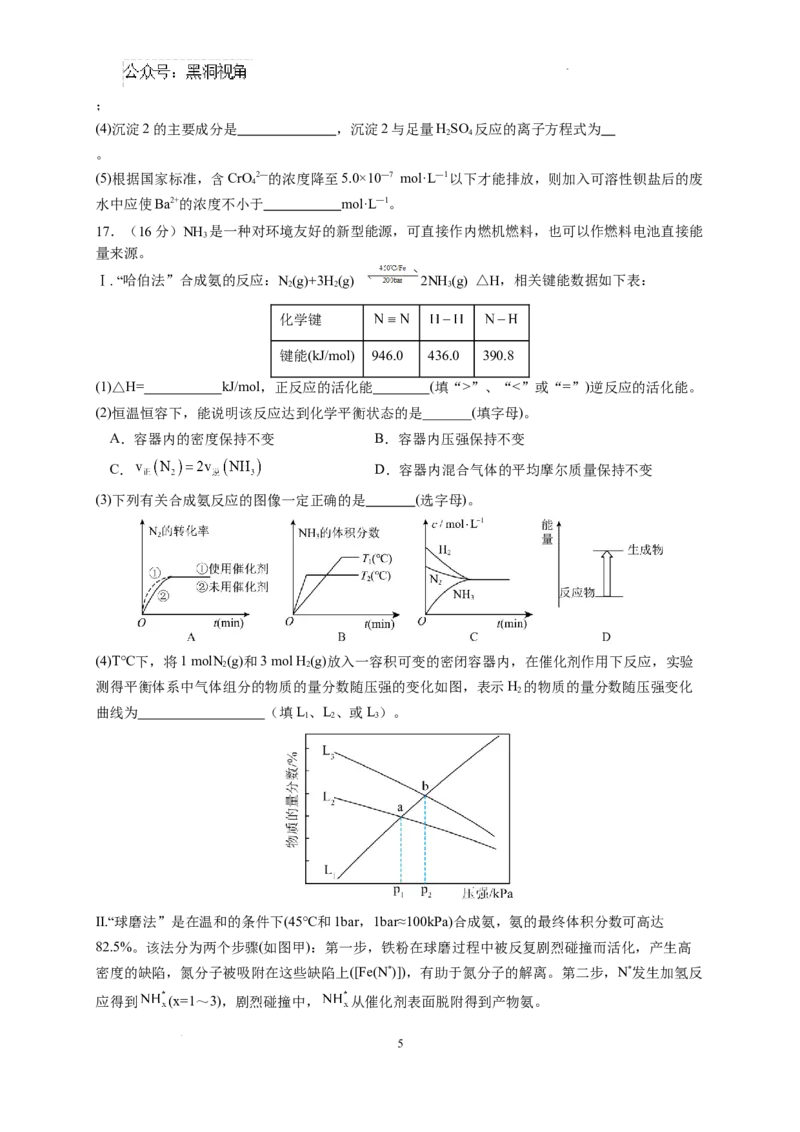
17.(16分)NH 是一种对环境友好的新型能源,可直接作内燃机燃料,也可以作燃料电池直接能
3
量来源。
Ⅰ. “哈伯法”合成氨的反应:N(g)+3H(g) 2NH (g) △H,相关键能数据如下表:
2 2 3
化学键
键能(kJ/mol) 946.0 436.0 390.8
(1)△H= kJ/mol,正反应的活化能 (填“>”、“<”或“=”)逆反应的活化能。
(2)恒温恒容下,能说明该反应达到化学平衡状态的是_______(填字母)。
A.容器内的密度保持不变 B.容器内压强保持不变
C. D.容器内混合气体的平均摩尔质量保持不变
(3)下列有关合成氨反应的图像一定正确的是 (选字母)。
(4)T℃下,将1 molN(g)和3 mol H (g)放入一容积可变的密闭容器内,在催化剂作用下反应,实验
2 2
测得平衡体系中气体组分的物质的量分数随压强的变化如图,表示H 的物质的量分数随压强变化
2
曲线为 (填L、L、或L)。
1 2 3
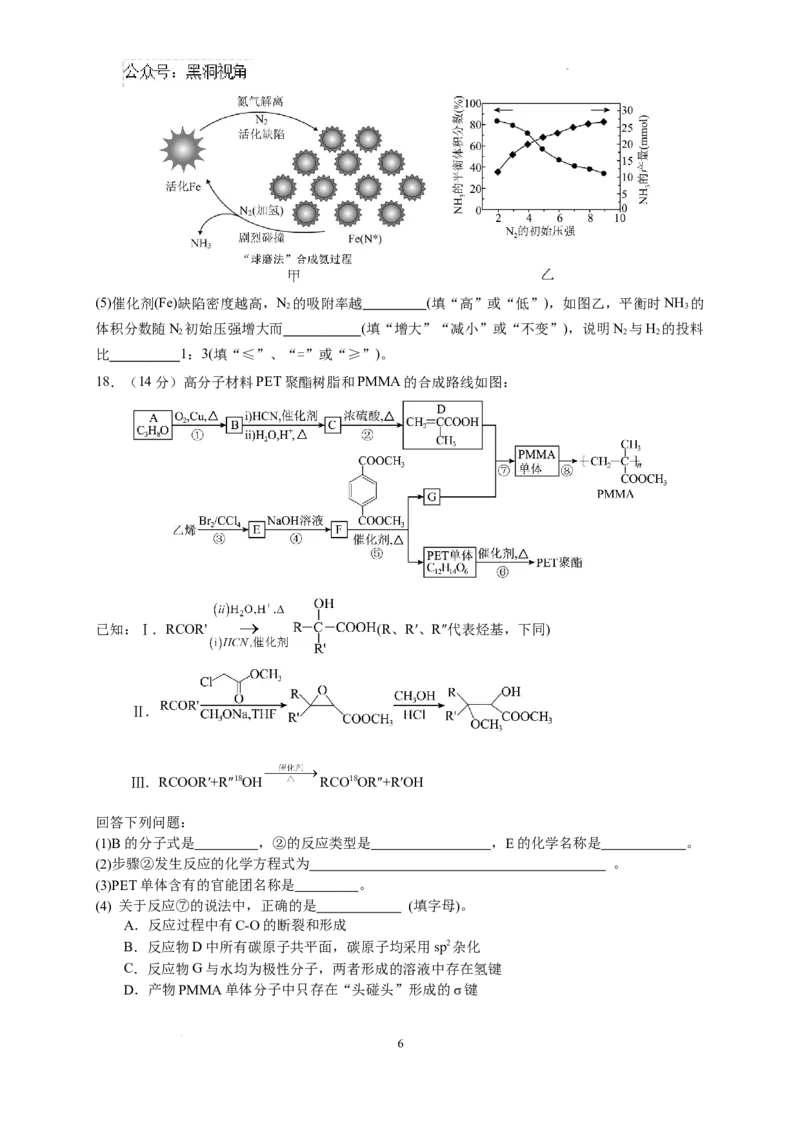
Ⅱ.“球磨法”是在温和的条件下(45℃和1bar,1bar≈100kPa)合成氨,氨的最终体积分数可高达
82.5%。该法分为两个步骤(如图甲):第一步,铁粉在球磨过程中被反复剧烈碰撞而活化,产生高
密度的缺陷,氮分子被吸附在这些缺陷上([Fe(N*)]),有助于氮分子的解离。第二步,N*发生加氢反
应得到 (x=1~3),剧烈碰撞中, 从催化剂表面脱附得到产物氨。
5
学科网(北京)股份有限公司(5)催化剂(Fe)缺陷密度越高,N 的吸附率越 (填“高”或“低”),如图乙,平衡时NH 的
2 3
体积分数随N 初始压强增大而 (填“增大”“减小”或“不变”),说明N 与H 的投料
2 2 2
比 1:3(填“≤”、“=”或“≥”)。
18.(14分)高分子材料PET聚酯树脂和PMMA的合成路线如图:
已知:Ⅰ.RCOR' (R、R′、R″代表烃基,下同)
Ⅱ.
Ⅲ.RCOOR′+R″18OH RCO18OR″+R′OH
回答下列问题:
(1)B的分子式是 ,②的反应类型是 ,E的化学名称是 。
(2)步骤②发生反应的化学方程式为 。
(3)PET单体含有的官能团名称是 。
(4) 关于反应⑦的说法中,正确的是 (填字母)。
A.反应过程中有C-O的断裂和形成
B.反应物D中所有碳原子共平面,碳原子均采用sp2杂化
C.反应物G与水均为极性分子,两者形成的溶液中存在氢键
D.产物PMMA单体分子中只存在“头碰头”形成的σ键
6
学科网(北京)股份有限公司CH CH=CH CH OH
(5)结合题中所给信息,以 3 2、 3 和 为原料合成 。
基于你的设计,回答下列问题:
①最后一步反应中的有机反应物为 (写结构简式)。
②步骤中涉及烯烃制醇的反应,其化学反应方程式为 。
7
学科网(北京)股份有限公司