文档内容
成都七中 2025 届高三年级入学考试卷
考试时间:75分钟 总分:100分
可能用到的相对原子质量:H-1;C-12;N-14;O-16;Ge-73
一、选择题:本题共 14小题,每小题 3分,共 42 分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1.2024巴黎奥运会是属于全人类的盛事,下列说法不正确的
B.奖牌中来自埃菲尔铁 C.运动员休息的纸板床
A.吉祥物材质聚酯纤维
D.工作制服材料属于有
属于无机高分子
塔的碎片属于无机金属 中间层聚乙烯属于有机
机高分子材料
材料 高分子材料
2.下列离子方程式中,错误的是
..
A. Na放入水中:2Na+2H O=2Na++2OH—+H ↑
2 2
B. 过量CO 通入石灰乳中:CO +OH— = HCO —
2 2 3
C. Al O 放入NaOH溶液中:Al O +2OH—=2AlO —+H O
2 3 2 3 2 2
D. Fe放入Fe (SO ) 中,Fe+2Fe3+=3Fe2+
2 4 3
3.下列叙述正确的是
A.常温下浓硫酸分别与Fe、Cu 反应,生成的气体相同
B. NaOH 溶液分别与NO
2
和CO
2
反应,反应的类型相同
C. Na O 分别与CO 、SO 反应,生成产物不同
2 2 2 2
D. 冶炼金属Mg 和Al,电解熔融物的类别都属于盐酸盐
4.我国四大发明黑火药反应原理:S+2KNO +3C=K S+N ↑+3CO ↑,N 为阿伏加德罗常数的值,当生成1mol
3 2 2 2 A
K S时,下列叙述错误的是
2 ..
A. 转移电子数为12N
A
B. 生成的N 质量为28g
2
C. 生成的还原产物为2mol
D. 生成的CO 含有孤电子对数为2N
2 A
第1页/共8页
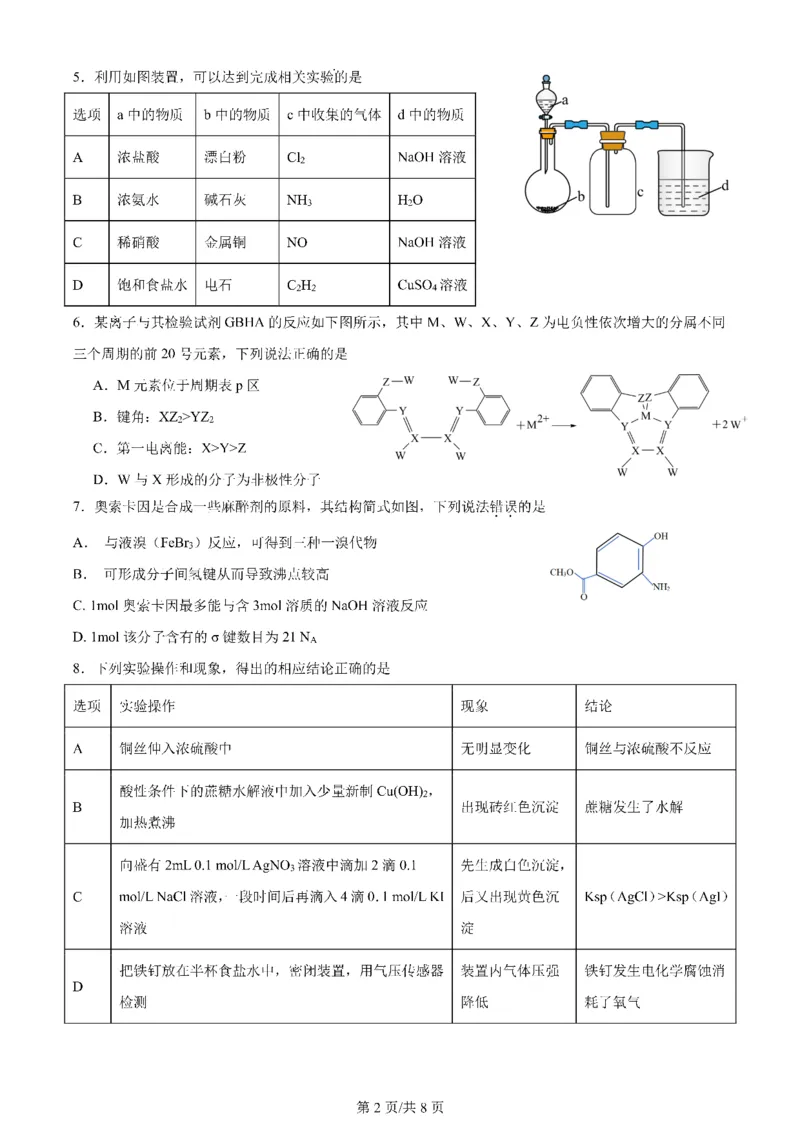
学科网(北京)股份有限公司9.一种离子液体的结构如图所示,已知阳离子中五元环上的原子处于同一平面。下列说法不正确的是
...
A.该物质中所有原子均达到了8e稳定结构
B.阳离子中存在π6
5
C.阴离子空间构型为正八面体
D.该物质的晶体属于离子晶体
10.PCl 发生水解反应的机理如下图。下列说法正确是
3
A.PCl 为非极性分子 B.H PO 中P为sp3杂化
3 3 3
C.PCl 的水解产物H PO 为三元酸 D.HPOCl 和H PO 均能形成分子间氢键
3 3 3 2 3 3
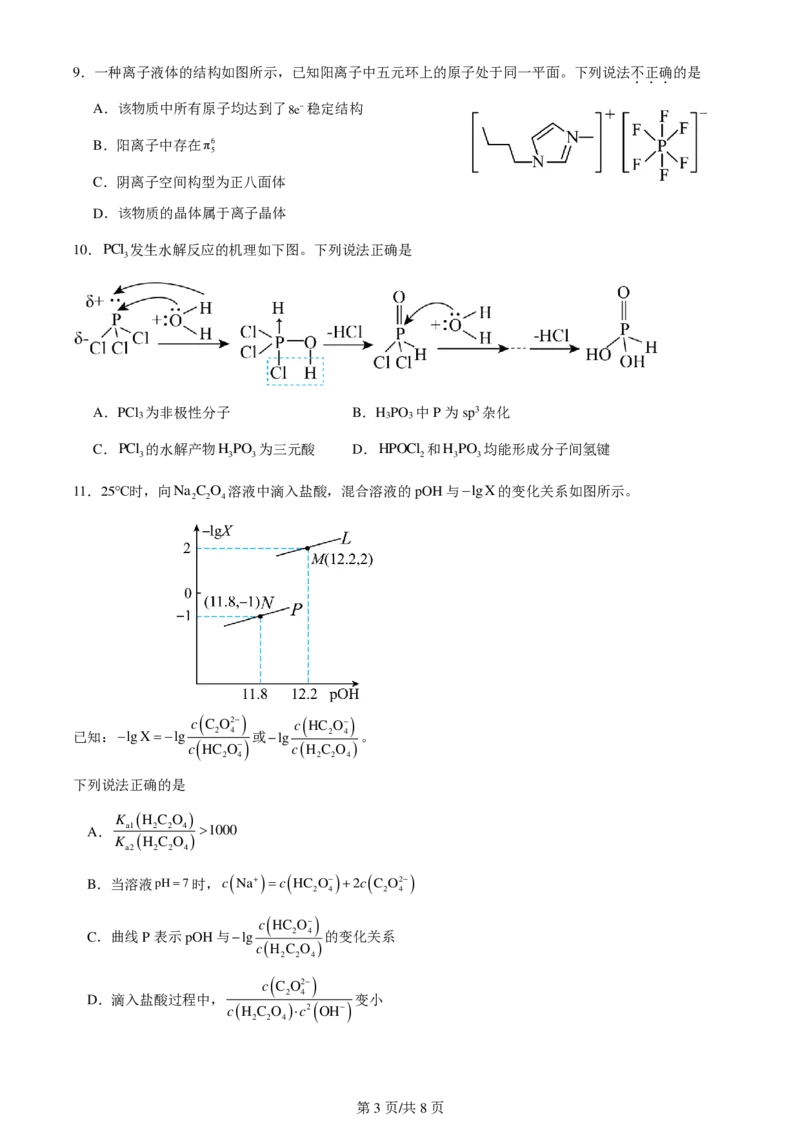
11.25℃时,向Na C O 溶液中滴入盐酸,混合溶液的pOH与lgX的变化关系如图所示。
2 2 4
c C O2 c HC O
已知:lgXlg 2 4 或lg 2 4 。
c HC O cH C O
2 4 2 2 4
下列说法正确的是
K H C O
A. a1 2 2 4 1000
K H C O
a2 2 2 4
B.当溶液pH7时,c
Na
c
HC
O
2c
C
O2
2 4 2 4
c
HC
O
C.曲线P表示pOH与lg 2 4 的变化关系
cH C O
2 2 4
c
C
O2
2 4
D.滴入盐酸过程中, 变小
cH C O c2 OH
2 2 4
第3页/共8页
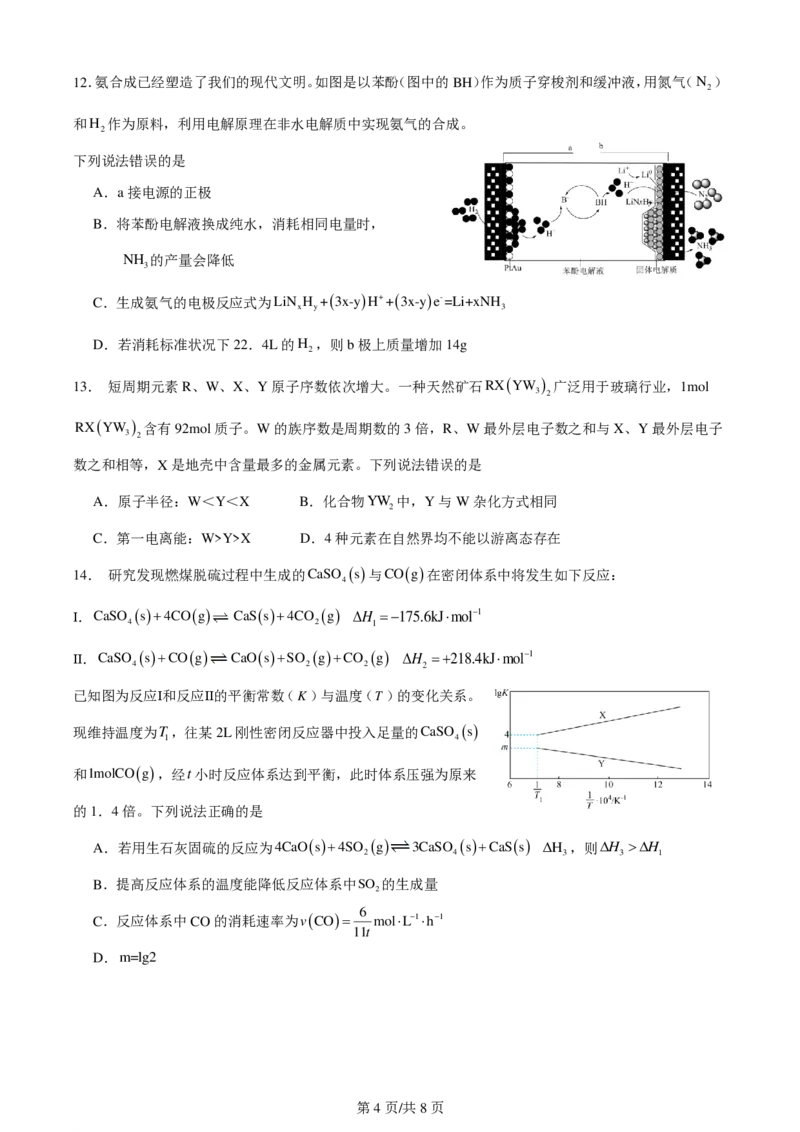
学科网(北京)股份有限公司12.氨合成已经塑造了我们的现代文明。如图是以苯酚(图中的BH)作为质子穿梭剂和缓冲液,用氮气(N )
2
和H 作为原料,利用电解原理在非水电解质中实现氨气的合成。
2
下列说法错误的是
A.a接电源的正极
B.将苯酚电解液换成纯水,消耗相同电量时,
NH 的产量会降低
3
C.生成氨气的电极反应式为LiN H +3x-yH++3x-ye-=Li+xNH
x y 3
D.若消耗标准状况下22.4L的H ,则b极上质量增加14g
2
13. 短周期元素R、W、X、Y原子序数依次增大。一种天然矿石RXYW 广泛用于玻璃行业,1mol
3 2
RXYW 含有92mol质子。W的族序数是周期数的3倍,R、W最外层电子数之和与X、Y最外层电子
3 2
数之和相等,X是地壳中含量最多的金属元素。下列说法错误的是
A.原子半径:W<Y<X B.化合物YW 中,Y与W杂化方式相同
2
C.第一电离能:W>Y>X D.4种元素在自然界均不能以游离态存在
14. 研究发现燃煤脱硫过程中生成的CaSO s与COg在密闭体系中将发生如下反应:
4
Ⅰ.CaSO s4COg CaSs4CO g H 175.6kJmol1
4 2 1
Ⅱ.CaSO sCOg CaOsSO gCO g H 218.4kJmol1
4 2 2 2
已知图为反应Ⅰ和反应Ⅱ的平衡常数(K)与温度(T )的变化关系。
现维持温度为T ,往某2L刚性密闭反应器中投入足量的CaSO s
1 4
和1molCOg,经t小时反应体系达到平衡,此时体系压强为原来
的1.4倍。下列说法正确的是
A.若用生石灰固硫的反应为4CaOs4SO g 3CaSO sCaSs ΔH ,则H H
2 4 3 3 1
B.提高反应体系的温度能降低反应体系中SO 的生成量
2
6
C.反应体系中CO的消耗速率为vCO molL1h1
11t
D.m=lg2
第4页/共8页
学科网(北京)股份有限公司二、非选择题:本题共 4小题,共 58分。
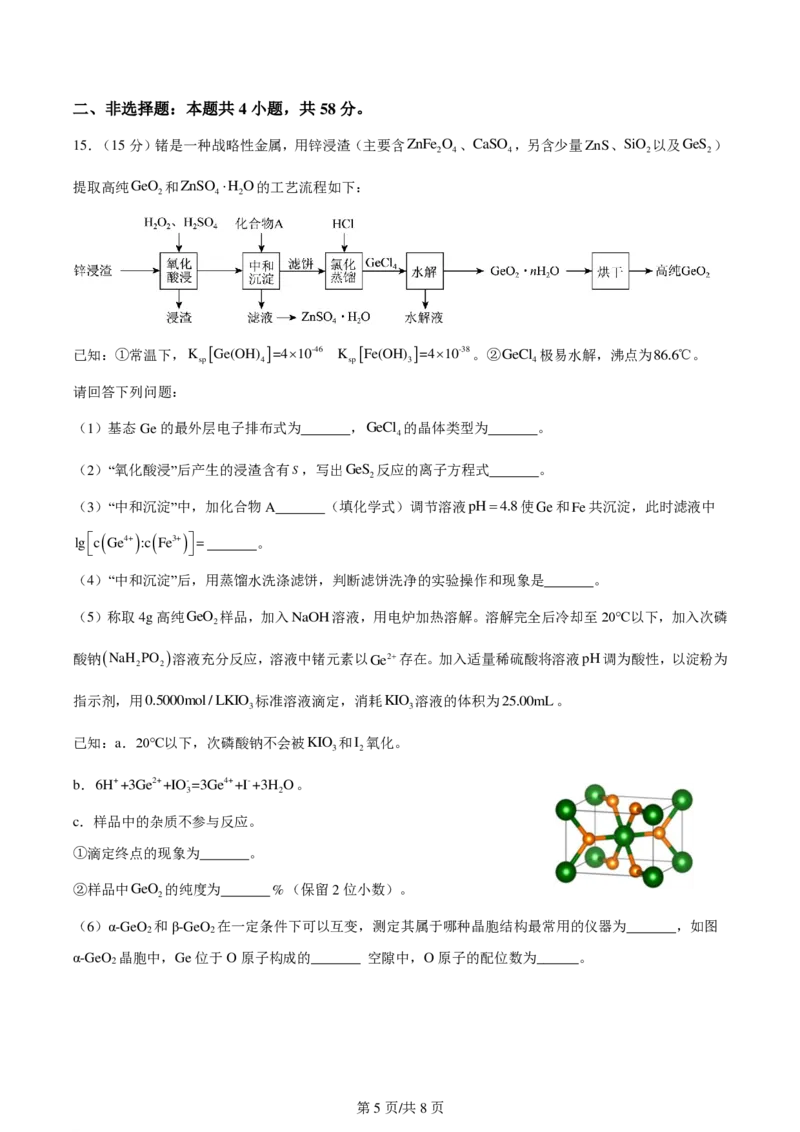
15.(15分)锗是一种战略性金属,用锌浸渣(主要含ZnFe O 、CaSO ,另含少量ZnS、SiO 以及GeS )
2 4 4 2 2
提取高纯GeO 和ZnSO H O的工艺流程如下:
2 4 2
已知:①常温下,K Ge(OH) =410-46 K Fe(OH) =410-38。②GeCl 极易水解,沸点为86.6℃。
sp 4 sp 3 4
请回答下列问题:
(1)基态Ge的最外层电子排布式为 ,GeCl 的晶体类型为 。
4
(2)“氧化酸浸”后产生的浸渣含有S,写出GeS 反应的离子方程式 。
2
(3)“中和沉淀”中,加化合物A (填化学式)调节溶液pH4.8使Ge和Fe共沉淀,此时滤液中
lgc Ge4+ :c Fe3+= 。
(4)“中和沉淀”后,用蒸馏水洗涤滤饼,判断滤饼洗净的实验操作和现象是 。
(5)称取4g高纯GeO 样品,加入NaOH溶液,用电炉加热溶解。溶解完全后冷却至20℃以下,加入次磷
2
酸钠NaH PO 溶液充分反应,溶液中锗元素以Ge2存在。加入适量稀硫酸将溶液pH调为酸性,以淀粉为
2 2
指示剂,用0.5000mol/LKIO 标准溶液滴定,消耗KIO 溶液的体积为25.00mL。
3 3
已知:a.20℃以下,次磷酸钠不会被KIO 和I 氧化。
3 2
b.6H++3Ge2++IO-=3Ge4++I-+3H O。
3 2
c.样品中的杂质不参与反应。
①滴定终点的现象为 。
②样品中GeO 的纯度为 %(保留2位小数)。
2
(6)α-GeO 和β-GeO 在一定条件下可以互变,测定其属于哪种晶胞结构最常用的仪器为_______,如图
2 2
α-GeO 晶胞中,Ge位于O原子构成的_______ 空隙中,O原子的配位数为______。
2
第5页/共8页
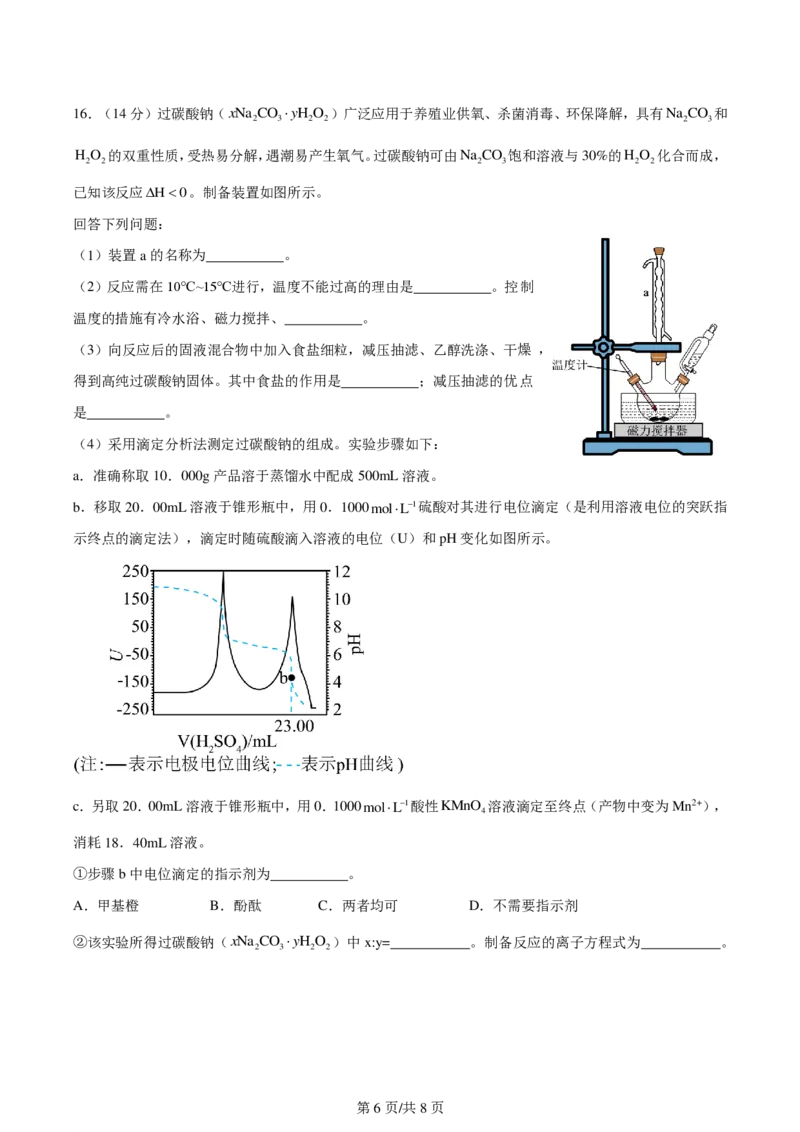
学科网(北京)股份有限公司16.(14分)过碳酸钠(xNa CO yH O )广泛应用于养殖业供氧、杀菌消毒、环保降解,具有Na CO 和
2 3 2 2 2 3
H O 的双重性质,受热易分解,遇潮易产生氧气。过碳酸钠可由Na CO 饱和溶液与30%的H O 化合而成,
2 2 2 3 2 2
已知该反应H0。制备装置如图所示。
回答下列问题:
(1)装置a的名称为 。
(2)反应需在10℃~15℃进行,温度不能过高的理由是 。控制
温度的措施有冷水浴、磁力搅拌、 。
(3)向反应后的固液混合物中加入食盐细粒,减压抽滤、乙醇洗涤、干燥 ,
得到高纯过碳酸钠固体。其中食盐的作用是 ;减压抽滤的优点
是 。
(4)采用滴定分析法测定过碳酸钠的组成。实验步骤如下:
a.准确称取10.000g产品溶于蒸馏水中配成500mL溶液。
b.移取20.00mL溶液于锥形瓶中,用0.1000molL1硫酸对其进行电位滴定(是利用溶液电位的突跃指
示终点的滴定法),滴定时随硫酸滴入溶液的电位(U)和pH变化如图所示。
c.另取20.00mL溶液于锥形瓶中,用0.1000molL1酸性KMnO 溶液滴定至终点(产物中变为Mn2+),
4
消耗18.40mL溶液。
①步骤b中电位滴定的指示剂为 。
A.甲基橙 B.酚酞 C.两者均可 D.不需要指示剂
②该实验所得过碳酸钠(xNa CO yH O )中x:y= 。制备反应的离子方程式为 。
2 3 2 2
第6页/共8页
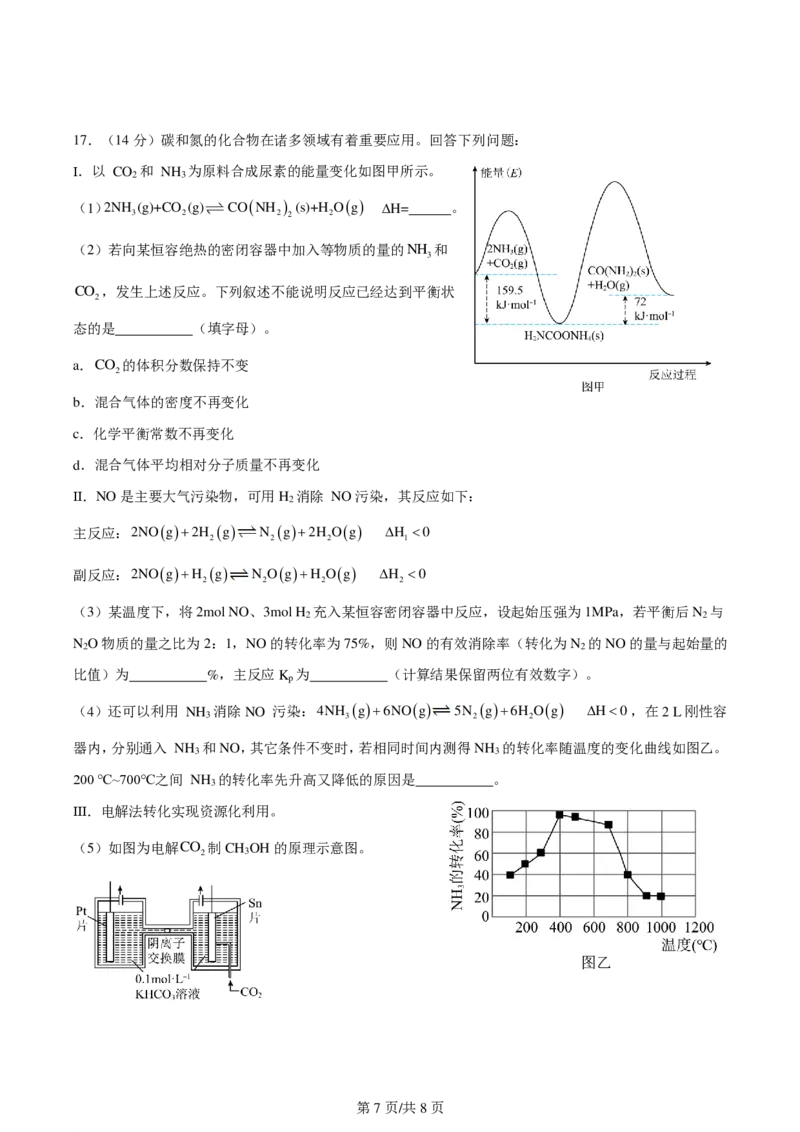
学科网(北京)股份有限公司17.(14分)碳和氮的化合物在诸多领域有着重要应用。回答下列问题:
Ⅰ.以 CO 和 NH 为原料合成尿素的能量变化如图甲所示。
2 3
(1)2NH (g)+CO (g) CONH (s)+H Og ∆H= 。
3 2 2 2 2
(2)若向某恒容绝热的密闭容器中加入等物质的量的NH 和
3
CO ,发生上述反应。下列叙述不能说明反应已经达到平衡状
2
态的是 (填字母)。
a.CO 的体积分数保持不变
2
b.混合气体的密度不再变化
c.化学平衡常数不再变化
d.混合气体平均相对分子质量不再变化
Ⅱ.NO是主要大气污染物,可用H 消除 NO污染,其反应如下:
2
主反应:2NOg2H g N g2H Og H 0
2 2 2 1
副反应:2NOgH g N OgH Og H 0
2 2 2 2
(3)某温度下,将2mol NO、3mol H 充入某恒容密闭容器中反应,设起始压强为1MPa,若平衡后N 与
2 2
N O物质的量之比为2:1,NO的转化率为75%,则NO的有效消除率(转化为N 的NO的量与起始量的
2 2
比值)为 %,主反应K 为 (计算结果保留两位有效数字)。
p
(4)还可以利用 NH 消除NO 污染:4NH g6NOg 5N g6H Og H0,在2 L刚性容
3 3 2 2
器内,分别通入 NH 和NO,其它条件不变时,若相同时间内测得NH 的转化率随温度的变化曲线如图乙。
3 3
200 ℃~700℃之间 NH 的转化率先升高又降低的原因是 。
3
Ⅲ.电解法转化实现资源化利用。
(5)如图为电解CO 制CH OH的原理示意图。
2 3
第7页/共8页
学科网(北京)股份有限公司①Sn片为 极(填“阴”或“阳”)。
②Pt片电极上的电极反应式为 (离子方程式)。
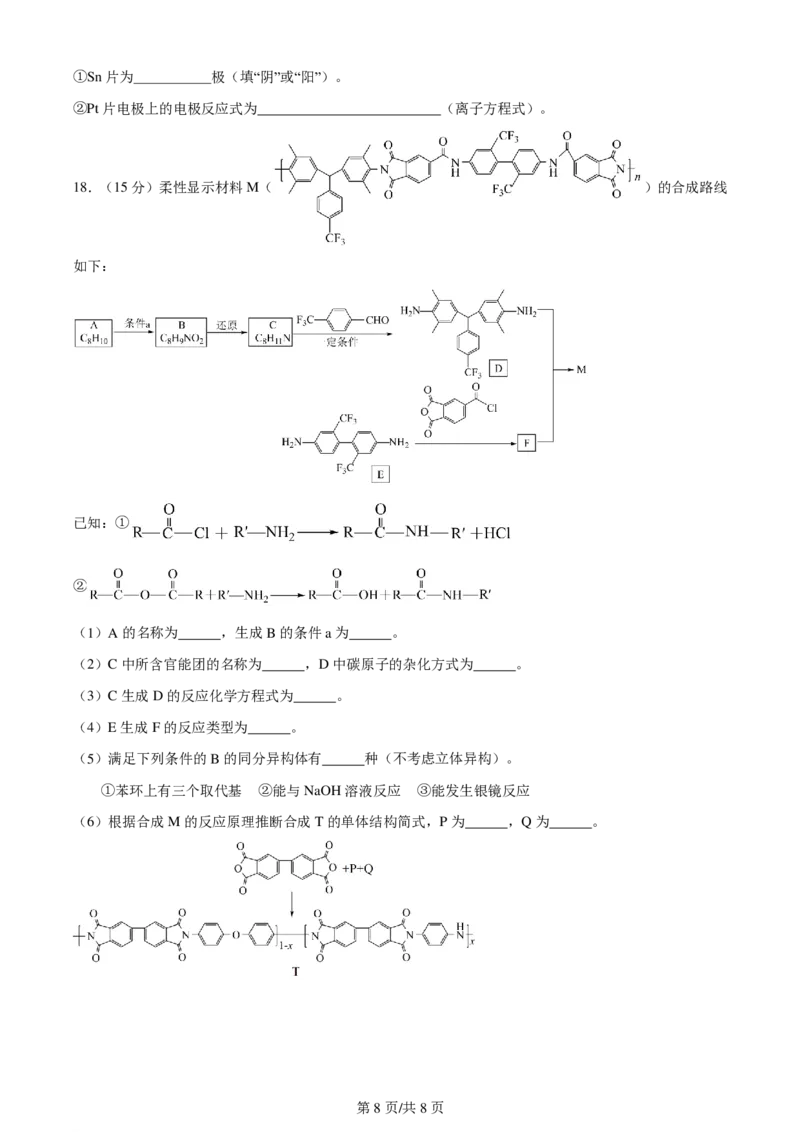
18.(15分)柔性显示材料M( )的合成路线
如下:
已知:①
②
(1)A的名称为 ,生成B的条件a为 。
(2)C中所含官能团的名称为 ,D中碳原子的杂化方式为 。
(3)C生成D的反应化学方程式为 。
(4)E生成F的反应类型为 。
(5)满足下列条件的B的同分异构体有 种(不考虑立体异构)。
①苯环上有三个取代基 ②能与NaOH溶液反应 ③能发生银镜反应
(6)根据合成M的反应原理推断合成T的单体结构简式,P为 ,Q为 。
第8页/共8页
学科网(北京)股份有限公司