文档内容
2025 届高三年级第二次质量调查化学学科试卷
命题人:化学备课组 审核人:化学备课组
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试用时60分钟。
第Ⅰ卷(单项选择题 共36分)
本卷共12题,每题3分,共36分。
以下数据可供解题时参考:
相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 S 32 Na 23 Fe 56 Cu 64
1.化学与生产、生活、科技密切相关。下列说法正确的是( )
A.杭州亚运会上的礼仪服饰用丝绸作为面料,丝绸属于纤维素
B.“长征七号”采用液氧、煤油等作为推进剂,液氧、煤油是纯净物
C.C919大飞机上使用了芳纶纤维,芳纶属于天然纤维
D.“天宫二号”空间站的太阳能电池帆板,其主要材料为晶体硅
2.下列相关微粒的说法正确的是( )
A.OH-的电子式:
B.基态氧原子的电子排布图:
C.聚丙烯腈的结构简式:
D. 的空间结构为三角锥形
3.下列关于物质分类的正确组合是( )
酸 碱 酸性氧化物 非电解质
A 硫酸 氨 SO 甲酸
3
气
B HCl 烧 CO 氯气
2
碱
C 冰醋酸 纯 NO BaSO
2 4
碱
D HNO 烧 SiO 乙醇
3 2
碱
4.N 为阿伏伽德罗常数的值,下列叙述正确的是( )
A
A.标准状况下,2.24LHF含有的分子数为0.1N
A
B.0.50mol1,2-二氯丙烷中的极性键数为4N
A
C.1LpH=13的 溶液中OH-数目为0.2N
A
D.常温、常压下,7.8g过氧化钠与足量CO 反应,电子转移数目为0.2N
2 A
5.下列离子方程式正确的是( )A.向少量NaOH溶液中滴加过量的 溶液:
B.向 溶液中通入 (标准状况):
C.KClO与 在碱性条件下反应制备 :
D.少量 通入 溶液中:
6.常温下,下列各组离子在指定溶液中可能大量共存的是( )
A.澄清透明的酸性溶液中: 、 、 、
B.由水电离的 的溶液: 、 、 、
C.加入苯酚显紫色的溶液中: 、 、 、
D.使甲基橙变红色的溶液: 、 、 、
7.将以下两试剂混合,现象与滴加顺序无关的是( )
选
试剂① 试剂②
项
A NaOH溶液
溶液
B KI—淀粉溶液
溶液
C 氨水
溶液
D HCl
8.铁及其化合物的转化具有重要应用。在指定条件下,下列物质间转化能实现的是( )
A.
B.
C.
D.
9.类比推理是化学的常用思维方法。下列推理正确的是( )
A. 是直线形分子,推测 也是直线形分子B. 与 反应生成 与 ,推测 与 反应生成 与
C.向 溶液中加入足量Zn发生反应: ,推测向 溶液中加入足量
Zn发生反应:
D.金刚石中碳原子均为sp3杂化,推测单晶硅中硅原子也均为sp3杂化
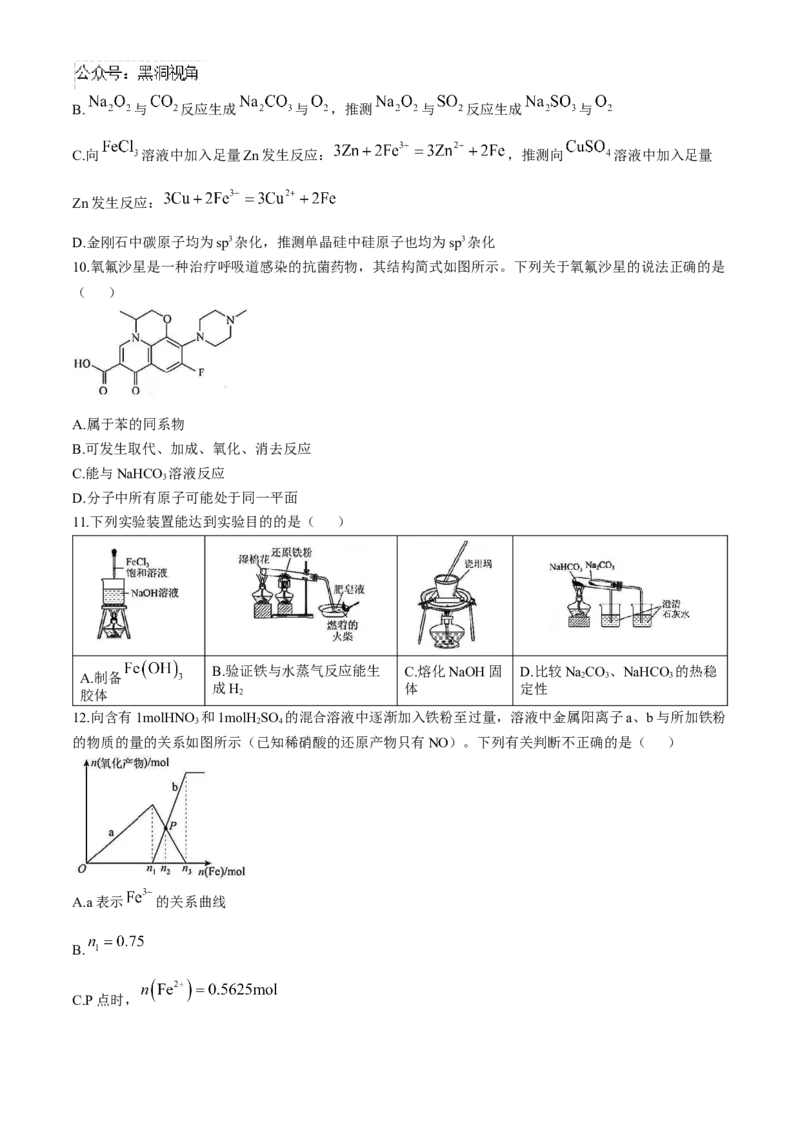
10.氧氟沙星是一种治疗呼吸道感染的抗菌药物,其结构简式如图所示。下列关于氧氟沙星的说法正确的是
( )
A.属于苯的同系物
B.可发生取代、加成、氧化、消去反应
C.能与NaHCO 溶液反应
3
D.分子中所有原子可能处于同一平面
11.下列实验装置能达到实验目的的是( )
B.验证铁与水蒸气反应能生 C.熔化NaOH固 D.比较NaCO、NaHCO 的热稳
A.制备 2 3 3
成H 体 定性
胶体 2
12.向含有1molHNO 和1molH SO 的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉
3 2 4
的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是( )
A.a表示 的关系曲线
B.
C.P点时,D.向P点溶液中加入铜粉,最多可溶解14.4g
第Ⅱ卷(非选择题 共64分)
本卷共4大题,共64分。
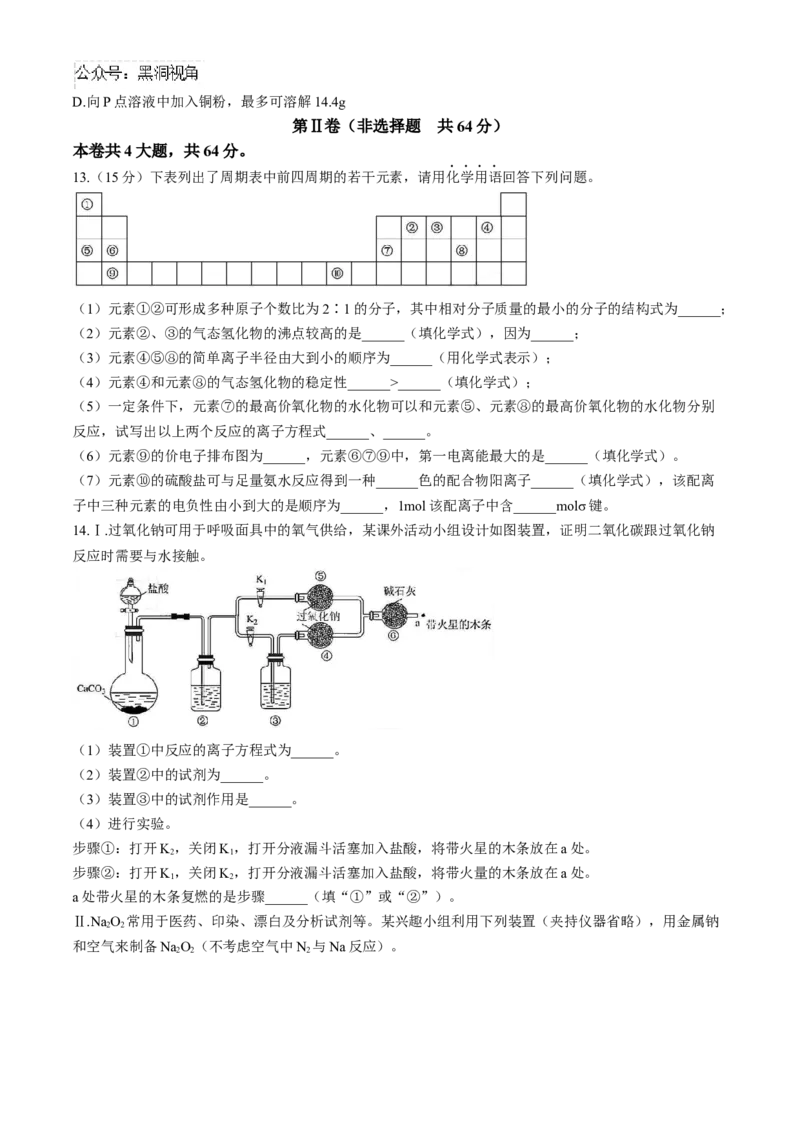
13.(15分)下表列出了周期表中前四周期的若干元素,请用化学用语回答下列问题。
(1)元素①②可形成多种原子个数比为2∶1的分子,其中相对分子质量的最小的分子的结构式为______;
(2)元素②、③的气态氢化物的沸点较高的是______(填化学式),因为______;
(3)元素④⑤⑧的简单离子半径由大到小的顺序为______(用化学式表示);
(4)元素④和元素⑧的气态氢化物的稳定性______>______(填化学式);
(5)一定条件下,元素⑦的最高价氧化物的水化物可以和元素⑤、元素⑧的最高价氧化物的水化物分别
反应,试写出以上两个反应的离子方程式______、______。
(6)元素⑨的价电子排布图为______,元素⑥⑦⑨中,第一电离能最大的是______(填化学式)。
(7)元素⑩的硫酸盐可与足量氨水反应得到一种______色的配合物阳离子______(填化学式),该配离
子中三种元素的电负性由小到大的是顺序为______,1mol该配离子中含______molσ键。
14.Ⅰ.过氧化钠可用于呼吸面具中的氧气供给,某课外活动小组设计如图装置,证明二氧化碳跟过氧化钠
反应时需要与水接触。
(1)装置①中反应的离子方程式为______。
(2)装置②中的试剂为______。
(3)装置③中的试剂作用是______。
(4)进行实验。
步骤①:打开K,关闭K,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
2 1
步骤②:打开K,关闭K,打开分液漏斗活塞加入盐酸,将带火量的木条放在a处。
1 2
a处带火星的木条复燃的是步骤______(填“①”或“②”)。
Ⅱ.Na O 常用于医药、印染、漂白及分析试剂等。某兴趣小组利用下列装置(夹持仪器省略),用金属钠
2 2
和空气来制备NaO(不考虑空气中N 与Na反应)。
2 2 2(5)若规定气流的方向为从左到右,各仪器连接的接口顺序(每个装置只用一次)是:空气
→______→______→f→e→______→______→______→______。
(6)装置Ⅰ中反应的化学方程式______。
(7)装置Ⅱ的作用是______。
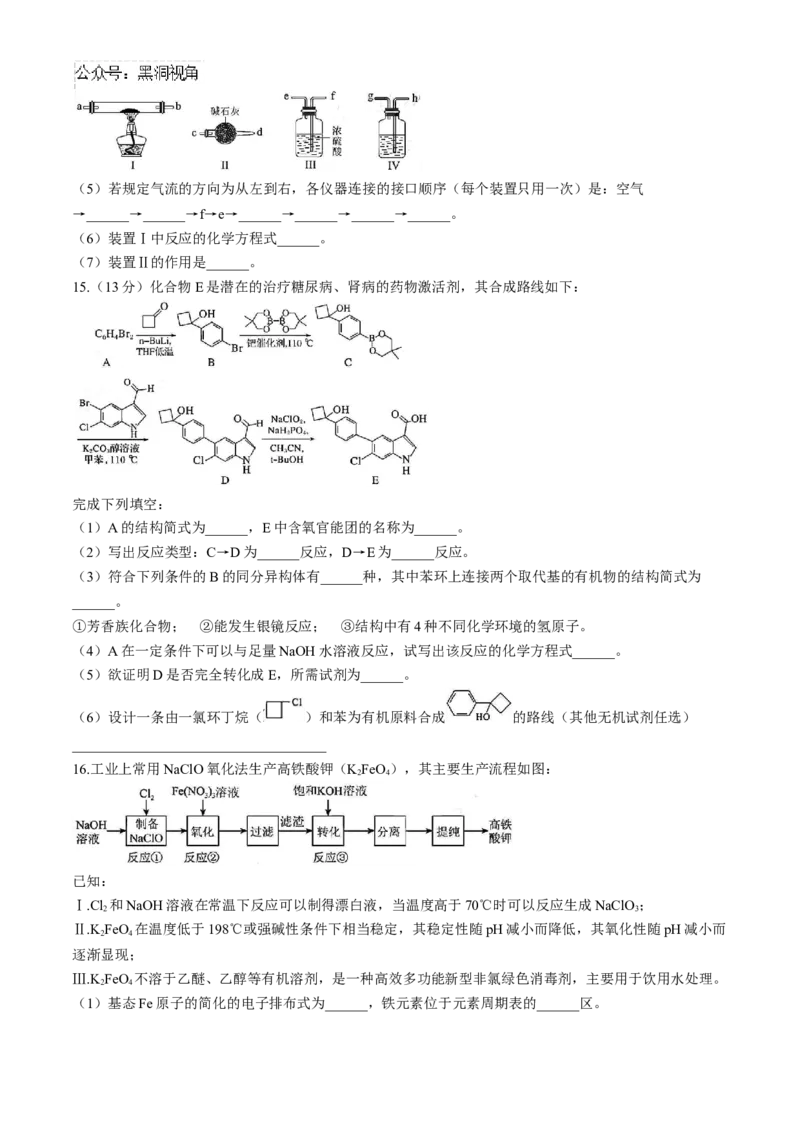
15.(13分)化合物E是潜在的治疗糖尿病、肾病的药物激活剂,其合成路线如下:
完成下列填空:
(1)A的结构简式为______,E中含氧官能团的名称为______。
(2)写出反应类型:C→D为______反应,D→E为______反应。
(3)符合下列条件的B的同分异构体有______种,其中苯环上连接两个取代基的有机物的结构简式为
______。
①芳香族化合物; ②能发生银镜反应; ③结构中有4种不同化学环境的氢原子。
(4)A在一定条件下可以与足量NaOH水溶液反应,试写出该反应的化学方程式______。
(5)欲证明D是否完全转化成E,所需试剂为______。
(6)设计一条由一氯环丁烷( )和苯为有机原料合成 的路线(其他无机试剂任选)
____________________________________
16.工业上常用NaClO氧化法生产高铁酸钾(KFeO),其主要生产流程如图:
2 4
已知:
Ⅰ.Cl 和NaOH溶液在常温下反应可以制得漂白液,当温度高于70℃时可以反应生成NaClO;
2 3
Ⅱ.K FeO 在温度低于198℃或强碱性条件下相当稳定,其稳定性随pH减小而降低,其氧化性随pH减小而
2 4
逐渐显现;
Ⅲ.K FeO 不溶于乙醚、乙醇等有机溶剂,是一种高效多功能新型非氯绿色消毒剂,主要用于饮用水处理。
2 4
(1)基态Fe原子的简化的电子排布式为______,铁元素位于元素周期表的______区。(2)写出温度高于70℃时氯气和NaOH发生反应的离子方程式:______。
(3)写出反应③的化学方程式:______。
(4)提纯高铁酸钾固体时,过滤需要用到的硅酸盐仪器主要有______,过滤后最好用______洗涤滤渣,
得到高纯度产品。
(5)实验室也可以用氯气与 在氢氧化钾溶液中反应制备少量KFeO,,写出该反应的离子方程
2 4
式______,该反应中每制得2molK FeO,消耗的氯气在标准状况下的体积为______L;在高铁酸钾溶液中
2 4
滴加盐酸,有黄绿色气体产生,原因是______(用文字描述)。2025 届高三年级第二次质量调查化学学科答案
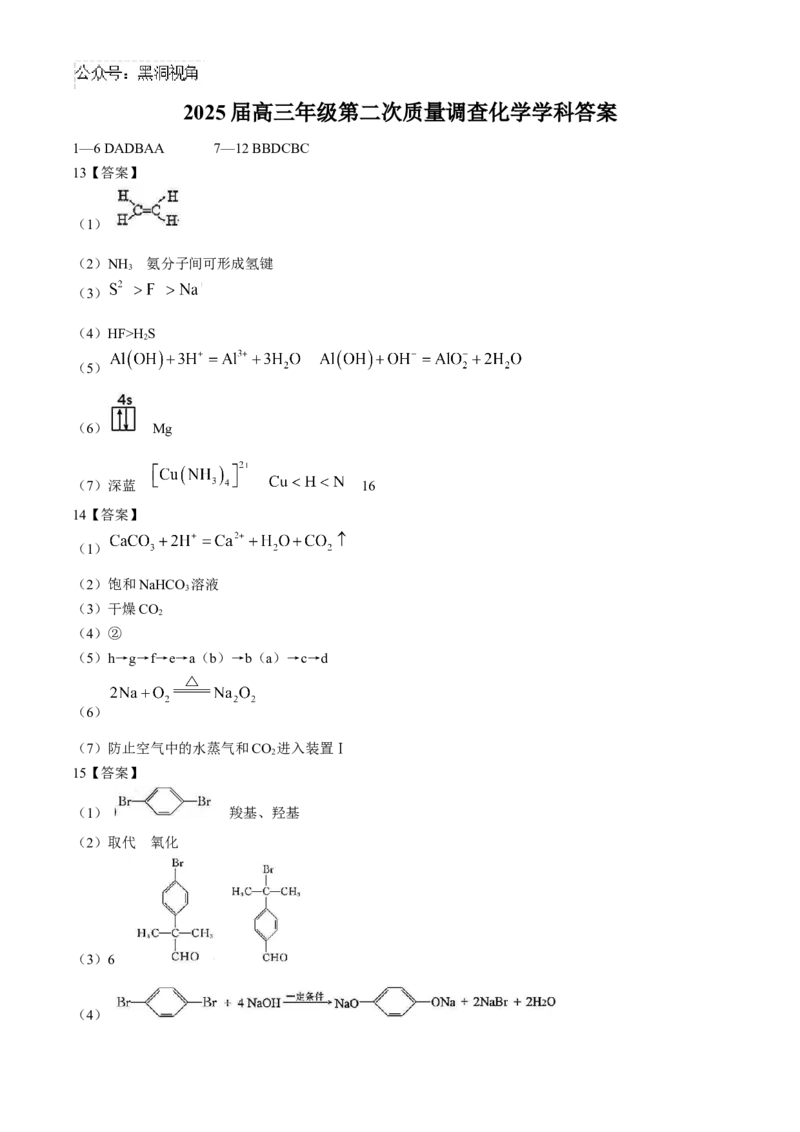
1—6 DADBAA 7—12 BBDCBC
13【答案】
(1)
(2)NH 氨分子间可形成氢键
3
(3)
(4)HF>H S
2
(5)
(6) Mg
(7)深蓝 16
14【答案】
(1)
(2)饱和NaHCO 溶液
3
(3)干燥CO
2
(4)②
(5)h→g→f→e→a(b)→b(a)→c→d
(6)
(7)防止空气中的水蒸气和CO 进入装置Ⅰ
2
15【答案】
(1) 羧基、羟基
(2)取代 氧化
(3)6
(4)(5)新制的 ,或银氨溶液
(6)
16【答案】
(1) d
(2) (反应条件写“加热”或“70℃”均可)
(3)
(4)烧杯、漏斗、玻璃棒 乙醇或乙醚
(5) 67.2
随着盐酸加入,溶液pH减小,高铁酸钾氧化性增强,氧化 生成