文档内容
河北区 2024—2025 学年度高三年级第一学期期中质量检测
化学
注意事项:
1.每题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净
后,再选涂其它答案标号。
2.Ⅰ卷共12题,每题3分,共36分。在每题列出的四个选项中,只有一项是最符合题目要
求的。以下数据可供解题时参考:
可能用到的相对原子质量:H 1 C 12 N 14 O 16 23 24 S 32 55
第Ⅰ卷共36分
一、单选题
1.我国是材料制造强国,材料对促进生产发展和改善人类生活发挥巨大作用,下列有关材料的说法正确的
是( )
A.冬奥火炬“飞扬”采用碳纤维复合材料打造,碳纤维是一种有机高分子材料
B.中国天眼FAST用到的高性能碳化硅是一种无机非金属材料
C.“奋斗者”号载人潜水器的钛合金属于金属材料且比纯金属钛具有更高的熔点
D.N95口罩所使用的聚丙烯材料属于合成纤维,是纯净物
2.我国科学家进行了如图所示的碳循环研究。下列说法正确的是( )
A.淀粉是多糖,在一定条件下能水解成葡萄糖
B.葡萄糖与果糖互为同分异构体,都属于烃类
C. 中含有 个电子
D. 被还原生成
3.关于氯气和水的反应,下列说法正确的是( )
A. 仅作氧化剂 B、 是氧化产物
C.每生成 ,有 被氧化 D.将新制氯水加入紫色石蕊溶液中,石蕊溶液先变红后褪色
4.下列实验操作能达到实验目的的是( )
选
实验目的 实验操作
项A
制备 胶体 将 浓溶液滴加到饱和 溶液中
B 检验乙醇和浓硫酸加热生成乙烯
将产生的气体通入酸性 溶液中
C
检验久置的 溶液是否被完全氧化 取少量待测液,滴加 溶液
D 探究浓度对反应速率的影响 常温下将铁片分别插入稀硝酸和浓硝酸中
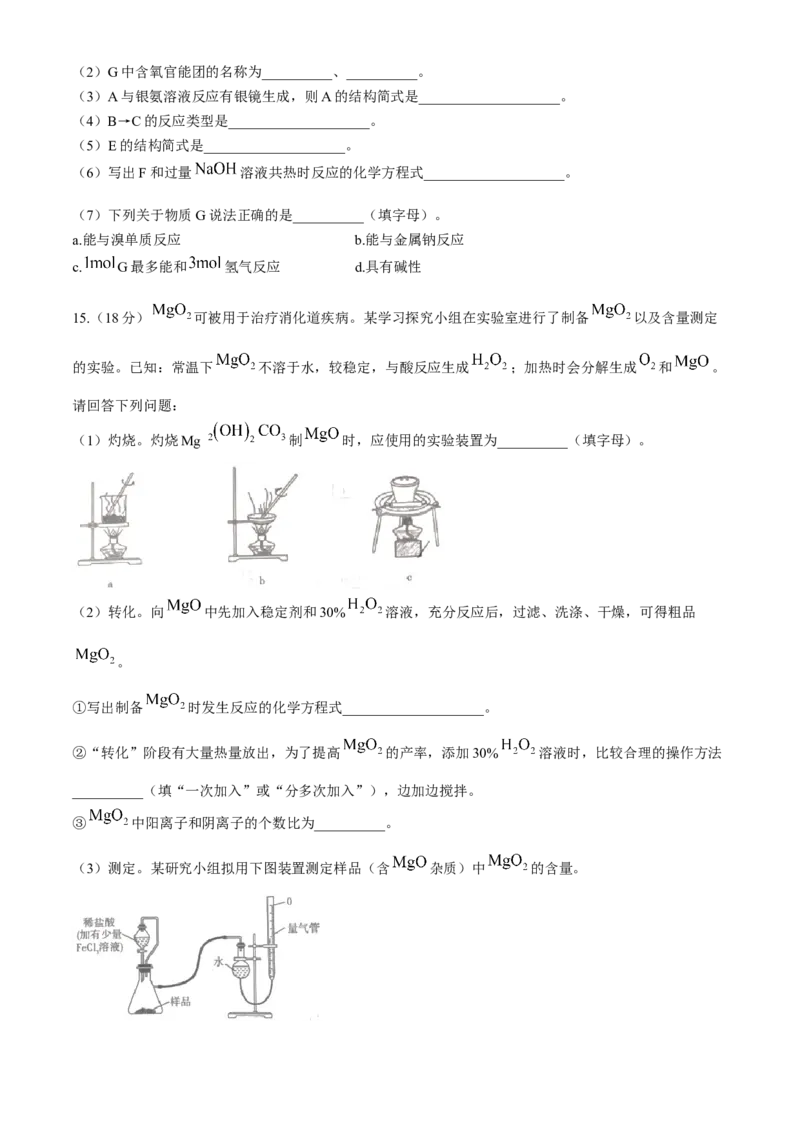
5.下图是一种具有磁性的“纳米药物”,可利用磁性引导该药物到达人体内的病变部位,该技术可大大提
高治疗效果。下列有关说法不正确的是( )
A.该“纳米药物”分散于水中可得胶体
B.该药物具有磁性与 外壳有关
C.高温下铁与水蒸气反应可获得
D.该“纳米药物”中的二氧化硅属于酸性氧化物,能与 溶液反应
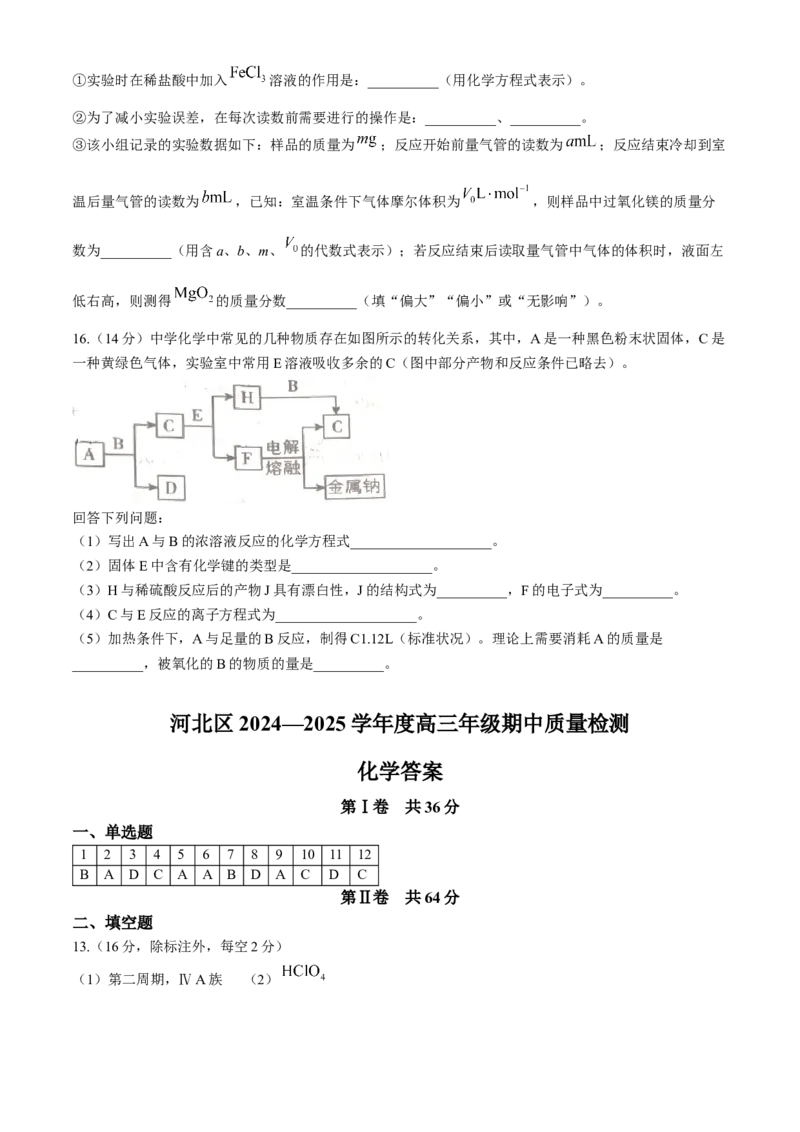
6.部分含铁物质的分类与相应化合价关系如图所示。下列推断合理的是( )
A.可存在f→c→b→e的转化
B.向含c的溶液中依次加入 和 溶液以检验c
4.d易与水反应生成e
D.工业上用电解法冶炼a
7.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
A. 、 、 都易溶于水,都是电解质
B.碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物
C. 、 、 均含有氧元素,都是氧化物
D.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
8.下列实验装置不能达到实验目的的是( )A.图Ⅰ:用 做喷泉实验 B.图Ⅱ:验证 与浓硝酸反应的热量变化
C.图Ⅲ:验证 易溶于水 D.图Ⅳ:制取氨气
9.下列离子组在一定条件下能大量共存,且加入相应试剂后对应的离子方程式正确的是( )
离子组 加入试剂 加入试剂后发生反应的离子方程式
A 稀硫酸
、 、
B 、 、 氢氧化钠溶液
C 氢氧化钠溶液
、 、
过量氢氧化钠溶
D
、 、 液
10.物质的性质决定用途,下列两者对应关系正确的是( )
A.钾钠合金具有还原性,用于原子反应堆的热交换剂
B. 具有氧化性,葡萄酒中添加 起到漂白作用
C.液氨汽化时吸收大量热,可用作制冷剂
D. 具有氧化性,可用作净水剂
11.下列关于金属及其化合物的说法正确的是( )
A.向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯中的固体若有铁,则无铜
B.将 、 、 分别在 中燃烧,可分别得到 、 、
C. 与水反应和红热的 与水蒸气反应均能生成碱
D.表面用砂纸打磨过的铝箔在酒精灯上加热,铝箔熔化但不滴落
12.常温常压下,电化学还原制氨气的总反应方程式:
若 代表阿伏加德罗常数的值,下列说法正确的是( )
A 中含有的共价键数目为
B.每产生 , 失去的电子数目为C.每当消耗标准状况下 时,生成 键的数目为
D. 氨水中,含有的 分子数目少于
第Ⅱ卷 共64分
注意事项:
1.用黑色字迹的签字笔或钢笔将答案写在“答题卡”上。
2.Ⅱ卷共4题,共64分。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 23 24 S 32 55
二、填空题
13.(16分)A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层
的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是
人体必需的微量元素,缺乏W会导致贫血症状。
(1)A在元素周期表中的位置是__________。
(2)上述元素最高价氧化物对应的水化物酸性最强的是__________(填化学式)。
(3)上述A、D、E三种元素原子半径由大到小的顺序为__________(填元素符号)。
(4)下列事实能用元素周期律解释的是__________(填字母序号)。
a.D的最高价氧化物对应水化物的碱性弱于
b.E的气态氢化物的稳定性小于
c. 的溶液可用于刻蚀铜制的印刷电路板
(5)工业上用电解法制备D的单质,反应的化学方程式为____________________。
(6)家用“管道通”的有效成分是烧碱和D的单质,使用时需加入一定量的水,此时发生反应的化学方
程式为________________________________________。
(7)W的单质可用于处理酸性废水中的 ,使其转换为 ,同时生成有磁性的W的氧化物X,再
进行后续处理。上述反应的离子方程式为__________。
14.(16分) 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成;
(1)D的分子式为____________________。(2)G中含氧官能团的名称为__________、__________。
(3)A与银氨溶液反应有银镜生成,则A的结构简式是____________________。
(4)B→C的反应类型是____________________。
(5)E的结构简式是____________________。
(6)写出F和过量 溶液共热时反应的化学方程式____________________。
(7)下列关于物质G说法正确的是__________(填字母)。
a.能与溴单质反应 b.能与金属钠反应
c. G最多能和 氢气反应 d.具有碱性
15.(18分) 可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备 以及含量测定
的实验。已知:常温下 不溶于水,较稳定,与酸反应生成 ;加热时会分解生成 和 。
请回答下列问题:
(1)灼烧。灼烧Mg 制 时,应使用的实验装置为__________(填字母)。
(2)转化。向 中先加入稳定剂和30% 溶液,充分反应后,过滤、洗涤、干燥,可得粗品
。
①写出制备 时发生反应的化学方程式____________________。
②“转化”阶段有大量热量放出,为了提高 的产率,添加30% 溶液时,比较合理的操作方法
__________(填“一次加入”或“分多次加入”),边加边搅拌。
③ 中阳离子和阴离子的个数比为__________。
(3)测定。某研究小组拟用下图装置测定样品(含 杂质)中 的含量。①实验时在稀盐酸中加入 溶液的作用是:__________(用化学方程式表示)。
②为了减小实验误差,在每次读数前需要进行的操作是:__________、__________。
③该小组记录的实验数据如下:样品的质量为 ;反应开始前量气管的读数为 ;反应结束冷却到室
温后量气管的读数为 ,已知:室温条件下气体摩尔体积为 ,则样品中过氧化镁的质量分
数为__________(用含a、b、m、 的代数式表示);若反应结束后读取量气管中气体的体积时,液面左
低右高,则测得 的质量分数__________(填“偏大”“偏小”或“无影响”)。
16.(14分)中学化学中常见的几种物质存在如图所示的转化关系,其中,A是一种黑色粉末状固体,C是
一种黄绿色气体,实验室中常用E溶液吸收多余的C(图中部分产物和反应条件已略去)。
回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式____________________。
(2)固体E中含有化学键的类型是____________________。
(3)H与稀硫酸反应后的产物J具有漂白性,J的结构式为__________,F的电子式为__________。
(4)C与E反应的离子方程式为____________________。
(5)加热条件下,A与足量的B反应,制得C1.12L(标准状况)。理论上需要消耗A的质量是
__________,被氧化的B的物质的量是__________。
河北区 2024—2025 学年度高三年级期中质量检测
化学答案
第Ⅰ卷 共36分
一、单选题
1 2 3 4 5 6 7 8 9 10 11 12
B A D C A A B D A C D C
第Ⅱ卷 共64分
二、填空题
13.(16分,除标注外,每空2分)
(1)第二周期,ⅣA族 (2)(3) (4)ab
(5)
(6)
(7)
14.(16分,每空2分)
(1) (2)酯基、羟基
(3) (4)取代反应
(5)
(6)
(7)ab
15.(18分,每空2分)
(1)c
(2)① ②分多次加入 ③1:1
(3)
②冷却至室温 上下移动右侧量气管,使左右两侧的液面相平
③ (合理给分) 偏小
16.(14分,每空2分)
(1)
(2)离子键、极性共价键(合理给分)(3)
(4)
(5)