文档内容
2023--2024 学年度高三上期第四次段考
化学试题
可能用到的相对原子质量:H 1 C12 N14 O16 S 32 Na 23 Cl 35.5 Fe 56
一.选择题(每小题 3 分,共 48 分,每小题只有一个选项正确。)
1. 化学与生活密切相关。下列过程没有发生化学变化的是
A. 使用小苏打除去面团里的酸性物质 B. 使用过氧乙酸对餐桌消毒
C. 使用活性炭祛除冰箱里的异味 D. 使用氢氟酸标记玻璃容器
2. 科技的进步是祖国实力增强的具体表现。下列有关说法错误的是
A. 北京冬奥会颁奖礼服添加的石墨烯是一种碳纳米材料,其化学性质与石墨相似
B. “天舟六号”为中国空间站送去推进剂 Xe 气,Xe是0 族元素
C. “嫦娥五号”返回器带回的月壤中含有 3He,它与地球上4He 的化学性质不同
2 2
D. “深地一号”为进军万米深度提供核心装备,制造钻头用的金刚石为共价晶体
3. 下列有关物质的性质与用途具有对应关系的是
A. 镁可以和 CO 反应,可用于制造信号弹和焰火
2
B. 纳米 Fe O 能与酸反应,可用作铁磁性材料
3 4
C. 石墨的熔点很高,可用作干电池电极材料
D. 无水 CoCl 呈蓝色,吸水后为粉红色[CoCl ·6H O],可用于制造变色硅胶(干燥剂)
2 2 2
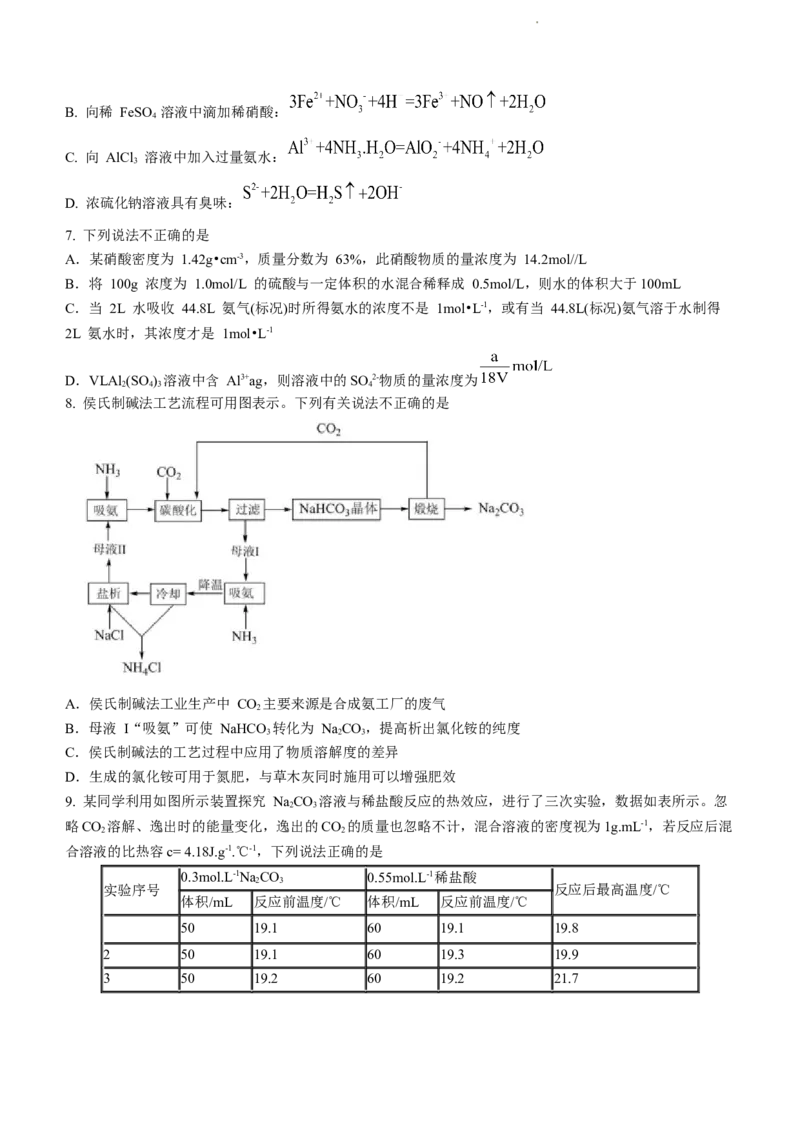
4. 实验室几种常见仪器如下,下列仪器在相应实验中选用不合理的是
A. 分离 MnO 和 KCl 混合物:③④ B. 用于除杂、干燥、收集气体:②
2
C. 粗盐提纯实验:③④⑤
D. 配制 480mL 一定物质的量浓度的溶液:①③
5. 1962 年,化学家 NeilBartlett 用 PtF 与 Xe 首次合成了 Xe 的第一种化合物——六氟合铂酸氙
6
( XePtF ),实验证明XePtF 是一种含有PtF 的离子化合物,常温下很稳定,遇水强烈水解生成PtO 、
6 6 6 2
HF、Xe、O。下列叙述正确的是
2
A.在合成XePtF 的反应中 Xe 作氧化剂
6
B. XePtF 水解过程中被还原的元素为 Pt 和 Xe
6
C.通常情况下,Xe 具有较强的还原性
D.1 mol XePtF 完全水解,转移 4 mol 电子
6
6. 下列解释实验事实的离子方程式书写正确的是
A. 用石灰乳与浓缩的海水制备氢氧化镁:
学科网(北京)股份有限公司B. 向稀 FeSO 溶液中滴加稀硝酸:
4
C. 向 AlCl 溶液中加入过量氨水:
3
D. 浓硫化钠溶液具有臭味:
7. 下列说法不正确的是
A.某硝酸密度为 1.42g•cm-3,质量分数为 63%,此硝酸物质的量浓度为 14.2mol//L
B.将 100g 浓度为 1.0mol/L 的硫酸与一定体积的水混合稀释成 0.5mol/L,则水的体积大于100mL
C.当 2L 水吸收 44.8L 氨气(标况)时所得氨水的浓度不是 1mol•L-1,或有当 44.8L(标况)氨气溶于水制得
2L 氨水时,其浓度才是 1mol•L-1
D.VLAl(SO ) 溶液中含 Al3+ag,则溶液中的SO 2-物质的量浓度为
2 4 3 4
8. 侯氏制碱法工艺流程可用图表示。下列有关说法不正确的是
A.侯氏制碱法工业生产中 CO 主要来源是合成氨工厂的废气
2
B.母液 I“吸氨”可使 NaHCO 转化为 NaCO,提高析出氯化铵的纯度
3 2 3
C.侯氏制碱法的工艺过程中应用了物质溶解度的差异
D.生成的氯化铵可用于氮肥,与草木灰同时施用可以增强肥效
9. 某同学利用如图所示装置探究 NaCO 溶液与稀盐酸反应的热效应,进行了三次实验,数据如表所示。忽
2 3
略CO 溶解、逸出时的能量变化,逸出的CO 的质量也忽略不计,混合溶液的密度视为1g.mL-1,若反应后混
2 2
合溶液的比热容c= 4.18J.g-1.℃-1,下列说法正确的是
0.3mol.L-1NaCO 0.55mol.L-1稀盐酸
2 3
实验序号 反应后最高温度/℃
体积/mL 反应前温度/℃ 体积/mL 反应前温度/℃
50 19.1 60 19.1 19.8
2 50 19.1 60 19.3 19.9
3 50 19.2 60 19.2 21.7
学科网(北京)股份有限公司A.用铜质的搅拌器会使所测△H 偏小
B.分批加入盐酸会使实验结果更准确
C.测量 NaCO 溶液的温度后可直接测盐酸温度
2 3
D.
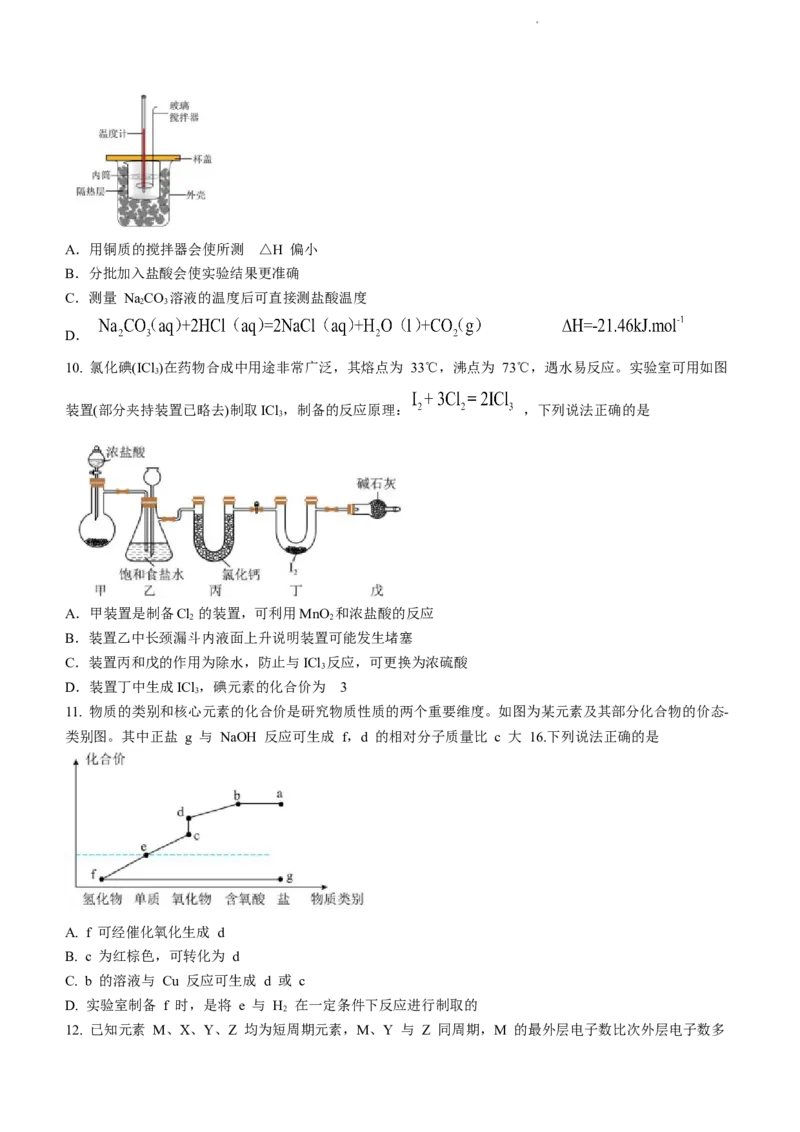
10. 氯化碘(ICl )在药物合成中用途非常广泛,其熔点为 33℃,沸点为 73℃,遇水易反应。实验室可用如图
3
装置(部分夹持装置已略去)制取ICl ,制备的反应原理: ,下列说法正确的是
3
A.甲装置是制备Cl 的装置,可利用MnO 和浓盐酸的反应
2 2
B.装置乙中长颈漏斗内液面上升说明装置可能发生堵塞
C.装置丙和戊的作用为除水,防止与ICl 反应,可更换为浓硫酸
3
D.装置丁中生成ICl ,碘元素的化合价为3
3
11. 物质的类别和核心元素的化合价是研究物质性质的两个重要维度。如图为某元素及其部分化合物的价态-
类别图。其中正盐 g 与 NaOH 反应可生成 f,d 的相对分子质量比 c 大 16.下列说法正确的是
A. f 可经催化氧化生成 d
B. c 为红棕色,可转化为 d
C. b 的溶液与 Cu 反应可生成 d 或 c
D. 实验室制备 f 时,是将 e 与 H 在一定条件下反应进行制取的
2
12. 已知元素 M、X、Y、Z 均为短周期元素,M、Y 与 Z 同周期,M 的最外层电子数比次外层电子数多
学科网(北京)股份有限公司1,Z 为电负性最强的元素,Y 是地壳中含量最高的元素,X 的 3p 轨道有 3 个电子。下列说法中不正确
的是
A. 第一电离能:Z>Y>X B. 简单离子半径:X>Y>Z
C. 简单气态氢化物的稳定性:Z>X D. X 最高价氧化物对应水化物能与盐酸反应
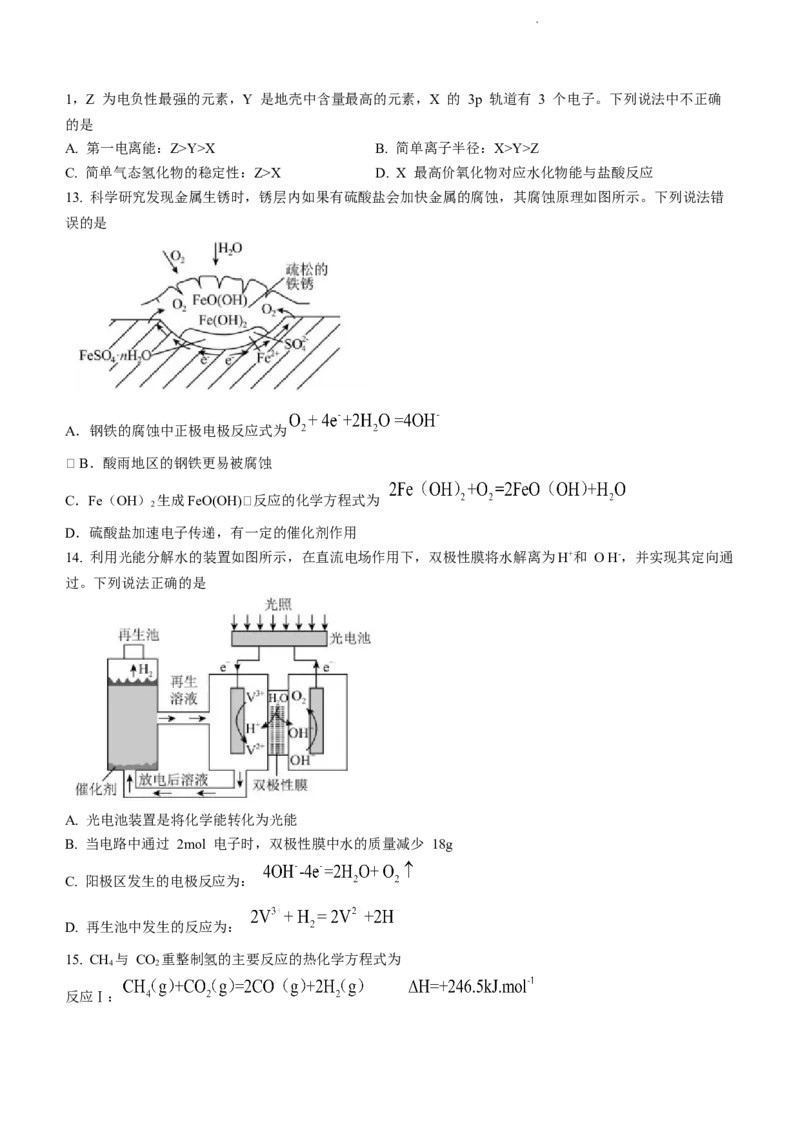
13. 科学研究发现金属生锈时,锈层内如果有硫酸盐会加快金属的腐蚀,其腐蚀原理如图所示。下列说法错
误的是
A.钢铁的腐蚀中正极电极反应式为
B.酸雨地区的钢铁更易被腐蚀
C.Fe(OH) 生成FeO(OH)反应的化学方程式为
2
D.硫酸盐加速电子传递,有一定的催化剂作用
14. 利用光能分解水的装置如图所示,在直流电场作用下,双极性膜将水解离为H+和 O H-,并实现其定向通
过。下列说法正确的是
A. 光电池装置是将化学能转化为光能
B. 当电路中通过 2mol 电子时,双极性膜中水的质量减少 18g
C. 阳极区发生的电极反应为:
D. 再生池中发生的反应为:
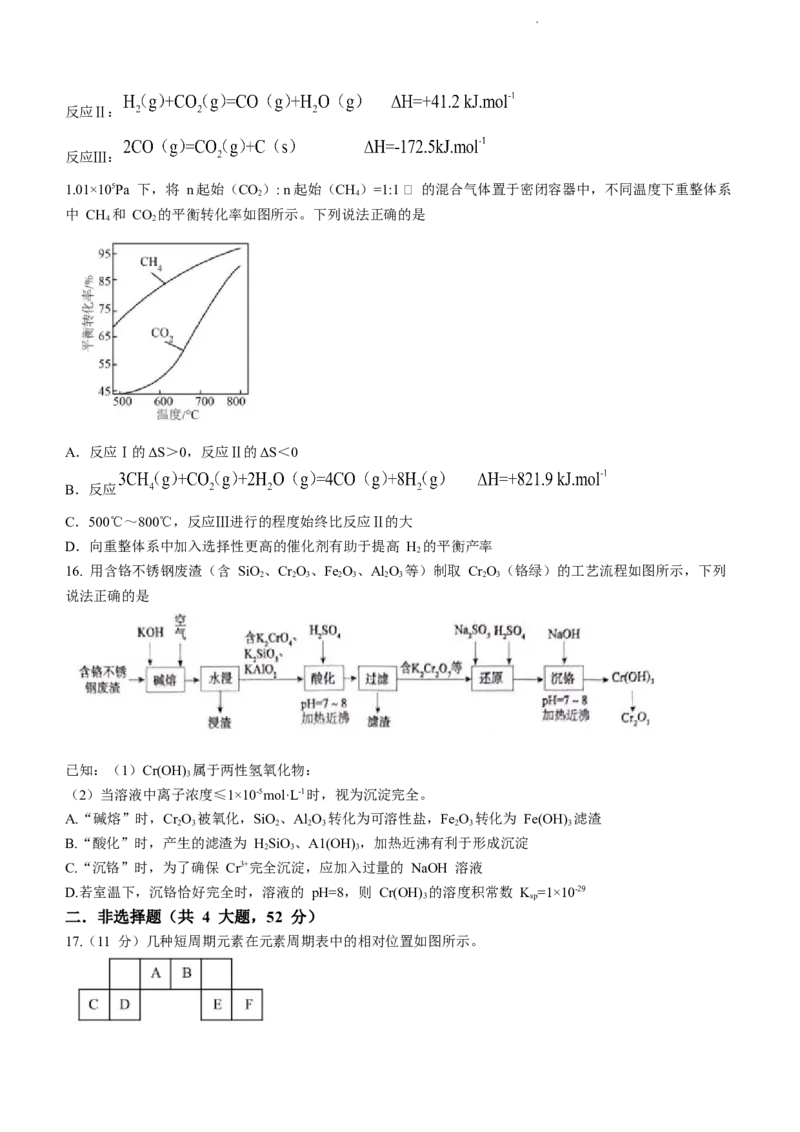
15. CH 与 CO 重整制氢的主要反应的热化学方程式为
4 2
反应Ⅰ:
学科网(北京)股份有限公司反应Ⅱ:
反应Ⅲ:
1.01×105Pa 下,将 n起始(CO): n起始(CH)=1:1 的混合气体置于密闭容器中,不同温度下重整体系
2 4
中 CH 和 CO 的平衡转化率如图所示。下列说法正确的是
4 2
A.反应Ⅰ的ΔS>0,反应Ⅱ的ΔS<0
B.反应
C.500℃~800℃,反应Ⅲ进行的程度始终比反应Ⅱ的大
D.向重整体系中加入选择性更高的催化剂有助于提高 H 的平衡产率
2
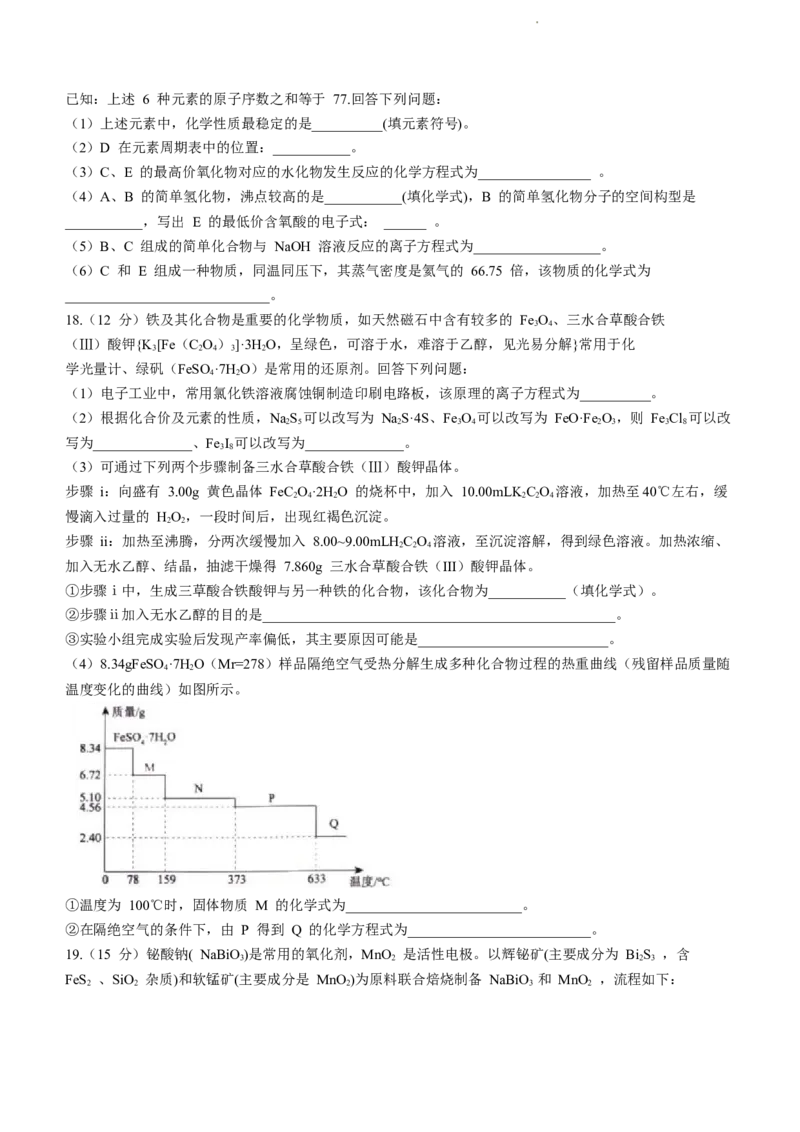
16. 用含铬不锈钢废渣(含 SiO、Cr O、Fe O、Al O 等)制取 Cr O(铬绿)的工艺流程如图所示,下列
2 2 3 2 3 2 3 2 3
说法正确的是
已知:(1)Cr(OH) 属于两性氢氧化物:
3
(2)当溶液中离子浓度≤1×10-5mol·L-1时,视为沉淀完全。
A.“碱熔”时,Cr O 被氧化,SiO、Al O 转化为可溶性盐,Fe O 转化为 Fe(OH) 滤渣
2 3 2 2 3 2 3 3
B.“酸化”时,产生的滤渣为 HSiO、A1(OH) ,加热近沸有利于形成沉淀
2 3 3
C.“沉铬”时,为了确保 Cr3+完全沉淀,应加入过量的 NaOH 溶液
D.若室温下,沉铬恰好完全时,溶液的 pH=8,则 Cr(OH) 的溶度积常数 K =1×10-29
3 sp
二.非选择题(共 4 大题,52 分)
17.(11 分)几种短周期元素在元素周期表中的相对位置如图所示。
学科网(北京)股份有限公司已知:上述 6 种元素的原子序数之和等于 77.回答下列问题:
(1)上述元素中,化学性质最稳定的是__________(填元素符号)。
(2)D 在元素周期表中的位置:___________。
(3)C、E 的最高价氧化物对应的水化物发生反应的化学方程式为________________ 。
(4)A、B 的简单氢化物,沸点较高的是___________(填化学式),B 的简单氢化物分子的空间构型是
___________,写出 E 的最低价含氧酸的电子式: ______ 。
(5)B、C 组成的简单化合物与 NaOH 溶液反应的离子方程式为__________________。
(6)C 和 E 组成一种物质,同温同压下,其蒸气密度是氦气的 66.75 倍,该物质的化学式为
_____________________________。
18.(12 分)铁及其化合物是重要的化学物质,如天然磁石中含有较多的 Fe O、三水合草酸合铁
3 4
(Ⅲ)酸钾{K [Fe(C O)]·3H O,呈绿色,可溶于水,难溶于乙醇,见光易分解}常用于化
3 2 4 3 2
学光量计、绿矾(FeSO ·7H O)是常用的还原剂。回答下列问题:
4 2
(1)电子工业中,常用氯化铁溶液腐蚀铜制造印刷电路板,该原理的离子方程式为__________。
(2)根据化合价及元素的性质,NaS 可以改写为 NaS·4S、Fe O 可以改写为 FeO·Fe O,则 Fe Cl 可以改
2 5 2 3 4 2 3 3 8
写为______________、Fe I 可以改写为______________。
3 8
(3)可通过下列两个步骤制备三水合草酸合铁(Ⅲ)酸钾晶体。
步骤 i:向盛有 3.00g 黄色晶体 FeC O·2H O 的烧杯中,加入 10.00mLKC O 溶液,加热至40℃左右,缓
2 4 2 2 2 4
慢滴入过量的 HO,一段时间后,出现红褐色沉淀。
2 2
步骤 ii:加热至沸腾,分两次缓慢加入 8.00~9.00mLHC O 溶液,至沉淀溶解,得到绿色溶液。加热浓缩、
2 2 4
加入无水乙醇、结晶,抽滤干燥得 7.860g 三水合草酸合铁(III)酸钾晶体。
①步骤ⅰ中,生成三草酸合铁酸钾与另一种铁的化合物,该化合物为___________(填化学式)。
②步骤ⅱ加入无水乙醇的目的是__________________________________________________。
③实验小组完成实验后发现产率偏低,其主要原因可能是___________________________。
(4)8.34gFeSO·7H O(Mr=278)样品隔绝空气受热分解生成多种化合物过程的热重曲线(残留样品质量随
4 2
温度变化的曲线)如图所示。
①温度为 100℃时,固体物质 M 的化学式为_________________________。
②在隔绝空气的条件下,由 P 得到 Q 的化学方程式为__________________________。
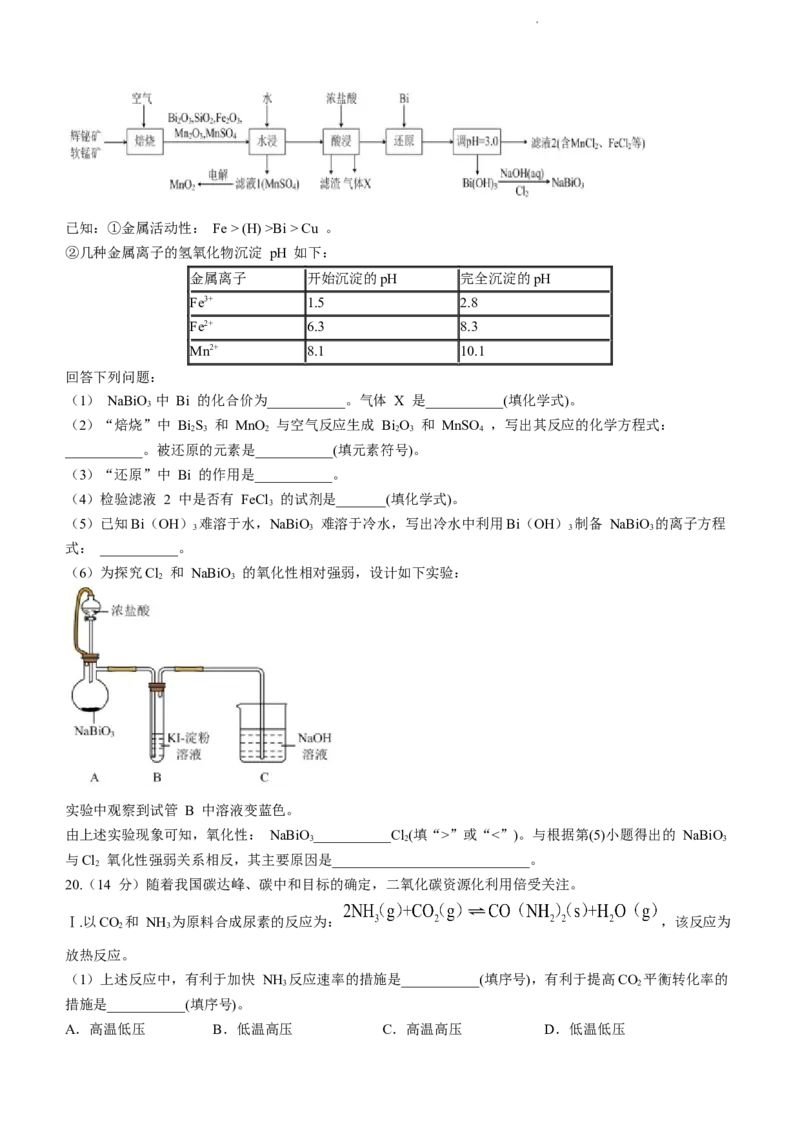
19.(15 分)铋酸钠( NaBiO)是常用的氧化剂,MnO 是活性电极。以辉铋矿(主要成分为 BiS ,含
3 2 2 3
FeS 、SiO 杂质)和软锰矿(主要成分是 MnO )为原料联合焙烧制备 NaBiO 和 MnO ,流程如下:
2 2 2 3 2
学科网(北京)股份有限公司已知:①金属活动性: Fe > (H) >Bi > Cu 。
②几种金属离子的氢氧化物沉淀 pH 如下:
金属离子 开始沉淀的pH 完全沉淀的pH
Fe3+ 1.5 2.8
Fe2+ 6.3 8.3
Mn2+ 8.1 10.1
回答下列问题:
(1) NaBiO 中 Bi 的化合价为___________。气体 X 是___________(填化学式)。
3
(2)“焙烧”中 BiS 和 MnO 与空气反应生成 BiO 和 MnSO ,写出其反应的化学方程式:
2 3 2 2 3 4
___________。被还原的元素是___________(填元素符号)。
(3)“还原”中 Bi 的作用是___________。
(4)检验滤液 2 中是否有 FeCl 的试剂是_______(填化学式)。
3
(5)已知Bi(OH) 难溶于水,NaBiO 难溶于冷水,写出冷水中利用Bi(OH) 制备 NaBiO 的离子方程
3 3 3 3
式: ___________。
(6)为探究Cl 和 NaBiO 的氧化性相对强弱,设计如下实验:
2 3
实验中观察到试管 B 中溶液变蓝色。
由上述实验现象可知,氧化性: NaBiO___________Cl(填“>”或“<”)。与根据第(5)小题得出的 NaBiO
3 2 3
与Cl 氧化性强弱关系相反,其主要原因是____________________________。
2
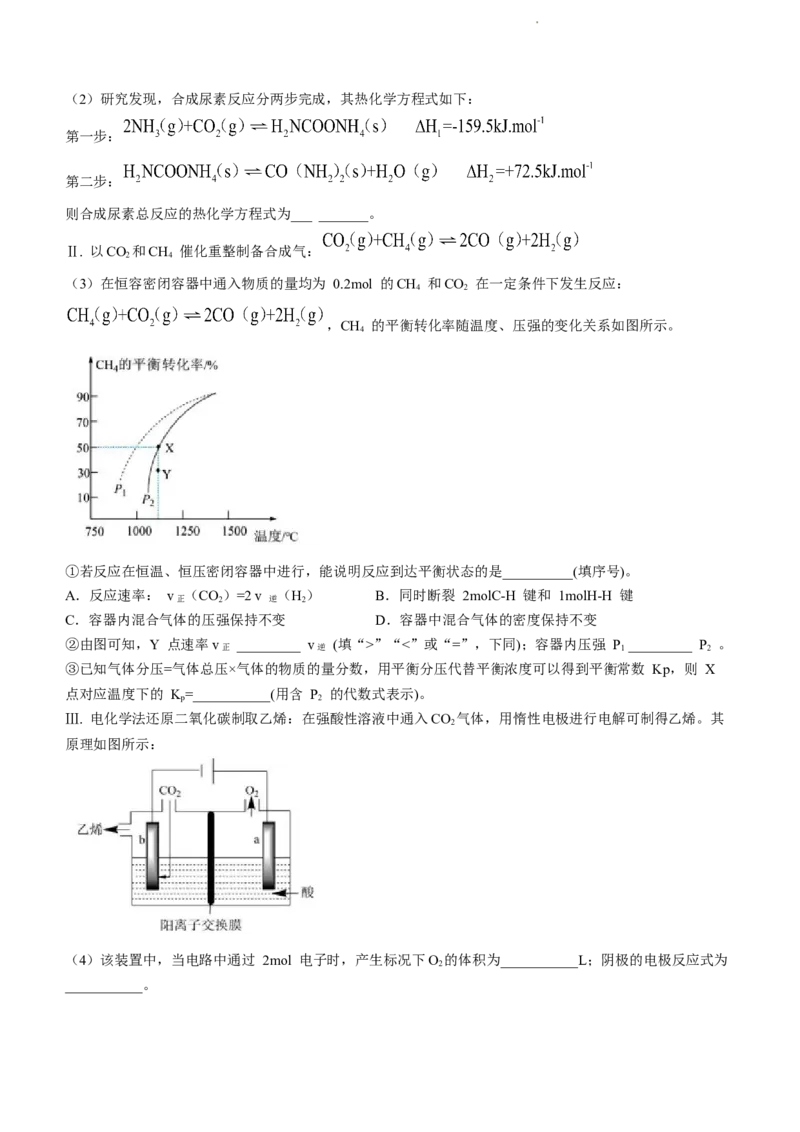
20.(14 分)随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
Ⅰ.以CO 和 NH 为原料合成尿素的反应为: ,该反应为
2 3
放热反应。
(1)上述反应中,有利于加快 NH 反应速率的措施是___________(填序号),有利于提高CO 平衡转化率的
3 2
措施是___________(填序号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
学科网(北京)股份有限公司(2)研究发现,合成尿素反应分两步完成,其热化学方程式如下:
第一步:
第二步:
则合成尿素总反应的热化学方程式为___ _______。
Ⅱ. 以CO 和CH 催化重整制备合成气:
2 4
(3)在恒容密闭容器中通入物质的量均为 0.2mol 的CH 和CO 在一定条件下发生反应:
4 2
,CH 的平衡转化率随温度、压强的变化关系如图所示。
4
①若反应在恒温、恒压密闭容器中进行,能说明反应到达平衡状态的是__________(填序号)。
A.反应速率: v (CO)=2 v (H) B.同时断裂 2molC-H 键和 1molH-H 键
正 2 逆 2
C.容器内混合气体的压强保持不变 D.容器中混合气体的密度保持不变
②由图可知,Y 点速率v _________ v (填“>”“<”或“=”,下同);容器内压强 P _________ P 。
正 逆 1 2
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 Kp,则 X
点对应温度下的 K=___________(用含 P 的代数式表示)。
p 2
Ⅲ. 电化学法还原二氧化碳制取乙烯:在强酸性溶液中通入CO 气体,用惰性电极进行电解可制得乙烯。其
2
原理如图所示:
(4)该装置中,当电路中通过 2mol 电子时,产生标况下O 的体积为___________L;阴极的电极反应式为
2
___________。
学科网(北京)股份有限公司2023--2024 学年度上期高三第四次段考
化学参考答案
1.【答案】C
【详解】A.面团发酵过程中产生的酸性物质主要是乳酸和醋酸, NaHCO 与酸发生了复分解反应,故不选
3
A;
B.过氧乙酸具有强氧化性,能杀菌消毒,属于化学变化,故不选 B;
C.活性炭具有吸附性,活性炭吸附气体从而祛除冰箱里的异味,属于物理变化,故选 C;
D.HF 可与玻璃容器中的SiO 反应生成 SiF 气体 ,属于化学变化,故不选 D;选 C。
2 4
2.【答案】C
【详解】A.石墨烯与石墨都是碳单质的不同形式,化学性质相似,A 正确;
B.Xe 是稀有气体,属于 0 族元素,B 正确;
C.3He和4He 是质子数相同,中子数不同的同一元素的不同核素,属于同位素,两者化学性质几乎相同,
2 2
但物理物质不同,C 错误;
D.金刚石是共价晶体,D 正确; 故选 C。
3.【答案】D
【详解】A.镁在空气中燃烧发出耀眼的白光,可用于制造信号弹和焰火,与镁能和二氧化碳反应没有关系,
A 错误;
B.纳米 Fe O 可用作铁磁性材料是因为其有磁性,与四氧化三铁能与酸反应没有关系,B 错误;
3 4
C.石墨可用作干电池电极材料是因其可以导电且常温下性质不活泼,与熔点很高无关,C 错误;
D.无水 CoCl 呈蓝色,吸水后为粉红色[CoCl ·6H O],因此可用于制造变色硅胶(干燥剂),D 正确;故选
2 2 2
D。
4.【答案】C
【详解】A.MnO 难溶于水,KCl 易溶于水,分离 MnO 和 KCl 混合物采用的实验操作是加水溶解、过滤,
2 2
用到的仪器有烧杯和普通漏斗,A 项正确;
B.装置②可用于气体的除杂、干燥(长进短出)、收集不与空气成分反应的气体,收集密度比空气大的气体时
应长进短出,收集密度比空气小的气体时应短进长出,B 项正确;
C.粗盐提纯实验中需要用到蒸发皿,而⑤是坩埚,用于灼烧固体,C 项错误;
D.配制 480mL 一定物质的量浓度的溶液需要使用 500mL 容量瓶,则需要先用烧杯溶解、稀释溶液,待溶
液冷却至室温再将溶液转移到 500mL 容量瓶中,D 项正确;答案选 C。
5.【答案】B
【分析】由题意得,发生反应的化学方程式为: ,水解时的化学反应方程式为:
【详解】A.在 反应中 Xe 的化合价升高,作为还原剂,A 错误;
学科网(北京)股份有限公司B.在 中,Pt 和 Xe 的化合价降低,被还原,B 正
确;
C.通常情况下,Xe 是稀有气体,化学性质不活泼,C 错误;
D. 反应中,1 mol XePtF 完全水解,转移 2 mol电子,
6
D 错误; 故选 B。
6.【答案】B
【详解】A.石灰乳是乳浊液,不能拆分,石灰乳与浓缩的海水制备氢氧化镁:
,A 错误;
B.向稀 FeSO 溶液中滴加稀硝酸,会发生氧化还原反应产生 Fe3+、NO、HO ,反应符合事实,遵循物质
4 2
的拆分原则,B 正确;
C.向 AlCl 溶液中加入过量氨水,反应产生Al( OH ) 沉淀和 NH Cl ,反应的离子方程式为:
3 3 4
,C 错误;
D.浓硫化钠分步水解产生硫化氢气体而有臭味,反应的离子方程式为 ,
,D 错误; 故选 B。
7.【答案】B
【详解】A.某硝酸密度为 1.42g•cm-3,质量分数为 63%,此硝酸物质的量浓度为
,A 正确;
B.将 100g 浓度为 1.0mol/L 的硫酸与一定体积的水混合稀释成 0.5mol/L,则混合溶液的体积是1.0mol/L
的硫酸体积的二倍,1.0mol/L 的硫酸的密度大于 1g/cm3,则 100g 浓度为 1.0mol/L 的硫酸的体积小于
100mL,所以水的体积也应小于 100mL,B 不正确;
C.2L 水吸收 44.8L 氨气(标况)(2mol),所得氨水的体积不是 2L,则浓度不是 1mol•L-1,当 44.8L(标况)氨
气溶于水制得 2L 氨水时,其浓度为 ,C 正确;
D.VLAl(SO ) 溶液中含 Al3+ag,则溶液中 Al3+的物质的量浓度为 ,则SO 2-物质
2 4 3 4
的量浓度为 ,D 正确;故选 B。
学科网(北京)股份有限公司8.【答案】D
【详解】A.合成氨厂在制备氮气和氢气中会产生大量的二氧化碳,废气利用,故 A 正确
B.通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,故 B 正确;
C.侯氏制碱法是将 CO、NH 通入饱和 NaCl 溶液中,发生以下反应: 、
2 3
,其中 NaHCO 溶解度最小,故有 NaHCO 的晶体析出,应用了物
3 3
质溶解度的差异,故 C 正确;
D.氮肥和草木灰不能同时施用,故 D 错误;故选:D。
9.【答案】D
【详解】A.铜会散热,用铜质的搅拌器会使所测的热量偏小,H 偏大,A 错误;
B. 要确保热量不散失,故应一次性迅速加入盐酸,B 错误;
C.测量 NaCO 溶液的温度后若直接测盐酸温度,碳酸钠和盐酸反应会导致热量散失,会使所测的热量偏小,
2 3
H 偏大,C 错误;
D. 3 次实验温度差分别为 0.7℃、0.7℃、2.5℃,第三次数据偏差大舍去,取平均温差为 0.7℃,从数据知,
盐酸略过量,生成 0.015mol 的二氧化碳,则放出热量 ,
则得 ,
D 正确;答案选 D。
10.【答案】B
【详解】A.二氧化锰和浓盐酸制备氯气需加热,所以利用装置甲选用药品二氧化锰和浓盐酸不能制得氯气,
A 错误;
B.丙装置发生堵塞,装置乙内压强增大,长颈漏斗内液面上升,B 正确;
C.装置丙的作用为除水,防止水进入发生装置中,装置戊中碱石灰除了可以除去空气中的水外,还可以对
氯气进行尾气处理,不能将其更换为浓硫酸,C 错误:
D.产物ICl 中 Cl 电负性大于 I,故碘元素的化合价为+3,D 错误;答案选 B。
3
11.【答案】C
【详解】A.氨气经催化氧化只能生成一氧化氮和水,A 错误;
B.一氧化氮为无色气体,B 错误;
C.浓硝酸与铜反应生成二氧化氮,稀硝酸与铜反应生成一氧化氮,C 制取;
D.实验室制取氨气时,是将氯化铵与氢氧化钙混合加热,D 错误; 故选 C。
12.【答案】D
【详解】A.同周期从左到右第一电离能增大趋势,第ⅡA、ⅤA 比同周期相邻元素的第一电离能大,第一
电离能:F>O>B,故 Z>Y>X,A 正确;
B.电子层数相同,核电核数越大,半径越小,故 P3->O2->F-,即 X>Y>Z,B 正确;
C.非金属性 F>P,则简单气态氢化物的稳定性 Z>X,C 正确;
D.X 最高价氧化物对应水化物为磷酸,磷酸不与盐酸反应,D 错误;故选 D。
学科网(北京)股份有限公司13.【答案】C
【详解】A.钢铁发生吸氧腐蚀时 C 作正极,氧气在正极得电子,电极反应式为 ,
A 正确;
B.酸性溶液可以加速铁的锈蚀,B 正确;
C. Fe (OH) 不稳定,易被氧气氧化生成FeO(OH),反应为
2
,C 错误;
D.已知,锈层内如果有硫酸盐会加快金属的腐蚀,硫酸盐能增加导电性,加速电子传递,有一定的催化剂
作用,D 正确;故选 C。
14.【答案】C
【详解】A.由图可知,该装置将光能转化为电能,再利用电解池将电能转化为化学能,最终达到分解水的
目的,选项 A 错误;
B.双极性膜可将水解离为H+和 O H-,根据阳极区的电极反应 计算当电路中通
过 1mol 电子时,双极性膜中水也会消耗 1mol,选项 B 错误;
C.光照过程中阳极区发生的电极反应为 ,选项 C 正确;
D.由装置图可知,再生池中发生的反应方程式为 ,选项 D 错误。
答案选 C。
15.【答案】C
【详解】A.反应Ⅰ中,生成物气体分子数大于反应物气体分子数,则ΔS>0,反应Ⅱ中,△H>0,反应能
自发进行,则必然存在ΔS>0,A 不正确;
B.利用盖斯定律,将反应 得,反应
,B 不正确;
C.从图中可以看出,500℃~800℃,CH 的平衡转化率始终大于 CO 的平衡转化率,则反应Ⅲ进行的程度
4 2
始终比反应Ⅱ的大,C 正确;
D.催化剂只改变反应速率,不影响平衡移动,所以不能提高 H2的平衡产率,D 不正确;故选 C。
16.【答案】 B
【解析】 Fe O 不反应,碱熔水浸得到的滤渣为 Fe O ,不是 Fe(OH) 滤渣,A 错误;
2 3 2 3 3
酸化除硅、铝,加热近沸有利于形成较大颗粒的沉淀,沉淀更充分,B 正确;
氢氧化铬是两性氢氧化物,加入过量氢氧化钠会溶解,C 错误;
沉铬完全时,若 pH = 8,则 Cr(OH) 的溶度积常数为 ,D 错误。
3
17.【答案】(1)Ar (1 分)
(2)第三周期第ⅣA 族 (1 分)
学科网(北京)股份有限公司(3) (1 分)
(4)①. HO (1 分) ②. V 形 (1 分) (2 分)
2
(5) (2 分)
(6) Al Cl (2 分)
2 6
【小问 1 详解】氩为 稀有气体元素,化学性质稳定;
【小问 2 详解】D 为硅元素,位于第三周期第ⅣA 族;
【小问 3 详解】氢氧化铝和高氯酸发生中和反应,反应的化学方程式为
;
【小问 4 详解】 NH 在常温下为气态,HO在常温下为液态,水的沸点高于氨气;HO的空间构型为 V 形;
3 2 2
Cl 的最低价含氧酸为 HClO
【小问 5 详解】B、C 组成的简单化合物为 Al O, Al O 为两性氧化物,与 NaOH 溶液反应的离子方程
2 3 2 3
式为 ;
【小问 6 详解】同温同压下,气体密度之比等于相对分子质量之比。该物质的相对分子质量为
,设该物质的化学式为( AlCl ) ,M[ (AlCl )]= 267g. mol-1 ,n =2,则该物质的化学式为
3 n 3 n
Al Cl 。
2 6
18.【答案】
(1) (1 分)
(2) FeCl ·2FeCl (写成 2FeCl ·FeCl 亦给分)(1 分) 3FeI·I(写成 I·3FeI 亦给分)(1 分)
2 3 3 2 2 2 2 2
(3) ①Fe(OH) (1 分)
3
②降低三水合草酸合铁酸钾晶体的溶解度,促进晶体析出(2 分)
③光照使 K [Fe(C O ) ]·3H O 分解(2 分)
3 2 4 3 2
(4) ①FeSO ·4H O(2 分)
4 2
② (条件写加热或高温亦可,条件不写给 1 分,产物写SO 和 O
2 2
不得分)(2 分)
【解析】 (1)电子工业中,常用氯化铁溶液腐蚀铜制造印刷线路板,该原理的反应方程式:
;
(2) FeCl 、FeCl 均存在,由化合价及原子守恒确定 Fe Cl 可改写成 FeCl ·2FeCl ,Fe3+会氧化 I-,即 FeI 不
2 3 3 8 2 3 3
存在,因此 Fe I 只能是 FeI 和 I ,改写成 3FeI·I 。
3 8 2 2 2 2
(3)由题干信息可知红褐色沉淀为 Fe(OH) ,三水合草酸合铁酸钾晶体可溶于水,难溶于乙醇,加入无水乙醇有利
3
于晶体的析出,光照易分解造成产率降低;
学科网(北京)股份有限公司(4)8. 34 g FeSO ·7H O 的物质的量为 0. 03 mol,加热先生成物质 M 6. 72 g,质量减少 1. 62 g,减少的质量
4 2
为水的质量,即减少 0. 09 mol HO,故 M 的化学式为 FeSO ·4H O,生成 N 的质量为 5. 10g,减少的质量为
2 4 2
1. 62 g,此时减少的质量仍为水的质量,减少 0. 09 mol HO,故 N 的化学式为FeSO ·H O,生成 P 质量为 4.
2 4 2
56 g,减少质量为 0. 54 g,此时减少的质量为水的质量,减少 0. 03 molH O,P 的化学式为 FeSO ,最后生成 2.
2 4
4 g Q,此时 Q 中 Fe 有 0. 03 mol,Fe 质量为 1. 68 g,剩余0. 72 g 为 O 的质量,有 O0. 045 mol,则 Q 的
化学式为Fe O ,Fe 化合价升高,则硫的化合价降低, 同时生成 SO 和 SO 。
2 3 2 3
19.【答案】
(1)①. 5 (1 分) ②. Cl (1 分)
2
(2) ①.
(2 分) ②. Mn、O (2 分)
(3)将 Fe3+还原为 Fe2+(2 分)
(4)KSCN (1 分)
(5) (2 分)
(6)①. > (2 分) ②. pH 降低, NaBiO 的氧化性增强(2 分)
3
【小问 1 详解】
由化合价代数和为零可知,NaBiO 中 Bi 的化合价为+5 价,三氧化二锰与浓盐酸反应生成二氯化锰和氯气,
3
气体 X 为Cl 。
2
【小问 2 详解】
硫化铋、二氧化锰,氧气在高温下生成三氧化二铋,根据得失电子守恒和原子守恒配平化学方程式为:
,Mn 元素、O 元素化合价降低,被还原;硫元素化合价升
高,被氧化。
【小问 3 详解】
根据题目所给信息可知,加入铋的目的是还原铁离子,将铁离子转化成亚铁离子进入滤液。
【小问 4 详解】可用硫氰化钾检验铁离子。
【小问 5 详解】
Bi (OH) 制备 NaBiO 的过程中 Bi 元素由+3 价上升到+5 价,被氧化,用强氧化剂 Cl 可以氧化氢氧化
3 3 2
铋生成铋酸钠、氯化钠和水,根据得失电子守恒和电荷守恒配平离子方程式为:
。
【小问 6 详解】
铋酸钠与浓盐酸反应生成氯气,说明铋酸钠的氧化性比氯气强,对比两个反应可知,(5)中反应在碱性环境中
进行,而本实验在酸性环境中进行,由此可知,随着 pH 降低,酸性增强,铋酸钠的氧化性增强。
20.【答案】
(1)①. C (1 分) ②. B (1 分)
学科网(北京)股份有限公司(2) (2 分)
(3)①. BD(2 分) ②. >(1 分) ③. < (1 分) ④. (2 分)
(4)①. 11.2 (2 分) ②. (2 分)
【小问 1 详解】
升高温度和增大压强都可以加快反应速率,故选 C;该该反应为放热反应同时为气体体积减小的反应,所以
低温高压可使化学平衡正向移动,有利于提高CO 平衡转化率,故选 B。
2
【小问 2 详解】
合成尿素的总反应=第一步反应+第二步反应,则总反应的热化学方程式为
。
【小问 3 详解】
①A.由反应速率 v (CO)=2v (H) 判断出正逆反应速率并不相等,故反应未达到平衡,A 错误;
正 2 逆 2
B.同时断裂 2molC-H 键和 1molH-H 键,说明消耗 0.5molCH 的同时消耗 1mol H ,正反应速率等于逆
4 2
反应速率,可说明反应达到平衡,B 正确;C.该反应在恒压密闭容器中进行,压强始终不变,故不能判断
是否达到平衡,C 错误;D.反应在恒压密闭容器中进行,随着反应进行混合气体总质量不变,但体积改变,
密度则是一个变量,当密度不变时则达到平衡状态,D 正确。
②由图可知 Y 点CH 的转化率小于其平衡转化率,说明此时未达到平衡状态,v > v ,该反应为气体体
4 正 逆
积增大的反应,压强增大化学平衡逆向移动,CH 转化率减小,则 P < P 。
4 1 2
③X 点CH 转化率为 50%,则有
4
,
则各物质的分压为
【小问 4 详解】
阳极反应为 ,当电路中通过 2mol 电子时,产生O 有 0.5mol,则标况下的体积为
2
V=n∙V =11.2L,阴极上二氧化碳得电子结合氢离子生成乙烯,其电极反应式为
m
学科网(北京)股份有限公司。
学科网(北京)股份有限公司