文档内容
天津市耀华中学 2025 届高三年级第一次月考
化学试卷
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试时间60分钟。第Ⅰ卷1
至4页,第Ⅱ卷5至8页。
答卷前,考生务必将姓名、班级、考号填在答题卡上。答卷时,考生务必将答案涂写在答题
卡上,答在试卷上的无效。考试结束后,将答题卡交回。
祝各位考生考试顺利!
第Ⅰ卷(共36分)
注意事项:
1.每题选出答案后,用铅笔将答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,
再选涂其他答案标号。
2.本卷共12题,每题3分,共36分。在每题给出的四个选项中,只有一项是最符合题目要求
的。
以下数据可供解题时参考:
相对原子质量:H-1 C-12 O-16 Na-23
1. 下列物质 的性质与用途具有对应关系的是
.
A NH 具有还原性,可用作制冷剂
3
B. FeCl 易水解生成胶体,可用于净水杀菌
3
C. NaHCO 受热易分解,可用于制抗酸药物
3
D. 超分子具有分子识别特征,可以用“杯酚”分离C 和C
60 70
2. 下列各组中两物质反应时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是
A. Na和O B. AlCl 溶液与NaOH溶液
2 3
C. NaO 和CO D. NaHCO 溶液和Ca(OH) 溶液
2 2 2 3 2
3. 已知N 是阿伏加德罗常数的值,下列说法不正确的是
A
A. 0.1mol铁粉与0.1molCl 反应,转移的电子数为0.3N
2 A
B. 在25℃101kPa条件下,11.2LO 所含原子个数为小于N
2 A
C. NaCl和NH Cl的混合物中含1molCl-,则混合物中质子数为28N
4 A
D. 7.8g Na O 与足量CO 反应生成气体1.12L(标准状况下)
2 2 2
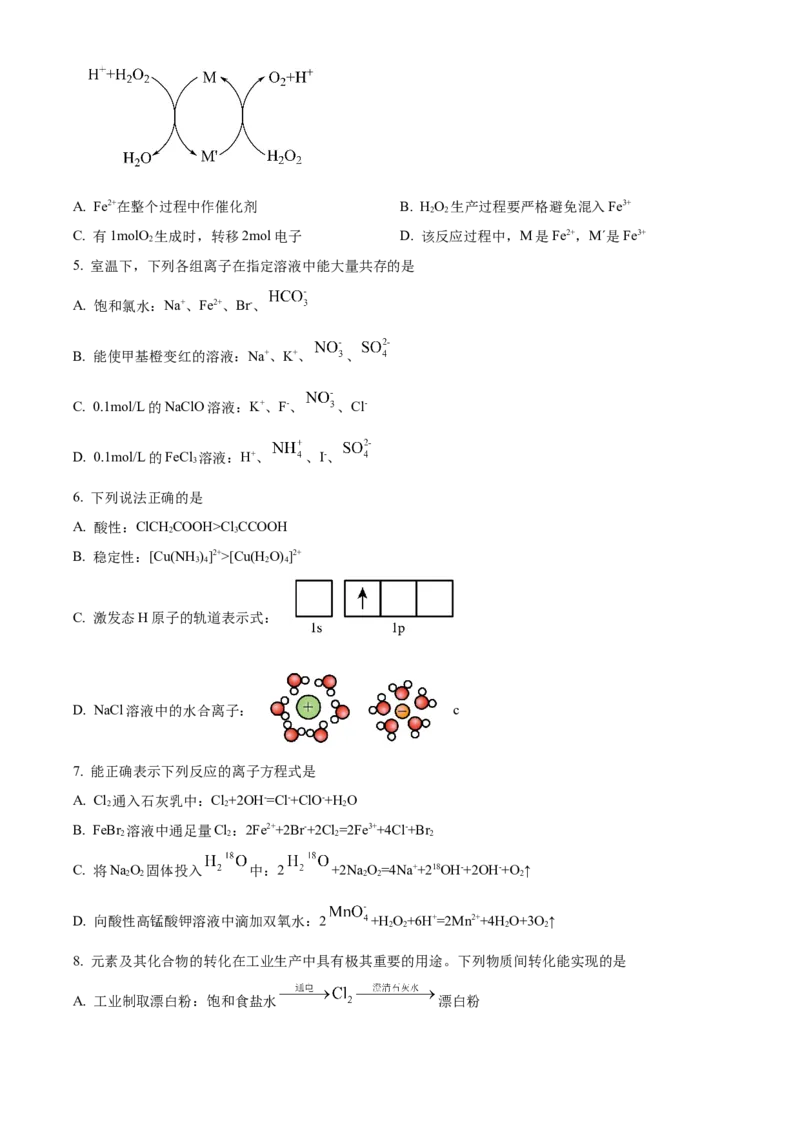
4. 向HO 溶液中加少量Fe (SO ) 溶液,反应原理如图所示。下列说法错误的是
2 2 2 4 3A. Fe2+在整个过程中作催化剂 B. HO 生产过程要严格避免混入Fe3+
2 2
C. 有1molO 生成时,转移2mol电子 D. 该反应过程中,M是Fe2+,M´是Fe3+
2
5. 室温下,下列各组离子在指定溶液中能大量共存的是
A. 饱和氯水:Na+、Fe2+、Br-、
B. 能使甲基橙变红的溶液:Na+、K+、 、
C. 0.1mol/L的NaClO溶液:K+、F-、 、Cl-
D. 0.1mol/L的FeCl 溶液:H+、 、I-、
3
6. 下列说法正确的是
A. 酸性:ClCH COOH>Cl CCOOH
2 3
B. 稳定性:[Cu(NH )]2+>[Cu(H O) ]2+
3 4 2 4
C. 激发态H原子的轨道表示式:
D. NaCl溶液中的水合离子: c
7. 能正确表示下列反应的离子方程式是
A. Cl 通入石灰乳中:Cl+2OH-=Cl-+ClO-+H O
2 2 2
B. FeBr 溶液中通足量Cl:2Fe2++2Br-+2Cl=2Fe3++4Cl-+Br
2 2 2 2
C. 将NaO 固体投入 中:2 +2Na O=4Na++218OH-+2OH-+O ↑
2 2 2 2 2
D. 向酸性高锰酸钾溶液中滴加双氧水:2 +H O+6H+=2Mn2++4H O+3O↑
2 2 2 2
8. 元素及其化合物的转化在工业生产中具有极其重要的用途。下列物质间转化能实现的是
A. 工业制取漂白粉:饱和食盐水 漂白粉B. 工业制取镁: 溶液 无水 Mg
C. 工业制纯碱:
D. 由重晶石制可溶性钡盐:重晶石
9. 一种2-甲基色酮内酯(Y)可通过下列反应合成。下列说法正确的是
A. 最多能与含 的浓溴水发生反应
B. X、Y分子中所有碳原子处于同一平面
C. 一定条件下, 可以发生加成、缩聚、消去、氧化反应
D. 与 完全加成后,每个产物分子中含有7个手性碳原子
10. 下列实验操作正确且能达到实验目的的是
A. 验证碳酸钠和碳酸氢钠的稳定性
B. 用装置比较 、C元素的非金属性
C. 用装置配制一定物质的量浓度的稀盐酸
D. 制备氢氧化亚铁并能较长时间看见白色沉淀
11. 以金属Fe为主要成分的Al、Fe、Cu废旧合金(还含少量 、 、 )的回收模拟实验如图
所示。下列说法错误的是A. 加入足量 溶液 发生反应:
B. 滤渣A为Fe、Cu、 、
C. 操作Ⅱ在表面皿中进行
D. 滤液B经蒸发浓缩、冷却结晶、过滤、洗涤可获得绿矾
12. 下列实验中,均产生白色沉淀。
下列分析不正确的是
A. NaCO 与NaHCO 溶液中所含微粒种类相同
2 3 3
B. CaCl 能促进NaCO、NaHCO 水解
2 2 3 3
C. Al (SO ) 能促进NaCO、NaHCO 水解
2 4 3 2 3 3
D. 4个实验中,溶液滴入后,试管中溶液pH均降低
第Ⅱ卷(共64分)
注意事项:
1.用黑色墨水的钢笔或签字笔将答案写在答题卡上。
2.本卷共4题,共64分。
的
13. 铁(Fe)、钴(Co)、镍(Ni)是第四周期第Ⅷ族 元素,在化学上称为铁系元素,其化合物在生产生活
中应用广泛。
(1)铁系元素能与CO形成Fe(CO) 、Ni(CO) 等金属羰基化合物。已知室温时Fe(CO) 为浅黄色液体,沸
5 4 5
点103℃,Fe(CO) 是________晶体,Fe(CO) 中含有的化学键类型包括_______。
5 5
A.极性共价键 B.离子键 C.配位键 D.金属键
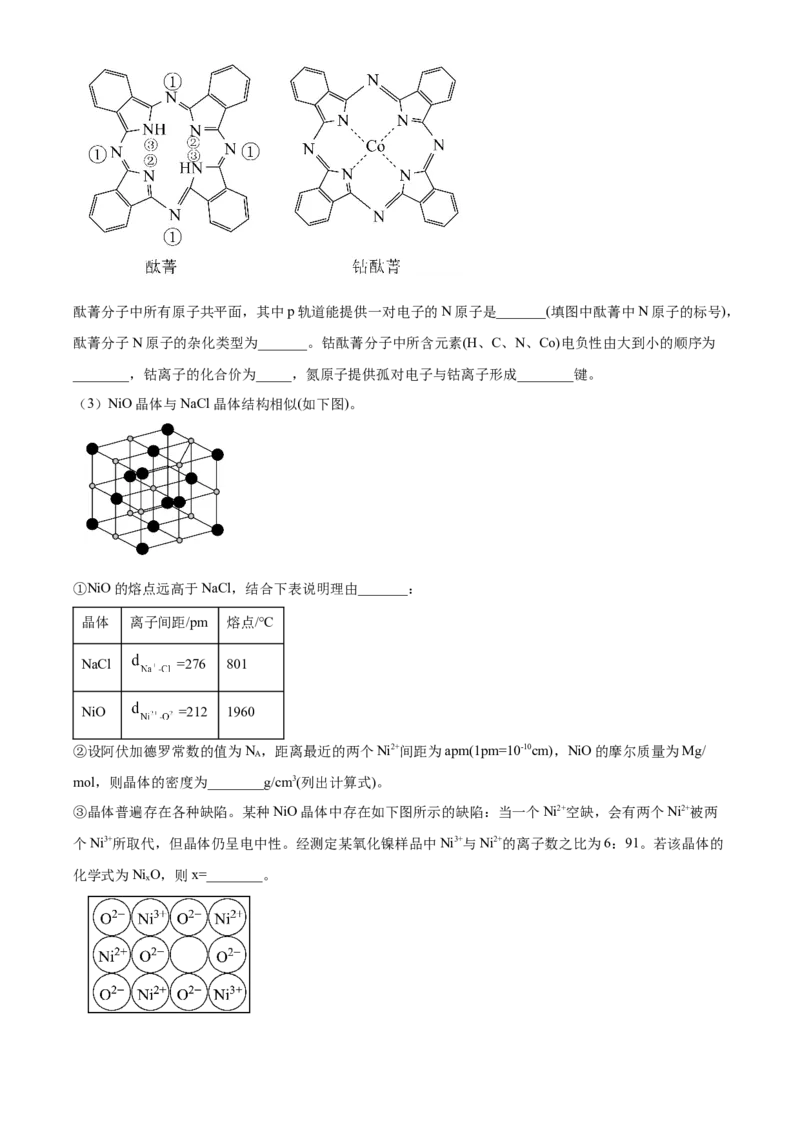
(2)酞菁和钴酞菁的分子结构如图所示。酞菁分子中所有原子共平面,其中p轨道能提供一对电子的N原子是_______(填图中酞菁中N原子的标号),
酞菁分子N原子的杂化类型为_______。钴酞菁分子中所含元素(H、C、N、Co)电负性由大到小的顺序为
________,钴离子的化合价为_____,氮原子提供孤对电子与钴离子形成________键。
(3)NiO晶体与NaCl晶体结构相似(如下图)。
①NiO的熔点远高于NaCl,结合下表说明理由_______:
晶体 离子间距/pm 熔点/℃
NaCl =276 801
NiO =212 1960
②设阿伏加德罗常数的值为N ,距离最近的两个Ni2+间距为apm(1pm=10-10cm),NiO的摩尔质量为Mg/
A
mol,则晶体的密度为________g/cm3(列出计算式)。
③晶体普遍存在各种缺陷。某种NiO晶体中存在如下图所示的缺陷:当一个Ni2+空缺,会有两个Ni2+被两
个Ni3+所取代,但晶体仍呈电中性。经测定某氧化镍样品中Ni3+与Ni2+的离子数之比为6:91。若该晶体的
化学式为Ni O,则x=________。
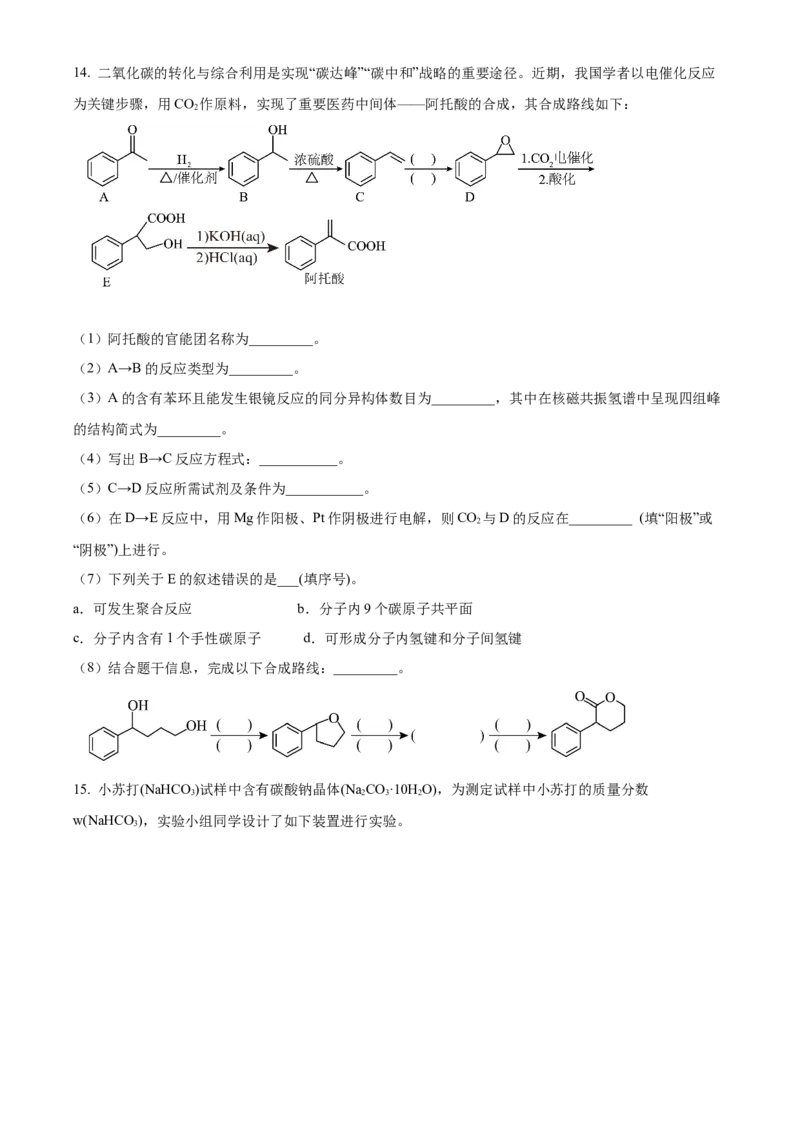
x14. 二氧化碳的转化与综合利用是实现“碳达峰”“碳中和”战略的重要途径。近期,我国学者以电催化反应
为关键步骤,用CO 作原料,实现了重要医药中间体——阿托酸的合成,其合成路线如下:
2
(1)阿托酸的官能团名称为_________。
(2)A→B的反应类型为_________。
(3)A的含有苯环且能发生银镜反应的同分异构体数目为_________,其中在核磁共振氢谱中呈现四组峰
的结构简式为_________。
(4)写出B→C反应方程式:___________。
(5)C→D反应所需试剂及条件为___________。
(6)在D→E反应中,用Mg作阳极、Pt作阴极进行电解,则CO 与D的反应在_________ (填“阳极”或
2
“阴极”)上进行。
(7)下列关于E的叙述错误的是___(填序号)。
a.可发生聚合反应 b.分子内9个碳原子共平面
c.分子内含有1个手性碳原子 d.可形成分子内氢键和分子间氢键
(8)结合题干信息,完成以下合成路线:_________。
15. 小苏打(NaHCO )试样中含有碳酸钠晶体(Na CO·10H O),为测定试样中小苏打的质量分数
3 2 3 2
w(NaHCO),实验小组同学设计了如下装置进行实验。
3实验过程:
Ⅰ、按图组装仪器,检查装置的气密性;
Ⅱ、将试样mg放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为mg、装置
1 2
C的质量为mg;
3
Ⅲ、关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N,一段
2
时间后,撤掉酒精灯,关闭活塞a;
Ⅳ、称得装置B的质量为mg、装置C的质量为mg。
4 5
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为__________,____________。
(2)装置C的作用为___________。装置D的作用为___________。
(3)实验过程中通入N 的目的为___________。
2
(4)用下列各项所提供的数据能计算出w(NaHCO)的是________(填选项字母)
3
序号 a b c d e
m、m、m、
数据 m、m、m 2 3 4 m、m、m m、m、m m、m、m
1 2 3 m 1 2 4 1 4 5 1 3 5
5
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确
的w(NaHCO),若能,则w(NaHCO)的计算式为:_______(若不能,此问不作答。)
3 3
(6)若没有D装置,则测得的w(NaHCO)_____(偏高、偏低、无影响)。
3
16. 氮及其化合物的利用是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。
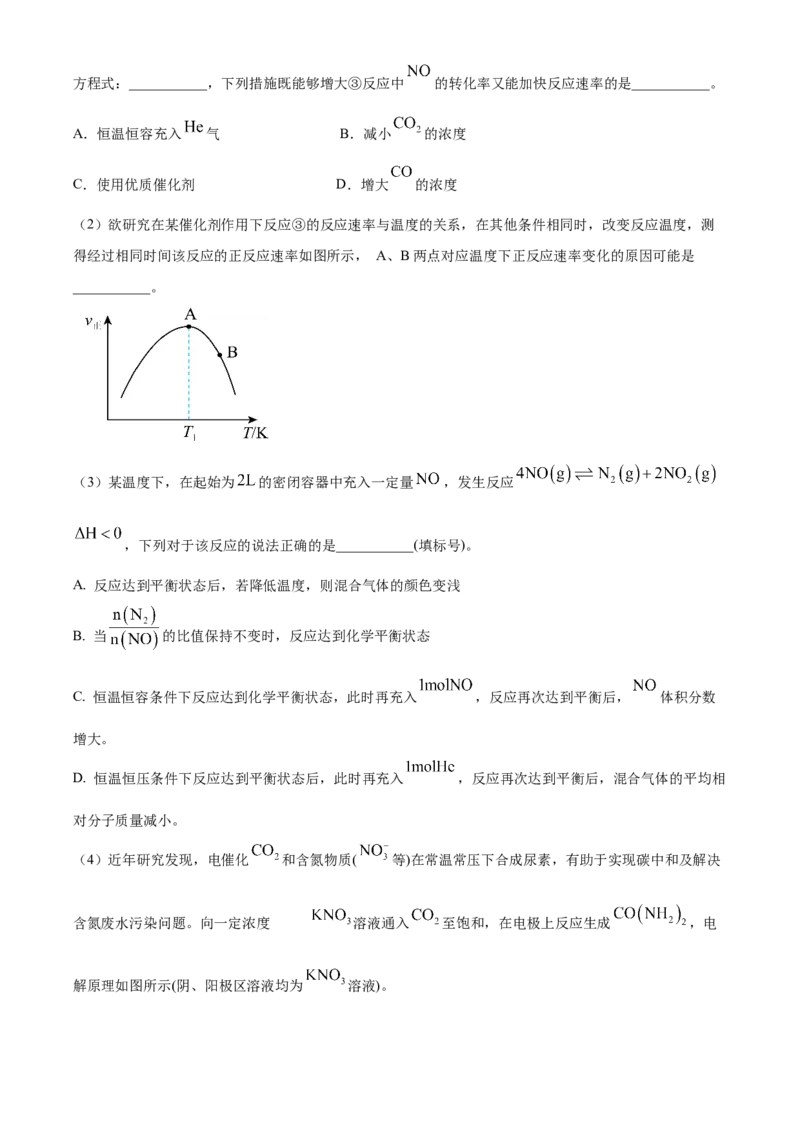
(1)已知:① ;② 的燃烧热为
;若某反应③的平衡常数表达式为 ,请写出反应③的热化学方程式:___________,下列措施既能够增大③反应中 的转化率又能加快反应速率的是___________。
A.恒温恒容充入 气 B.减小 的浓度
C.使用优质催化剂 D.增大 的浓度
(2)欲研究在某催化剂作用下反应③的反应速率与温度的关系,在其他条件相同时,改变反应温度,测
得经过相同时间该反应的正反应速率如图所示, A、B两点对应温度下正反应速率变化的原因可能是
___________。
(3)某温度下,在起始为 的密闭容器中充入一定量 ,发生反应
,下列对于该反应的说法正确的是___________(填标号)。
A. 反应达到平衡状态后,若降低温度,则混合气体的颜色变浅
B. 当 的比值保持不变时,反应达到化学平衡状态
C. 恒温恒容条件下反应达到化学平衡状态,此时再充入 ,反应再次达到平衡后, 体积分数
增大。
D. 恒温恒压条件下反应达到平衡状态后,此时再充入 ,反应再次达到平衡后,混合气体的平均相
对分子质量减小。
(4)近年研究发现,电催化 和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决
含氮废水污染问题。向一定浓度 的溶液通入 至饱和,在电极上反应生成 ,电
解原理如图所示(阴、阳极区溶液均为 溶液)。①电解池中电极X应接直流电源的___________极。
②电解过程中生成尿素的电极反应式是___________。
(5)工业上可以用氨水除去反应 中产生的 ,得到
溶液,反应 的平衡常数 ___________。(已知常温下
的电离平衡常数 , 的电离平衡常数 )天津市耀华中学 2025 届高三年级第一次月考
化学试卷
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试时间60分钟。第Ⅰ卷1
至4页,第Ⅱ卷5至8页。
答卷前,考生务必将姓名、班级、考号填在答题卡上。答卷时,考生务必将答案涂写在答题
卡上,答在试卷上的无效。考试结束后,将答题卡交回。
祝各位考生考试顺利!
第Ⅰ卷(共36分)
注意事项:
1.每题选出答案后,用铅笔将答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,
再选涂其他答案标号。
2.本卷共12题,每题3分,共36分。在每题给出的四个选项中,只有一项是最符合题目要求
的。
以下数据可供解题时参考:
相对原子质量:H-1 C-12 O-16 Na-23
【1题答案】
【答案】D
【2题答案】
【答案】C
【3题答案】
【答案】A
【4题答案】
【答案】A
【5题答案】
【答案】B
【6题答案】
【答案】B
【7题答案】
【答案】C
【8题答案】
【答案】D
【9题答案】
【答案】A
【10题答案】【答案】D
【11题答案】
【答案】C
【12题答案】
【答案】B
第Ⅱ卷(共64分)
注意事项:
1.用黑色墨水的钢笔或签字笔将答案写在答题卡上。
2.本卷共4题,共64分。
【13题答案】
【答案】(1) ①. 分子 ②. AC
(2) ①. ③ ②. sp2杂化 ③. N> C> H> Co ④. +2 ⑤. 配位
(3) ①. NiO和NaCl晶体类型相同,Ni2+和O2-所带电荷数多于Na+和Cl-,Ni2+和O2-间距比Na+和Cl-间
距更小,NiO晶体中离子键更强 ②. ③. 0.97
【14题答案】
【答案】(1)碳碳双键、羧基
(2)加成反应(或还原反应)
(3) ① 4 ②.
.
(4) +H O
2
(5)O,△/催化剂
2
(6)阴极 (7)b
( 8 ) )【15题答案】
【 答 案 】 ( 1 ) ① . ②.
(2) ①. 吸收反应生成的CO ②. 防止空气中CO 和水蒸气进入影响测定结果
2 2
(3)把装置中CO 和水蒸气排出,被装置B和装置C吸收
2
(4)bce (5)
(6)偏大
【16题答案】
【答案】(1) ①. ②. D
(2)温度过高,催化剂活性降低,正反应速率降低 (3)BD
(4) ①. 负极 ②.
(5)