文档内容
2024 级高二入学考试
化学试题
考试时间:75分钟,满分100分
注意事项:可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5 K39 I 127
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求
的。
1.下列生活事件中所涉及的化学知识正确的是
选项 劳动项目 化学知识
A 用洗洁精清洗餐具上的油污 洗涤剂能溶解油污
B 炒菜时油锅着火,用锅盖盖灭 降低油的着火点
C 用炭黑制作墨汁 炭黑有还原性
D 玉米成熟前施用氮肥 氮肥能使农作物生长茂盛
A.A B.B C.C D.D
2.宏观辨识与微观探析是化学学科核心素养之一。下列反应方程式书写正确的是
A.氧化钡与稀硫酸混合:
B.用浓氨水检验氯气管道是否泄漏:8NH +3Cl =6NH Cl+N
3 2 4 2
C.稀硝酸中加入少量铁屑:
D.向酸性 溶液中通入 气体:
3.短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是
A.X、Y、Z三种元素中,X的非金属性最强
B.Y的最高正化合价为+7价
C.常压下X单质的熔点比Z单质的低
D.Z的氢化物为强酸
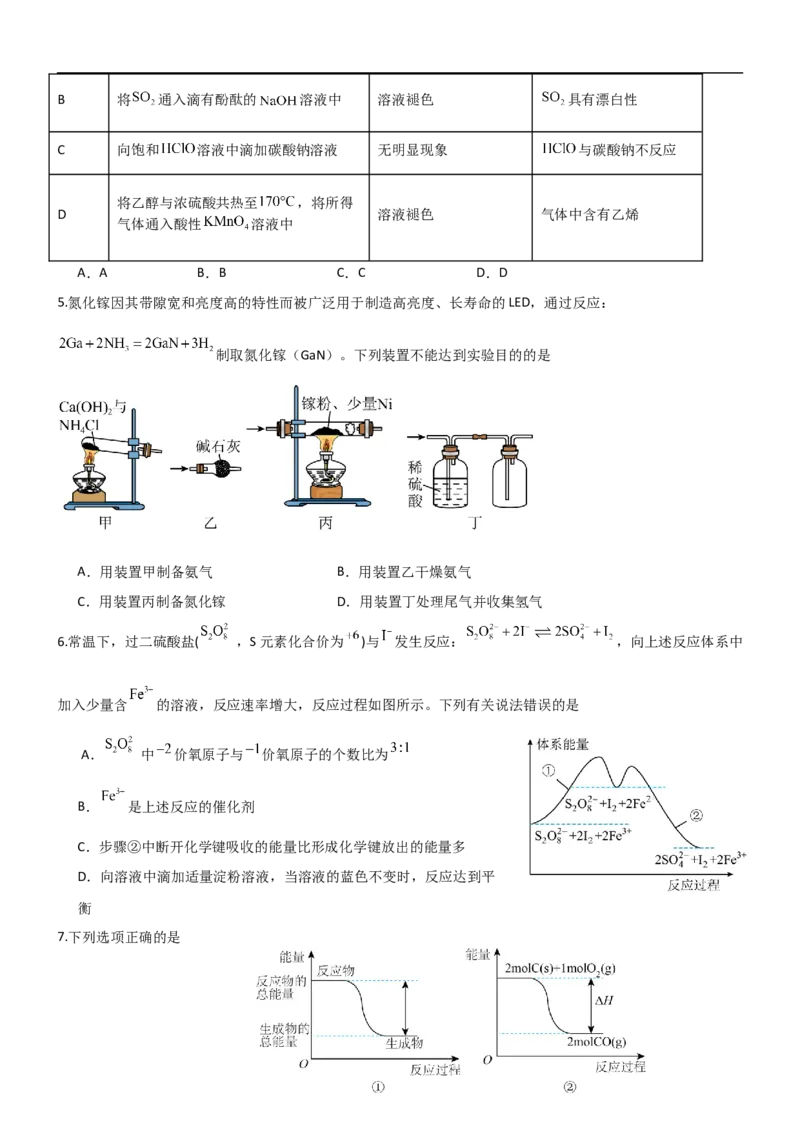
4.下列实验操作、实验现象和结论或解释均正确的是
选项 实验操作 实验现象 结论或解释
向某溶液中滴加足量的 溶液并加
A 湿润红色石蕊试纸变蓝 原溶液中一定含有
热,试管口放置湿润红色石蕊试纸B 将 通入滴有酚酞的 溶液中 溶液褪色 具有漂白性
C 向饱和 溶液中滴加碳酸钠溶液 无明显现象 与碳酸钠不反应
将乙醇与浓硫酸共热至 ,将所得
D 溶液褪色 气体中含有乙烯
气体通入酸性 溶液中
A.A B.B C.C D.D
5.氮化镓因其带隙宽和亮度高的特性而被广泛用于制造高亮度、长寿命的LED,通过反应:
制取氮化镓(GaN)。下列装置不能达到实验目的的是
A.用装置甲制备氨气 B.用装置乙干燥氨气
C.用装置丙制备氮化镓 D.用装置丁处理尾气并收集氢气
6.常温下,过二硫酸盐( ,S元素化合价为 )与 发生反应: ,向上述反应体系中
加入少量含 的溶液,反应速率增大,反应过程如图所示。下列有关说法错误的是
A. 中 价氧原子与 价氧原子的个数比为
B. 是上述反应的催化剂
C.步骤②中断开化学键吸收的能量比形成化学键放出的能量多
D.向溶液中滴加适量淀粉溶液,当溶液的蓝色不变时,反应达到平
衡
7.下列选项正确的是A.图①可表示 晶体与 晶体反应的能量变化
B.图②中ΔH表示碳的燃烧热
C.若用铜丝代替图③仪器a进行相应的实验操作,测得中和热ΔH偏大
D.图④表示实验的环境温度为20℃,将物质的量浓度相等、体积分别为 、 的 、NaOH溶液混合,
混合液的最高温度随V(NaOH)的变化(已知 )
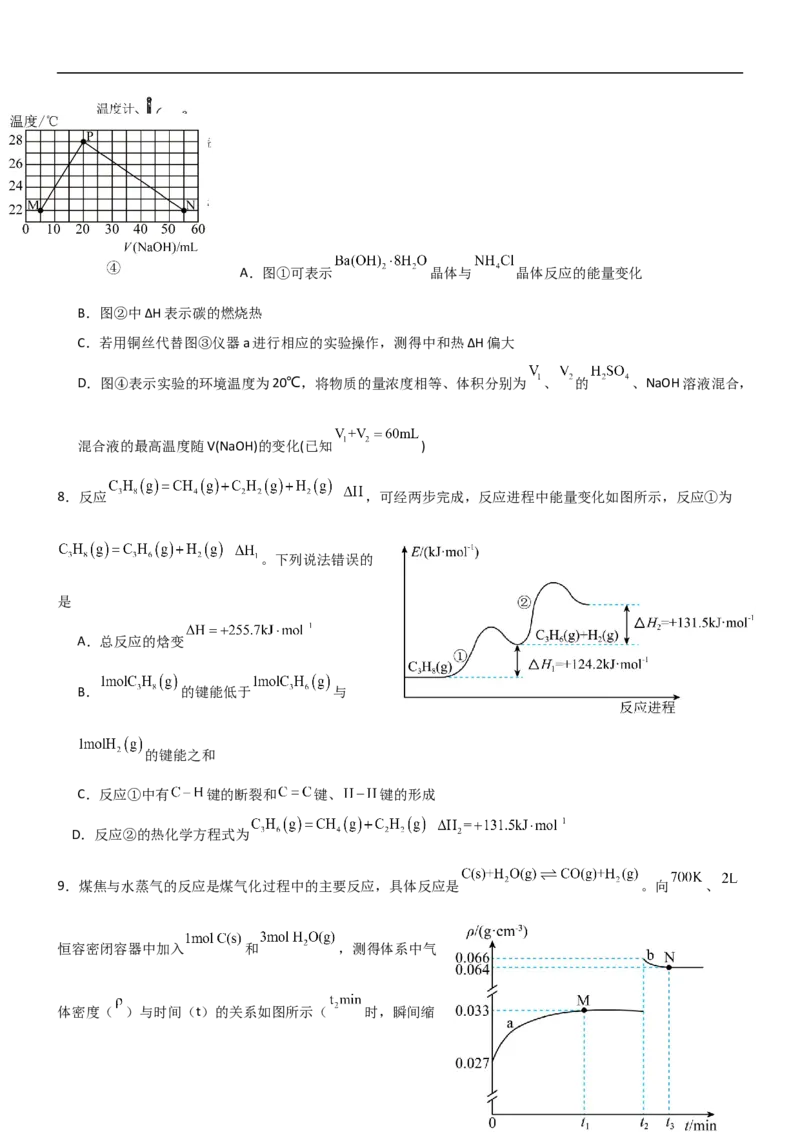
8.反应 ,可经两步完成,反应进程中能量变化如图所示,反应①为
。下列说法错误的
是
A.总反应的焓变
B. 的键能低于 与
的键能之和
C.反应①中有 键的断裂和 键、 键的形成
D.反应②的热化学方程式为
9.煤焦与水蒸气的反应是煤气化过程中的主要反应,具体反应是 。向 、
恒容密闭容器中加入 和 ,测得体系中气
体密度( )与时间(t)的关系如图所示( 时,瞬间缩小容器体积为 )。下列说法正确的是
A.M点时,体系已达平衡状态
B.0→ 内,用 表示的平均反应速率为
C. 时,该反应的平衡常数
D.N点时,向容器中同时充入 和 ,则 大于
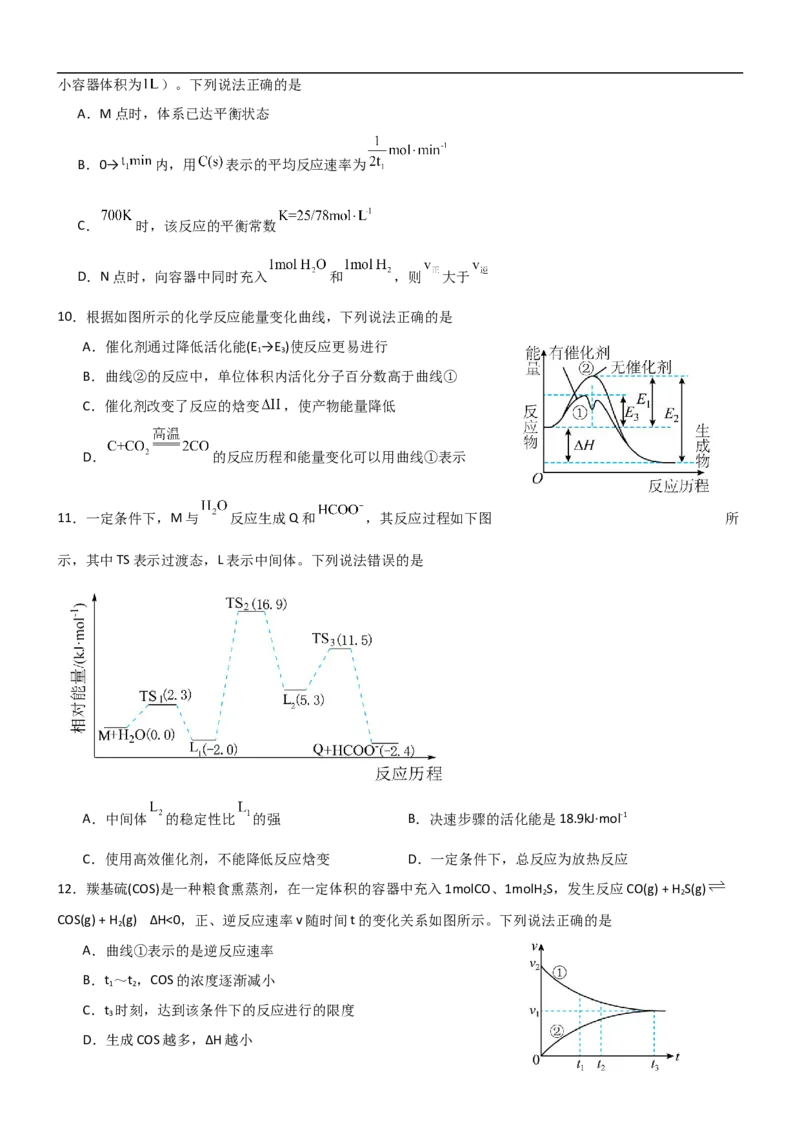
10.根据如图所示的化学反应能量变化曲线,下列说法正确的是
A.催化剂通过降低活化能(E →E )使反应更易进行
1 3
B.曲线②的反应中,单位体积内活化分子百分数高于曲线①
C.催化剂改变了反应的焓变 ,使产物能量降低
D. 的反应历程和能量变化可以用曲线①表示
11.一定条件下,M与 反应生成Q和 ,其反应过程如下图 所
示,其中TS表示过渡态,L表示中间体。下列说法错误的是
A.中间体 的稳定性比 的强 B.决速步骤的活化能是18.9kJ·mol-1
C.使用高效催化剂,不能降低反应焓变 D.一定条件下,总反应为放热反应
12.羰基硫(COS)是一种粮食熏蒸剂,在一定体积的容器中充入1molCO、1molH S,发生反应CO(g) + H S(g)
2 2
COS(g) + H (g) ΔH<0,正、逆反应速率v随时间t的变化关系如图所示。下列说法正确的是
2
A.曲线①表示的是逆反应速率
B.t ~t ,COS的浓度逐渐减小
1 2
C.t 时刻,达到该条件下的反应进行的限度
3
D.生成COS越多,ΔH越小13.用相同质量的锌片和铜片构成原电池,如图所示,下列说法不正确的是
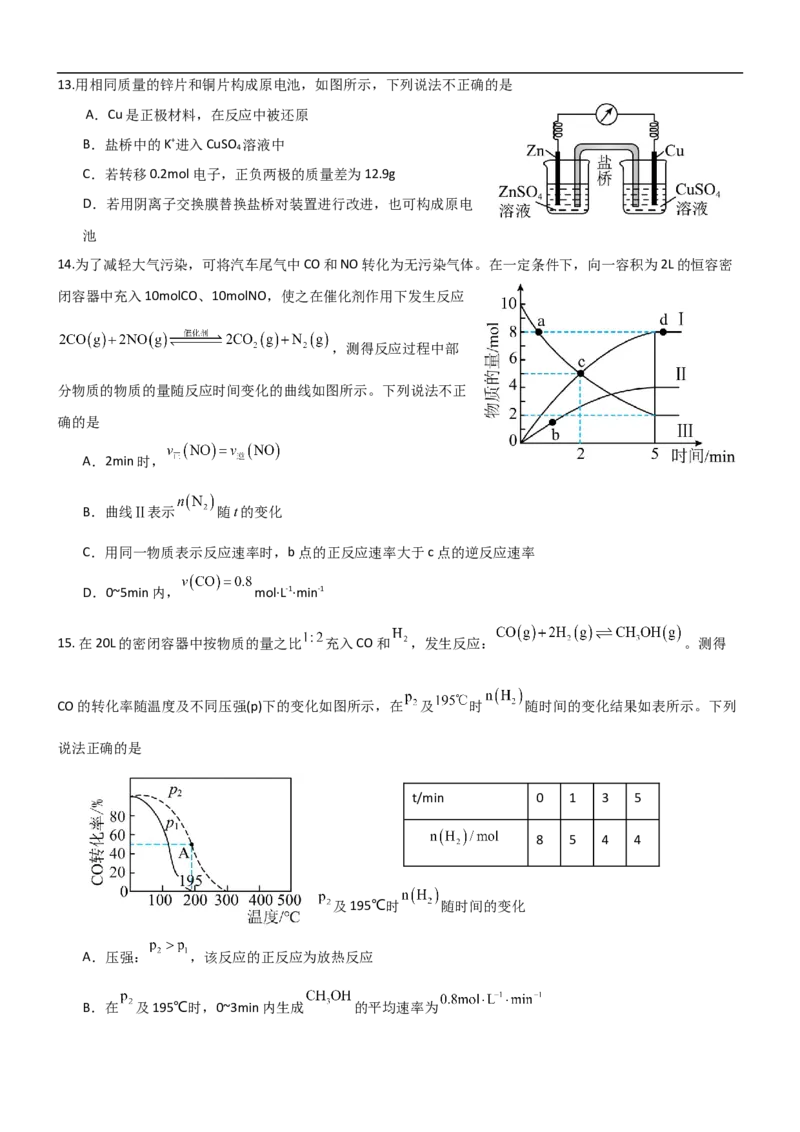
A.Cu是正极材料,在反应中被还原
B.盐桥中的K+进入CuSO 溶液中
4
C.若转移0.2mol电子,正负两极的质量差为12.9g
D.若用阴离子交换膜替换盐桥对装置进行改进,也可构成原电
池
14.为了减轻大气污染,可将汽车尾气中CO和NO转化为无污染气体。在一定条件下,向一容积为2L的恒容密
闭容器中充入10molCO、10molNO,使之在催化剂作用下发生反应
,测得反应过程中部
分物质的物质的量随反应时间变化的曲线如图所示。下列说法不正
确的是
A.2min时,
B.曲线Ⅱ表示 随t的变化
C.用同一物质表示反应速率时,b点的正反应速率大于c点的逆反应速率
D.0~5min内, mol·L-1·min-1
15.在20L的密闭容器中按物质的量之比 充入CO和 ,发生反应: 。测得
CO的转化率随温度及不同压强(p)下的变化如图所示,在 及 时 随时间的变化结果如表所示。下列
说法正确的是
t/min 0 1 3 5
8 5 4 4
及195℃时 随时间的变化
A.压强: ,该反应的正反应为放热反应
B.在 及195℃时,0~3min内生成 的平均速率为C.在 及195℃时,该反应的平衡常数为5
D.在A点时, 的平衡转化率为45%
二、填空题(共4小题,合计55分)
16.(每空2分,共12分)金属矿物资源的利用有着非常重要的意义。回答下列问题:
(1)下列反应原理不符合工业冶炼金属实际情况的是______(填字母)。
A. (熔融) B. (熔融)
C. D.
(2)白口铁(镀锌铁)在生产、生活中有广泛应用。某小组以菱锌矿(主要成分是 ,以及CuO、FeO、
MgO和 等)制备白口铁的流程如下:
①“浸取”前将菱锌矿粉碎的目的是 ,“浸取”后溶液中主要含有的金属阳离子为 。
②“滤渣1”的主要成分是 (填化学式)。
③“滤渣3”中主要成分是 和 ,写出“氧化”时发生反应的离子方程式: 。
④加Zn时转化的离子方程式为 。
17.(每空2分,共14分) 常用做食盐补碘剂。工业生产 的流程如下:
已知:
(1)用 固体配制 溶液。①计算需准确称取 固体的质量为 。
②用已经准确称取 固体配制溶液时,除了烧杯和玻璃棒外,还必须使用的玻璃仪器有 。
③下列操作可能使所配 溶液浓度偏小的是 (填写字母)。
a.溶解用的烧杯和玻璃棒未洗涤
b.定容时俯视容量瓶的刻度线
c.配溶液前容量瓶中有少量蒸馏水
d.定容、摇匀后发现液面低于刻度线,再加水至液面最低点与刻度线相切
(2)“反应”时化学方程式为 。
①用单线桥标出该反应中电子转移的方向和数目: 。
②写出NaOH溶液吸收 的离子方程式: 。
(3)写出生产中将 转化为 的另一种反应物的化学式: 。
(4)为了测定 产品的纯度,准确称取1.000g产品,配制成250mL溶液,取25.00mL溶液于锥形瓶中,加稀
硫酸酸化,再加入足量KI溶液充分反应,加淀粉指示剂,用 标准溶液测定,恰好反应时,
共消耗 标准溶液27.00mL。计算 产品的纯度为 。
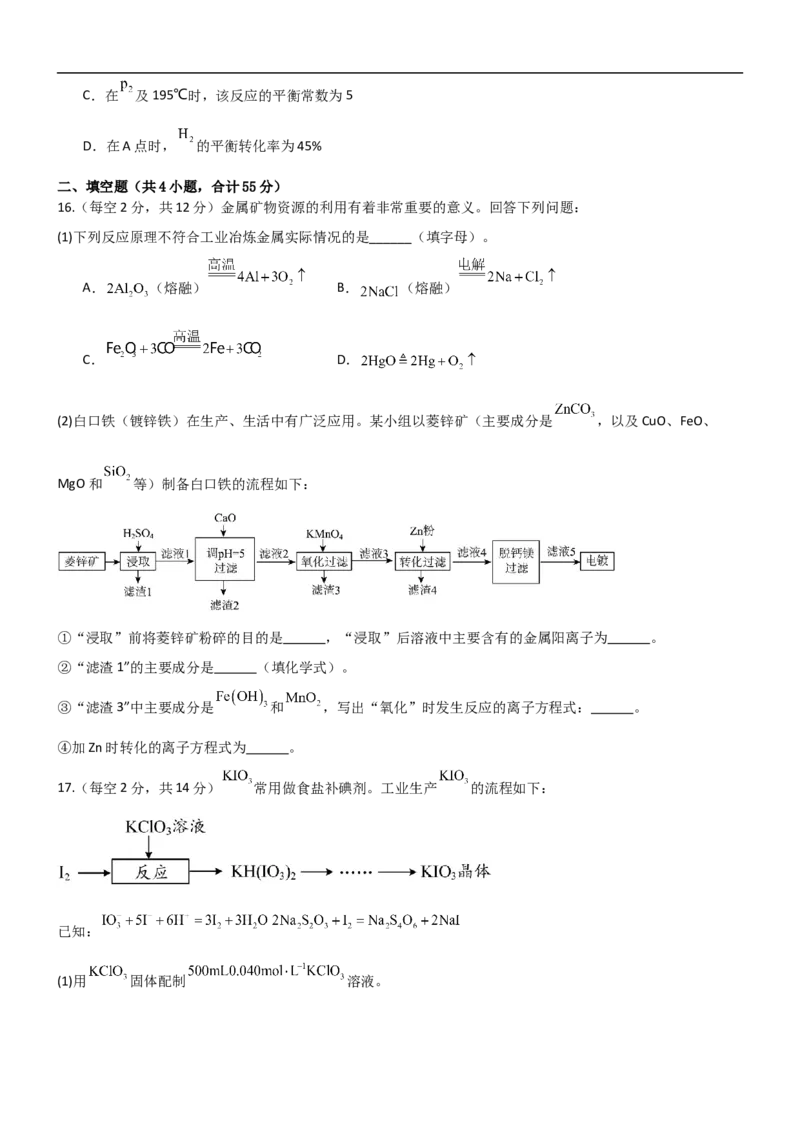
18.【(1)小问每空1分,其余每空2分,共14分】氢能被确定为国家未来能源体系的重要组成部分,研究制
氢技术具有重要意义。乙醇—水催化重整可获得氢气,主要反应如下:
反应1:
反应2:
反应3:
(1) (用 和 表示),反应1在低温下 (填“能”或“不能”)自发进行。
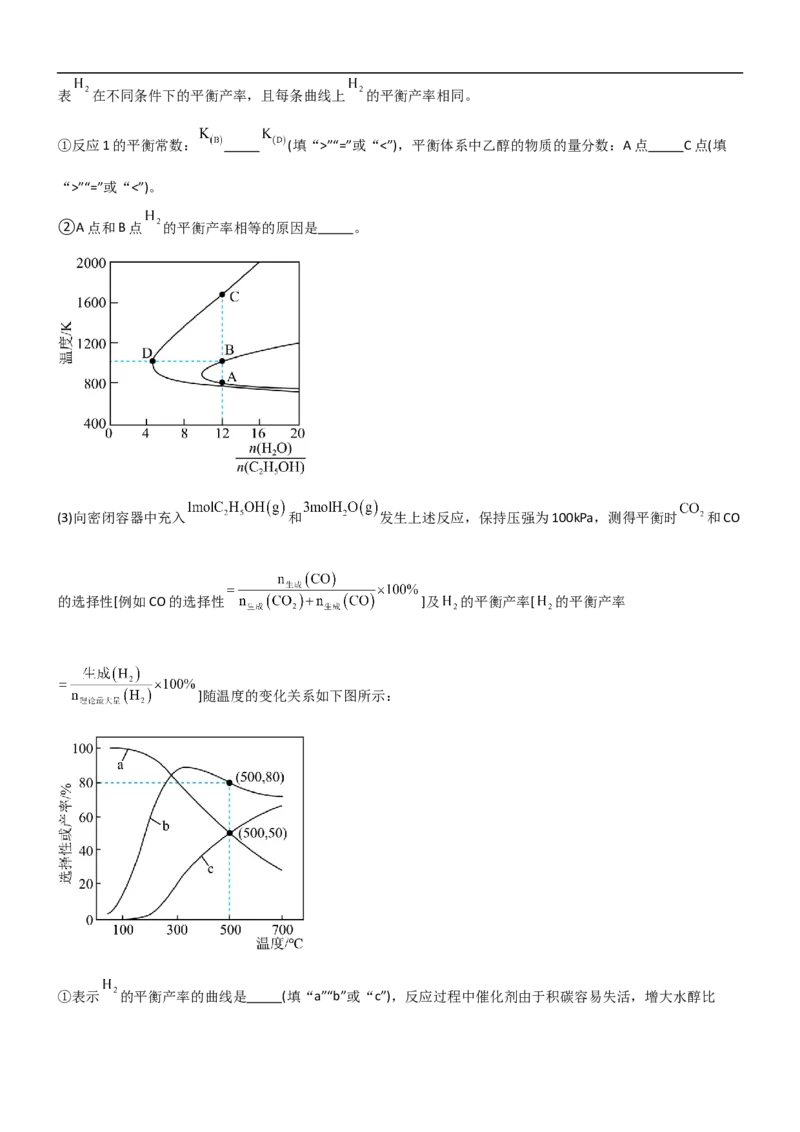
(2)压强为100kPa, 的平衡产率与温度、起始时水醇比 的关系如下图所示,两条曲线上的点代表 在不同条件下的平衡产率,且每条曲线上 的平衡产率相同。
①反应1的平衡常数: (填“>”“=”或“<”),平衡体系中乙醇的物质的量分数:A点 C点(填
“>”“=”或“<”)。
②A点和B点 的平衡产率相等的原因是 。
(3)向密闭容器中充入 和 发生上述反应,保持压强为100kPa,测得平衡时 和CO
的选择性[例如CO的选择性 ]及 的平衡产率[ 的平衡产率
]随温度的变化关系如下图所示:
①表示 的平衡产率的曲线是 (填“a”“b”或“c”),反应过程中催化剂由于积碳容易失活,增大水醇比可有效减少积碳,原因是 (用化学方程式表示)。
②500℃,100kPa条件下,用平衡分压表示反应2的平衡常数 。
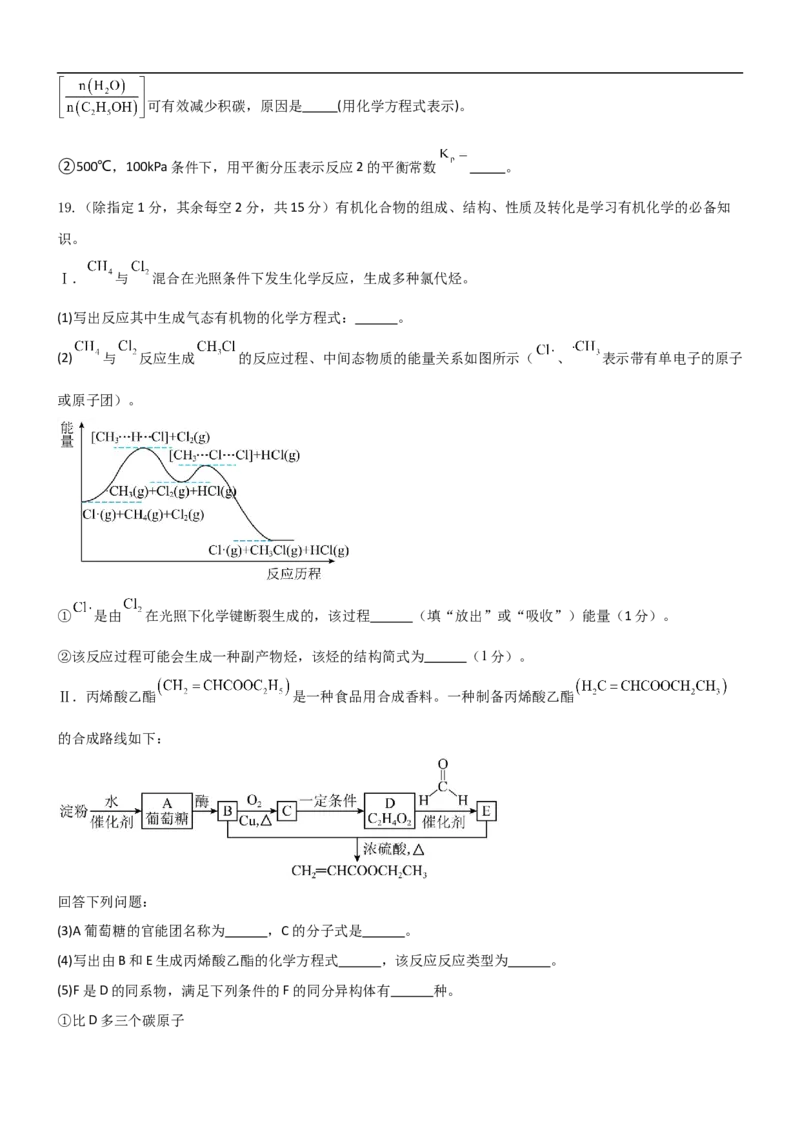
19.(除指定1分,其余每空2分,共15分)有机化合物的组成、结构、性质及转化是学习有机化学的必备知
识。
Ⅰ. 与 混合在光照条件下发生化学反应,生成多种氯代烃。
(1)写出反应其中生成气态有机物的化学方程式: 。
(2) 与 反应生成 的反应过程、中间态物质的能量关系如图所示( 、 表示带有单电子的原子
或原子团)。
① 是由 在光照下化学键断裂生成的,该过程 (填“放出”或“吸收”)能量(1分)。
②该反应过程可能会生成一种副产物烃,该烃的结构简式为 (1分)。
Ⅱ.丙烯酸乙酯 是一种食品用合成香料。一种制备丙烯酸乙酯
的合成路线如下:
回答下列问题:
(3)A葡萄糖的官能团名称为 ,C的分子式是 。
(4)写出由B和E生成丙烯酸乙酯的化学方程式 ,该反应反应类型为 。
(5)F是D的同系物,满足下列条件的F的同分异构体有 种。
①比D多三个碳原子②能和碳酸氢钠反应