文档内容
文山市第一中学高二年级 12 月月考
化学试卷
本试卷共8页,共18题,全卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必用黑色碳素笔将自己的姓名、学校、班级、考场号、座位号在答题卡上填写清
楚,
并将条形码准确粘贴在条形码区域内。
2.选择题的作答:每小题选出答案后,用 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号,写在试卷、草稿纸和答题卡的非答题区域均无效。
3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内,写在试卷、草稿纸和答题
卡上的非答题区域均无效。
4.考试结束后,请将本试卷和答题卡一并上交。
可能用到的相对原子质量:H-1 O-16 Na-23 S-32 K-39 Cu-64 Zn-65
一、单项选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合
题目要求的。
1.化学与科技、生产、生活息息相关。下列说法错误的是
A.长期过量使用NH Cl等铵态化肥易导致土壤酸化
4
B.采用催化转换技术能提高汽车尾气中有害气体的平衡转化率
C.“奋斗者”号载人潜水器使用的锂离子电池是二次电池
D.煤气中毒与血红蛋白跟 、CO结合过程中的平衡移动有关
2.设N 为阿伏加德罗常数的值,下列说法正确的是
A
A.1 L 0.1mol·L-1的NaHCO 溶液中HCO -和CO2-离子数之和为0.1N
3 3 3 A
B.电解NaOH溶液,阴极产生22.4 L气体时,理论上电路中转移电子的数目为2 N
A
C.常温下,pH=2的HC O 溶液中,含有H+ 数为0.01 N
2 2 4 A
D.25℃时1L pH=13的Ba(OH) 溶液中含有的OH-离子数为0.1N
2 A
3.常温下,下列各组离子在相应条件下可能大量共存的是
A.能使甲基橙显橙色的溶液中:NH +、K+、NO -、Cl-
4 3
B.由水电离的c(H+)=10-12mol·L-1的溶液中:Fe2+、Na+、NO -、SO 2-
3 4
C.惰性电极电解饱和食盐水后的溶液中:Al3+、Na+、SO 2-、Br-
4
D. 的溶液中:NH 、Ba2+、Cl-、NO -
34.下列有关反应的化学方程式或离子方程式正确的是
A.用石墨电极电解 溶液:2Na++2Cl- ===== 2Na+Cl↑
2
B.氢氧碱性燃料电池正极电极反应式:O+4H++4e- = 2HO
2 2
C.TiCl 制备TiO:TiCl +(x+2)H O = TiO·xHO↓+4HCl
4 2 4 2 2 2
D.向硫代硫酸钠溶液中滴加稀硫酸:3SO2-+2H+ = 2SO 2-+4S↓+H O
2 3 4 2
5.利用下列装置进行实验,能达到实验目的的是
A.用 KOH标准溶液 B.制取Fe(OH) 胶体 C.制备无水MgCl D.用pH试纸测定
3 2
滴定锥形瓶中的盐酸 NaClO溶液的pH
A.A B.B C.C D.D
6.下列实验操作与现象,得出的结论错误的是
选项 实验操作与现象 结论
A 将充满NO
2
的玻璃球浸泡在冰水中,红棕色变浅 2NO
2
(g) ⇌N
2
O
4
(g) △H<0
B 用pH试纸测0.01mol/LNaHC O 溶液的酸碱性,试纸显红色 HC O 是强酸
2 4 2 2 4
C 向含有酚酞的NaCO 溶液中加少量BaCl 固体,溶液红色变浅 NaCO 溶液中存在水解平衡
2 3 2 2 3
D 室温下,向0.1mol/L NaCl和0.01mol/L NaI混合溶液中逐滴滴 相同温度下:
加AgNO 溶液,立即出现黄色沉淀 Ksp(AgCl)> Ksp(AgI)
3
A.A B.B C.C D.D
7.下列有关热化学方程式的说法正确的是
A.已知C(s)+O(g)=CO (g) ΔH=a kJ·mol-1,2C(s)+O(g)=2CO(g) ΔH=b kJ·mol-1,则2a>b
2 2 2
B.NH (g)+HCl(g)=NH Cl(s)在室温下能自发进行,说明该反应的ΔH<0
3 4
C.在稀溶液中,1 mol HCl与1 mol NaOH完全反应放出的热量等于1 mol醋酸与1 mol NaOH完全反
应放出的热量
D.甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则表示甲烷燃烧热的热化学方程式为CH(g)+2O(g)=CO (g)+
4 2 2
2HO(g) ΔH=-890.3 kJ·mol-1
2
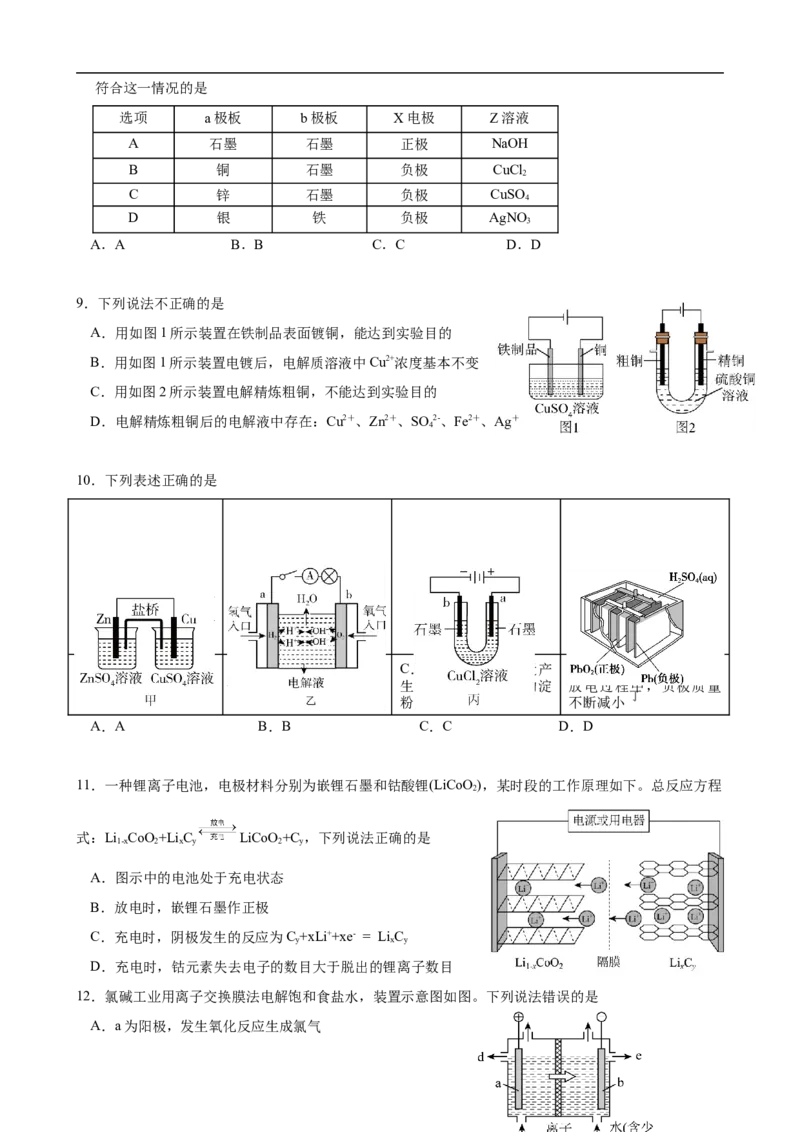
8.如图所示,X、Y分别是直流电源的两极化,学试通卷电·第后 发2 页现(a共极 板8 页质)量增加,b极板处有无色无味气体放出。符合这一情况的是
选项 a极板 b极板 X电极 Z溶液
A 石墨 石墨 正极 NaOH
B 铜 石墨 负极 CuCl
2
C 锌 石墨 负极 CuSO
4
D 银 铁 负极 AgNO
3
A.A B.B C.C D.D
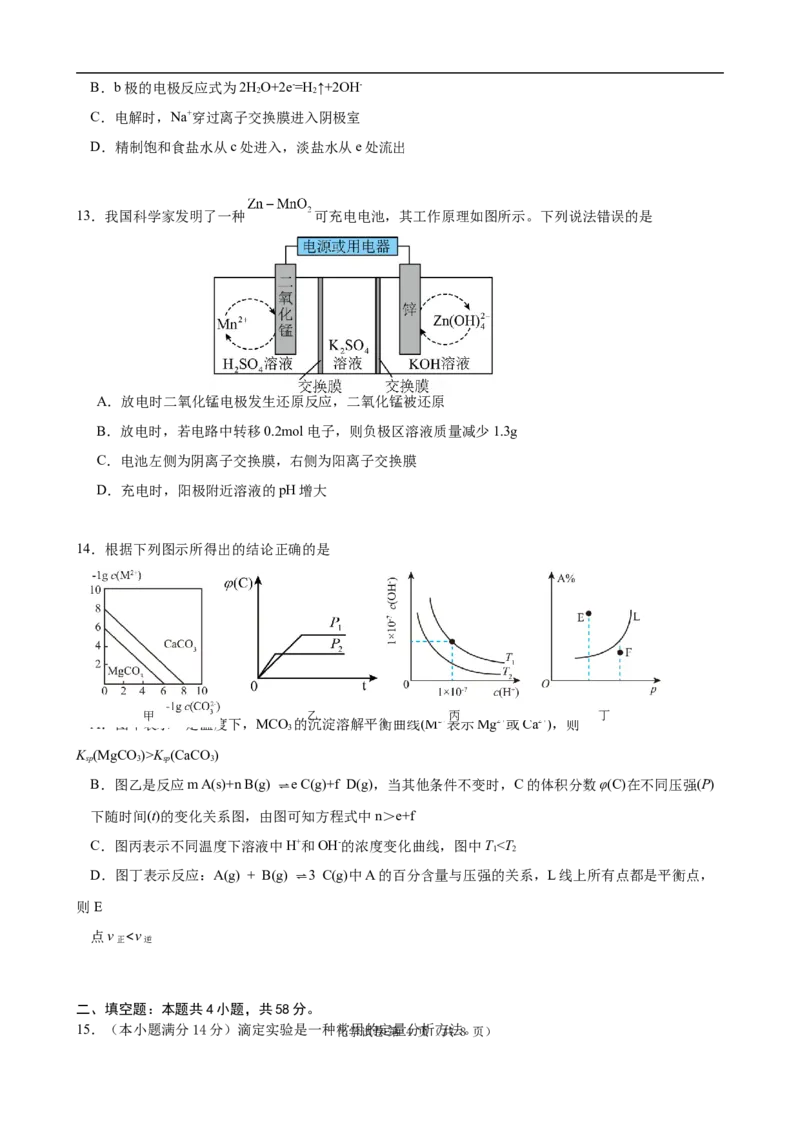
9.下列说法不正确的是
A.用如图1所示装置在铁制品表面镀铜,能达到实验目的
B.用如图1所示装置电镀后,电解质溶液中Cu2+浓度基本不变
C.用如图2所示装置电解精炼粗铜,不能达到实验目的
D.电解精炼粗铜后的电解液中存在:Cu2+、Zn2+、SO 2-、Fe2+、Ag+
4
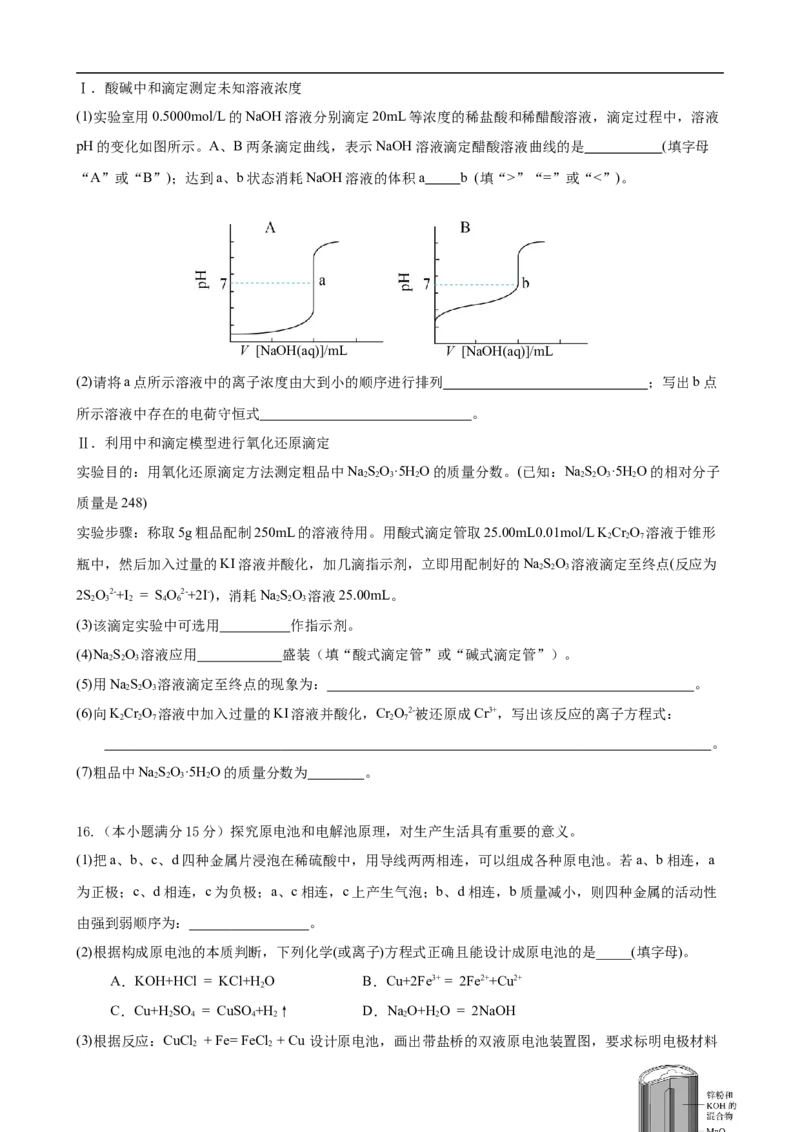
10.下列表述正确的是
A.装置甲:盐桥中的 B.装置乙:外电路中电 C.装置丙:a极附近产 D.装置丁:铅酸蓄电池
Cl-移向CuSO 溶液 流由a极流向b极 生的气体能使湿润的淀 放电过程中,负极质量
4 丁
粉碘化钾试纸变蓝 不断减小
A.A B.B C.C D.D
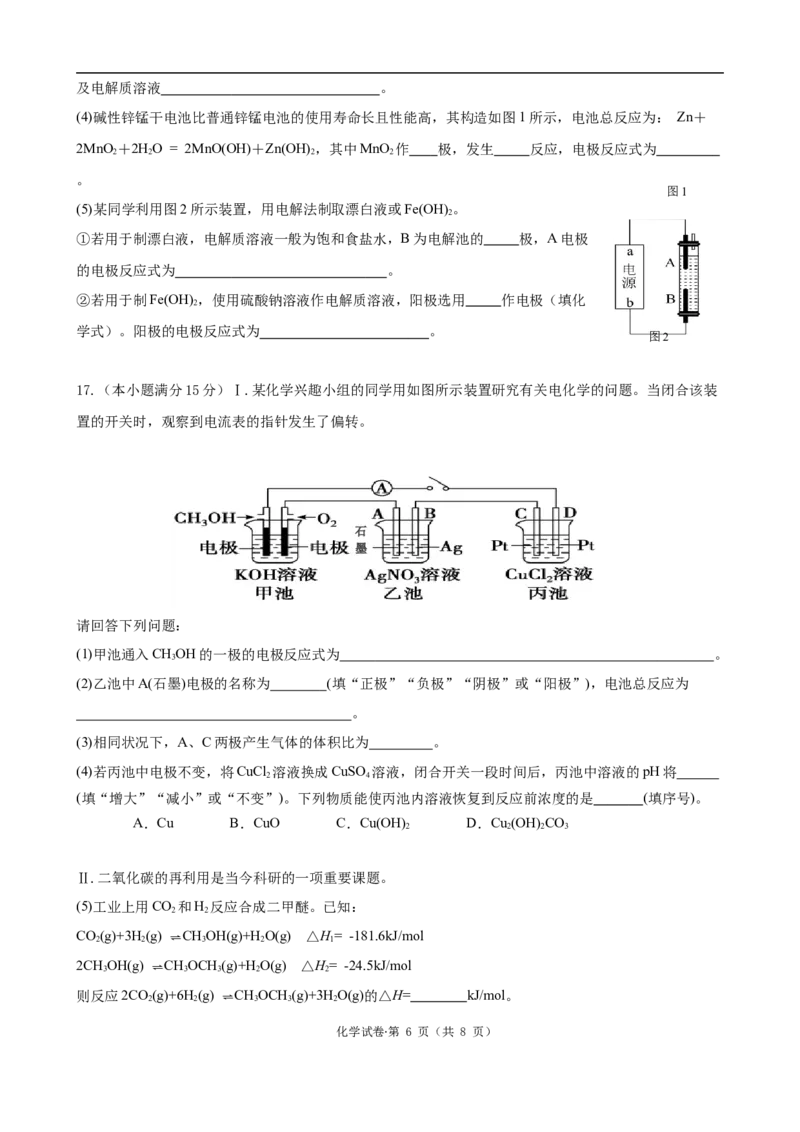
11.一种锂离子电池,电极材料分别为嵌锂石墨和钴酸锂(LiCoO ),某时段的工作原理如下。总反应方程
2
式:Li CoO+Li C LiCoO +C ,下列说法正确的是
1-x 2 x y 2 y
A.图示中的电池处于充电状态
B.放电时,嵌锂石墨作正极
C.充电时,阴极发生的反应为C +xLi++xe- = LiC
y x y
D.充电时,钴元素失去电子的数目大于脱出的锂离子数目
12.氯碱工业用离子交换膜法电解饱和食盐水,装置示意图如图。下列说法错误的是
A.a为阳极,发生氧化反应生成氯气B.b极的电极反应式为2HO+2e-=H ↑+2OH-
2 2
C.电解时,Na+穿过离子交换膜进入阴极室
D.精制饱和食盐水从c处进入,淡盐水从e处流出
13.我国科学家发明了一种 可充电电池,其工作原理如图所示。下列说法错误的是
A.放电时二氧化锰电极发生还原反应,二氧化锰被还原
B.放电时,若电路中转移0.2mol电子,则负极区溶液质量减少1.3g
C.电池左侧为阴离子交换膜,右侧为阳离子交换膜
D.充电时,阳极附近溶液的pH增大
14.根据下列图示所得出的结论正确的是
甲 乙 丙 丁
A.图甲表示一定温度下,MCO 的沉淀溶解平衡曲线(M2+表示Mg2+或Ca2+),则
3
K (MgCO )>K (CaCO)
sp 3 sp 3
B.图乙是反应m A(s)+n B(g) e C(g)+f D(g),当其他条件不变时,C的体积分数φ(C)在不同压强(P)
⇌
下随时间(t)的变化关系图,由图可知方程式中n>e+f
C.图丙表示不同温度下溶液中H+和OH-的浓度变化曲线,图中T”“=”或“<”)。
V [NaOH(aq)]/mL V [NaOH(aq)]/mL
(2)请将a点所示溶液中的离子浓度由大到小的顺序进行排列 ;写出b点
所示溶液中存在的电荷守恒式 。
Ⅱ.利用中和滴定模型进行氧化还原滴定
实验目的:用氧化还原滴定方法测定粗品中NaSO·5HO的质量分数。(已知:NaSO·5HO的相对分子
2 2 3 2 2 2 3 2
质量是248)
实验步骤:称取5g粗品配制250mL的溶液待用。用酸式滴定管取25.00mL0.01mol/L K Cr O 溶液于锥形
2 2 7
瓶中,然后加入过量的KI溶液并酸化,加几滴指示剂,立即用配制好的NaSO 溶液滴定至终点(反应为
2 2 3
2SO2-+I = SO2-+2I-),消耗NaSO 溶液25.00mL。
2 3 2 4 6 2 2 3
(3)该滴定实验中可选用 作指示剂。
(4)NaSO 溶液应用 盛装(填“酸式滴定管”或“碱式滴定管”)。
2 2 3
(5)用NaSO 溶液滴定至终点的现象为: 。
2 2 3
(6)向KCr O 溶液中加入过量的KI溶液并酸化,Cr O2-被还原成Cr3+,写出该反应的离子方程式:
2 2 7 2 7
。
(7)粗品中NaSO·5HO的质量分数为 。
2 2 3 2
16.(本小题满分15分)探究原电池和电解池原理,对生产生活具有重要的意义。
(1)把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池。若a、b相连,a
为正极;c、d相连,c为负极;a、c相连,c上产生气泡;b、d相连,b质量减小,则四种金属的活动性
由强到弱顺序为: 。
(2)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是_____(填字母)。
A.KOH+HCl = KCl+H O B.Cu+2Fe3+ = 2Fe2++Cu2+
2
C.Cu+H SO = CuSO +H ↑ D.NaO+HO = 2NaOH
2 4 4 2 2 2
(3)根据反应:CuCl + Fe= FeCl + Cu 设计原电池,画出带盐桥的双液原电池装置图,要求标明电极材料
2 2及电解质溶液 。
(4)碱性锌锰干电池比普通锌锰电池的使用寿命长且性能高,其构造如图1所示,电池总反应为: Zn+
2MnO +2HO = 2MnO(OH)+Zn(OH) ,其中MnO 作 极,发生 反应,电极反应式为
2 2 2 2
。
图1
(5)某同学利用图2所示装置,用电解法制取漂白液或Fe(OH) 。
2
①若用于制漂白液,电解质溶液一般为饱和食盐水,B为电解池的 极,A电极
的电极反应式为 。
②若用于制Fe(OH) ,使用硫酸钠溶液作电解质溶液,阳极选用 作电极(填化
2
学式)。阳极的电极反应式为 。
图2
17.(本小题满分15分)Ⅰ.某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装
置的开关时,观察到电流表的指针发生了偏转。
石
墨
请回答下列问题:
(1)甲池通入CHOH的一极的电极反应式为 。
3
(2)乙池中A(石墨)电极的名称为 (填“正极”“负极”“阴极”或“阳极”),电池总反应为
。
(3)相同状况下,A、C两极产生气体的体积比为 。
(4)若丙池中电极不变,将CuCl 溶液换成CuSO 溶液,闭合开关一段时间后,丙池中溶液的pH将
2 4
(填“增大”“减小”或“不变”)。下列物质能使丙池内溶液恢复到反应前浓度的是 (填序号)。
A.Cu B.CuO C.Cu(OH) D.Cu (OH) CO
2 2 2 3
Ⅱ.二氧化碳的再利用是当今科研的一项重要课题。
(5)工业上用CO 和H 反应合成二甲醚。已知:
2 2
CO(g)+3H(g) CHOH(g)+H O(g) △H= -181.6kJ/mol
2 2 ⇌ 3 2 1
2CHOH(g) CHOCH (g)+H O(g) △H= -24.5kJ/mol
3 ⇌ 3 3 2 2
则反应2CO(g)+6H(g) CHOCH (g)+3H O(g)的△H= kJ/mol。
2 2 ⇌ 3 3 2
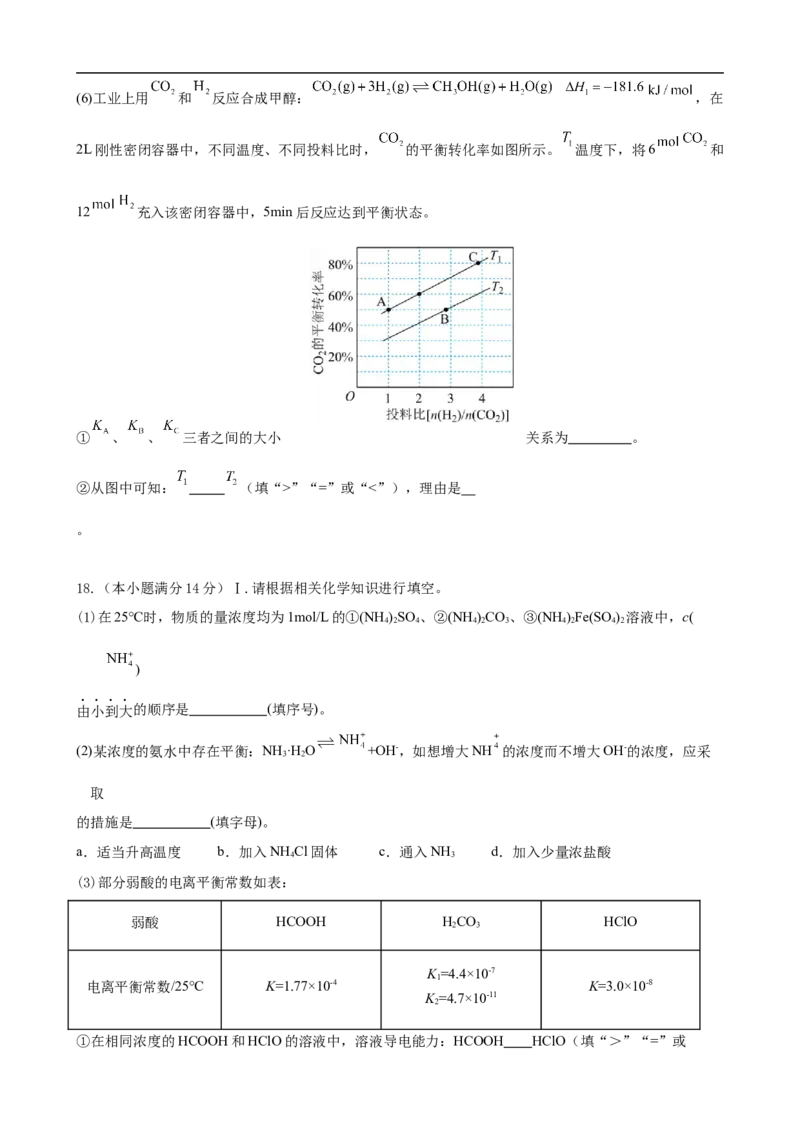
化学试卷·第 6 页(共 8 页)(6)工业上用 和 反应合成甲醇: ,在
2L刚性密闭容器中,不同温度、不同投料比时, 的平衡转化率如图所示。 温度下,将6 和
12 充入该密闭容器中,5min后反应达到平衡状态。
① 、 、 三者之间的大小 关系为 。
②从图中可知: (填“>”“=”或“<”),理由是
。
18.(本小题满分14分)Ⅰ.请根据相关化学知识进行填空。
(1)在25℃时,物质的量浓度均为1mol/L的①(NH )SO 、②(NH )CO、③(NH )Fe(SO ) 溶液中,c(
4 2 4 4 2 3 4 2 4 2
)
由小到大的顺序是 (填序号)。
(2)某浓度的氨水中存在平衡:NH ·H O +OH-,如想增大NH 的浓度而不增大OH-的浓度,应采
3 2
取
的措施是 (填字母)。
a.适当升高温度 b.加入NH Cl固体 c.通入NH d.加入少量浓盐酸
4 3
(3)部分弱酸的电离平衡常数如表:
弱酸 HCOOH HCO HClO
2 3
K =4.4×10-7
1
电离平衡常数/25℃ K=1.77×10-4 K=3.0×10-8
K =4.7×10-11
2
①在相同浓度的HCOOH和HClO的溶液中,溶液导电能力:HCOOH HClO(填“>”“=”或“<”)。
②常温时,NaCO 的水解常数K = (列出计算式即可)。
2 3 h1
③将少量CO 气体通入NaClO溶液中,写出该反应离子方程式: 。
2
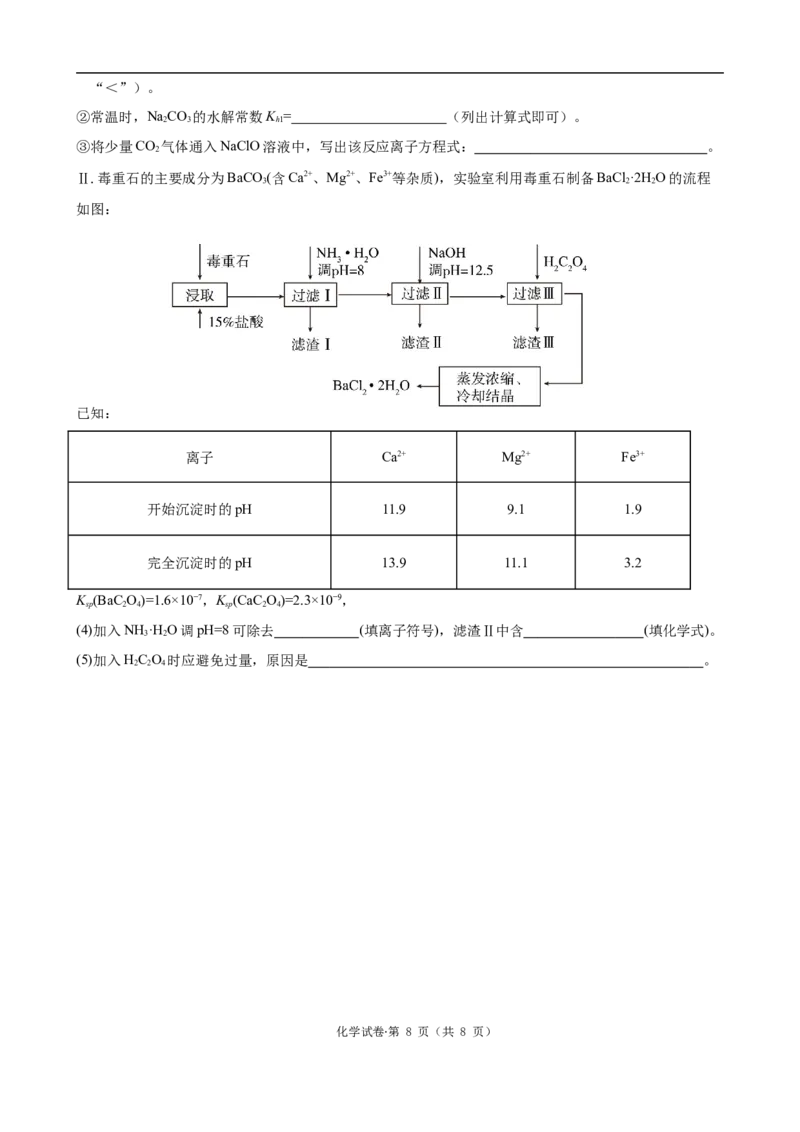
Ⅱ.毒重石的主要成分为BaCO (含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl ·2H O的流程
3 2 2
如图:
已知:
离子 Ca2+ Mg2+ Fe3+
开始沉淀时的pH 11.9 9.1 1.9
完全沉淀时的pH 13.9 11.1 3.2
K (BaC O)=1.6×10−7,K (CaC O)=2.3×10−9,
sp 2 4 sp 2 4
(4)加入NH ·H O调pH=8可除去 (填离子符号),滤渣Ⅱ中含 (填化学式)。
3 2
(5)加入HC O 时应避免过量,原因是 。
2 2 4
化学试卷·第 8 页(共 8 页)