文档内容
玉溪一中2025—2026学年上学期高二年级期中考
化学学科试卷
考试时间:75分钟 试卷满分:100分 命题人:2028届高一化学备课组
可能用到的相对原子质量:H-1 O-16 Na-23 Mg-24
一、单选题:本题共14小题,每题3分,共42分。
1、化学与科技、生产、生活密切相关。下列说法正确的是( )
A. 新型手性螺环催化剂能降低反应的焓变
B.青铜是铜中加入铅、锡制得的合金,其成分会加快铜的腐蚀
C.“天舟五号”飞船搭载的燃料电池放电时主要将热能转化为电能
D.煤气中毒后的救治与氧气、一氧化碳和血红蛋白结合过程中的化学平衡移动有关
2、工业上常用NaClO处理氨氮废水,其原理为:3NaClO+2NH =N +3NaCl+3H O,下列
3 2 2
有关说法错误的是( )
A.Cl-的结构示意图:
B.水分子的球棍模型:
C.N 的结构式:N≡N
2
D.NaCl的电子式为:
3、下列指定过程对应的方程式书写正确的是( )
A.氧化亚铁溶于稀硝酸:FeO + 2H+==Fe2+ + H O
2
B. 向Na SiO 溶液中滴加稀盐酸:Na SiO + 2H+== H SiO ↓+ 2Na+
2 3 2 3 2 3
C. 向次氯酸钙溶液通入少量二氧化碳:ClO-+CO +H O==HClO+HCO -
2 2 3
D. Ba(OH) 溶液中加过量 NH HSO 溶液:Ba 2++2OH-+2H+ + SO 2-==BaSO ↓+2H O
2 4 4 4 4 2
4、阿伏伽德罗常数的值为N ,下列说法正确的是( )
A
A.0.1 mol 27Al3+中含有的电子数为1.3N
A
B. 标准状况下,2.24L SO 中所含电子数为4N
3 A
C. 电解熔融MgCl 制2.4 g Mg,电路中通过的电子数为0.2N
2 A
D.密闭容器中,3mol H 与2mol N 充分反应生成NH ,转移电子数为6N
2 2 3 A
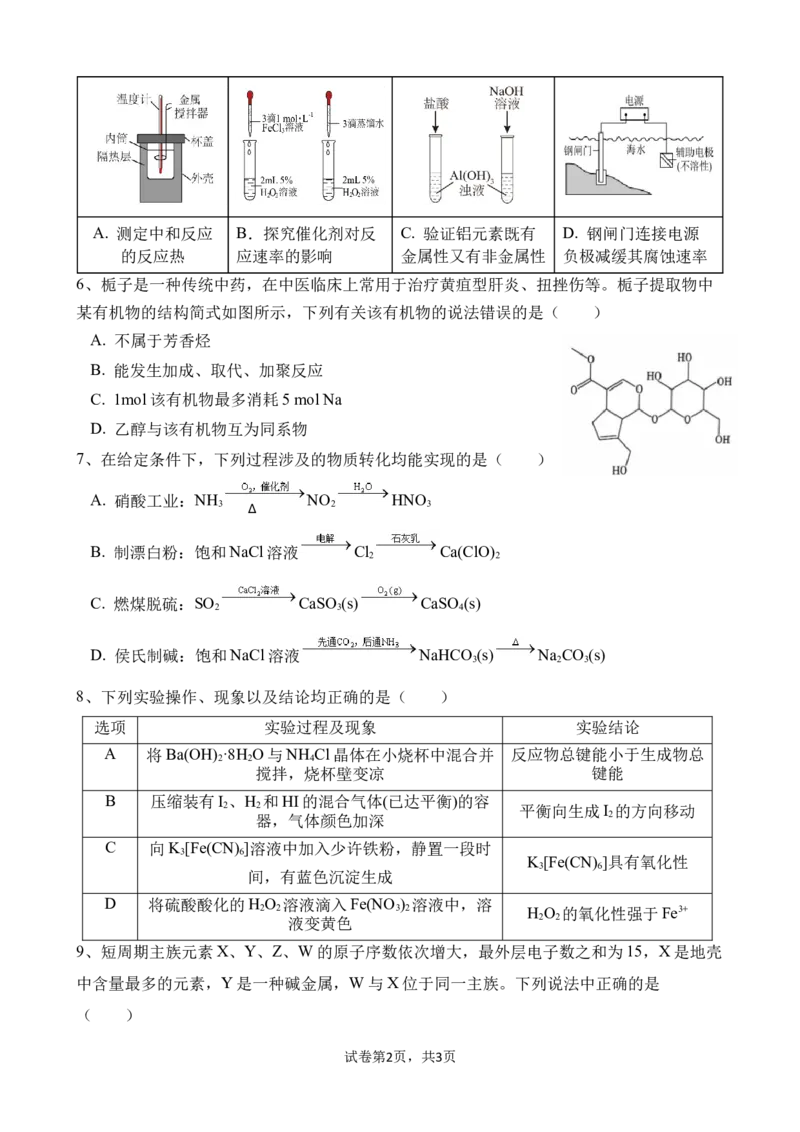
5、下列装置或操作不能达到实验目的的是( )
试卷第1页,共3页A. 测定中和反应 B.探究催化剂对反 C. 验证铝元素既有 D. 钢闸门连接电源
的反应热 应速率的影响 金属性又有非金属性 负极减缓其腐蚀速率
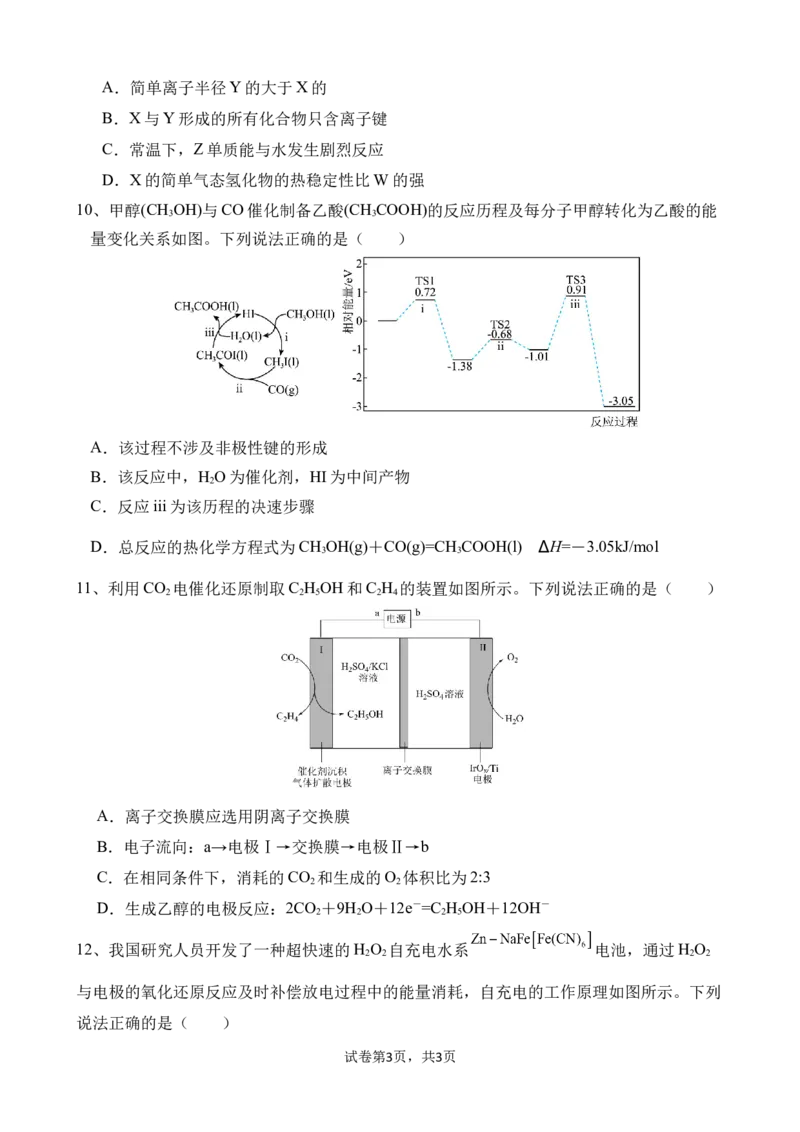
6、栀子是一种传统中药,在中医临床上常用于治疗黄疽型肝炎、扭挫伤等。栀子提取物中
某有机物的结构简式如图所示,下列有关该有机物的说法错误的是( )
A. 不属于芳香烃
B. 能发生加成、取代、加聚反应
C. 1mol该有机物最多消耗5 mol Na
D. 乙醇与该有机物互为同系物
7、在给定条件下,下列过程涉及的物质转化均能实现的是( )
A. 硝酸工业:NH NO HNO
3 2 3
∆
B. 制漂白粉:饱和NaCl溶液 Cl Ca(ClO)
2 2
C. 燃煤脱硫:SO CaSO (s) CaSO (s)
2 3 4
D. 侯氏制碱:饱和NaCl溶液 NaHCO (s) Na CO (s)
3 2 3
8、下列实验操作、现象以及结论均正确的是( )
选项 实验过程及现象 实验结论
A 将Ba(OH) ·8H O与NH Cl晶体在小烧杯中混合并 反应物总键能小于生成物总
2 2 4
搅拌,烧杯壁变凉 键能
B 压缩装有I 、H 和HI的混合气体(已达平衡)的容
2 2 平衡向生成I 的方向移动
器,气体颜色加深 2
C 向K [Fe(CN) ]溶液中加入少许铁粉,静置一段时
3 6
K [Fe(CN) ]具有氧化性
3 6
间,有蓝色沉淀生成
D 将硫酸酸化的H O 溶液滴入Fe(NO ) 溶液中,溶
2 2 3 2 H O 的氧化性强于Fe3+
液变黄色 2 2
9、短周期主族元素X、Y、Z、W的原子序数依次增大,最外层电子数之和为15,X是地壳
中含量最多的元素,Y是一种碱金属,W与X位于同一主族。下列说法中正确的是
( )
试卷第2页,共3页A.简单离子半径Y的大于X的
B.X与Y形成的所有化合物只含离子键
C.常温下,Z单质能与水发生剧烈反应
D.X的简单气态氢化物的热稳定性比W的强
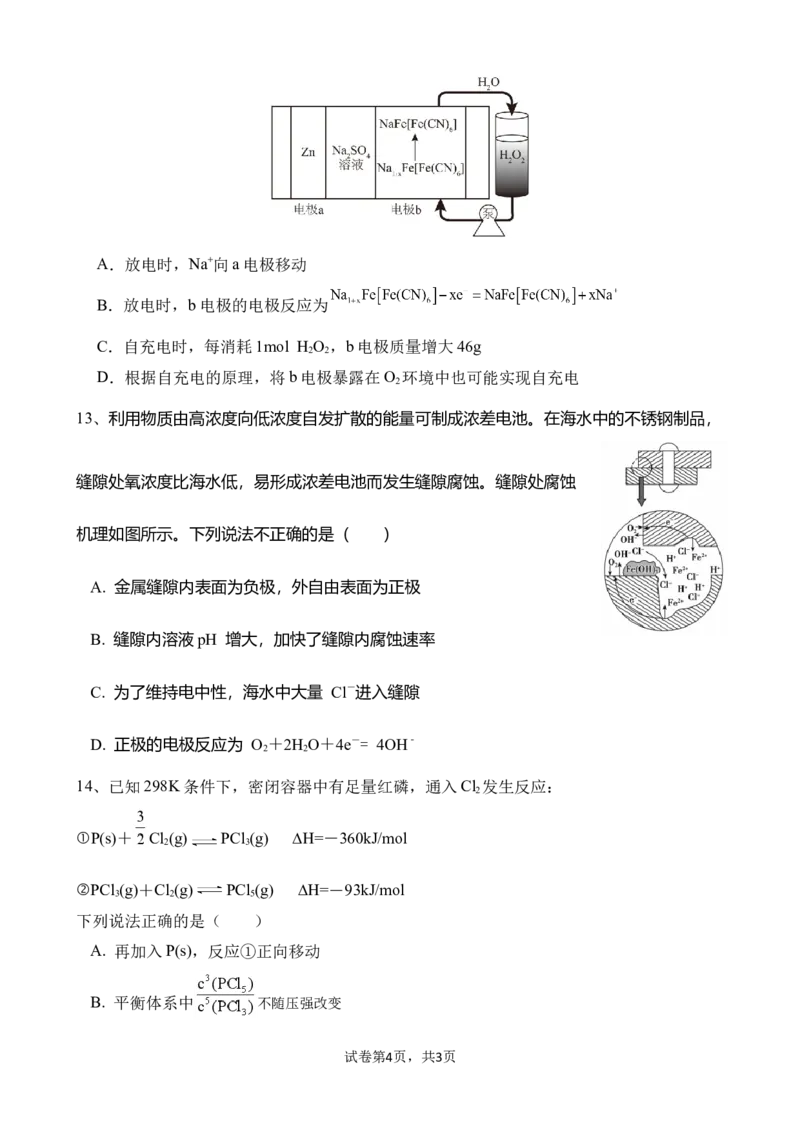
10、甲醇(CH OH)与CO催化制备乙酸(CH COOH)的反应历程及每分子甲醇转化为乙酸的能
3 3
量变化关系如图。下列说法正确的是( )
A.该过程不涉及非极性键的形成
B.该反应中,H O为催化剂,HI为中间产物
2
C.反应iii为该历程的决速步骤
D.总反应的热化学方程式为CH OH(g)+CO(g)=CH COOH(l) ∆H=-3.05kJ/mol
3 3
11、利用CO 电催化还原制取C H OH和C H 的装置如图所示。下列说法正确的是( )
2 2 5 2 4
A.离子交换膜应选用阴离子交换膜
B.电子流向:a→电极Ⅰ→交换膜→电极Ⅱ→b
C.在相同条件下,消耗的CO 和生成的O 体积比为2:3
2 2
D.生成乙醇的电极反应:2CO +9H O+12e-=C H OH+12OH-
2 2 2 5
12、我国研究人员开发了一种超快速的H O 自充电水系 电池,通过H O
2 2 2 2
与电极的氧化还原反应及时补偿放电过程中的能量消耗,自充电的工作原理如图所示。下列
说法正确的是( )
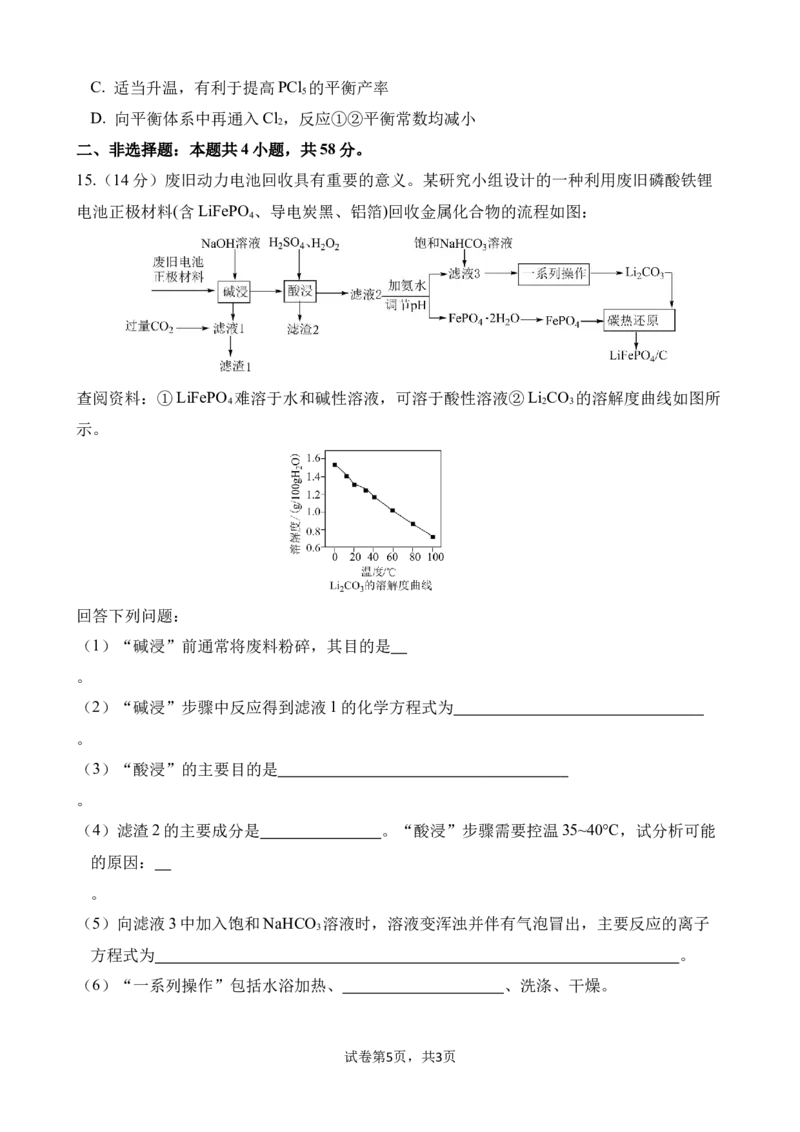
试卷第3页,共3页A.放电时,Na+向a电极移动
B.放电时,b电极的电极反应为
C.自充电时,每消耗1mol H O ,b电极质量增大46g
2 2
D.根据自充电的原理,将b电极暴露在O 环境中也可能实现自充电
2
13、利用物质由高浓度向低浓度自发扩散的能量可制成浓差电池。在海水中的不锈钢制品,
缝隙处氧浓度比海水低,易形成浓差电池而发生缝隙腐蚀。缝隙处腐蚀
机理如图所示。下列说法不正确的是( )
A. 金属缝隙内表面为负极,外自由表面为正极
B. 缝隙内溶液pH 增大,加快了缝隙内腐蚀速率
C. 为了维持电中性,海水中大量 Cl-进入缝隙
D. 正极的电极反应为 O +2H O+4e-= 4OH-
2 2
14、已知298K条件下,密闭容器中有足量红磷,通入Cl 发生反应:
2
①P(s)+ Cl (g) PCl (g) ∆H=-360kJ/mol
2 3
②PCl (g)+Cl (g) PCl (g) ∆H=-93kJ/mol
3 2 5
下列说法正确的是( )
A. 再加入P(s),反应①正向移动
B. 平衡体系中 不随压强改变
试卷第4页,共3页C. 适当升温,有利于提高PCl 的平衡产率
5
D. 向平衡体系中再通入Cl ,反应①②平衡常数均减小
2
二、非选择题:本题共4小题,共58分。
15.(14分)废旧动力电池回收具有重要的意义。某研究小组设计的一种利用废旧磷酸铁锂
电池正极材料(含LiFePO 、导电炭黑、铝箔)回收金属化合物的流程如图:
4
查阅资料:①LiFePO 难溶于水和碱性溶液,可溶于酸性溶液②Li CO 的溶解度曲线如图所
4 2 3
示。
回答下列问题:
(1)“碱浸”前通常将废料粉碎,其目的是
。
(2)“碱浸”步骤中反应得到滤液1的化学方程式为
。
(3)“酸浸”的主要目的是
。
(4)滤渣2的主要成分是 。“酸浸”步骤需要控温35~40℃,试分析可能
的原因:
。
(5)向滤液3中加入饱和NaHCO 溶液时,溶液变浑浊并伴有气泡冒出,主要反应的离子
3
方程式为 。
(6)“一系列操作”包括水浴加热、 、洗涤、干燥。
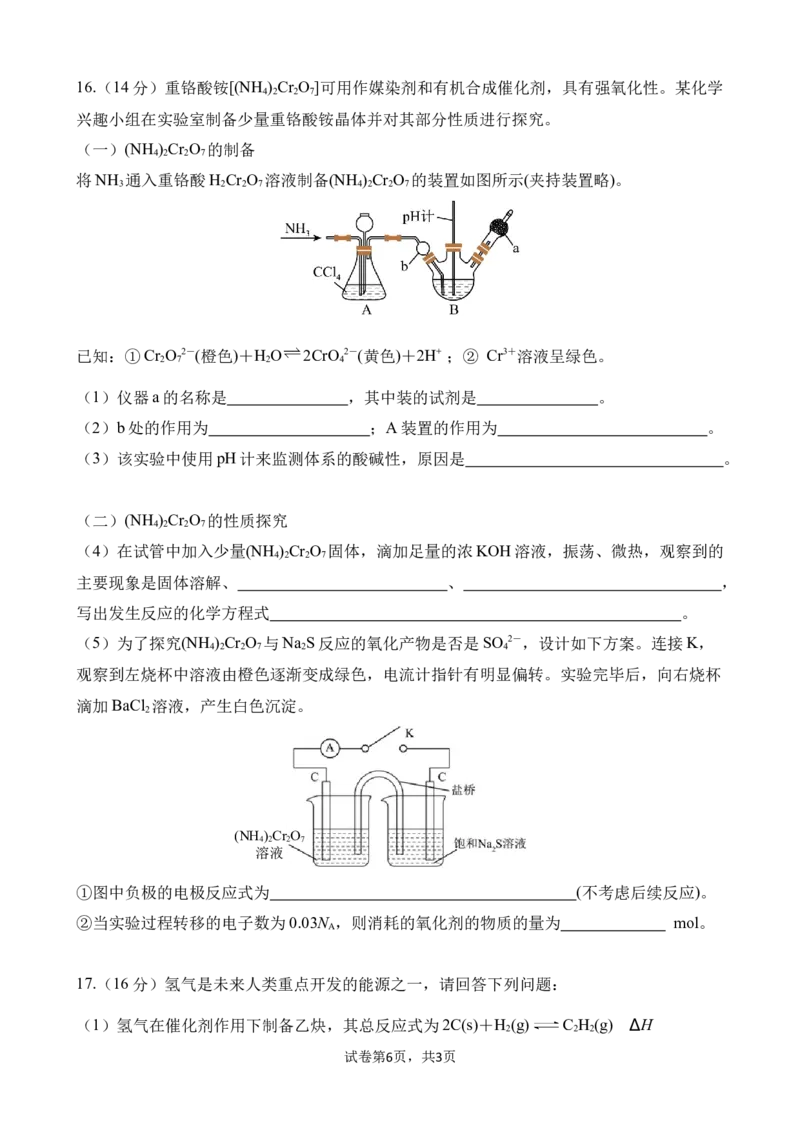
试卷第5页,共3页16.(14分)重铬酸铵[(NH ) Cr O ]可用作媒染剂和有机合成催化剂,具有强氧化性。某化学
4 2 2 7
兴趣小组在实验室制备少量重铬酸铵晶体并对其部分性质进行探究。
(一)(NH ) Cr O 的制备
4 2 2 7
将NH 通入重铬酸H Cr O 溶液制备(NH ) Cr O 的装置如图所示(夹持装置略)。
3 2 2 7 4 2 2 7
已知:①Cr O 2-(橙色)+H O 2CrO 2-(黄色)+2H+ ;② Cr3+溶液呈绿色。
2 7 2 4
(1)仪器a的名称是 ,其中装的试剂是 。
(2)b处的作用为 ;A装置的作用为 。
(3)该实验中使用pH计来监测体系的酸碱性,原因是 。
(二)(NH ) Cr O 的性质探究
4 2 2 7
(4)在试管中加入少量(NH ) Cr O 固体,滴加足量的浓KOH溶液,振荡、微热,观察到的
4 2 2 7
主要现象是固体溶解、 、 ,
写出发生反应的化学方程式 。
(5)为了探究(NH ) Cr O 与Na S反应的氧化产物是否是SO 2-,设计如下方案。连接K,
4 2 2 7 2 4
观察到左烧杯中溶液由橙色逐渐变成绿色,电流计指针有明显偏转。实验完毕后,向右烧杯
滴加BaCl 溶液,产生白色沉淀。
2
(NH )Cr O
4 2 2 7
溶液
①图中负极的电极反应式为 (不考虑后续反应)。
②当实验过程转移的电子数为0.03N ,则消耗的氧化剂的物质的量为 mol。
A
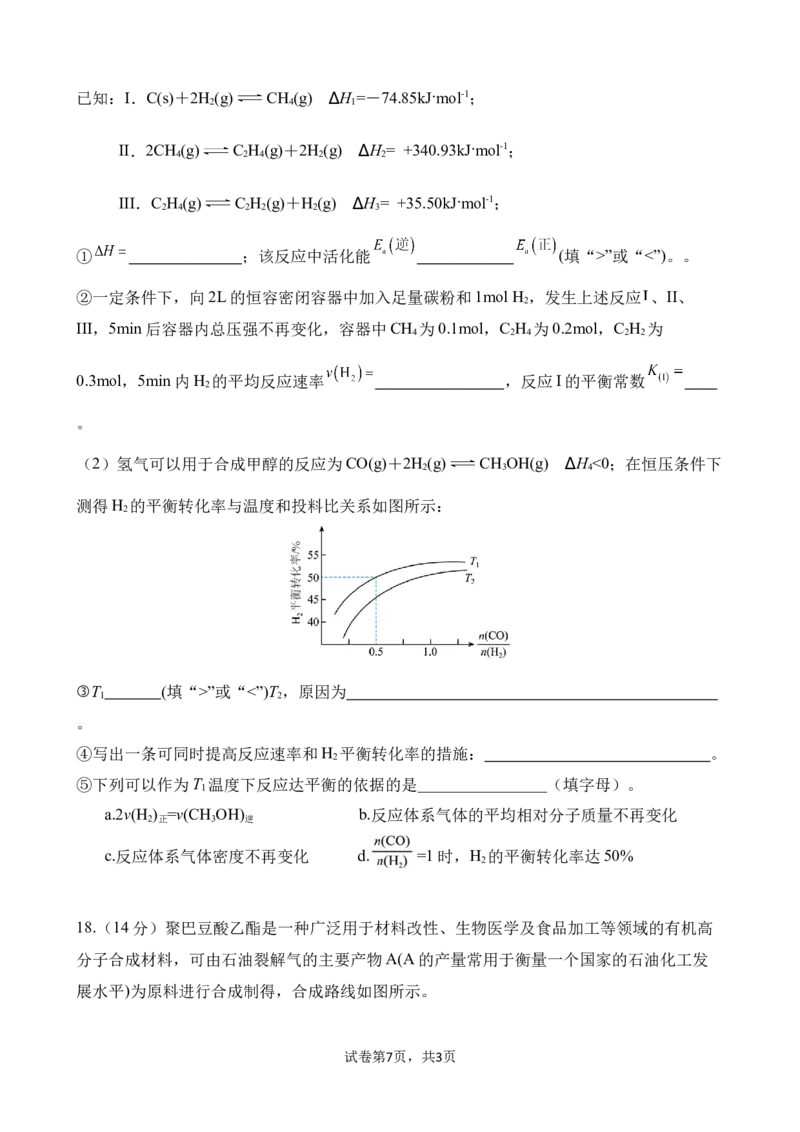
17.(16分)氢气是未来人类重点开发的能源之一,请回答下列问题:
(1)氢气在催化剂作用下制备乙炔,其总反应式为2C(s)+H (g) C H (g) ∆H
2 2 2
试卷第6页,共3页已知:I.C(s)+2H (g) CH (g) ∆H =-74.85kJ·mol-1;
2 4 1
II.2CH (g) C H (g)+2H (g) ∆H = +340.93kJ·mol-1;
4 2 4 2 2
III.C H (g) C H (g)+H (g) ∆H = +35.50kJ·mol-1;
2 4 2 2 2 3
① ;该反应中活化能 (填“>”或“<”)。。
②一定条件下,向2L的恒容密闭容器中加入足量碳粉和1mol H ,发生上述反应 、II、
2
III,5min后容器内总压强不再变化,容器中CH 为0.1mol,C H 为0.2mol,C H 为
4 2 4 2 2
0.3mol,5min内H 的平均反应速率 ,反应I的平衡常数
2
。
(2)氢气可以用于合成甲醇的反应为CO(g)+2H (g) CH OH(g) ∆H <0;在恒压条件下
2 3 4
测得H 的平衡转化率与温度和投料比关系如图所示:
2
③T (填“>”或“<”)T ,原因为
1 2
。
④写出一条可同时提高反应速率和H 平衡转化率的措施: 。
2
⑤下列可以作为T 温度下反应达平衡的依据的是________________(填字母)。
1
a.2v(H ) =v(CH OH) b.反应体系气体的平均相对分子质量不再变化
2 正 3 逆
c.反应体系气体密度不再变化 d. =1时,H 的平衡转化率达50%
2
18.(14分)聚巴豆酸乙酯是一种广泛用于材料改性、生物医学及食品加工等领域的有机高
分子合成材料,可由石油裂解气的主要产物A(A的产量常用于衡量一个国家的石油化工发
展水平)为原料进行合成制得,合成路线如图所示。
试卷第7页,共3页请回答下列有关问题:
(1)A的结构简式为 ,物质C的名称是 。
(2)化合物G中官能团的名称为 。
(3)有关E的说法正确的是 (填标号)。
a.能发生氧化、加成、加聚反应
b.E也可以与酸性高锰酸钾溶液反应得到F
c.E中4个碳原子一定共平面
(4)写出B与F反应生成G的化学方程式:
。
(5)绿色化学的核心内容之一是“原子经济性反应”,即反应物中的原子全部转化为目标
产物。反应①、②、③中符合“原子经济性反应”的是 (填序号)。
(6)G发生加聚反应生成高分子H,其结构简式为
试卷第8页,共3页