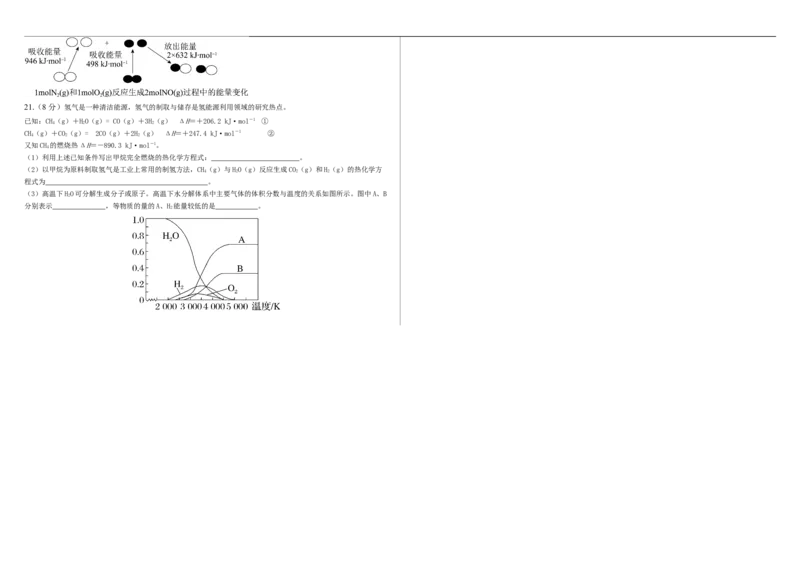
文档内容
育才高级中学高二上学期九月月考 A.化学反应速率既有正值,又有负值
化学试卷 B.测定某化学反应从开始到2 s末的反应速率,指的是2 s末的瞬时速率
考试时间:100分钟; C.对于同一化学反应,选用不同的物质表示化学反应速率时,其数值一定不同
注意事项:
D.不能用固体和纯液体表示化学反应速率
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上 7.1 g碳与适量水蒸气反应生成CO和H,需吸收10.94 kJ热量,此反应的热化学方程式为( )。
2
第I卷(选择题)
A.C+H O CO+H ΔH=131.28 kJ·mol-1
2 2
一、选择题(本题共16道小题,每小题3分,共48分
B.C(s)+H O(g) CO(g)+H(g) ΔH=10.94 kJ·mol-1
1.下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )。 2 2
C.C(s)+H O(l) CO(g)+H(g) ΔH=131.28 kJ·mol-1
A.Cu能与浓硝酸反应,而不与浓盐酸反应 2 2
D.C(s)+H O(g) CO(g)+H(g) ΔH=131.28 kJ·mol-1
B.Cu与浓硝酸反应比与稀硝酸反应快 2 2
8.反应 A(g)+3B(g) 2C(g)+2D(g),在四种不同情况下的反应速率分别为① v(A)=0.45 mol·L-1·s-1、② v(B)=0.6
C.N 与O 在常温、常压下不反应,放电时可反应
2 2
mol·L-1·s-1、③v(C)=0.4 mol·L-1·s-1、④v(D)=0.45 mol·L-1·s-1,该反应在四种不同情况下进行的快慢顺序为( )。
D.Cu与浓硫酸能反应,而不与稀硫酸反应
A.①>③=②>④ B.④>②=③>①
2.下列操作一定能加快相应化学反应速率的是( )
C.②>①=④>③ D.①>④>②=③
A.延长反应时间 B.增大容积 C.升高体系温度 D.增大浓度
9.反应A+B C(ΔH<0)分两步进行:①A+B X(ΔH>0),②X C(ΔH<0)。下列图像能正确表示该反应过程中的能量变
3.已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出b kJ热量,则下列表示乙炔燃烧的热化学方程
化的是( )。
式正确的是( )。
A.2C H(g)+5O(g) 4CO(g)+2HO(l) ΔH=+2b kJ·mol-1
2 2 2 2 2
5
2
B.C H(g)+ O (g) 2CO(g)+HO(l) ΔH=-2b kJ·mol-1
2 2 2 2 2
C.2C H(g)+5O(g) 4CO(g)+2HO(l) ΔH=-2b kJ·mol-1
2 2 2 2 2
D.2C H(g)+5O(g) 4CO(g)+2HO(l) ΔH=-b kJ·mol-1
2 2 2 2 2
4.下列关于盖斯定律的理解不正确的是( )。
A.不管化学反应是一步完成或分几步完成,其反应热是相同的
B.化学反应的反应热只与反应体系的始态和终态有关,与反应途径无关
C.可以直接测量任意反应的反应热
10.硫代硫酸钠溶液与稀硫酸反应的化学方程式为NaSO+H SO NaSO +SO↑+S↓+H O,下列各组实验中最先出现浑
2 2 3 2 4 2 4 2 2
D.可以用已经精确测定的反应的热效应来计算难以测量或无法测量的反应的热效应
浊的是( )。
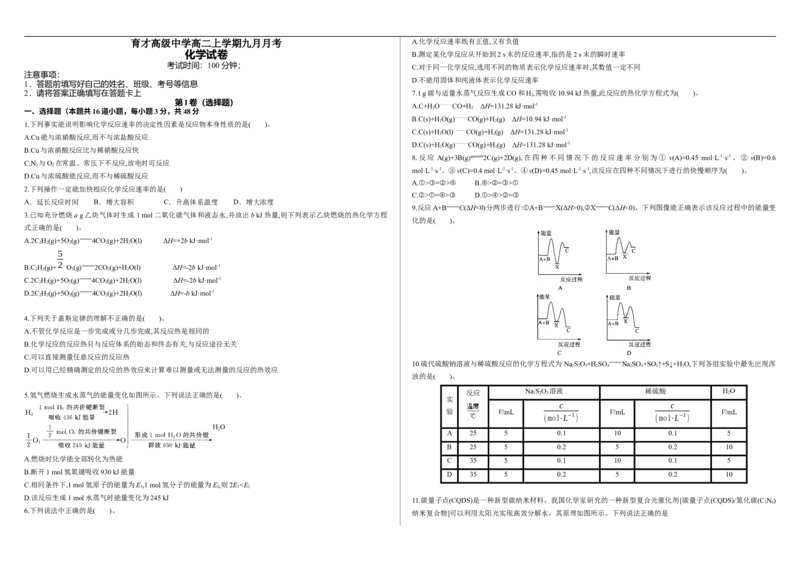
5.氢气燃烧生成水蒸气的能量变化如图所示。下列说法正确的是( )。 反应 Na 2 S 2 O 3 溶液 稀硫酸 H 2 O
实
c c
验 V/mL V/mL V/mL
(mol⋅L−1
)
(mol⋅L−1
)
HO
2
A 25 5 0.1 10 0.1 5
B 25 5 0.2 5 0.2 10
A.燃烧时化学能全部转化为热能 C 35 5 0.1 10 0.1 5
B.断开1 mol氢氧键吸收930 kJ能量
D 35 5 0.2 5 0.2 10
C.相同条件下,1 mol氢原子的能量为E,1 mol氢分子的能量为E,则2EN B.水分解过程中,HO 作催化剂
2 2
D.由该反应可推出凡是需要加热才能发生的反应均为吸热反应
C.两种纳米材料均属于共价化合物 D.若反应II是放热反应,则反应I一定是吸热反应
15.过渡态理论认为:化学反应不是通过反应物分子的简单碰撞完成的。在反应物分子生成产物分子的过程中,首先生成
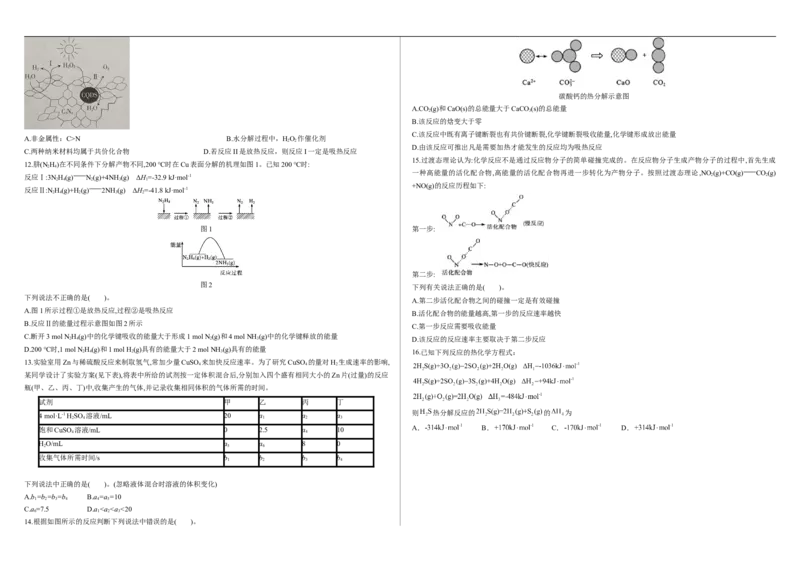
12.肼(N H)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图1。已知200 ℃时:
2 4
一种高能量的活化配合物,高能量的活化配合物再进一步转化为产物分子。按照过渡态理论,NO(g)+CO(g) CO(g)
反应Ⅰ:3N H(g) N(g)+4NH (g) ΔH=-32.9 kJ·mol-1 2 2
2 4 2 3 1
+NO(g)的反应历程如下:
反应Ⅱ:N H(g)+H(g) 2NH (g) ΔH=-41.8 kJ·mol-1
2 4 2 3 2
图1 第一步:
第二步:
图2
下列有关说法正确的是( )。
下列说法不正确的是( )。
A.第二步活化配合物之间的碰撞一定是有效碰撞
A.图1所示过程①是放热反应,过程②是吸热反应
B.活化配合物的能量越高,第一步的反应速率越快
B.反应Ⅱ的能量过程示意图如图2所示
C.第一步反应需要吸收能量
C.断开3 mol N H(g)中的化学键吸收的能量大于形成1 mol N (g)和4 mol NH (g)中的化学键释放的能量
2 4 2 3 D.该反应的反应速率主要取决于第二步反应
D.200 ℃时,1 mol NH(g)和1 mol H (g)具有的能量大于2 mol NH (g)具有的能量
2 4 2 3 16.已知下列反应的热化学方程式:
13.实验室用Zn与稀硫酸反应来制取氢气,常加少量CuSO 来加快反应速率。为了研究CuSO 的量对H 生成速率的影响,
4 4 2
某同学设计了实验方案(见下表),将表中所给的试剂按一定体积混合后,分别加入四个盛有相同大小的Zn片(过量)的反应
瓶(甲、乙、丙、丁)中,收集产生的气体,并记录收集相同体积的气体所需的时间。
试剂 甲 乙 丙 丁
则 热分解反应的 的 为
4 mol·L-1 H SO 溶液/mL 20 a a a
2 4 1 2 3
饱和CuSO 溶液/mL 0 2.5 a 10 A. B. C. D.
4 4
HO/mL a a 8 0
2 5 6
收集气体所需时间/s b b b b
1 2 3 4
下列说法中正确的是( )。(忽略液体混合时溶液的体积变化)
A.b=b =b =b B.a=a =10
1 2 3 4 4 5
C.a=7.5 D.a