文档内容
2024 届高三 5 月大联考(全国甲卷)
理综生物·全解全析及评分标准
阅卷注意事项:
1.阅卷前请各学科教研组长,组织本学科改卷老师开会,强调改卷纪律,统一标准。
2.请老师改卷前务必先做一遍试题,了解自己所改试题的答案、评分细则、答题角度后,再开始改卷。
3.请老师认真批阅,不可出现错改、漏改现象,如果不小心漏改或错改了,可以点击回评按钮重评。
4.成绩发布后,如果有学校反馈错评乱评,平台定位阅卷老师,进行通报批评。
5.根据学生答题的关键词,结合评分细则,意思相近或合理均给分。
6.阅卷平台出现的相关问题,如果刷新页面重新登录未能解决,请将问题反馈给学校负责技术的老师(或
考试负责人),由其统一在技术QQ群里反馈问题并协助解决。
1 2 3 4 5 6
A C B C B D
1.A 【解析】泛素属于多肽,其氮元素主要存在于“—CO—NH—”中,A错误;泛素属于多肽,可与双
缩脲试剂发生作用,产生紫色反应,B正确;错误折叠的蛋白质可能通过泛素标记途径降解,C正确;由
题干信息“待降解的蛋白质被泛素标记后,可以被蛋白酶识别,进而被降解成短肽”推知,泛素标记途
径可以调节蛋白质的种类和数量,D正确。
2.C 【解析】一次性施肥过多会导致土壤溶液浓度高于根细胞细胞液浓度,根细胞失水,水分子进出细胞
是被动运输,A正确;甘油属于脂溶性物质,可以通过自由扩散进入小肠绒毛上皮细胞,B正确;除主动
运输外,人体组织细胞还可以通过协助扩散的方式从内环境中吸收离子,如神经细胞可以通过协助扩散
的方式从内环境中吸收Na+,C错误;抗体是大分子,通过胞吞方式进入细胞,该过程需要消耗能量,D
正确。
3.B 【解析】动物在冬眠期呼吸频率下降,细胞呼吸会减弱,产热减少,体温下降,A 正确;动物体内,
调控体温的中枢位于下丘脑,调控呼吸活动的中枢位于脑干,B错误;冬眠期动物体内抗利尿激素浓度降
低,说明由下丘脑合成并由垂体释放抗利尿激素的活动减弱,C正确;在冬季,食物减少,温度较低,冬
眠有利于某些动物适应寒冷等不利条件,D正确。
4.C 【解析】科学家用荧光染料分别标记小鼠细胞表面的蛋白质和人细胞表面的蛋白质,将两种细胞融合,
证明了细胞膜具有流动性,该实验未利用同位素标记法,A错误;证明DNA的半保留复制实验运用了密
度梯度离心法,而不是差速离心法,B错误;常通过绘制种群数量增长曲线研究种群数量的变化规律,属
理科综合 全解全析及评分标准 第1页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}于建立数学模型,C正确;探究土壤微生物的分解作用实验中,实验组需进行处理,以排除土壤微生物的
作用,对照组不做处理,两组之间属于对照实验,该实验没有采用对比实验这一方法,D错误。
5.B 【解析】动物甲、动物乙的K 值均未知,无法判断t 前动物甲的种群数量是否多于动物乙,A错误;
1
t 前,K/N 在减小,动物乙的种群数量在增加,t 后,K/N 仍在减小,动物乙的种群数量仍然在增加,故
1 1
t 时动物乙的年龄结构为增长型,B正确;t 后动物甲的K/N仍然在减小,种群数量仍然在增加,C错误;
1 1
K表示环境容纳量,食物的多少、栖息空间的大小、气候等均会影响K值的大小,D错误。
6.D 【解析】由于这两对等位基因位于一对同源染色体上,所以这两对等位基因的遗传不遵循基因的自由
组合定律,A正确;母本的9号染色体上带有其他非同源染色体的片段,这属于染色体结构变异中的易
位,B正确;子代少量一定比例的有色淀粉质及无色蜡质的出现,说明亲代产生了基因型为AD和ad的
两种重组型配子,最可能的原因是母本在减数分裂时,含d的染色体片段和含D的染色体片段(或含A
的染色体片段和含a的染色体片段)发生了交叉互换,两种重组型配子与基因型为ad的雄配子结合,产
生了基因型为AaDd的有色淀粉质和基因型为aadd的无色蜡质,C正确、D错误。
29.(10分)
(1)类囊体薄膜(2分) 质子泵转运H+(2分) NADPH(或[H])的形成(2分)(后两个空
顺序可颠倒)
(2)①phyB(2分)
②除红光外,白光中的其他光质也能够调节叶绿素的含量(合理即可,2分)
【解析】(1)图中有水的光解、ATP的生成和NADPH(或[H])的合成过程,是光合作用的光反应过
程,光反应发生在叶绿体的类囊体薄膜上,因此图示生物膜为类囊体薄膜。ATP合酶的活动依赖于膜两
侧的H+浓度差,膜内侧因水的光解产生H+,通过质子泵向膜内转运H+导致膜内H+浓度高;而膜外因
H+参与合成NADPH被消耗,使膜外H+浓度降低。因此水的光解、质子泵转运H+以及NADPH的形成
共同维持了膜两侧的H+浓度梯度。
(2)①不论是在白光还是红光照射下,水稻野生型和phyA缺失突变体中的叶绿素含量差别不大,而phyB
缺失突变体水稻中叶绿素含量明显较野生型低。由此可知phyB基因在叶绿素合成中的调控作用更强。
②白光是复合光,四组水稻的叶绿素含量均表现为红光条件明显低于白光条件,原因可能是,除红光外,
白光中的其他光质也能够调节叶绿素的含量。
30.(10分)
(1)T(2分) 成年前(2分)
(2)抑制免疫系统攻击自身成分(合理即可,2分) 实验思路:将生理状态相同的健康雄性小鼠
随机均分为甲、乙两组,甲组注射适量的抗CD25+T细胞的抗体,乙组注射等量的生理盐水,在相同且
理科综合 全解全析及评分标准 第2页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}适宜的条件下培养,一段时间后,观察其是否患自身免疫病(3分)。预期实验结果:甲组小鼠出现自
身免疫病,乙组小鼠未出现自身免疫病(1分)。(其他答案合理也给分,共4分)
【解析】(1)胸腺是T细胞分化、发育、成熟的场所;实验1中的对照实验说明T细胞的成熟主要发
生在成年前。
(2)实验2说明,缺乏CD25+T细胞会导致自身免疫病的发生,因此可推测CD25+T细胞的功能为抑制
免疫系统攻击自身成分。由提供的实验材料分析,可通过对照实验来验证CD25+T细胞的功能,具体操
作为将生理状态相同的健康雄性小鼠随机均分为甲、乙两组,甲组注射适量的抗CD25+T细胞的抗体,
乙组注射等量的生理盐水,在相同且适宜的条件下培养,一段时间后,观察其是否患自身免疫病。由于
是验证性实验,所以结果是唯一的,即对照组不患自身免疫病,实验组患自身免疫病。
31.(9分)
(1)次生(1分) 栖息空间和食物条件(2分)
(2)促进生物在荒野之间扩散与基因交流,提高遗传多样性(合理即可,2分) 减少不同种群之间
的竞争,进而快速形成优势种群(合理即可,2分)
(3)可提高物种丰富度,使该生态系统中的食物链和食物网更复杂,生态系统的功能增强,抵抗外界
干扰的能力增强,有利于维持城市的生态平衡(合理即可,2分)
【解析】(1)城市植被再野化的过程是通过生态修复使生物群落呈现近荒野状态,该过程发生了群落
的次生演替,植物群落的再野化为动物关键种的引入提供了栖息空间和食物条件。
(2)从保护生物多样性方面分析,①过程连通荒野生境片段可以将碎片化的栖息地连起来,促进生物
在荒野之间扩散与基因交流,提高遗传多样性;②过程中,将不同种植物分别集群种植形成集群分布格
局,从种间关系角度分析,有利于减少不同种群之间的竞争,进而快速形成优势种群。
(3)从促进生态平衡角度分析,重建城市荒野生境可以提高物种丰富度,使该生态系统中的食物链和
食物网更复杂,生态系统的功能增强,抵抗外界干扰的能力增强,有利于维持城市的生态平衡。
32.(10分)
(1)碱基(对)的排列顺序不同(2分)
(2)b(2分) BbXDXD、BbXDXd(2分)
(3)实验思路:让该白毛雌性个体与子代中的黑毛(或黄毛)雄性个体杂交,观察后代的表现型(2分)。
预期实验结果:若后代只表现出黑毛和白毛,则该白毛雌性个体的基因型为 bbXDXD;若后代表现出黑
毛、白毛、黄毛三种颜色,则该白毛雌性个体的基因型为bbXDXd(2分)。(合理即可,共4分)
【解析】(1)基因D与d的根本区别是它们的碱基(对)的排列顺序不同。
(2)分析题表可知,子代中(黑毛+黄毛)∶白毛=1∶1,由于雄性是纯合的,所以亲本关于B、b的基
理科综合 全解全析及评分标准 第3页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}因型是雌性为Bb,雄性为bb,因此导致与毛色色素形成有关的酶失活的基因是b。由于D、d基因位于X
染色体上,与该动物毛色色素的合成有关,亲本雌性为黑毛,子代雄性出现黄毛,所以亲本雌性的基因
型中有BbXDXd,又由于亲本雄性为纯合白毛个体,子代雌性个体黑毛∶白毛=1∶1,所以,亲本雄性的基
因型为bbXDY。若亲本雌性只有一种基因型,则子代雄性中,黑毛∶黄毛=1∶1,而实验结果为黑毛∶
黄毛=3∶1,因此亲本雌性的基因型有两种:BbXDXD、BbXDXd,各占1/2。
(3)子代中白毛雌性个体的基因型为bbXDXD、bbXDXd,欲通过一次杂交实验确定某白毛雌性个体的基
因型,可让该白毛雌性个体与子代中的黑毛(或黄毛)雄性个体杂交,观察后代的表现型。若后代中只
表现出黑毛和白毛,则该白毛雌性个体的基因型为bbXDXD;若后代表现出黑毛、白毛、黄毛三种颜色,
则该白毛雌性个体的基因型为bbXDXd。
37.(15分)
(1)兼性厌氧(1分) 酵母菌具有以核膜为界限的细胞核(2分)
(2)平板划线法、稀释涂布平板法(2分) 培养基中营养物质浓度过高时,可能导致微生物渗透失
水,生长受抑制;浓度过低,则不能满足微生物生长的需要(合理即可,4分)
(3)提高温度(至30~35 ℃)(2分) 提供氧气(或通入无菌空气)(2分)(两空顺序可颠倒)
(4)凝胶色谱法(2分)
【解析】(1)从呼吸类型上分析,酵母菌是兼性厌氧型微生物。米醋发酵所用的微生物是醋酸菌,是原
核生物,酵母菌是真核生物。原核生物和真核生物在结构上的最大区别是,真核生物具有以核膜为界限
的细胞核。
(2)微生物接种时,常用的方法是平板划线法和稀释涂布平板法。纯化培养酵母菌时,培养基中营养
物质浓度过高,可能导致微生物渗透失水,对微生物的生长起抑制作用;浓度过低,则不能满足微生物
生长的需要,因此培养基中营养物质浓度过高或过低对微生物的生长均不利。
(3)米酒发酵时,主要利用的是酵母菌的无氧呼吸,发酵温度为18~25 ℃;米醋发酵时,利用的是醋
酸菌的有氧呼吸,发酵温度为30~35 ℃,因此利用米酒继续发酵酿制米醋,需要提高温度,还需要提供
氧气(或通入无菌空气)。
(4)根据相对分子质量的大小分离蛋白质的常用方法是凝胶色谱法。
38.(15分)
(1)DNA 双链复制(答“DNA 复制”或“DNA 半保留复制”均给分,2 分) 2(2 分) 两种引物
分别与nifH基因两条模板链上的一段碱基序列互补配对、引物自身或两种引物之间不存在碱基互补配对
序列(答出一点给1分,答全给3分,共3分)
(2)密码子具有简并性(2分)
理科综合 全解全析及评分标准 第4页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}(3)限制性核酸内切酶(限制酶)、DNA连接酶(2分) 不含氮(2分)
(4)减少氮肥的使用、降低生产成本、减少环境污染等(合理即可,答出一点给1分,共2分)
【解析】(1)科研人员采用了PCR技术快速扩增nifH基因,PCR(多聚酶链式反应)属于体外DNA复
制技术,其原理是 DNA 双链复制;该技术的反应体系中需要加入引物,引物的作用是与目的基因模板
链结合,故引物需要与目的基因两条模板链上的一段碱基互补配对,即需要2种引物;设计的两种引物
自身或两种引物之间不能存在碱基互补配对序列,以免发生错误的碱基互补配对。
(2)由于密码子具有简并性,所以克隆到的nifH基因与数据库中的nifH基因的编码序列即使有两个碱
基对不同,仍然可以编码出氨基酸序列相同的固氮酶。
(3)构建基因表达载体时,需要利用限制性核酸内切酶(限制酶)对目的基因和质粒分别切割,还需
要利用 DNA 连接酶对二者进行连接。欲从个体水平上进行鉴定,可将该微生物培养在不含氮的培养基
中,若能正常生长,则其具有固氮能力,若不能生长,则其不具有固氮能力。
(4)与没有转基因固氮根际微生物的水稻种植相比,有转基因固氮根际微生物的水稻种植的优点是,
有利于减少氮肥等化学肥料的使用,降低了生产成本,同时减少了环境污染。
理科综合 全解全析及评分标准 第5页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}理综化学·全解全析及评分标准
阅卷注意事项:
1.阅卷前请学科教研组长组织改卷老师开会,强调改卷纪律,统一标准。
2.请老师改卷前务必先做一遍试题,了解自己所改试题的答案、评分细则、答题角度后,再开始改卷。
3.请老师认真批阅,不可出现漏改、错改现象,如果不小心漏改或错改了,可以点击回评按钮重评。
4.成绩发布后,如果有学校反馈错评、乱评,平台定位阅卷老师,情况属实的将进行通报批评。
5.化学主观题若学生答出不同于所给参考答案和评分标准里的其他要点,且符合题目要求,均可灵活给分。
6.阅卷平台出现的相关问题,如果刷新页面重新登录未能解决,请将问题反馈给学校负责技术的老师(或
考试负责人),由其统一在技术QQ群里反馈问题并协助解决。
7 8 9 10 11 12 13
B D B A C C D
7.B 【解析】2CuCO ·Cu(OH) 中的Cu2+、CO2−、OH−均是常温下的稳定离子,均不易被氧化,A项正确;
3 2 3
“焚炼”过程中碳酸钙分解为氧化钙和二氧化碳,石灰未发生氧化还原反应,B 项错误;“相激火生”过程
中KNO 发生爆炸,发生了氧化还原反应,C项正确;柳絮的主要化学成分是纤维素,D项正确。
3
8.D 【解析】X的分子式为C H O ,A项错误;Y中的苯环与碳碳双键均可以与H 加成,故1 mol Y最
11 14 3 2
多能与4 mol H 发生加成反应,B项错误;X含有的官能团为羟基、酯基,C项错误;α−苯基丙烯酸分
2
子中的苯环、羧基均能发生取代反应,碳碳双键能发生氧化反应,D项正确。
9.B 【解析】Na O 和Na S的摩尔质量相等,均为78 g·mol−1,则39 g混合物的物质的量为0.5 mol,含
2 2 2
有1.5 mol离子,A项错误;162.5 g FeCl 的物质的量为1 mol,但是Fe(OH) 胶体粒子是集合体,所以
3 3
胶粒的数目小于FeCl 中Fe3+的数目,B项正确;异丁烯的结构简式为(CH ) C=CH ,0.5 mol异丁烯分
3 3 2 2
子中共用电子对(双键为2对)的数目为6N ,C项错误;NO和O 发生反应:O +2NO=2NO ,生
A 2 2 2
成的NO 又会发生反应:2NO N O ,体系中分子总数小于N ,D项错误。
2 2 2 4 A
10.A 【解析】AgBr转化为Ag S沉淀,能表明Ag S的溶解度比AgBr的更小,A项正确;NaClO溶液会
2 2
使pH试纸褪色,不能测出NaClO溶液的pH,B项错误;中和反应反应热测定实验需要酸碱尽快反应,
避免热量损失,而酸碱中和滴定实验需要酸碱缓慢反应,两个实验不能一起完成,C项错误;混合液冷
却后需要加入碱中和过量的酸,然后再加入银氨溶液,D项错误。
11.C 【解析】由题意可推知X为H,Y为O,Z为Na,W为Cl。O的非金属性在同主族元素中最强,简
单氢化物的稳定性最强,A项正确;Y与Z可能形成Na O、Na O ,Na O 中含有共价键和离子键,B
2 2 2 2 2
项正确;简单离子半径:Cl−>O2−>Na+>H+,C 项错误;X、Y 两种元素组成的含 18 电子的分子为
H O ,能与酸性高锰酸钾溶液反应使之褪色,D项正确。
2 2
理科综合 全解全析及评分标准 第6页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}12.C 【解析】两种不同介质条件下,电子移动的方向均为由 M电极到N电极,故 M 电极为负极,N 电
极为正极,N电极的电势均高于M电极,A项错误;图1中负极反应式为H −2e−=2H+,图2中负
2
极反应式为H +O2−− 2e−=H O,B项错误;该电池用于金属表面镀银时,镀件为阴极,与电池的负
2 2
极相连,即M电极连接镀件,C项正确;当有6 mol电子发生转移时,理论上消耗氨气2 mol,但未指
明气体是否处于标准状况,无法计算气体体积,D项错误。
13.D 【解析】b点时加入50 mL NaOH溶液,产物为NaH PO ,c点时加入100 mL NaOH溶液,产物为
2 4
Na HPO ,溶液pH为9.5左右,呈碱性,指示滴定至c点时,可使用酚酞作指示剂,A项正确;由图
2 4
可知,NaH PO 溶液显酸性,H PO−的电离程度大于其水解程度,故b点溶液中由水电离出的c(H+)<
2 4
2 4
1.0×10−7 mol·L−1,B项正确;V(NaOH)=25.00 mL时,溶质的组成为等物质的量的H PO 与NaH PO ,
3 4 2 4
HPO2−主要来源于H PO−的电离,是微弱的,故溶液中 c(H PO )>c(HPO2−),C 项正确;c 点溶质为
3 4
4 2 4 4
Na HPO ,存在质子守恒:c(H PO−)+2c(H PO )+c(H+)=c(OH−)+c(PO3−),元素守恒:c(Na+)= 2c(PO3−)+
2 4 3 4
2 4 4 4
2c( HPO2− )+ 2c( H PO− )+2c(H PO ),两式联立后得到:c(Na+)+c(OH−)=c( PO3− )+ 2c( HPO2− )+
3 4
4 2 4 4 4
3c(H PO−)+4c(H
3
PO
4
)+ c(H+),已知c点溶液呈碱性,c(H+)≠ c(OH−),D项错误。
2 4
26.(14分)
(1)球形冷凝管(1分) 浓硫酸;防止NaOH溶液中的水进入反应器中(2分,试剂1分,作用1
分,答案合理即可)
(2)Cu O+2CH COOH=2CH COOCu+H O(2分) 吸收水分,提供反应物(2分,写出1点给
2 3 3 2
1分,答案合理即可)
(3)反应过程中有H 逸出,H 遇明火易爆炸(2分,答案合理即可)
2 2
(4)真空干燥(1分,答“干燥”也给分,答案合理即可)
12.3abV
(5)① 1 (2分,或其他合理书写形式) ②AD(2分,1个1分,多选或错选不得分)
mV
2
【解析】(1)仪器c的名称是球形冷凝管;由题干信息知,CH COOCu易水解,因此仪器d中的试剂是
3
浓硫酸,作用是防止NaOH溶液中的水进入反应器中。
(2)Cu O和冰醋酸反应的化学方程式为Cu O+2CH COOH=2CH COOCu+H O。醋酸酐和水反应生
2 2 3 3 2
成醋酸,一方面吸收水分防止CH COOCu水解,另一方面生成反应物CH COOH。
3 3
(3)制备过程不可选用明火直接加热,原因是反应过程中有H 逸出,H 遇明火可能发生爆炸,因此应
2 2
避免与明火接触。
(4)已知醋酸亚铜固体遇空气易水解或被氧化,因此需要真空干燥,最终得到醋酸亚铜固体。
理科综合 全解全析及评分标准 第7页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}(5)①根据 CH COOCu+Fe3+=Cu2++Fe2++CH COO−,Fe2++Ce4+=Fe3++Ce3+,可得到关系式:
3 3
CH COOCu~Fe2+~Ce4+~Ce(SO ) ,则V mL待测液中所含CH COOCu的物质的量为(ab×10−3)mol,
3 4 2 2 3
V V
则 V mL 待测液中所含 CH COOCu的物质的量为( 1 ×ab×10−3) mol,质量为( 1 ×ab×10−3) mol×
1 3
V V
2 2
0.123abV
1 g
0.123abV V 12.3abV
123 g·mol−1= 1 g,因此产品中CH COOCu的质量分数为 2 ×100%= 1 %。
3
V m g mV
2 2
②未用标准溶液润洗滴定管,会使消耗的标准溶液体积偏大,使测定结果偏高,A项错误;滴定时需
要适当控制滴定速度,使反应充分进行,B项正确;当滴定接近终点时,用锥形瓶内壁将半滴标准液刮
落,并用蒸馏水冲洗内壁,可减小实验误差,提高滴定的准确度,C项正确;滴定前滴定管尖嘴部分有
气泡,滴定后无气泡,会使读得的消耗标准溶液的体积偏大,使测定结果偏高,D项错误。
27.(15分)
(1)粉碎天青石矿或适当增大Na CO 溶液的浓度、适当升高温度、搅拌等(1分,答案合理即可)
2 3
SrSO
4
(s)+CO
3
2−(aq) S rCO
3
(s)+SO2
4
−(aq)或SrSO
4
+CO
3
2− S rCO
3
+SO2
4
−(2分)
(2)2Fe2+ + H O +2H+=2Fe3+ +2H O(2分)
2 2 2
(3)5.2≤pH<6.0(2分) 1×10−8.3(2分)
(4)升高温度使Ca(OH) 溶解度降低,有利于除尽Ca2+(2分,答案合理即可)
2
(5)Sr2+ +HCO−+ NH ·H O=SrCO ↓ +H O +NH+(2分,漏写“↓”不扣分)
3 3 2 3 2 4
(6)过滤、洗涤、干燥(2分)
【解析】(1)粉碎天青石矿或适当增大 Na CO 溶液的浓度、适当升高温度、搅拌等均能提高浸取率。
2 3
由已知信息①可知,SrSO 可转化为 SrCO ,而最终目的也是制备 SrCO ,所以加 Na CO 溶液的目的
4 3 3 2 3
是将SrSO
4
转化为SrCO
3
,反应的离子方程式为SrSO
4
(s)+CO2−(aq) S rCO
3
(s)+SO2−(aq)。
3 4
(2)“酸浸”时,加入H O 使Fe2+转化为Fe3+,以便后续步骤中除去杂质铁,反应的离子方程式为2Fe2+
2 2
+ H O +2H+=2Fe3+ +2H O。
2 2 2
(3)“第一次调pH”目的是除去Fe3+和Al3+,根据表格数据知,pH≥6.0时Zn2+会沉淀,pH≥7.8时Al(OH)
3
会溶解,所以调节pH范围为5.2≤pH<6.0。Al3+刚好完全沉淀时溶液中c(OH−)=1×10−8.8 mol·L−1,Fe3+刚
好完全沉淀时溶液中c(OH−)=1×10−9.9 mol·L−1,则K sp[Fe(OH)
3
]=1×10−5×(1×10−9.9)3= 1×10−34.7,所以Al3+
K [Fe(OH) ] 1×10−34.7
刚好完全沉淀时,溶液中c(Fe3+)= sp 3 = mol·L−1=1×10−8.3 mol·L−1。
c3(OH−) (1×10−8.8)3
(4)Ca(OH) 的溶解度随温度的升高而降低,水浴加热可使 Ca2+沉淀更充分,且趁热过滤可减少 Ca2+
2
理科综合 全解全析及评分标准 第8页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}在溶液中的残留。
(5)根据题干信息可知,“沉锶”时,主要反应的离子方程式为Sr2+ +HCO−+ NH ·H O=SrCO ↓ +H O
3 3 2 3 2
+NH+。
4
(6)“沉锶”步骤中已经得到产品碳酸锶且为固体,所以后续“系列操作”为过滤、洗涤、干燥。
28.(14分)
(1)CH OH(g)+CuAl O (s)+CuO(s)=2CuAlO (s)+CO (g)+2H (g) ΔH= +(49+Q) kJ·mol−1(2分,方
3 2 4 2 2 2
程式正确得1分,ΔH正确得1分)
(2)>(2分)
443×12
(3)①60%或0.6(2分) ② 或31944(2分)
4×8
③减小(1 分) 未通入 N 相当于增大压强,该反应为反应前后气体分子数增大的反应,增大反应
2
体系的压强,不利于反应正向进行,因此H O的平衡转化率减小(2分,答案合理即可)
2
(4)阳极(1分) ⅱ(1分) ⅲ(1分)
【解析】(1)总反应为CH
3
OH(g)+H
2
O(g) C O
2
(g)+3H
2
(g) ΔH=+49 kJ·mol−1,反应Ⅰ的热化学方程式
为2CuAlO (s)+H O(g)=CuAl O (s)+CuO(s)+H (g) ΔH=−Q kJ·mol−1,总反应−反应Ⅰ=反应Ⅱ,则反应Ⅱ
2 2 2 4 2
的热化学方程式为CH OH(g)+CuAl O (s)+CuO(s)=2CuAlO (s)+CO (g)+2H (g) ΔH=+(49+Q) kJ·mol−1。
3 2 4 2 2 2
(2)根据图示可知,b催化剂作用下反应的速率常数较大,说明该条件下反应的活化能低,因此正反应
活化能的大小为E(a)>E(b)。
(3)达平衡时容器内的压强为132 kPa,CO 分压为12 kPa,副反应为反应前后气体分子数不变的反应,
2
故压强变化量是主反应造成的。初始时容器中各物质的分压分别为p(CH OH)=p(H O)=20 kPa,p(N ) =
3 2 2
60 kPa。
根据反应列守恒:
主反应: CH
3
OH(g)+H
2
O(g) C O
2
(g)+3H
2
(g) 化学计量数差值=2
压强变化/kPa 16 16 16 48 32
平衡时CO 的分压为12 kPa,则副反应转化的CO 的分压为4 kPa。
2 2
副反应: CO
2
(g)+H
2
(g) C O(g)+H
2
O(g)
压强变化/kPa 4 4 4 4
12 kPa
①平衡时,转化的H O的分压为16 kPa−4 kPa=12 kPa,因此H O的平衡转化率为 ×100%=60%。
2 2
20 kPa
②平衡时,各物质的分压分别为p(CH OH)=4 kPa,p(H O)=8 kPa,p(CO )=12 kPa,p(H )=44 kPa,则用
3 2 2 2
理科综合 全解全析及评分标准 第9页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}443×12
分压表示甲醇制氢反应的平衡常数K = kPa2。
p
4×8
③若初始时容器中未通入N ,n(CH OH)∶n(H O)=1∶1,初始压强仍为100 kPa,相当于增大压强,甲
2 3 2
醇制氢反应的平衡向逆反应方向移动,则H O的平衡转化率减小。
2
(4)电氧化过程中甲醇失电子,应在阳极发生氧化反应;由表可知,催化剂ⅱ存在下,反应①决速步的
活化能最小,故三种催化剂中对反应①的催化活性最强的是ⅱ;催化剂ⅰ对反应②的选择性高,催化剂ⅱ
对反应①的选择性高,催化剂ⅲ对两个反应的催化效果相当,对反应①和反应②的选择性都比较低。
35.(15分)
(1)5s25p2(1分) 12(1分) 0(1分) O>S>Zn或O、S、Zn(1分)
(2)sp2、sp3(2分,写出1个给1分) B(1分)
(3)F>N>O或F、N、O(2分) 同周期主族元素从左到右第一电离能呈增大趋势,而N原子的价
层电子2p轨道是较稳定的半充满结构,较难失电子,所以第一电离能:F> N> O(2分,答案合理即可)
(4)①Cs LiYCl (2分,元素顺序不作要求)
2 6
1
×(2×133+7+89+35.5×6)
② 2 (2分,其他书写形式正确也给分)
N ×(a×10−7)3
A
【解析】(1)Sn 是主族元素,位于第五周期第ⅣA 族,主族元素的价层电子为最外层电子,即基态 Sn
原子的价层电子排布式为 5s25p2。核外电子空间运动状态种类数=该原子核外电子所占原子轨道数,基
态Ti原子核外电子排布式为1s22s22p63s23p63d24s2,其电子总共占据1+1+3+1+3+2+1=12个轨道,所以
核外电子有12种空间运动状态。Zn2+核外电子排布式为1s22s22p63s23p63d10,没有未成对电子。非金属
性越强电负性越大,故Zn、S、O三种元素的电负性由大到小的顺序为O>S>Zn。
(2)图1结构中苯环及 上C原子为sp2杂化, 上C原子为sp3杂化。基态B原子的价
层电子排布式为2s22p1,杂化后,2p能级有1个空轨道,可接受电子形成配位键。
(3)同周期主族元素从左到右第一电离能呈增大趋势,基态N原子的价层电子排布式为 2s22p3,2p轨
道电子是较稳定的半充满结构,较难失电子,所以第一电离能:F> N> O。
1
(4)①根据均摊法,此晶胞中 Cs+位于体心,有 1 个,Li+和 Y3+各位于四个顶点,都只有 个,Cl−位
2
于棱上,有 3 个,晶胞中离子个数比为 Cs+∶Li+∶Y3+∶Cl−=2∶1∶1∶6,所以该晶体的化学式为
1
×(2×133+7+89+35.5×6)
1
Cs LiYCl 。②此晶胞中只含 个Cs LiYCl ,故该晶体密度为 2 g·cm−3。
2 6 2 2 6 N ×(a×10−7)3
A
36.(15分)
(1)苯甲酸(2分) C H O S (1分,答案合理即可)
7 6 8 2
理科综合 全解全析及评分标准 第10页(共18页)
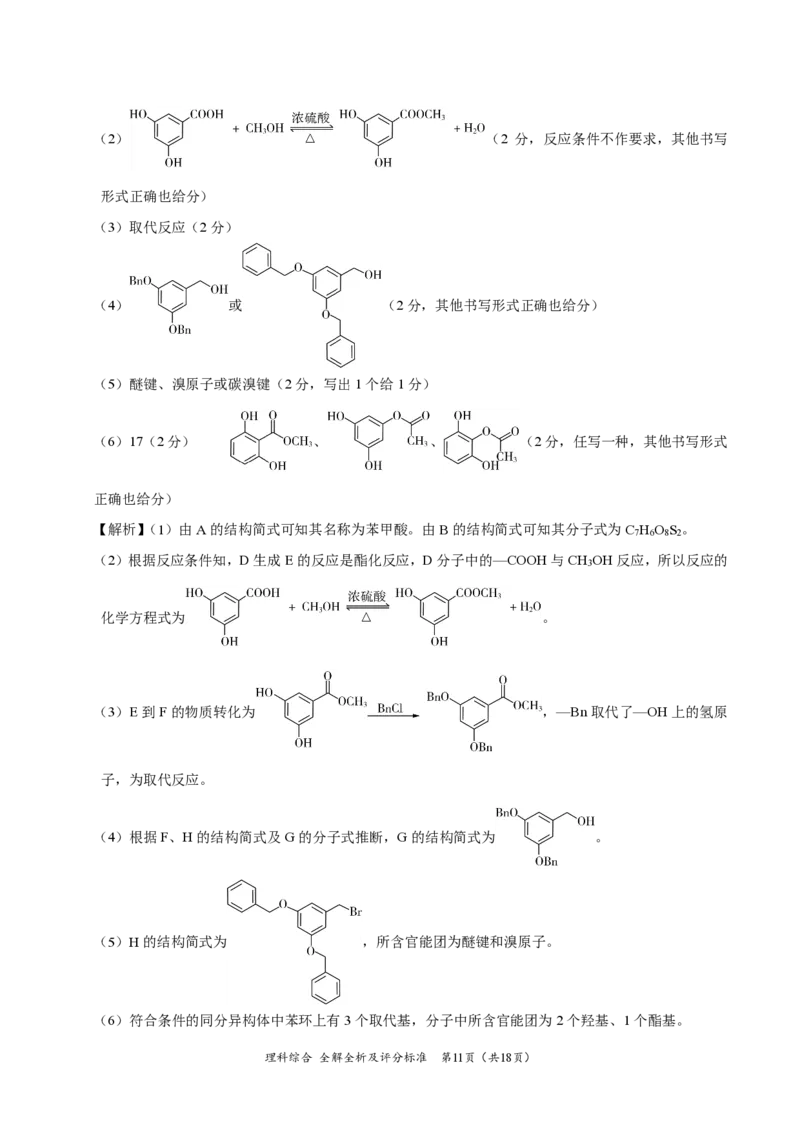
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}(2) (2 分,反应条件不作要求,其他书写
形式正确也给分)
(3)取代反应(2分)
(4) 或 (2分,其他书写形式正确也给分)
(5)醚键、溴原子或碳溴键(2分,写出1个给1分)
(6)17(2分) 、 、 (2分,任写一种,其他书写形式
正确也给分)
【解析】(1)由A的结构简式可知其名称为苯甲酸。由B的结构简式可知其分子式为C H O S 。
7 6 8 2
(2)根据反应条件知,D生成E的反应是酯化反应,D分子中的—COOH与CH OH反应,所以反应的
3
化学方程式为 。
(3)E到F的物质转化为 ,—Bn取代了—OH上的氢原
子,为取代反应。
(4)根据F、H的结构简式及G的分子式推断,G的结构简式为 。
(5)H的结构简式为 ,所含官能团为醚键和溴原子。
(6)符合条件的同分异构体中苯环上有3个取代基,分子中所含官能团为2个羟基、1个酯基。
理科综合 全解全析及评分标准 第11页(共18页)
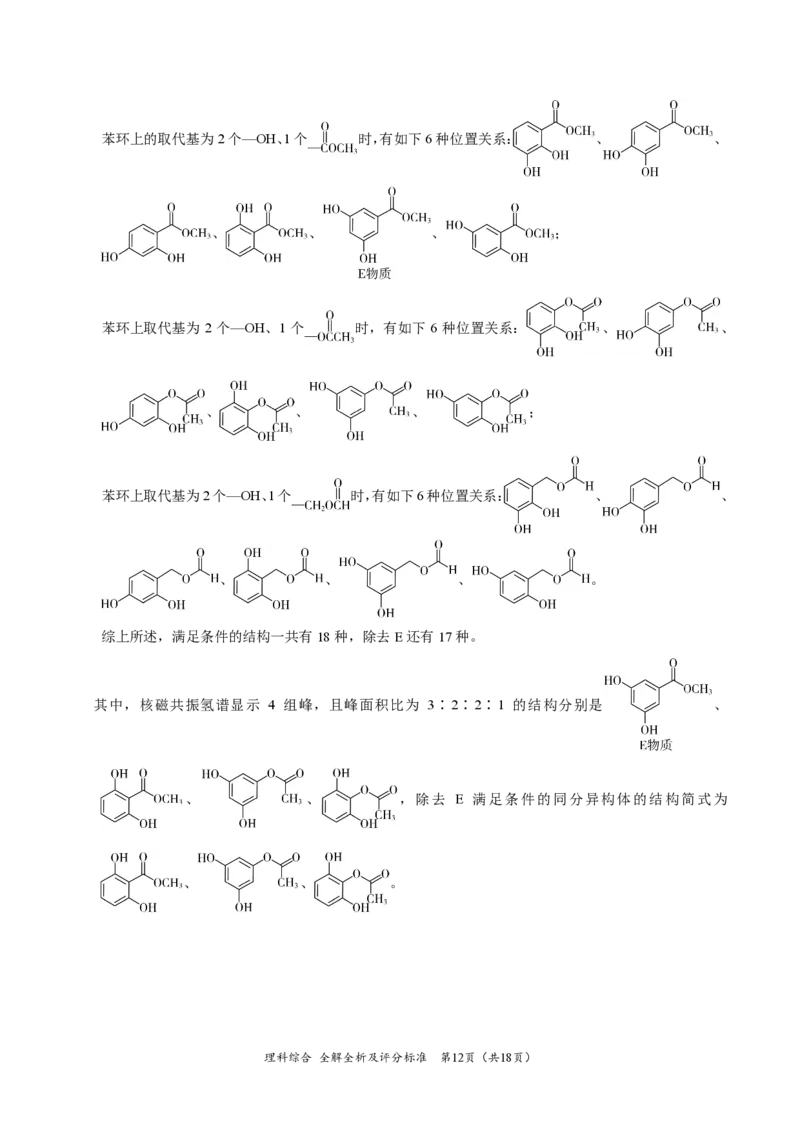
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}苯环上的取代基为2个—OH、1个 时,有如下6种位置关系: 、 、
、 、 、 ;
苯环上取代基为 2 个—OH、1 个 时,有如下 6 种位置关系: 、 、
、 、 、 ;
苯环上取代基为2个—OH、1个 时,有如下6种位置关系: 、 、
、 、 、 。
综上所述,满足条件的结构一共有18种,除去E还有17种。
其中,核磁共振氢谱显示 4 组峰,且峰面积比为 3∶2∶2∶1 的结构分别是 、
、 、 ,除去 E 满足条件的同分异构体的结构简式为
、 、 。
理科综合 全解全析及评分标准 第12页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}理综物理·全解全析及评分标准
阅卷注意事项:
1.阅卷前请各学科教研组长,组织本学科改卷老师开会,强调改卷纪律,统一标准。
2.请老师改卷前务必先做一遍试题,了解自己所改试题的答案、评分细则、答题角度后,再开始改卷。
3.请老师认真批阅,不可出现错改、漏改现象,如果不小心漏改或错改了,可以点击回评按钮重评。
4.成绩发布后,如果有学校反馈错评乱评,平台定位阅卷老师,进行通报批评。
5.要在学生列出的公式中找寻有用公式,合理即可按公式给分。
6.不要只看结果,结果正确,但中间公式无法建立有效衔接的,不能给满分;同样,结果错误,但正确列
出的公式应给分,因第(1)问中结果算错,使后面最终结果出错(过程列式正确),不宜重复扣分。
7.阅卷平台出现的相关问题,如果刷新页面重新登录未能解决,请将问题反馈给学校负责技术的老师(或
考试负责人),由其统一在技术QQ群里反馈问题并协助解决。
14 15 16 17 18 19 20 21
C C D C B AC AD ACD
1
14.C 【解析】由衰变方程知,238Pu的衰变属于α衰变,A错误;43.85年是 个半衰期,则未发生衰变
94 2
1 0.5 2 3 1
的Pu原子核的质量m=m = m < m ,则有超过 的238Pu发生了衰变,B错误;由爱因斯
0 2 2 0 4 0 4 94
坦质能方程可知,一次衰变中释放出的能量为∆E=∆mc2 =(m −m −m )c2,C 正确;238Pu能自发衰
1 2 3 94
变为234U,说明238Pu比234U更加不稳定,238Pu的比结合能比234U小,D错误。
92 94 92 94 92
15.C 【解析】设t=0时前车速度为v ,两车距离d =80 m,若前车在加速运动,两车距离不可能先增加后
0 0
1
减小,所以前车一定在减速运动,设前车加速度大小为a,经时间t,两车距离 d =d +v t− at2 −ut 。
0 0
2
1
把t=1 s代入,得 23=v − a 。把t=2 s代入,得 22=v −a 。两式联立,可得 v =24 m/s , a=2 m/s2,
0 0 0
2
A错误,C正确;设经过时间t 1 ,两车速度相等,u=v −at ,得t 1 =2 s,B错误;把t=4 s代入,可得
0 1
此时两车距离d=80 m,D错误。
16.D 【解析】三颗天链卫星都是地球同步卫星,运行轨道都相同且运行速度大小相等,并相对地面静止,
而“天宫”空间站相对地面运动,则三颗天链卫星与“天宫”空间站不是相对静止,A、B错误;地球半径
未知,不能根据题中条件算出地球的密度,C错误;天链卫星与“天宫”空间站都绕地球运行,由开普勒
第三定律知,D正确。
17.C 【解析】汽车螺旋上坡时,受到牵引力、重力、弹力、摩擦力,而向心力是效果力,A 错误;桥梁
设计成“外高内低”的目的是让重力的分力提供向心力,减小所需的静摩擦力,B错误;螺旋上升的桥梁
设计,可以减小坡度,减小重力沿桥面的分力,保证车辆行驶安全,C正确;车辆沿“外高内低”的路面
理科综合 全解全析及评分标准 第13页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}螺旋运动,且不改变运动半径,当增加速率时,向心力一定变大,但摩擦力大小不一定变大,D错误。
18.B 【解析】金属棒在磁场中做匀加速直线运动,设金属棒在磁场中某位置的速度为v,则回路中的电流
I =
E
=
BLv
,由牛顿第二定律有mg−BIL=ma,
B2L2v
=mg−ma ,即vL2 =c (定值)。设金属棒刚进
R R R
入磁场时的速度大小为v
0
,金属棒在磁场中的位移设为x,则 L2 v2 +2ax =c ,即 x=
c2
−
v
0
2
。对x
0 2aL4 2a
关于L进行求导,有 x′=− 2c2 ⋅ 1 ,由此可知,随着L的减小,x的变化越来越快,B正确。
a L5
19.AC【解析】在返回舱拉着减速伞以收尾速度匀速下降过程,整体受力平衡,有(m+M)g− f =0,可
2(m+M)g
Mg
得 v= ,A正确;对返回舱有Mg−NFcosα=0,可得 F = ,B错误;减速伞和返
CρS Ncosα
回舱的总质量越大,匀速运动时减速伞所受阻力越大,收尾速度 v 越大,C 正确;减速伞迎风面积 S
变大,其他数据不变,收尾速度v变小,D错误。
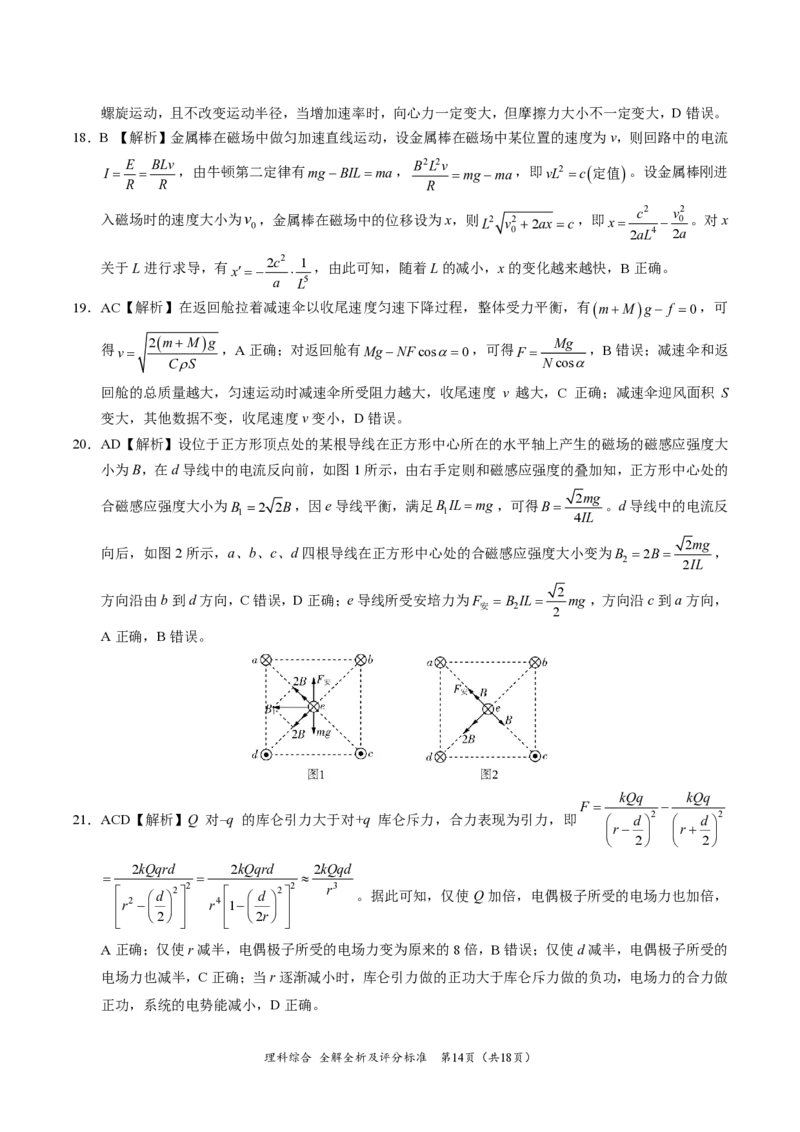
20.AD【解析】设位于正方形顶点处的某根导线在正方形中心所在的水平轴上产生的磁场的磁感应强度大
小为B,在d导线中的电流反向前,如图1所示,由右手定则和磁感应强度的叠加知,正方形中心处的
2mg
合磁感应强度大小为B =2 2B,因e导线平衡,满足BIL=mg,可得B= 。d导线中的电流反
1 1 4IL
2mg
向后,如图2所示,a、b、c、d四根导线在正方形中心处的合磁感应强度大小变为B =2B= ,
2
2IL
2
方向沿由b到d方向,C错误,D正确;e导线所受安培力为F = B IL= mg ,方向沿c到a方向,
安 2
2
A正确,B错误。
kQq kQq
F = −
21.ACD【解析】Q 对–q 的库仑引力大于对+q 库仑斥力,合力表现为引力,即 d 2 d 2
r− r+
2 2
2kQqrd 2kQqrd 2kQqd
= = ≈
d 2
2
d 2
2 r3
。据此可知,仅使 Q 加倍,电偶极子所受的电场力也加倍,
r2 − r41−
2 2r
A正确;仅使r减半,电偶极子所受的电场力变为原来的8倍,B错误;仅使d减半,电偶极子所受的
电场力也减半,C正确;当r逐渐减小时,库仑引力做的正功大于库仑斥力做的负功,电场力的合力做
正功,系统的电势能减小,D正确。
理科综合 全解全析及评分标准 第14页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}22.(1)0.20(0.2 也正确,2 分) (2)9.65(2 分) (3)空气阻力的影响(时间测量不准等,合理
即可,2分)
t −t
【解析】(1)从第1滴滴下到第21滴滴下共有20个时间间隔,则相邻两滴滴下的间隔T = 2 1 =0.20 s。
20
(2)相邻三个液滴的中心位置对应的读数分别为h
1
=0.211 m、h
2
=0.805 m、h
3
=1.785 m,由∆h=gT2,
h −2h +h
其中∆h=(h −h )−(h −h ),可得g = 3 2 1 =9.65 m/s2。
3 2 2 1 T2
(3)测得的重力加速度小于当地的真实值,产生误差的原因有空气阻力的影响、时间测量不准等。
23.(1)V (1分) (2)电流表(1分) (3)2.90(2分) 1.8(2分) (4)42(2分) (5)
1
无误差(1分)
【解析】(1)待测电池组电动势约为3 V,电压表V 量程0~15 V,量程过大,电压表V 的量程0~3 V,
2 1
量程合适,电压表应选择V 。
1
(2)当电阻丝接入电路的阻值过小时,若无保护电阻,通过电流表的电流会超出其量程。所以保护电
阻R 的作用是防止通过电流表的电流过大。
0
(3)对整个回路,由闭合电路欧姆定律有U =E−I(r+R ),U −I 图像纵轴截距为电动势的测量值,
A
可知E=2.90 V,斜率绝对值k =r+R ,可得r=k−R =1.8 Ω。
A A
U U
(4)设电阻丝接入电路的长度为L时,电阻值 R=λL ,由欧姆定律可知 R+R = ,整理得 =R +λL ,
0 0
I I
U
可知 −L 图像的斜率即为所求的λ,由图可知λ=42 Ω/m。
I
(5)把电流表和电池组视为等效电源,电流表示数是等效电源的准确电流,电压表示数是等效电源准
确的路端电压,测得的电池组的电动势是等效电源的电动势,而等效电源的电动势等于电源的电动势。
若考虑电压表的内阻,测得的电池组的电动势相比实际值无误差。
1
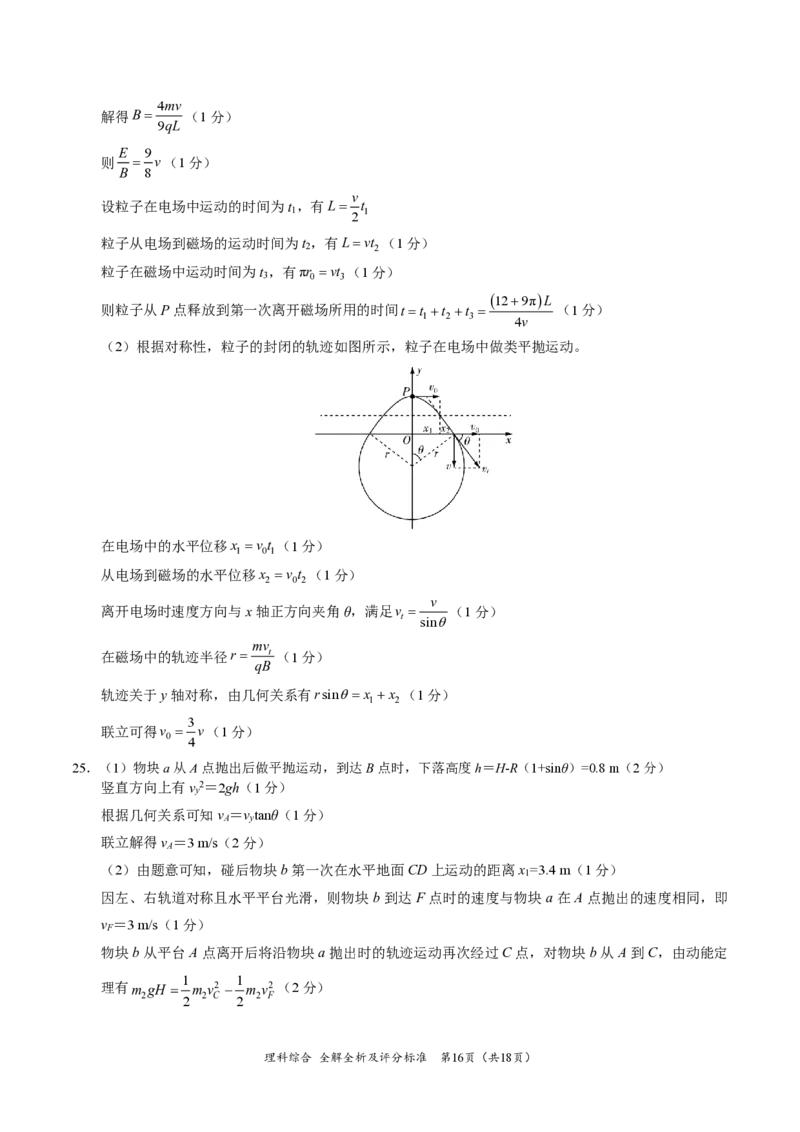
24.(1)粒子在电场中做加速运动,由动能定理有 qEL= mv2 −0 (1分)
2
mv2
解得E = (1分)
2qL
粒子在磁场中做圆周运动的轨迹如图所示,设轨迹半径为r 。
0
v2
由牛顿第二定律,有qvB=m (1分)
r
0
又有2r =4.5L
0
理科综合 全解全析及评分标准 第15页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}4mv
解得B= (1分)
9qL
E 9
则 = v(1分)
B 8
v
设粒子在电场中运动的时间为t ,有L= t
1 1
2
粒子从电场到磁场的运动时间为t ,有L=vt (1分)
2 2
粒子在磁场中运动时间为t ,有πr =vt (1分)
3 0 3
(12+9π)L
则粒子从P点释放到第一次离开磁场所用的时间t =t +t +t = (1分)
1 2 3
4v
(2)根据对称性,粒子的封闭的轨迹如图所示,粒子在电场中做类平抛运动。
在电场中的水平位移x =v t (1分)
1 01
从电场到磁场的水平位移x =v t (1分)
2 0 2
v
离开电场时速度方向与x轴正方向夹角θ,满足v = (1分)
t sinθ
mv
在磁场中的轨迹半径r = t (1分)
qB
轨迹关于y轴对称,由几何关系有rsinθ=x +x (1分)
1 2
3
联立可得v = v(1分)
0
4
25.(1)物块a从A点抛出后做平抛运动,到达B点时,下落高度h=H-R(1+sinθ)=0.8 m(2分)
竖直方向上有v 2=2gh(1分)
y
根据几何关系可知v =v tanθ(1分)
A y
联立解得v =3 m/s(2分)
A
(2)由题意可知,碰后物块b第一次在水平地面CD上运动的距离x =3.4 m(1分)
1
因左、右轨道对称且水平平台光滑,则物块b到达F点时的速度与物块a在A点抛出的速度相同,即
v =3 m/s(1分)
F
物块b从平台A点离开后将沿物块a抛出时的轨迹运动再次经过C点,对物块b从A到C,由动能定
1 1
理有m gH = m v2 − m v2 (2分)
2 2 C 2 F
2 2
理科综合 全解全析及评分标准 第16页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}1
对物块b再次经过C点至停止运动,由动能定理有−µm gx =0− m v2 (2分)
2 2 2 C
2
解得x 3.27 m<3.4 m
2
则整个过 ≈ 程中物块b在水平地面CD上运动的总路程x=x 1 +x 2 =6.67 m(1分)
(3)由对称性知,碰后物块b经过D点的速度v =v =7 m/s(1分)
D C
设物块b碰后的速度大小为v ,对物块b第一次在CD上的运动过程,由动能定理有
2
1 1
−µm gL= m v2 − m v2
2
2
2 D
2
2 2(1分)
解得 v =10 m/s
2
在C点,物块a、b发生弹性碰撞,设碰后物块a的速度大小为v ,由动量守恒定律和能量守恒定律分
1
别有mv =mv +m v (1分)
1 C 1 1 2 2
1 1 1
mv2 = mv2 + m v2(1分)
1 C 1 1 2 2
2 2 2
联立可得 m :m =5:2 (1分)
1 2
33.(1)ACD(5分) 【解析】附着层内分子间的距离小于液体内部分子间的距离,分子间表现斥力,液
体与固体之间表现为浸润,A正确;温度升高,饱和汽压增大,空气中水蒸气总量不变,空气相对湿
度降低,B错误;空气中PM2.5的运动是由于空气分子无规则运动对它频繁地碰撞所引起的,C正确;
密封在容器内的气体,容积不变,温度升高,压强增大,气体分子对器壁单位面积上的平均作用力增
大,D正确;从单一热源吸收热量,使之完全用来对外做功,但会引起其他的变化,E错误。
(2)(ⅰ)对封闭理想气体,初状态: p =76 cmHg、V =20 mL、T =285 K
0 0 0
4
末状态: p =(76+4) cmHg=80 cmHg、V =(20+ ×0.2) mL=20.4 mL、T =?(2分)
1 1 1
2
pV pV
根据气体状态方程可得 0 0 = 1 1 (2分)
T T
0 1
代入数据解得T =306 K(1分)
1
(ⅱ)通过注入水银使左侧管中的水银液面仍回到B处,该过程为等温变化,对封闭理想气体,
初状态: p =80 cmHg、V =20.4 mL
1 1
末状态:p =?、V =V =20 mL(1分)
2 2 0
根据气体状态方程可得 pV = p V (2分)
1 1 2 0
解得p =81.6 cmHg(1分)
2
则需要另外注入的水银体积V =0.2×(81.6−76) mL=1.12 mL(1分)
理科综合 全解全析及评分标准 第17页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}L
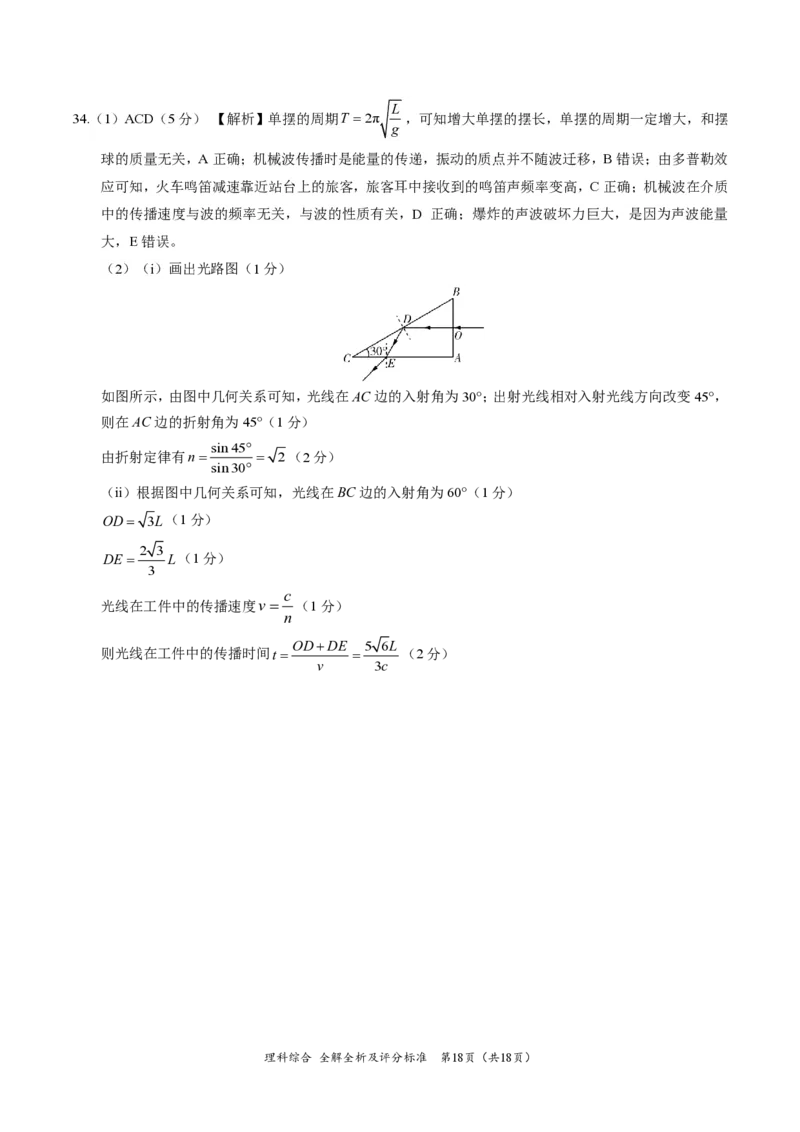
34.(1)ACD(5分) 【解析】单摆的周期T =2π ,可知增大单摆的摆长,单摆的周期一定增大,和摆
g
球的质量无关,A正确;机械波传播时是能量的传递,振动的质点并不随波迁移,B错误;由多普勒效
应可知,火车鸣笛减速靠近站台上的旅客,旅客耳中接收到的鸣笛声频率变高,C正确;机械波在介质
中的传播速度与波的频率无关,与波的性质有关,D 正确;爆炸的声波破坏力巨大,是因为声波能量
大,E错误。
(2)(ⅰ)画出光路图(1分)
如图所示,由图中几何关系可知,光线在AC边的入射角为30°;出射光线相对入射光线方向改变45°,
则在AC边的折射角为45°(1分)
sin45°
由折射定律有n= = 2(2分)
sin30°
(ⅱ)根据图中几何关系可知,光线在BC边的入射角为60°(1分)
OD= 3L(1分)
2 3
DE = L(1分)
3
c
光线在工件中的传播速度v= (1分)
n
OD+DE 5 6L
则光线在工件中的传播时间t = = (2分)
v 3c
理科综合 全解全析及评分标准 第18页(共18页)
{#{QQABQYQEogCAQIAAABhCQQFACgIQkAAACAoOABAIIAAAyBFABCA=}#}