文档内容
六安二中 2025 届高三第二次月考
化学试卷
分值:100分 时间:75分钟
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27 P:31 S:
32 Fe:56 Cu:64
一、选择题(每小题3分,共42分)
1. 从古至今,人类的生活、生产都离不开材料的应用。下列说法正确的是
A. 歼-20上采用的氮化镓涂层,属于新型金属材料
的
B. 人民币票面文字处采用了含Fe O 磁性油墨,Fe O 常用作红色颜料
3 4 3 4
C. 北斗卫星上使用的硅太阳能电池阵,利用SiO 将太阳能转化为电能
2
D. 神舟十七号返回舱降落回收过程中使用了芳纶制作的降落伞,芳纶是有机高分子材料
【答案】D
【解析】
【详解】A.氮化镓(GaN)是一种半导体材料,不是金属材料,A错误;
B.Fe O 为黑色固体,常用作红色颜料的是Fe O,B错误;
3 4 2 3
C.硅太阳能电池阵是利用硅半导体的性质将太阳能转化为电能,C错误;
D.芳纶是一种有机高分子材料,具有高强度和耐热性,常用于制作降落伞等,D正确;
答案选D。
2. 纳米铜粉(平均粒径30~80nm)可用于 和 合成甲醇等反应过程的催化剂,以辉铜矿(主要成分为
)为原料制备纳米铜粉的工艺流程如图所示:
已知: 浸取时,浸渣中含有硫单质; 还原时,生成的气体对环境没有污染。
下列说①法错误的是 ②
第1页/共21页
学科网(北京)股份有限公司A. “浸取”时,发生反应的化学方程式为
B. “萃取”时,选择的萃取剂不溶于水,在该工艺中可循环使用
C. “还原”时,消耗 和 的物质的量之比为1:2
D. 用激光笔照射纳米铜粉,可观察到丁达尔效应
【答案】D
【解析】
【分析】辉铜矿中加入FeCl 溶液浸取发生反应Cu S+4FeCl =2CuCl +4FeCl +S,过滤后得到氯化铜和氯化
3 2 3 2 2
亚铁,加入萃取剂萃取,将氯化铜和氯化亚铁分离,再加入硫酸进行反萃取,此时铜离子在水相中,水相
中加入NH 还原生成纳米铜粉。
2 4
【详解】A.根据题干可知,“浸取”时,浸渣中含有硫单质,则是Cu S与FeCl 反应生成了S,Cu也会失
2 3
电子生成铜离子,Fe3+得电子生成亚铁离子,发生反应的化学方程式为
,A项正确;
B.“萃取”时,可分离出水相,说明选择的萃取剂不溶于水,同时后续的反萃取后又得到萃取剂,说明该
萃取剂在该工艺中可循环使用,B项正确;
C.根据已知信息可知,“还原”时, 转化为 ,1mol 转移4mol ,1mol 转化为Cu转
移2mol ,因此消耗 和 的物质的量之比为1:2,C项正确;
D.该流程中制得的纳米铜粉属于纯净物,没有溶于水形成胶体,因此不能产生丁达尔效应,D项错误;
答案选D。
3. 下列用于解释事实的化学用语书写正确的是
A. 向 溶液中滴入过量氨水:
B. 用氨水吸收烟气中少量的
C. 向 浊液中加入 溶液,生成红褐色沉淀:
D. 电解熔融 的阴极反应:
【答案】A
第2页/共21页
学科网(北京)股份有限公司【解析】
【详解】A.向 溶液中滴入过量氨水生成Al(OH) 沉淀,A项正确;
3
B.用氨水吸收烟气中少量的SO ,生成 ,正确的离子方程式为
2
,B项错误;
C.向 浊液中加入 溶液,生成红褐色沉淀, 是难溶物,不拆,正确的离子方
程式为 ,C项错误;
D.电解熔融 ,阴极Na+放电,正确的电极方程式为Na++e-=Na,D项错误;
答案选A。
4. 设 为阿伏加德罗常数的值,下列叙述正确的是
A. 40gSiC晶体中含有的 的数目为
B. 100g质量分数为46%的 的水溶液中含有的氧原子数目为
C. 标准状况下,11.2L 与11.2LHF均含有 个质子
D. 1mol 中含有的 键的数目为
【答案】B
【解析】
【详解】A.SiC是共价晶体,1molSiC中含4molSi-C键,40gSiC晶体中含有的 的数目为 ,A
错误;
B.100g质量分数为46%的 的水溶液, 的质量为46g,物质的量为1mol,氧原子为
1mol,溶剂水的质量为54g,物质的量为3mol,O原子物质的量为3mol,O原子共4mol,数目为 ,B
正确;
第3页/共21页
学科网(北京)股份有限公司C.标准状况下HF不是气体,无法计算质子数,C错误;
D.C H 符合链状烷烃通式,分子中所含共价键数=6×3+1=19,故1mol 中含有的 键的数目为
6 14
,D错误;
故选B。
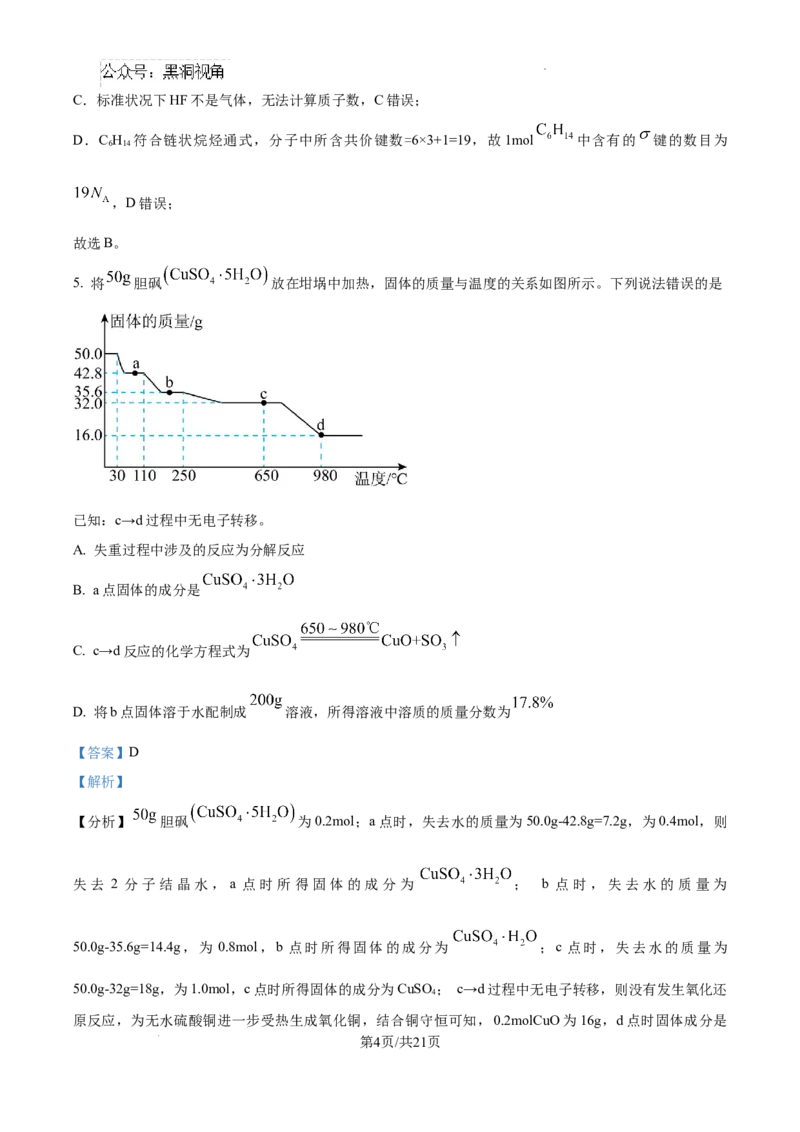
5. 将 胆砜 放在坩埚中加热,固体的质量与温度的关系如图所示。下列说法错误的是
已知:c→d过程中无电子转移。
A. 失重过程中涉及的反应为分解反应
B. a点固体的成分是
C. c→d反应的化学方程式为
D. 将b点固体溶于水配制成 溶液,所得溶液中溶质的质量分数为
【答案】D
【解析】
【分析】 胆砜 为0.2mol;a点时,失去水的质量为50.0g-42.8g=7.2g,为0.4mol,则
失去 2 分子结晶水,a 点时所得固体的成分为 ; b 点时,失去水的质量为
50.0g-35.6g=14.4g,为 0.8mol,b 点时所得固体的成分为 ;c 点时,失去水的质量为
50.0g-32g=18g,为1.0mol,c点时所得固体的成分为CuSO ; c→d过程中无电子转移,则没有发生氧化还
4
原反应,为无水硫酸铜进一步受热生成氧化铜,结合铜守恒可知,0.2molCuO为16g,d点时固体成分是
第4页/共21页
学科网(北京)股份有限公司CuO;
【详解】A.失重过程中为一种物质生成多种物质的反应,涉及的反应为分解反应,故A正确;
B.a点固体的成分是 ,故B正确;
C.c→d过程中无电子转移,则没有发生氧化还原反应,为无水硫酸铜进一步受热生成氧化铜和三氧化硫,
c→d反应的化学方程式为 ,故C正确;
D.b点时所得固体的成分为 ,结合铜守恒,将b点固体溶于水配制成 溶液,所得溶液
中溶质的质量分数为 ,D错误;
故选D。
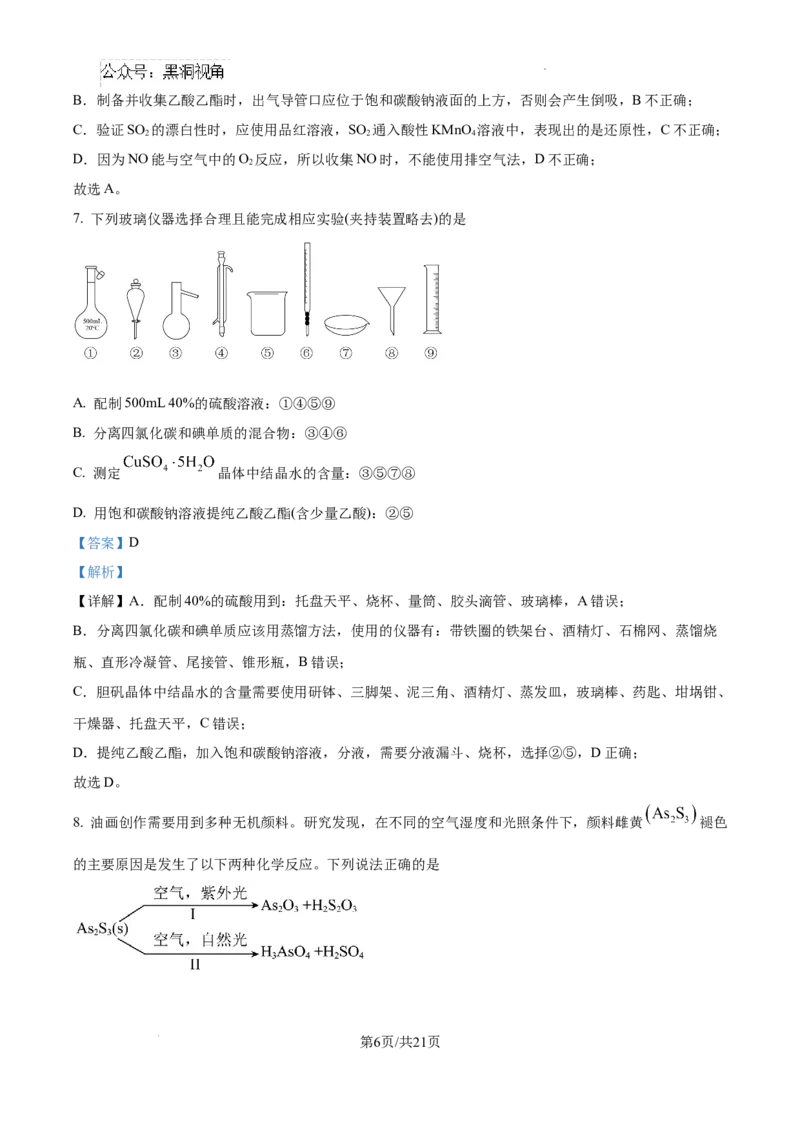
6. 下列实验装置能达到实验目的的是
A.除去碳酸钠固体中的少量碳酸氢钠 B.制备并收集乙酸乙酯
C.验证SO 的漂白性 D.制备并收集NO
2
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.除去碳酸钠固体中的少量碳酸氢钠,可利用碳酸氢钠热稳定性差的性质,用加热法将碳酸氢
钠转化为碳酸钠,A正确;
第5页/共21页
学科网(北京)股份有限公司B.制备并收集乙酸乙酯时,出气导管口应位于饱和碳酸钠液面的上方,否则会产生倒吸,B不正确;
C.验证SO 的漂白性时,应使用品红溶液,SO 通入酸性KMnO 溶液中,表现出的是还原性,C不正确;
2 2 4
D.因为NO能与空气中的O 反应,所以收集NO时,不能使用排空气法,D不正确;
2
故选A。
7. 下列玻璃仪器选择合理且能完成相应实验(夹持装置略去)的是
A. 配制500mL 40%的硫酸溶液:①④⑤⑨
B. 分离四氯化碳和碘单质的混合物:③④⑥
C. 测定 晶体中结晶水的含量:③⑤⑦⑧
D. 用饱和碳酸钠溶液提纯乙酸乙酯(含少量乙酸):②⑤
【答案】D
【解析】
【详解】A.配制40%的硫酸用到:托盘天平、烧杯、量筒、胶头滴管、玻璃棒,A错误;
B.分离四氯化碳和碘单质应该用蒸馏方法,使用的仪器有:带铁圈的铁架台、酒精灯、石棉网、蒸馏烧
瓶、直形冷凝管、尾接管、锥形瓶,B错误;
C.胆矾晶体中结晶水的含量需要使用研钵、三脚架、泥三角、酒精灯、蒸发皿,玻璃棒、药匙、坩埚钳、
干燥器、托盘天平,C错误;
D.提纯乙酸乙酯,加入饱和碳酸钠溶液,分液,需要分液漏斗、烧杯,选择②⑤,D正确;
故选D。
8. 油画创作需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄 褪色
的主要原因是发生了以下两种化学反应。下列说法正确的是
第6页/共21页
学科网(北京)股份有限公司A. 与水作用可生成对应的酸:
B. 反应Ⅰ中元素 和 都被氧化
C. 反应Ⅰ和Ⅱ中,氧化 转移电子数之比为
D. 反应Ⅰ和Ⅱ中,参加反应的 :Ⅰ<Ⅱ
【答案】C
【解析】
【分析】根据转化信息,反应Ⅰ为As S 在紫外光条件下被氧气氧化为As O 和HSO ,化学方程式为:
2 3 2 3 2 2 3
;反应Ⅱ为 As S 在自然光条件下被氧气氧化为 HAsO 和
2 3 3 4
HSO ,化学方程式为: 。
2 4
【详解】A.As O 与水作用时,可以生成对应的酸为HAsO ,故A项错误;
2 3 3 3
B.As S 中元素As为+3价,元素S为-2价,则反应Ⅰ中,As S 在紫外光条件下被氧气氧化为As O 和
2 3 2 3 2 3
HSO,HSO 中S化合价为+2价,化合价升高被氧化;As O 中As元素化合价为+3,未发生改变,未被
2 2 3 2 2 3 2 3
氧化,故B项错误;
C.反应Ⅰ中,As S 中S元素从-2价升高为中的+2价,则氧化1molAs S 转移的电子数为:
2 3 2 3
3×4mol=12mol;反应Ⅱ中,As S 中As元素从+3价升高为中的+5价,S元素从-2价升高为HSO 的+6价,
2 3 2 4
则氧化1molAs S 转移的电子数为:2×2mol+3×8mol=28mol,因此反应Ⅰ和Ⅱ中氧化1molAs S 转移的电
2 3 2 3
子数之比为: ,故C项正确;
D.结合分析中反应Ⅰ和Ⅱ的方程式中化学计量数可知,参加反应的 :Ⅰ>Ⅱ,故D项错误;
故答案选C。
阅读下列材料,完成下面小题。
资源化利用 ,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
第7页/共21页
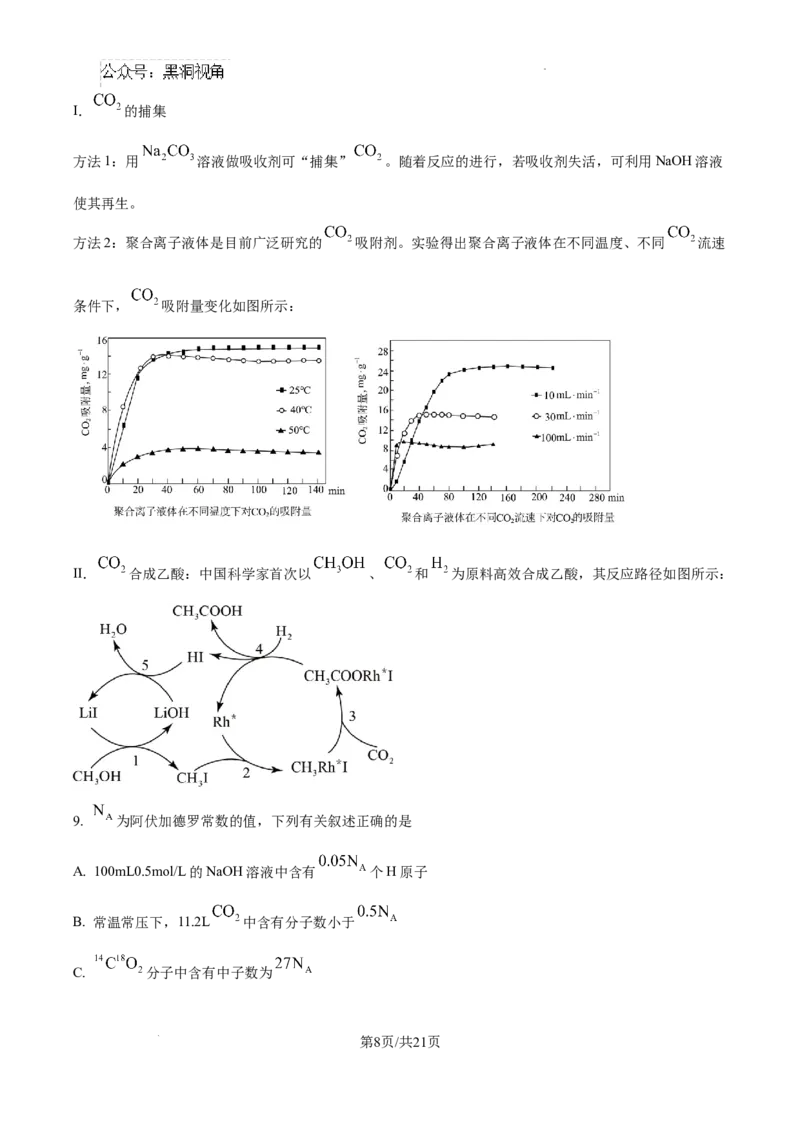
学科网(北京)股份有限公司Ⅰ. 的捕集
方法1:用 溶液做吸收剂可“捕集” 。随着反应的进行,若吸收剂失活,可利用NaOH溶液
使其再生。
方法2:聚合离子液体是目前广泛研究的 吸附剂。实验得出聚合离子液体在不同温度、不同 流速
条件下, 吸附量变化如图所示:
Ⅱ. 合成乙酸:中国科学家首次以 、 和 为原料高效合成乙酸,其反应路径如图所示:
9. 为阿伏加德罗常数的值,下列有关叙述正确的是
A. 100mL0.5mol/L的NaOH溶液中含有 个H原子
B. 常温常压下,11.2L 中含有分子数小于
C. 分子中含有中子数为
第8页/共21页
学科网(北京)股份有限公司D. 3.2g 中含有共价键个数为
10. 下列相关说法正确的是
A. NaOH、 、 均含有共价键和离子键
B. NaOH溶液使“ 吸收剂”再生的离子反应:
C. 低温高流速有利于聚合离子液体吸附
D. 合成乙酸的总反应:
【答案】9. B 10. B
【解析】
【
9题详解】
A. 100mL0.5mol/L的NaOH溶液中含H物质有溶质氢氧化钠也有溶剂水,含有H原子个数不止 ,
A错误;
B. 常温常压下,气体摩尔体积大于22.4L/mol,11.2L 中含有分子数小于 ,B正确;
C. 一个 分子中含有中子数为27,未给二氧化碳的物质的量,含有中子数目无法计算,C错误;
D. 一个甲醇含有5个共价键,故3.2g 即0.1mol甲醇中含有共价键个数为 ,D错误;
故选B。
【10题详解】
A. 含有共价键,不含有离子键,A错误;
B. 用 溶液做吸收剂可“捕集” 生成酸式盐碳酸氢钠,NaOH溶液使“ 吸收剂”再
生的离子反应: ,B正确;
C. 由聚合离子液体在不同温度、不同 流速条件下的图示可知低温低流速有利于二氧化碳吸附,C错误;
第9页/共21页
学科网(北京)股份有限公司D. 合成乙酸的总反应: ,D错误;
故选B。
11. 下列方案不能测出 和 的混合物中 的质量分数的是
A. 取ag混合物充分加热,质量减少bg
B. 取ag混合物与足量稀硫酸充分反应,得到
C. 取ag混合物与足量 溶液充分反应,得到bg溶液
D. 取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体
【答案】C
【解析】
【详解】A. 受热易分解生成碳酸钠、水和二氧化碳,所以通过加热分解利用差量法即可计算出
质量分数,A不符合题意;
B.取ag混合物与足量稀硫酸充分反应,得到 ,根据碳守恒可计算出 和 的总的
物质的量,结合总质量ag,可计算出 质量分数,B不符合题意;
C.取ag混合物与过量氢氧化钠溶液充分反应,加热、蒸干、灼烧,得bg固体,bg固体为碳酸钠及过量
NaOH,不可以计算出 质量分数,C符合题意;
D. 和 均可与盐酸反应生成水、二氧化碳和氯化钠,所以bg固体是氯化钠,利用守恒
法可计算出 质量分数,D不符合题意;
故选C。
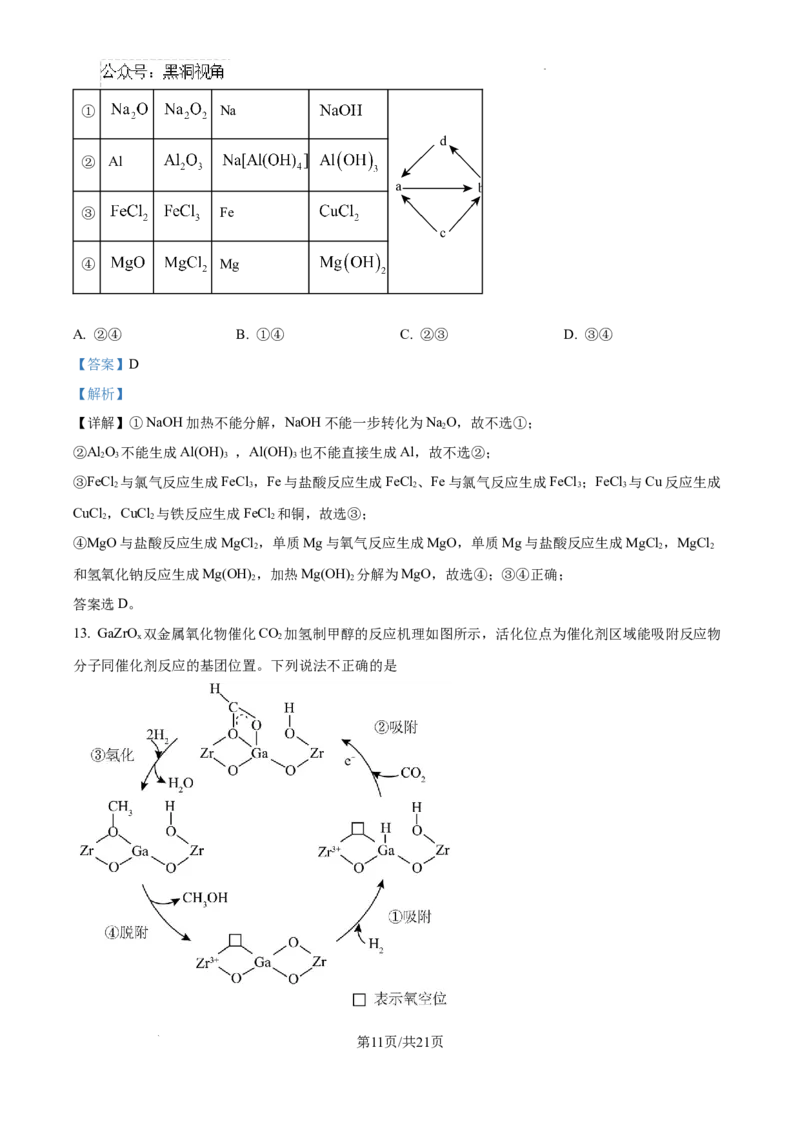
12. 下表中的各组物质之间通过一步反应就能实现如图所示转化的是
编
a b c d
号
第10页/共21页
学科网(北京)股份有限公司① Na
② Al
③ Fe
④ Mg
A. ②④ B. ①④ C. ②③ D. ③④
【答案】D
【解析】
【详解】①NaOH加热不能分解,NaOH不能一步转化为NaO,故不选①;
2
②Al O 不能生成Al(OH) ,Al(OH) 也不能直接生成Al,故不选②;
2 3 3 3
③FeCl 与氯气反应生成FeCl ,Fe与盐酸反应生成FeCl 、Fe与氯气反应生成FeCl ;FeCl 与Cu反应生成
2 3 2 3 3
CuCl ,CuCl 与铁反应生成FeCl 和铜,故选③;
2 2 2
④MgO与盐酸反应生成MgCl ,单质Mg与氧气反应生成MgO,单质Mg与盐酸反应生成MgCl ,MgCl
2 2 2
和氢氧化钠反应生成Mg(OH) ,加热Mg(OH) 分解为MgO,故选④;③④正确;
2 2
答案选D。
13. GaZrO 双金属氧化物催化CO 加氢制甲醇的反应机理如图所示,活化位点为催化剂区域能吸附反应物
x 2
分子同催化剂反应的基团位置。下列说法不正确的是
第11页/共21页
学科网(北京)股份有限公司A. 该过程的总反应可表示为CO+3H CHOH+H O
2 2 3 2
B. 反应①②③④均有极性键的断裂与形成
C. CO 和H 的活化位点相同
2 2
D. 氧空位浓度高,有利于增强CO 的吸附能力
2
【答案】C
【解析】
【详解】A.由图可知,该图表示GaZrO 双金属氧化物催化CO 加氢制甲醇的反应机理,总反应为
x 2
CO+3H CHOH+H O,A正确;
2 2 3 2
B.反应 中有Ga-O极性键断裂,Ga-H极性键形成;反应 中有Ga-H极性键断裂,C-H极性键形成;
反应 中①有Ga-O极性键断裂,C-H极性键形成;反应 中②H-O极性键断裂,Ga-O极性键形成,B正确;
C.根③据图示,CO
2
活化位点是氧空位,与H
2
活化位点④不相同,C错误;
D.根据图示,氧空位与二氧化碳作用,氧空位浓度高,有利于增强CO 的吸附能力,D正确;
2
故选C。
14. 是重要的化工原料,可以按如下流程充分利用。已知: 是离子化合物,各原子均满足8电
子稳定结构。
下列说法正确的是
A. 反应③实现了氮的固定
B. 的电子式为
C. 反应②过程中,氮元素的杂化方式由 变为
D. 结合 能力:
【答案】B
【解析】
【详解】A.氮的固定指将游离态氮转化为化合态氮,反应③是化合态氮到游离态氮,不属于氮的固定,
A错误;
第12页/共21页
学科网(北京)股份有限公司B. 的电子式为 ,B正确;
C.反应②过程中,含氮元素的物质由 变成 , 和 中氮元素的杂化方式都为 ,C
错误;
D.甲基为推电子基团,使得 中N原子周围电子云密度比 的大,易给出孤电子对与 形成
配位键,故结合 能力: ,D错误;
答案选B。
二、填空题(共58分)
15. 钠及其化合物在人类生产、生活中起着重要的作用。
请回答下列问题:
(1)工业上,将 和 以1∶2的物质的量之比配成溶液,再通入 可制取 ,同时放
出 ,写出该反应的化学方程式:___________。
(2)我国化学家侯德榜发明了联合制碱法,为世界制碱工业做出了巨大贡献。联合制碱法的主要过程如
图所示(部分物质已略去)。
①写出反应①的化学方程式:___________。
②下列关于该流程的说法正确的是___________(填标号)。
A.可循环使用的物质只有
B.副产物 可用作氮肥
第13页/共21页
学科网(北京)股份有限公司C.优先通入 气体至饱和,后通入 ,就会产生 沉淀
(3)向50mL的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入0.1mol/L的稀盐
酸,产生气体的体积(标准状况)如图所示。
①通入二氧化碳后形成溶液的溶质成分是___________(填化学式)。
②滴入25mL稀盐酸过程中,溶液导电性___________(填“增强”“减弱”或“不变”),试解释其原因:
___________。
③原50mL氢氧化钠溶液的浓度为___________。
【答案】(1)
.
(2) ① ②. B
(3) ①. NaOH、 ②. 减弱 ③. 发生中和反应,溶液中的离子总数不变,溶液体积
增大,导致溶液的导电性减弱 ④. 0.15mol/L
【解析】
【小问1详解】
将 和 以1∶2的物质的量之比配成溶液,再通入 可制取 ,同时放出 ,根据
得失电子守恒,该反应的化学方程式: ;
【小问2详解】
①向饱和食盐水中通入氨气和二氧化碳气体,反应生成碳酸氢钠和氯化铵,化学方程式:
;
②A.侯氏制碱法制碱过程中可循环利用的物质有二氧化碳和氯化钠,A错误;
第14页/共21页
学科网(北京)股份有限公司B.副产物 中含N元素,可用作氮肥,B正确;
C.该过程需先通入氨气,使溶液呈碱性以吸收更多的二氧化碳,生成碳酸氢钠,C错误;
【小问3详解】
①氢氧化钠溶液中通入一定量的二氧化碳,反应可生成碳酸氢钠,向反应后溶液中加入稀盐酸,加入0-
50mL未产生气体,说明存在NaOH;
②滴入25mL稀盐酸过程中,发生的主要反应: ,溶液中的离子总数不变,溶液体积增大,
导致溶液的导电性减弱;
③当加入75mL盐酸时,恰好生成NaCl,原NaOH物质的量等于氯化氢物质的量,
n(NaOH)=0.1mol/L×0.075L=0.0075mol,原50mL氢氧化钠溶液的浓度:c(NaOH)=
。
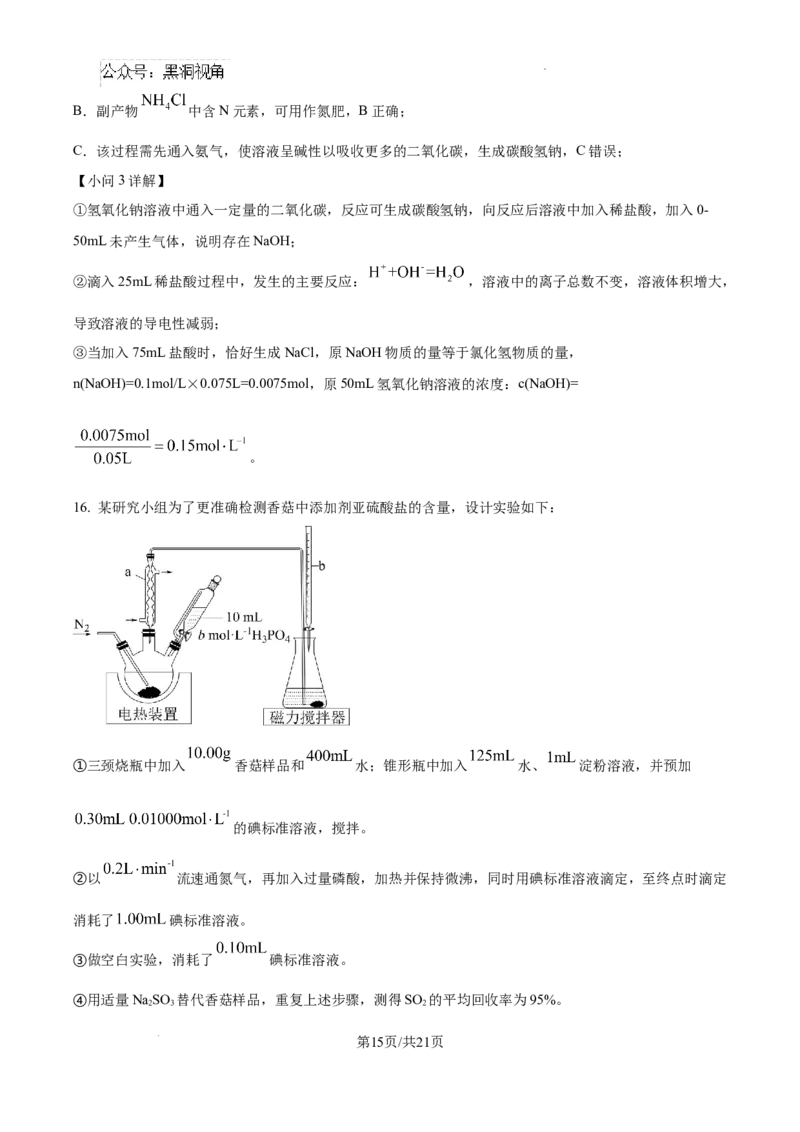
16. 某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
①三颈烧瓶中加入 香菇样品和 水;锥形瓶中加入 水、 淀粉溶液,并预加
的碘标准溶液,搅拌。
②以 流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定
消耗了 碘标准溶液。
③做空白实验,消耗了 碘标准溶液。
④用适量NaSO 替代香菇样品,重复上述步骤,测得SO 的平均回收率为95%。
2 3 2
第15页/共21页
学科网(北京)股份有限公司已知: , 。
回答下列问题:
(1)装置图中仪器a、b的名称分别为_______、_______。
(2)三颈烧瓶适宜的规格为_______(填标号)。
A. B. C.
(3)解释加入HPO ,能够生成SO 的原因:_______。
3 4 2
(4)滴定管在使用前需要_______、洗涤、润洗;滴定终点时溶液的颜色为_______;滴定反应的离子方
程式为_______。
(5)若先加磷酸再通氮气,会使测定结果_______(填“偏高”“偏低”或“无影响”)。
(6)该样品中亚硫酸盐含量为_______ mg•kg -1 (以SO 计,结果保留三位有效数字)。
2
【答案】(1) ①. 球形冷凝管 ②. 恒压滴液漏斗 (2)C
(3)加入HPO 后,溶液中存在化学平衡 ,SO 的溶解度随着温度升高而减小,
3 4 2
SO 逸出后,促进了化学平衡 向右移动
2
(4) ①. 检验其是否漏水 ②. 蓝色 ③. I+ SO +2H O=2I-+4H++SO2- (5)偏低 (6)
2 2 2 4
80.8
【解析】
【分析】由题中信息可知,检测香菇中添加剂亚硫酸盐的含量的原理是:用过量的磷酸与其中的亚硫酸盐
反应生成SO ,用氮气将SO 排入到锥形瓶中被水吸收,最后用碘标准溶液滴定,测出样品中亚硫酸盐含
2 2
量。
【小问1详解】
根据仪器a、b的结构可知,装置图中仪器a、b的名称分别为球形冷凝管和恒压滴液漏斗,故答案为:球
形冷凝管;恒压滴液漏斗;
【小问2详解】
三颈烧瓶中加入10.00g香菇样品和400 mL水,向其中加入HPO 的体积不超过10 mL。在加热时,三颈烧
3 4
瓶中的液体不能超过其容积的 ,因此,三颈烧瓶适宜的规格为1000 mL,故答案为:C;
【小问3详解】
第16页/共21页
学科网(北京)股份有限公司K (H PO )=7.1×10-3<K (H SO ) =1.3×10-2,但HPO 为难挥发性的酸,而HSO 易分解为SO 和水,加热
a1 3 4 a1 2 3 3 4 2 3 2
时SO 的溶解度随着温度升高而减小,SO 逸出后,促进了化学平衡HSO SO +H O向右移动,故答案
2 2 2 3 2 2
为:加入HPO 后,溶液中存在化学平衡HSO SO +H O,SO 的溶解度随着温度升高而减小,SO 逸
3 4 2 3 2 2 2 2
出后,促进了化学平衡HSO SO +H O向右移动;
2 3 2 2
【小问4详解】
滴定管在使用前需要检验其是否漏水、洗涤、润洗;滴定前,溶液中的碘被SO 还原为碘离子,溶液的颜
2
色为无色,当滴加最后半滴标准碘液时淀粉溶液由无色变为蓝色,且半分钟之内不褪色说明已达滴定终点,
反应的离子方程式为I+ SO +2H O=2I-+4H++SO2-,故答案为:检验其是否漏水;蓝色;I+ SO +2H O=2I-
2 2 2 4 2 2 2
+4H++SO2-;
4
【小问5详解】
若先加磷酸再通氮气,则不能将装置中的空气及时排出,有部分亚硫酸盐和SO 被装置中的氧气氧化,碘
2
的标准液的消耗量将减少,因此会使测定结果偏低,故答案为:偏低;
【小问6详解】
实验中SO 消耗的标准碘液的体积为0.30 mL+1.00 mL=1.30 mL,减去空白实验消耗的0.10 mL,则实际消
2
耗标准碘液的体积为1.20mL,根据反应I+ SO +2H O=2I-+4H++ SO 2-可以计算出n(SO )= n(I )= (1.20×10-
2 2 2 4 2 2
3)L×0.010 00 mol· L-1=1.20 10-5 mol,由于 SO 的平均回收率为 95%,则实际生成的 n(SO )=
2 2
, 则 根 据 S 元 素 守 恒 可 知 , 该 样 品 中 亚 硫 酸 盐 含 量 为
,故答案为:80.8。
17. 回答下列问题。
(1)已知CuO具有氧化性,与氨气加热反应的产物中含有两种单质。写出在加热条件下CuO和 反
应的化学方程式:___________。
(2)在 、 、 、 、 、 组成的一个氧化还原反应体系中,发生
第17页/共21页
学科网(北京)股份有限公司的反应过程。将以上物质组成一个正确的离子方程式,并用单线桥标出其电子转移的方向和数目:
___________。
(3) 与NaOH和NaClO的混合溶液作用,是一种制备理想的绿色水处理剂( )的方法,
写出该反应的化学方程式:___________。
(4) 可用于实验室制 ,若不加催化剂,400℃时 分解只生成两种盐,其中一种是无氧
酸盐,另一种盐的阴阳离子个数比为1∶1,写出该反应的化学方程式:___________。
的
(5)某地污水中有机污染物 主要成分是三氯乙烯( ),向该污水中加入 (还原产物为
)溶液可将其中的三氯乙烯除去,氧化产物只有 ,写出该反应的化学方程式:___________。
【答案】(1)
( 2 ) ( 3 )
(4)
(5)
【解析】
【
小问1详解】
已知CuO具有氧化性,能够和氨气反应生成两种单质(Cu、N),则在加热条件下CuO和NH 反应的化学
2 3
方程式为 ;
【小问2详解】
第18页/共21页
学科网(北京)股份有限公司被还原为Bi3+,Bi元素化合价降低了2,则应该有Mn2+被氧化为 ,Mn元素化合价升高了5,
由最小公倍数可知,反应共转移10个电子,反应的离子方程式与电子转移情况为
;
【小问3详解】
Fe(OH) 与NaOH和NaClO的混合液作用生成NaFeO,铁元素化合价升高,氯元素化合价降低,得到氯化
3 2 4
钠: ;
【小问4详解】
若不加催化剂,400℃时KClO 分解只生成两种盐,其中一种是无氧酸盐KCl,另一种盐也是钾盐,且阴阳
3
离子个数比为1:1,生成KCl时氯元素化合价降低,由+5变为-1,则另一部分氯元素化合价升高为+7得
到KClO,结合电子守恒、元素质量守恒可知反应为 ;
4
【小问5详解】
污水中加入KMnO (还原产物为MnO )溶液可将其中的三氯乙烯除去,氧化产物只有CO,则氯元素转化
4 2 2
为KCl,结合元素质量守恒可知,同时生成HCl,反应为2KMnO +C HCl =2MnO↓+HCl+2KCl+2CO ↑。
4 2 3 2 2
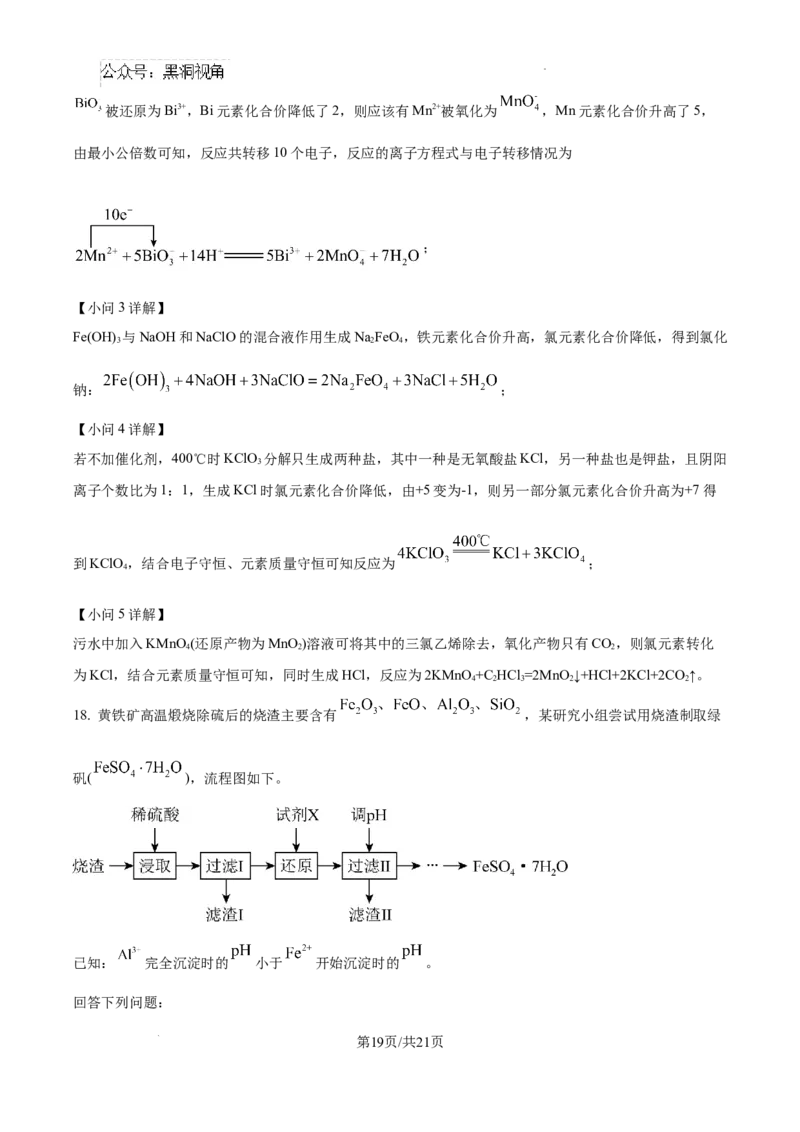
18. 黄铁矿高温煅烧除硫后的烧渣主要含有 ,某研究小组尝试用烧渣制取绿
矾( ),流程图如下。
已知: 完全沉淀时的 小于 开始沉淀时的 。
回答下列问题:
第19页/共21页
学科网(北京)股份有限公司(1)为提高烧渣的浸取速率,可采用的措施有_______(填标号)。
a升高温度 b.将烧渣粉碎 c.增大烧渣用量 d.适当增大硫酸浓度 e.增大反应容器气压
(2)滤渣I的主要成分是_______(填化学式)。
(3)试剂X可以选用多种物质,若X是一种非金属氧化物,写出还原过程中发生反应的离子方程式:
_______。
(4)滤渣II的主要成分是_______(填化学式)。
(5)过滤II后的滤液为 溶液,从 溶液得到 的一系列操作中应将 溶液
放置于_______(填仪器名称)中加热。
(6)绿矾容易被氧化变质,写出实验室中检验绿矾是否被氧化变质的操作和现象:_______。
(7)该研究小组取 烧渣进行实验,最后得到绿矾的质量为 ,若从烧渣制取绿矾的流程中
没有使用含铁的试剂,则烧渣中 的质量百分数为______。(假设流程中的铁元素全部转化到绿矾中)
【答案】(1)abd (2)SiO
2
(3)
(4)
(5)蒸发皿 (6)取少量固体于试管中,加入蒸馏水溶解,滴加KSCN溶液,若溶液变红则已变质,
若无明显现象,则未变质
(7)36.00%
【解析】
【分析】 加入稀硫酸, 溶于稀硫酸生成相应的盐,但
不溶,故滤渣I为 。向滤液中加入还原剂X将Fe3+还原为Fe2+,还原剂X可以是Fe或具有还原
性的SO ,调pH除去Al3+,所以滤渣II为 。得到滤液为 溶液,经过蒸发浓缩、冷却结晶、
2
过滤、洗涤等操作得到绿矾晶体,加热过程在烧杯中进行。
【小问1详解】
升高温度、将烧渣粉碎、适当增加稀硫酸浓度可以加快速率,故答案为abd;
【小问2详解】
第20页/共21页
学科网(北京)股份有限公司为酸性氧化物,不溶于稀硫酸,则滤渣I为 ,故答案为 ;
【小问3详解】
还原剂为非金属氧化物,且生成物绿矾中有S元素,则X为SO ,反应中Fe3+还原为Fe2+,SO 被氧化
2 2
,故答案为 ;
【小问4详解】
根据已知条件 完全沉淀时的 小于 开始沉淀时的 ,调pH除去 ,所以滤渣II为
,故答案为 ;
【小问5详解】
过滤II后的滤液为FeSO 溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤等操作得到绿矾晶体,蒸发浓缩在
4
蒸发皿中进行,故答案为蒸发皿;
【小问6详解】
绿矾容易被氧化为Fe3+,用KSCN溶液检验,故答案为取少量固体于试管中,加入蒸馏水溶解,滴加
KSCN溶液,若溶液变红则已变质,若无明显现象,则未变质;
【小问7详解】
根据题意,产品绿矾中的Fe全部来源于烧渣中,根据元素守恒可计算出烧渣中Fe的质量为
,则Fe的质量分数为 ,故答案为36.00%。
第21页/共21页
学科网(北京)股份有限公司