文档内容
南京市 2024-2025 学年第一学期五校联盟期末学情调研
高二化学
本卷:共100分 考试时间:75分钟
相对原子质量:C-12 H-1 O-16 Cl-35.5 Cr-55 Mg-24 K-39
一、单项选择题(本题共13小题,每小题只有一个正确选项。每题3分,共39分)
1. 保护钢铁有利于节约资源、保护环境,下列钢铁的保护方法中不正确的是
A. 铁栅栏上涂上油漆 B. 铁闸与直流电源正极相连
.
C 轮船底部镶嵌锌块 D. 家用铁锅水洗后及时擦干
2. Haber和Bosch分别在1918和1931年因合成氨成功获得诺贝尔奖,同时带给世界“肥胖”和“战争动乱”。
下列化学用语说法正确的是
A. 的电子式为: B. 价层电子排布式为:
C. 含7个中子的 原子可表示为: D. 的结构式为:
3. 升高温度,下列物理量不一定增大的是
A. 化学平衡常数K B. 水的离子积常数K
w
C. 化学反应速率v D. BaSO 的溶度积K
4 sp
的
4. 在给定条件下,下列选项所示 物质间转化均能实现的是
A.
B.
C.
D.
5. 短周期元素X、Y、Z、W原子序数依次增大。基态X的原子核外成对电子数是未成对电子数的2倍,
基态Z原子核外s轨道与p轨道电子数相等;W元素原子是同周期元素原子半径最大的。下列说法正确的
是
A. X位于元素周期表的s区 B. Z、W可形成原子个数比为 的共价化合物
C. 电负性: D. 第一电离能:6. 含 的烟气会形成酸雨,工业上常利用 溶液作为吸收液脱除烟气中的 ,随着 的吸收,
吸收液的 不断变化,下列粒子浓度关系一定正确的是
A. 溶液中存在:c(Na+)>c(SO )>c(H SO )>c(HSO )
2 3
B. 已知 溶液 ,该溶液中: c(Na+)>c(HSO )>c(H SO ) >c(SO )
2 3
C. 当吸收液呈酸性时:c(Na+)=c(SO )+ c(HSO )+c(H SO )
2 3
D. 当吸收液呈中性时:c(Na+)=2c(SO )+ c(HSO )
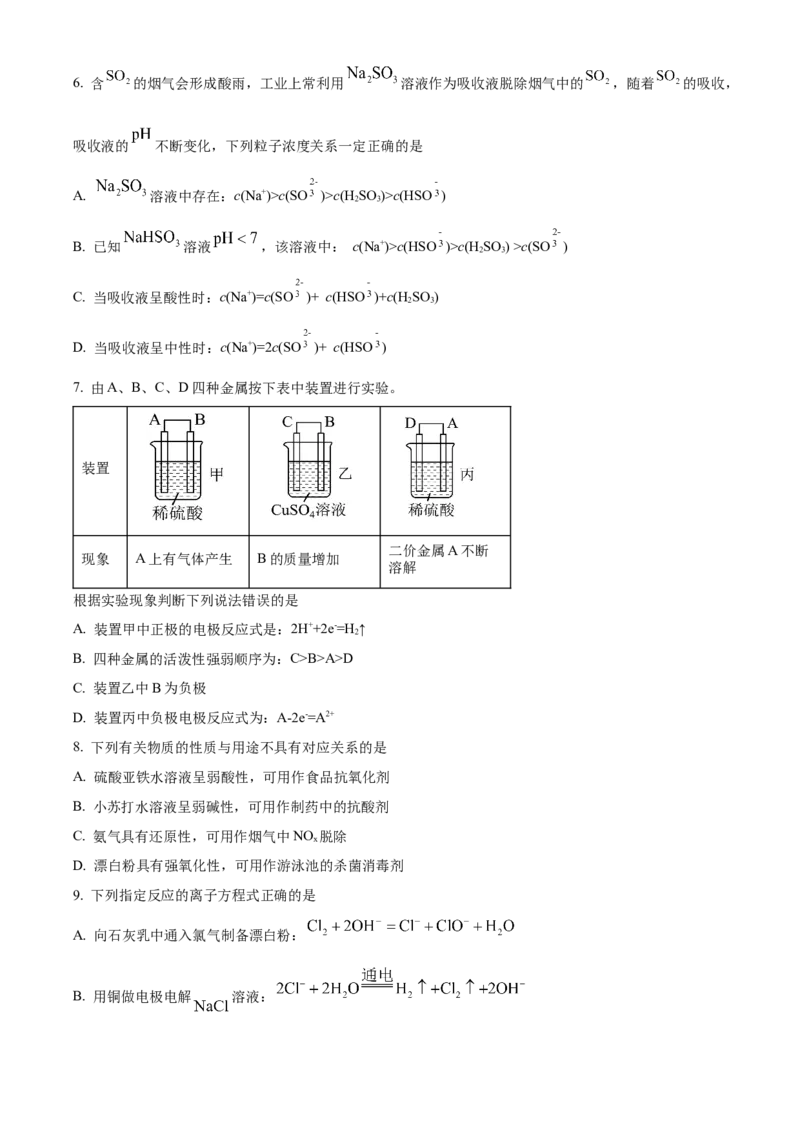
7. 由A、B、C、D四种金属按下表中装置进行实验。
装置
二价金属A不断
现象 A上有气体产生 B的质量增加
溶解
根据实验现象判断下列说法错误的是
A. 装置甲中正极的电极反应式是:2H++2e-=H ↑
2
B. 四种金属的活泼性强弱顺序为:C>B>A>D
C. 装置乙中B为负极
D. 装置丙中负极电极反应式为:A-2e-=A2+
8. 下列有关物质的性质与用途不具有对应关系的是
A. 硫酸亚铁水溶液呈弱酸性,可用作食品抗氧化剂
B. 小苏打水溶液呈弱碱性,可用作制药中的抗酸剂
C. 氨气具有还原性,可用作烟气中NO 脱除
x
D. 漂白粉具有强氧化性,可用作游泳池的杀菌消毒剂
9. 下列指定反应的离子方程式正确的是
A. 向石灰乳中通入氯气制备漂白粉:
B. 用铜做电极电解 溶液:C. 溶液滴加 溶液:
D. 少量铁粉与稀硝酸反应:
10. 下列实验操作、现象和所得到的结论均正确的是
选项 实验内容 实验结论
向 的 溶液中滴入 3 滴
同 温 度 下 的:
的 溶液,再滴入4滴
A
的 溶液,先产生白色沉淀,后产生红褐色
沉淀
在相同条件下,用 试纸测定同等浓度的
结 合 能 力 :
B 和 溶 液 的 ,
取 溶 液 于 试 管 中 , 加 入
若溶液变血红色,则 和
C 溶液,充分反应后滴入5滴
反应有一定限度
溶液
向2支盛有 不同浓度 溶液的试管
D 探究浓度对反应速率的影响
中,同时加入 溶液,观察并比较实
验现象
A. A B. B C. C D. D
11. 下列说法正确的是
A. HS-的水解方程式为:HS-+ H O HO++S2-
2 3
B. CHCOOH 溶液加水稀释后,溶液中 的值减小
3
C. 将pH =4的盐酸稀释后,溶液中所有离子的浓度均降低
D. 100℃时,pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1
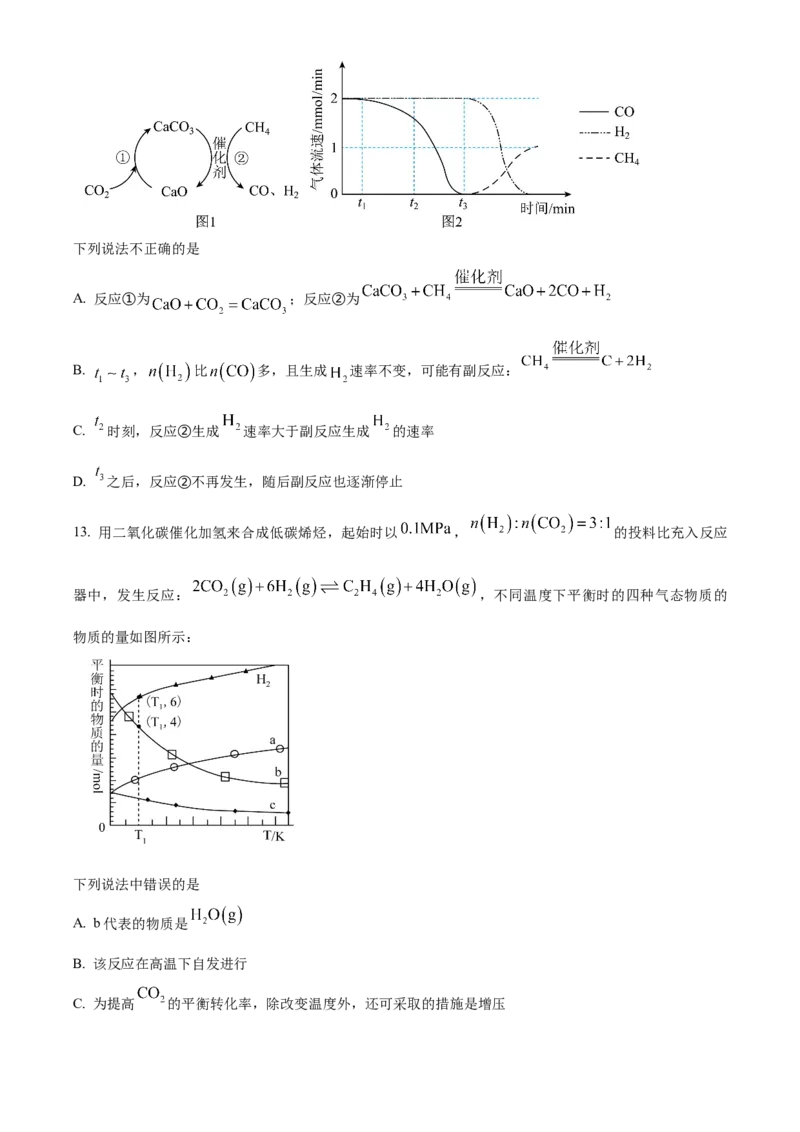
12. 捕获和转化可减少 排放并实现资源利用,原理如图1所示。反应①完成之后,以 为载气,
的
以恒定组成 、 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反
应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上检测到有积碳。下列说法不正确的是
A. 反应①为 ;反应②为
B. , 比 多,且生成 速率不变,可能有副反应:
C. 时刻,反应②生成 速率大于副反应生成 的速率
D. 之后,反应②不再发生,随后副反应也逐渐停止
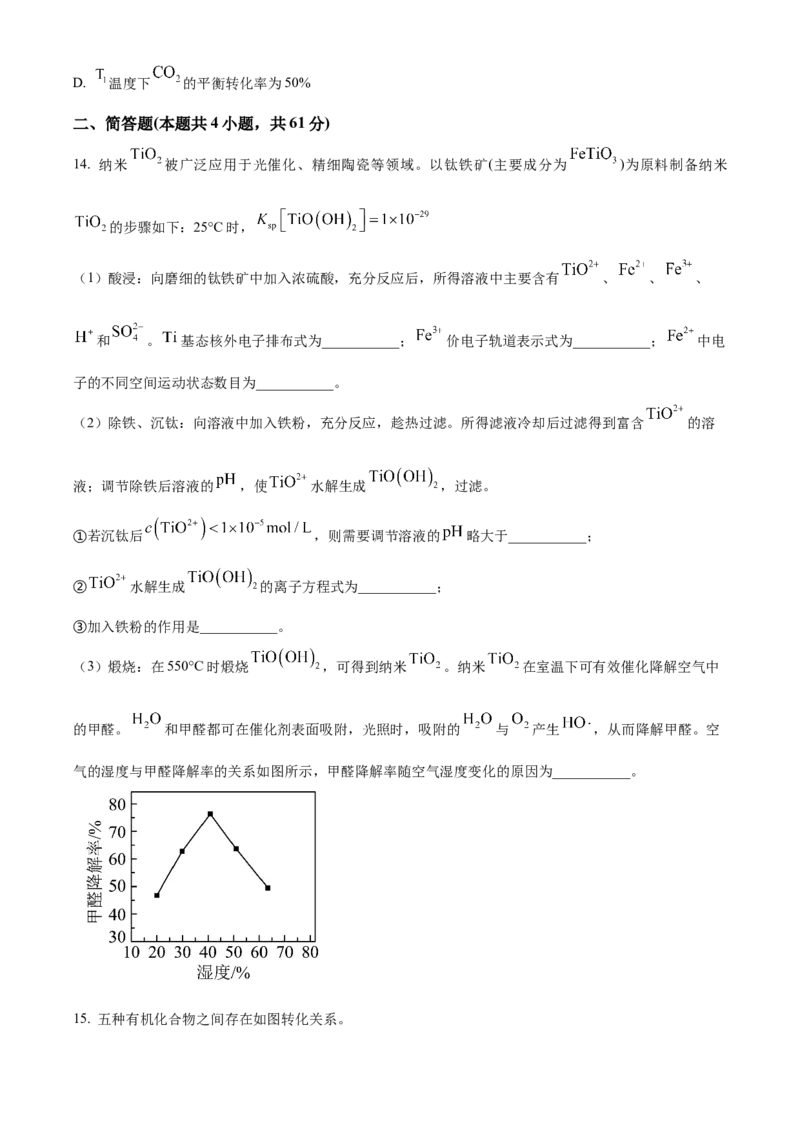
13. 用二氧化碳催化加氢来合成低碳烯烃,起始时以 , 的投料比充入反应
器中,发生反应: ,不同温度下平衡时的四种气态物质的
物质的量如图所示:
下列说法中错误的是
A. b代表的物质是
B. 该反应在高温下自发进行
C. 为提高 的平衡转化率,除改变温度外,还可采取的措施是增压D. 温度下 的平衡转化率为50%
二、简答题(本题共4小题,共61分)
14. 纳米 被广泛应用于光催化、精细陶瓷等领域。以钛铁矿(主要成分为 )为原料制备纳米
的步骤如下:25°C时,
(1)酸浸:向磨细的钛铁矿中加入浓硫酸,充分反应后,所得溶液中主要含有 、 、 、
和 。 基态核外电子排布式为___________; 价电子轨道表示式为___________; 中电
子的不同空间运动状态数目为___________。
(2)除铁、沉钛:向溶液中加入铁粉,充分反应,趁热过滤。所得滤液冷却后过滤得到富含 的溶
液;调节除铁后溶液的 ,使 水解生成 ,过滤。
①若沉钛后 ,则需要调节溶液的 略大于___________;
② 水解生成 的离子方程式为___________;
③加入铁粉的作用是___________。
(3)煅烧:在550°C时煅烧 ,可得到纳米 。纳米 在室温下可有效催化降解空气中
的甲醛。 和甲醛都可在催化剂表面吸附,光照时,吸附的 与 产生 ,从而降解甲醛。空
气的湿度与甲醛降解率的关系如图所示,甲醛降解率随空气湿度变化的原因为___________。
15. 五种有机化合物之间存在如图转化关系。(1) 中所含的官能团的名称是___________;反应①的化学方程式为___________;该反应的类型是
___________反应。
(2)反应③可选用铜做催化剂,该反应的化学方程式为___________。
(3)用 同位素标记乙醇中的氧元素(即 ),通过测定产物来判断反应⑤中反应物的断键方式。
结果表明 分子在发生该反应时断开的是碳氧键,则得到的有机产物应为___________(写结构
简式)。
(4)A是常见的有机高分子材料,可由 直接进行加聚反应得到,A的结构简式___________。
16. 氯酸镁[ ]常用作催熟剂、除草剂等,实验室制备少量 的流程如图:
为
已知:①卤块主要成分 ,含有 、 等杂质。
②四种化合物的溶解度( )随温度( )变化曲线如图所示。(1)加速卤块在酸性 溶液中溶解的措施有:___________。(任写一点)。
(2)滤渣的成分___________。
(3)加入 饱和溶液后发生反应的化学方程式为___________(溶解度低的物质以沉淀形式析出)。
产品中 含量的测定:
步骤1:准确称量 产品配成 溶液。
步骤2:取 试液于锥形瓶中,加入 稀硫酸和 的 溶液,微
热。
步骤3:冷却至室温,用 溶液滴定剩余的 至终点。此过程中反应的离子方程式
为: 。
步骤4:将步骤2、3重复两次
(4)①写出步骤2中发生反应的离子方程式:___________;
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果___________(填“偏大、偏小”或“不变”)。
(5)若平均消耗 溶液 ,则产品中 的质量分数为___________。(写
出必要的计算过程)
17. Ⅰ.探究含碳化合物的转化,对“碳中和”“碳达峰”具有重要现实意义。
(1)如图是利用电解法将 转化的原理示意图,其中铂电极为___________极;铜电极上生成 的
电极反应式为___________。
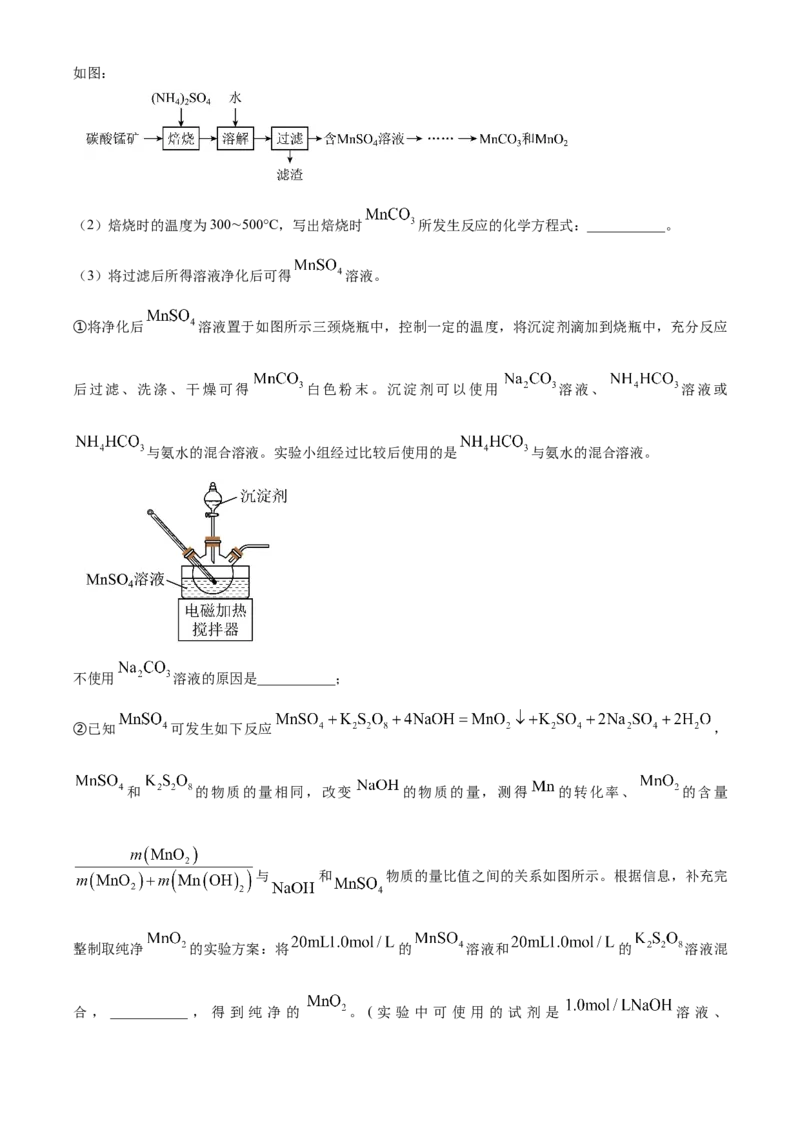
Ⅱ.实验室以碳酸锰矿(含 及少量 、 、 等氧化物)为原料制高纯 和 的流程如图:
(2)焙烧时的温度为300∼500°C,写出焙烧时 所发生反应的化学方程式:___________。
(3)将过滤后所得溶液净化后可得 溶液。
①将净化后 溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应
后过滤、洗涤、干燥可得 白色粉末。沉淀剂可以使用 溶液、 溶液或
与氨水的混合溶液。实验小组经过比较后使用的是 与氨水的混合溶液。
不使用 溶液的原因是___________;
②已知 可发生如下反应 ,
和 的物质的量相同,改变 的物质的量,测得 的转化率、 的含量
与 和 物质的量比值之间的关系如图所示。根据信息,补充完
整制取纯净 的实验方案:将 的 溶液和 的 溶液混
合 , ___________ , 得 到 纯 净 的 。 ( 实 验 中 可 使 用 的 试 剂 是 溶 液 、溶液、 溶液)。