文档内容
2024-2025 学年第一学期高二期中学情调研测试
化学试题
(考试时间:75分钟 满分:100分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Ca-40 Cl-35.5 Cr-52
一、单项选择题:共13题,每题3分,共计39分。每题只有一个选项最符合题意。
1.我国探月工程取得重大进展。月壤中含有Ca、Fe等元素的磷酸盐,下列元素位于元素周期表第三周期
的是( )
A.O B.P C.Ca D.Fe
2.反应 应用于石油开采。下列说法正确的是( )
A. 属于离子化合物 B. 中N元素的化合价为+5
C. 的电子式为 D. 的结构示意图为
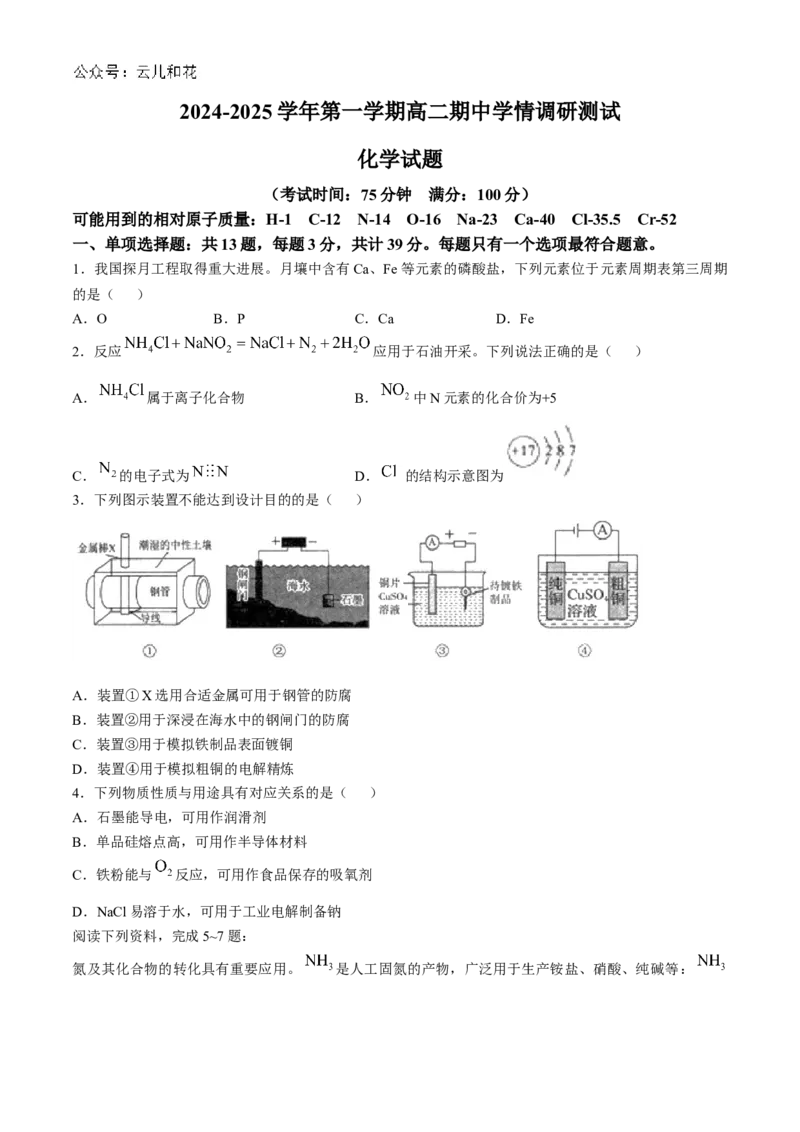
3.下列图示装置不能达到设计目的的是( )
A.装置①X选用合适金属可用于钢管的防腐
B.装置②用于深浸在海水中的钢闸门的防腐
C.装置③用于模拟铁制品表面镀铜
D.装置④用于模拟粗铜的电解精炼
4.下列物质性质与用途具有对应关系的是( )
A.石墨能导电,可用作润滑剂
B.单品硅熔点高,可用作半导体材料
C.铁粉能与 反应,可用作食品保存的吸氧剂
D.NaCl易溶于水,可用于工业电解制备钠
阅读下列资料,完成5~7题:
氮及其化合物的转化具有重要应用。 是人工固氮的产物,广泛用于生产铵盐、硝酸、纯碱等:能被NaClO氧化成 (水合肼): 在一定条件下与 反应可制备尿素,尿素加热至
150-160℃将脱氨成缩二脲。
5.实验室制取 时,下列装置能达到相应实验目的的是( )
A. B.
C. D.
6.下列有关氮及其化合物反应过程的说法不正确的是( )
A.人工固氮:
B. 广泛用于生产纯碱:
C. 能被NaClO氧化成 :
D. 在一定条件下与 反应可制备尿素:
7.以 和 为原料可以合成尿素 ,涉及的化学反应如下:
反应Ⅰ: (快) kJ·mol-1
反应Ⅱ: (慢) kJ·mol-1
下列有关说法正确的是( )
A.反应 kJ·mol-1
B. 和 合成尿素的总反应速率由反应Ⅰ决定
C.增大压强,既能加快反应Ⅰ的速率又能提高原料的平衡转化率
D.生产过程中温度越高,尿素的产率越高
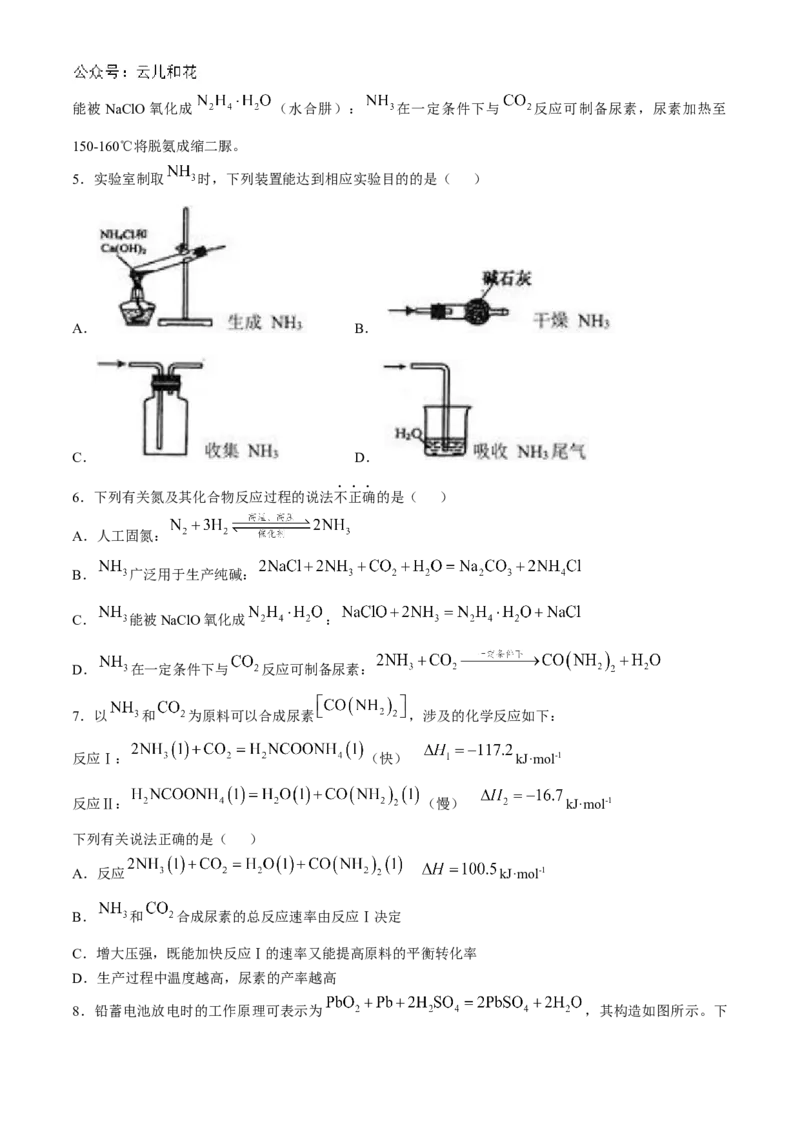
8.铅蓄电池放电时的工作原理可表示为 ,其构造如图所示。下列有关说法正确的是( )
题8图
A.电池工作时, 移向 极移动 B.电池工作时,负极质量减小
C.电池工作时, 发生氧化反应 D.每生成1mol ,转移电子数为
9.下列选项所示的物质间转化均能实现的是( )
A.
B.
C. 漂白粉
D. (稀)
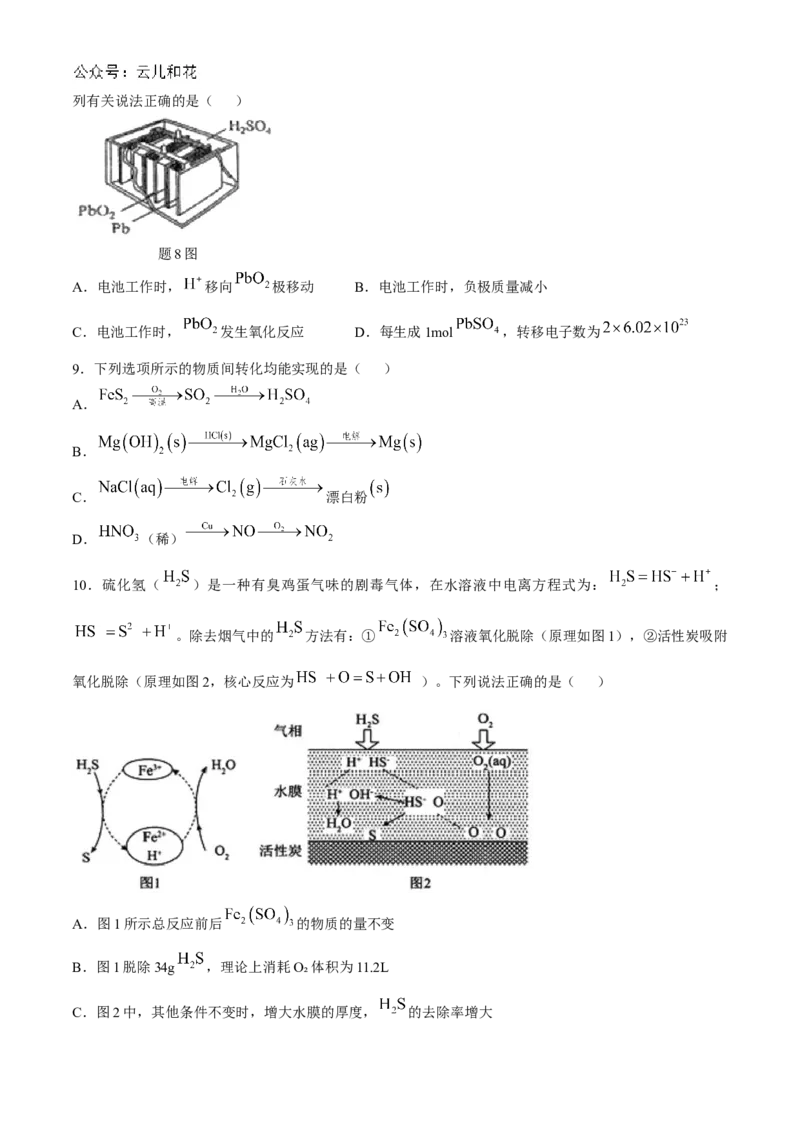
10.硫化氢( )是一种有臭鸡蛋气味的剧毒气体,在水溶液中电离方程式为: ;
。除去烟气中的 方法有:① 溶液氧化脱除(原理如图1),②活性炭吸附
氧化脱除(原理如图2,核心反应为 )。下列说法正确的是( )
A.图1所示总反应前后 的物质的量不变
B.图1脱除34g ,理论上消耗O₂体积为11.2L
C.图2中,其他条件不变时,增大水膜的厚度, 的去除率增大D.图2中,其他条件不变时,增大水膜的pH,促进 的电离, 的去除率一定增大
11.室温下,根据下列实验过程及现象,能验证相应实验结论的是( )
选项 实验过程及现象 实验结论
A 酸 性 :
用0.1mol·L-1NaOH溶液分别中和等体积的0.1mol·L-1 溶液
和0.1mol·L-1 溶液, 消耗的NaOH溶液多
B 向2mLFeSO₄溶液中滴加2~3滴酚酞试液,溶液颜色未发生变化
未水解
C 溶 度 积 常 数 :
向2mL浓度均为0.1mol·L-1的 和 混合溶液中滴加少
量0.1mol·L-1 溶液,振荡,产生白色沉淀
D
结 合 能 力 :
用pH试纸分别测定相同浓度 溶液和 溶液
pH, 溶液pH大
12.已知 是一种二元弱酸, 、 .
室温下,通过下列实验探究盐溶液的性质。
实验 实验操作和现象
1
测得0.1mol·L· 溶液的pH约为4.75
2
向0.1mol·L·1 溶液中滴加等浓度等体积0.1mol·L-1KOH溶液
若忽略溶液混合时的体积变化,下列说法错误的是( )
A.在 溶液中:
B.依据实验1推测:
C.实验2所得溶液中:
D.实验2所得溶液中:
13.在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为
反应Ⅰ: kJ/mol
反应Ⅱ: kJ/mol
反应Ⅲ: kJ/mol
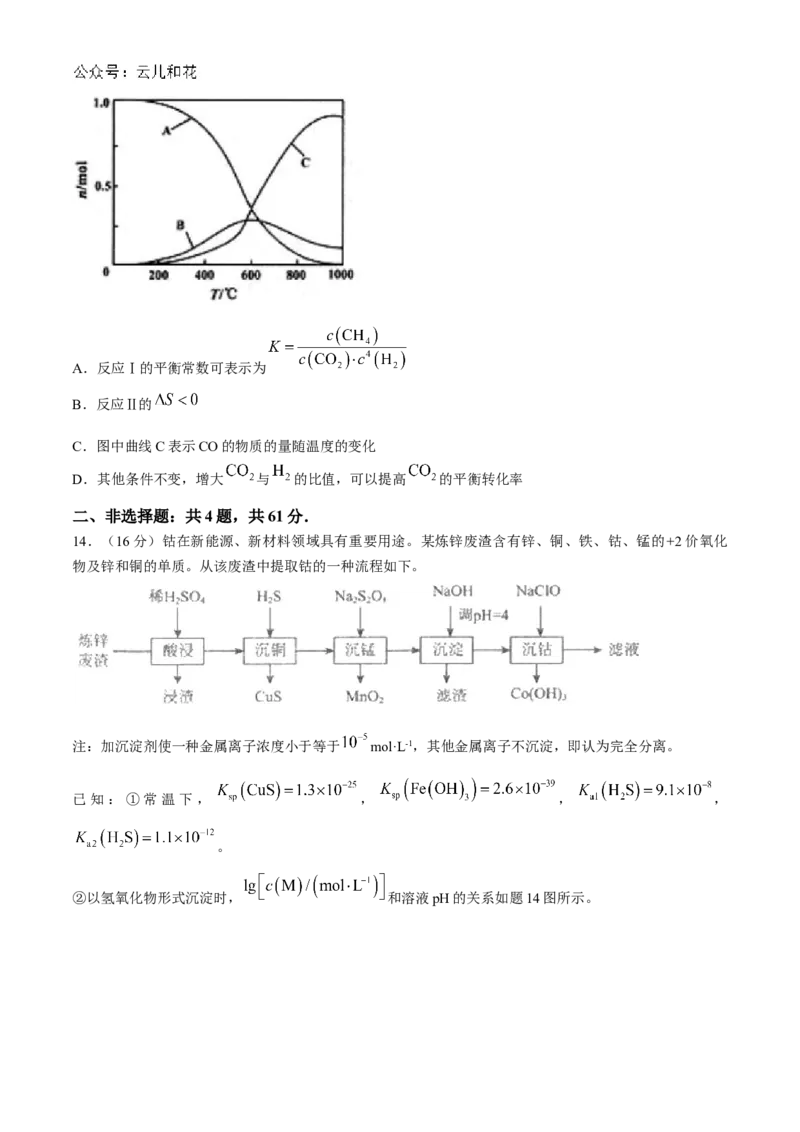
向恒压、密闭容器中通入4mol 和1mol ,平衡时 、CO、 的物质的量随温度的变化如下
图所示。下列说法正确的是( )A.反应Ⅰ的平衡常数可表示为
B.反应Ⅱ的
C.图中曲线C表示CO的物质的量随温度的变化
D.其他条件不变,增大 与 的比值,可以提高 的平衡转化率
二、非选择题:共4题,共61分.
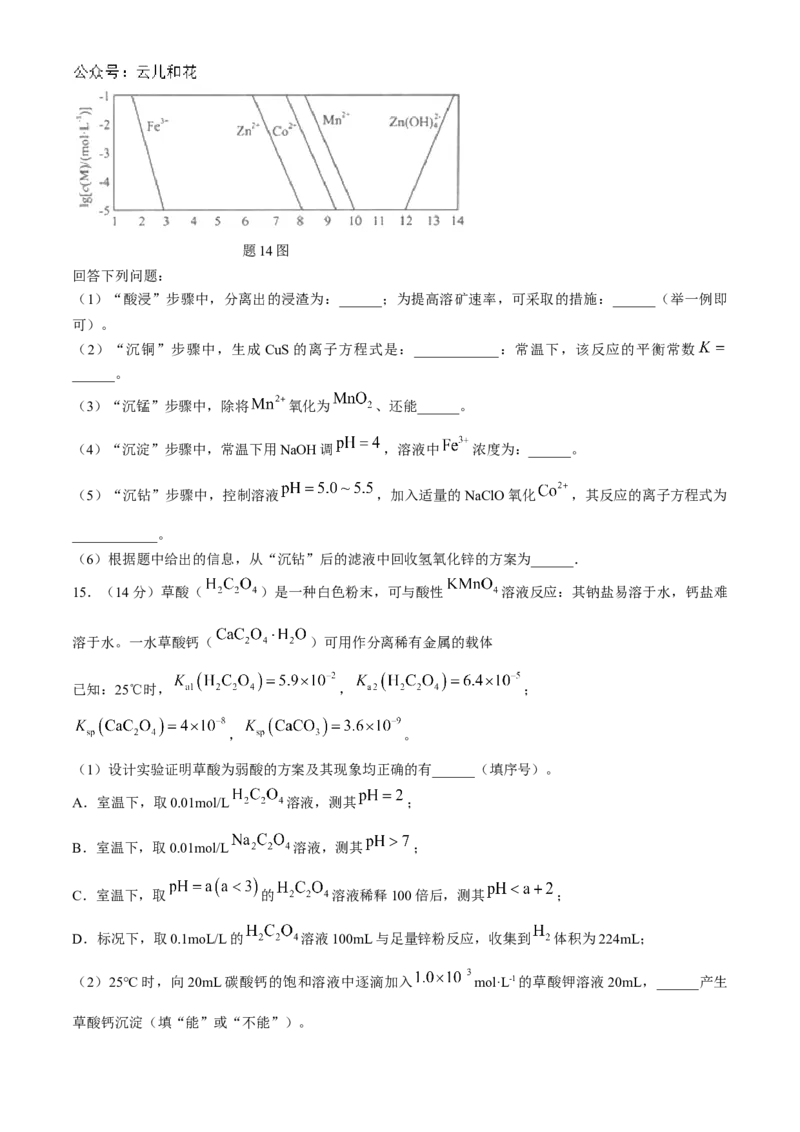
14.(16分)钴在新能源、新材料领域具有重要用途。某炼锌废渣含有锌、铜、铁、钴、锰的+2价氧化
物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
注:加沉淀剂使一种金属离子浓度小于等于 mol·L-1,其他金属离子不沉淀,即认为完全分离。
已知:①常温下, , , ,
。
②以氢氧化物形式沉淀时, 和溶液pH的关系如题14图所示。题14图
回答下列问题:
(1)“酸浸”步骤中,分离出的浸渣为:______;为提高溶矿速率,可采取的措施:______(举一例即
可)。
(2)“沉铜”步骤中,生成 CuS的离子方程式是:____________:常温下,该反应的平衡常数
______。
(3)“沉锰”步骤中,除将 氧化为 、还能______。
(4)“沉淀”步骤中,常温下用NaOH调 ,溶液中 浓度为:______。
(5)“沉钻”步骤中,控制溶液 ,加入适量的NaClO氧化 ,其反应的离子方程式为
____________。
(6)根据题中给出的信息,从“沉钻”后的滤液中回收氢氧化锌的方案为______.
15.(14分)草酸( )是一种白色粉末,可与酸性 溶液反应:其钠盐易溶于水,钙盐难
溶于水。一水草酸钙( )可用作分离稀有金属的载体
已知:25℃时, , ;
, 。
(1)设计实验证明草酸为弱酸的方案及其现象均正确的有______(填序号)。
A.室温下,取0.01mol/L 溶液,测其 ;
B.室温下,取0.01mol/L 溶液,测其 ;
C.室温下,取 的 溶液稀释100倍后,测其 ;
D.标况下,取0.1moL/L的 溶液100mL与足量锌粉反应,收集到 体积为224mL;
(2)25°C时,向20mL碳酸钙的饱和溶液中逐滴加入 mol·L-1的草酸钾溶液20mL,______产生
草酸钙沉淀(填“能”或“不能”)。(3)测定 的纯度:取 3.000g 样品于锥形瓶中,加入 10mL3.0000mol/L
溶液溶解,再稀释至100mL。从锥形瓶中取20.00mL溶液,用0.1000mol/L的 标准溶液滴
定,为了提高实验的准确性,学习小组共进行3次实验,记录数据如下表:
待测液/mL
/mL /mL
20.00 0.00 13.95
20.00 1.05 15.10
20.00 0.35 15.25
①滴定终点的现象是,加入最后半滴 标准溶液,______。
②滴定过程中发生的反应离子方程式为____________。
③计算 的纯度______(写出计算过程)。
④下列操作会引起测定结果偏高的是______(填序号)。
A.滴定管在盛装 溶液前未润洗
B.滴定过程中,锥形瓶振荡的太剧烈,以致部分液体溅出
C.锥形瓶水洗后未干燥
D.滴定前读数正确,滴定终点时仰视读数
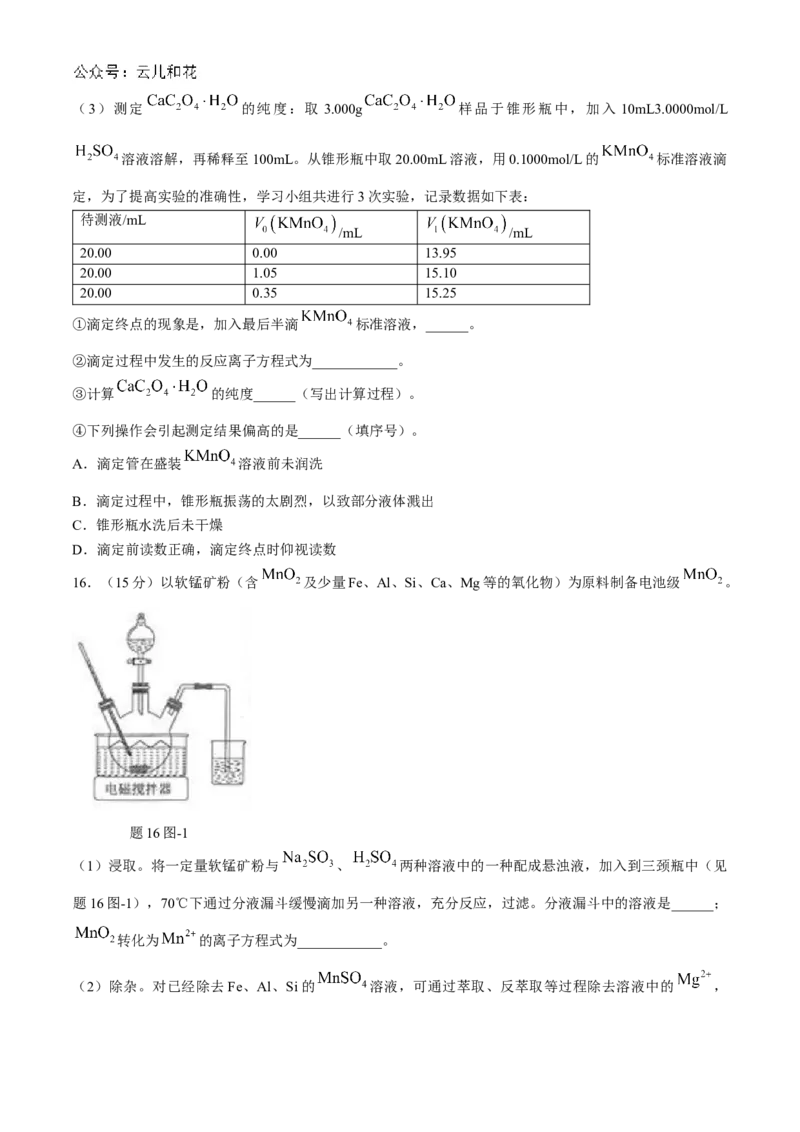
16.(15分)以软锰矿粉(含 及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级 。
题16图-1
(1)浸取。将一定量软锰矿粉与 、 两种溶液中的一种配成悬浊液,加入到三颈瓶中(见
题16图-1),70℃下通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。分液漏斗中的溶液是______;
转化为 的离子方程式为____________。
(2)除杂。对已经除去Fe、Al、Si的 溶液,可通过萃取、反萃取等过程除去溶液中的 ,已知: 被萃取剂HA萃取的原理可表示为 (水层) (有机层) (有
机层) (水层)
反萃取是利用稀硫酸将有机层中的 转移到水层,需将稀硫酸和有机层共同加入到______(填仪器名
称)中进行实验操作。为使 尽可能多地发生上述转移,下列实验条件或操作有效的是______(填序
号)。
A.适当提高 浓度 B.加足量蒸馏水
C.用适量稀硫酸分多次反萃取 D.充分振荡
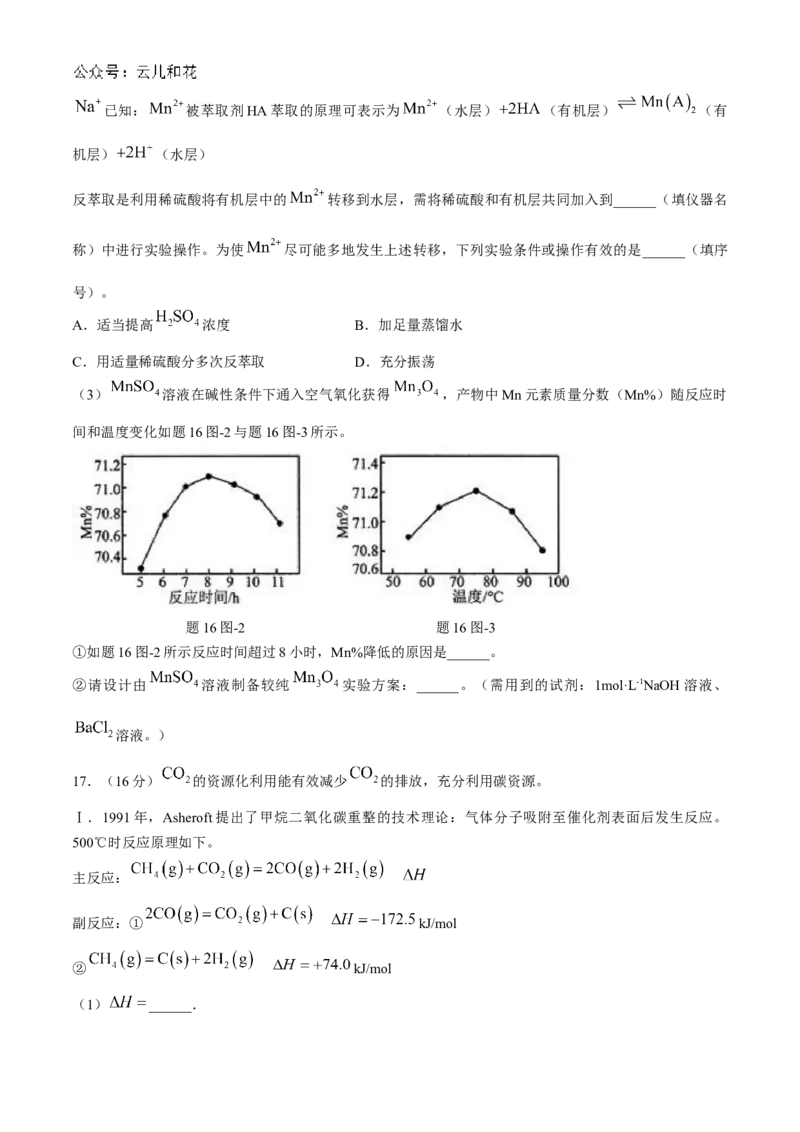
(3) 溶液在碱性条件下通入空气氧化获得 ,产物中Mn元素质量分数(Mn%)随反应时
间和温度变化如题16图-2与题16图-3所示。
题16图-2 题16图-3
①如题16图-2所示反应时间超过8小时,Mn%降低的原因是______。
②请设计由 溶液制备较纯 实验方案:______。(需用到的试剂:1mol·L-1NaOH溶液、
溶液。)
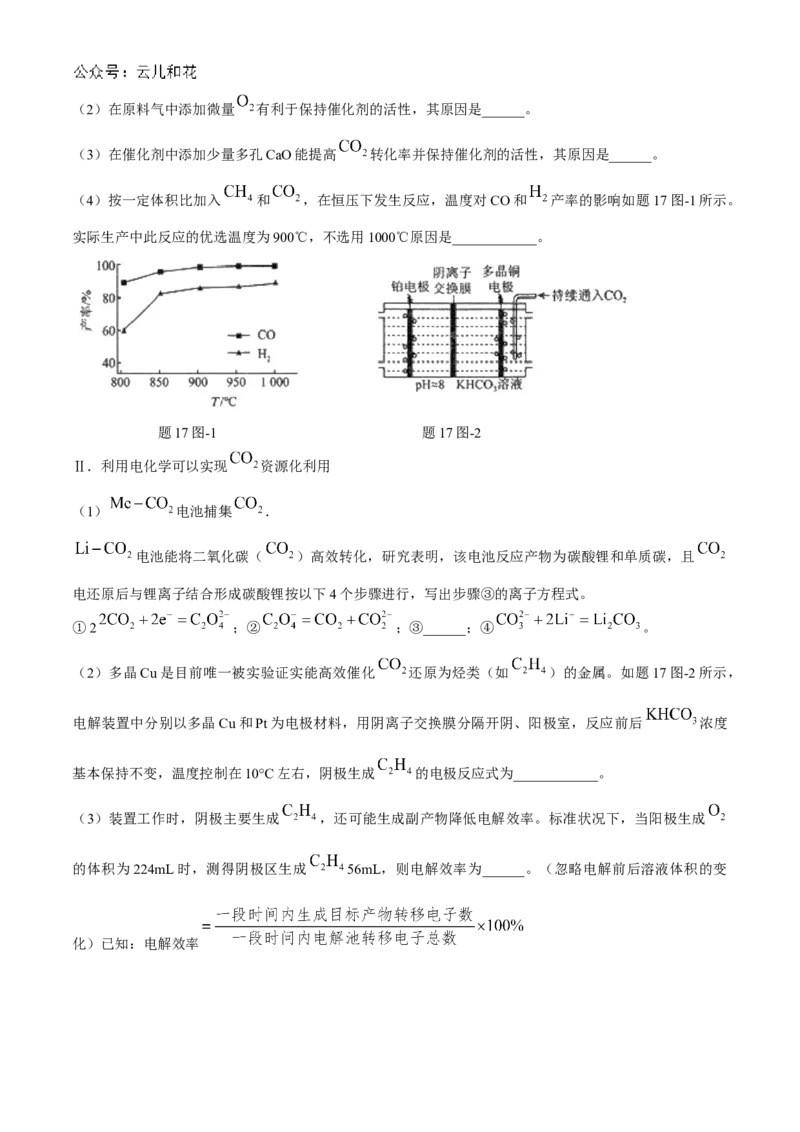
17.(16分) 的资源化利用能有效减少 的排放,充分利用碳资源。
Ⅰ.1991年,Asheroft提出了甲烷二氧化碳重整的技术理论:气体分子吸附至催化剂表面后发生反应。
500℃时反应原理如下。
主反应:
副反应:① kJ/mol
② kJ/mol
(1) ______.(2)在原料气中添加微量 有利于保持催化剂的活性,其原因是______。
(3)在催化剂中添加少量多孔CaO能提高 转化率并保持催化剂的活性,其原因是______。
(4)按一定体积比加入 和 ,在恒压下发生反应,温度对CO和 产率的影响如题17图-1所示。
实际生产中此反应的优选温度为900℃,不选用1000℃原因是____________。
题17图-1 题17图-2
Ⅱ.利用电化学可以实现 资源化利用
(1) 电池捕集 .
电池能将二氧化碳( )高效转化,研究表明,该电池反应产物为碳酸锂和单质碳,且
电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤③的离子方程式。
①2 ;② ;③______;④ 。
(2)多晶Cu是目前唯一被实验证实能高效催化 还原为烃类(如 )的金属。如题17图-2所示,
电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后 浓度
基本保持不变,温度控制在10°C左右,阴极生成 的电极反应式为____________。
(3)装置工作时,阴极主要生成 ,还可能生成副产物降低电解效率。标准状况下,当阳极生成
的体积为224mL时,测得阴极区生成 56mL,则电解效率为______。(忽略电解前后溶液体积的变
化)已知:电解效率2024-2025 学年第一学期高二期中学情调研测试
化学试题答案
1-5:BABCB 6-10:BCADA 11-13:DDC
14(16分)(每空2分)
(1)铜适当提高“酸浸”是的温度/适当提高“酸浸”时稀硫酸的浓度/将炼锌废渣粉碎
(2)
(3)将 氧化为
(4)(5)
(6)向滤液中滴加NaOH溶液,边加边搅拌,控制溶液的 ,静置后过滤、洗涤、干燥。
15.(14分)(1)AC
(2)不能
(3)①溶液变为浅红色,且半分钟不褪色②
③85.17%(4分)
解:从测定数据可得 标准溶液消耗14ml,
根据电子得失可得关系式: , mol/L L
mol(1分),
可得100ml溶液中: mol(1分),
g(1分),
则该样品中 的质量分数为2.555g/3g (1分)
④AD(除标注外,其余每空2分)
16.(15分)(1) 溶液
(2)分液漏斗ACD
(3) 被氧化成更高价态锰的氧化物( 或 ) 向 溶液中加入一定量
1mol·L-1NaOH溶液,边搅拌边通入空气,控制75℃加热8h左右,过滤,洗涤,取最后一次洗涤滤液中加
溶液,无浑浊(5分)(除标注外,其余每空2分)
17.(16分)Ⅰ.(1)+246.5kJ/mol
(2)微量 及时与副反应①、②产生的碳反应,防止催化剂表面积碳
(3)少量多孔CaO有利于将 吸附至催化剂表面,促进主反应进行,提高催化效率;高浓度的 有
利于消除催化剂表面的积碳,保持了催化剂的活性
(4)900°C时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低
Ⅱ.(1) (3分)(2) (3分)(3)75%(除标注外,其余每空2分)