文档内容
莆田一中 2023-2024 学年度上学期第一学段考试试卷
高三 化学
(时间:75分钟 满分 100 分)
可能用到的相对原子质量: H1 C12 O16 Na23 S32 Mo96
一、单项选择题(共10小题,每小题4分,满分40分)
1. 化学与人类的生产、生活有着密切联系。下列叙述正确的是
A. 误食重金属盐引起人体中毒,可以喝大量的食盐水解毒
B. 嫦娥5号在月球展示的红旗是用蚕丝粉、芳纶等组成的复合材料,该材料属于新型无机非金属材料
C. SO₂可用于丝织品漂白是由于其能氧化丝织品中有色成分
D. 食品袋中放入盛有硅胶和铁粉的透气小袋目的是防止食物受潮、氧化
2. N 为阿伏加德罗常数的值。下列说法正确的是
A
A.19g羟基 (−18OH)所含中子数为 10N
A
B. 标准状况下, 44.8L HF 含有2N 个极性键
A
C.1mol NaHSO₄晶体含有的离子数为3N
A
D.0.1mol⋅L⁻¹KAl(SO₄)₂溶液中SO2−
的数目为 0.2N
4 A
3. 下列有关物质的应用与氧化还原反应无关的是
A. 用细菌将 H₂S 转化为H₂SO₄
B. 用 Na₂O₂作潜水器的供氧剂
C. 用明矾处理污水
D. 用糯米为原料酿制啤酒
4.臭氧层可阻止紫外线辐射,氟利昂(如( CFCl₃))破坏臭氧层的反应过程如图所示。下列说法正确的是
A. 过程I中断裂极性键C—F键 B. 过程II和III中不涉及电子转移
C. 臭氧被破坏的过程中Cl作催化剂 D. CFCl₃的空间构型是正四面体形
5.下列各组离子中,能大量共存且加入(或通入)少量X试剂后发生反应的离子方程式对应正确的是
选 离子组 试剂X 离子方程式
项
A
Mg²⁺、K⁺、Cl⁻、SO2−
氨水 Mg²⁺+2OH⁻=Mg(OH)₂↓
4
B K⁺、HCO₃⁻、AlO₂⁻ 少量CO₂ 2AlO₂⁻+3H₂O+CO₂=2Al(OH)₃↓+CO2− ⁻
3
C NH₄⁺、Fe²⁺、SO2− 少量Ba(OH)₂溶液 Fe²⁺+SO2− +Ba²⁺+2OH⁻=Fe(OH)₂↓+BaSO₄↓
4 4K⁺、Na⁺、ClO⁻、SO2−
D 4 少量SO₂ SO₂+ClO⁻+H₂O=SO2− +Cl⁻+2H⁺
4
⁻
6.对于反应 2SO₂(g)+O₂(g)=2SO₃(g)△H=akJ⋅mol⁻¹,能量变化如图所示。下列说法中,不正确的
是( )
A.2SO₂(g)+O₂(g)⇌2SO₃(l)△H>akJ⋅mol⁻¹
B. 过程II可能使用了催化剂,使用催化剂不可以提高 SO₂的平衡转化率
C. 反应物断键吸收能量之和小于生成物成键释放能量之和
D. 将 2mol SO₂(g)和 l mol O₂(g)置于一密闭容器中充分反应后, 放出或吸收的热量小于|a|kJ
7. 完成下述实验,装置或试剂不正确的是
D. 制 备 晶 体
A. 制备NH₃ B. 测量 O₂体积 C. 制备Fe(OH)₂
Cu(NH₃)₄]SO₄·H₂O
8. 部分含镁或含铜物质的分类与相应化合价关系如图所示,其中e为氯化物。下列推断不合理的是
A. 转化a→c→d在给定条件下均可一步反应实现
B. b可与盐酸反应生成e和 a,b既有氧化性又有还原性
C. 新制的 d 可用于检验葡萄糖中的醛基
D. 经过e→d→e→a的转化可实现从海水中提取镁
9. 某溶液含 Na+ 、N H+ 、SO2−、Cl−、Fe2+ 、Fe3+ 中的几种,且各离子浓度相同。为确定其组成,
4 4
进行实验:①取少量溶液,加入足量HNO₃酸化的 Ba(NO₃)₂(aq),产生白色沉淀,过滤;②向滤液中加
入足量的 NaOH(aq),产生红褐色沉淀,微热,产生气体。关于原溶液的说法正确的是
A. 不能确定是否有 Fe³⁺
B. 需通过焰色反应确定 Na⁺是否存在
C.Fe²⁺、Fe³⁺都存在
D. 存在 N H+ 、SO2−、Cl−、Fe2+
4 4
10. LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:下列说法错误的是
A. 还原工序逸出的Br₂用NaOH溶液吸收,吸收液直接返回还原工序
B. 除杂工序中产生的滤渣可用煤油进行组分分离
C. 中和工序中的化学反应为 Li₂CO₃+2HBr=CO₂↑+2LiBr+H₂O
D. 参与反应的 n(Br₂):n(BaS):n(H₂SO₄)为1∶1∶1
二、填空题(共4小题,满分60分)
11.(15分)钠及其化合物在生产、生活中有着重要的用途,根据所学知识,回答下列问题。
I.某汽车安全气囊的产气药剂主要含有 NaN₃、Fe₂O₃、KClO₄、NaHCO₃等物质。当汽车发生碰撞
时,NaN₃迅速分解产生 N₂和Na,同时放出大量的热,N₂使气囊迅速膨胀,从而起到保护作用。
(1)KClO₄可处理产生的Na, KClO₄中氯元素的化合价为 。
(2)NaHCO₃是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为
。
II.某实验小组设计如下实验方案测定 Na₂CO₃与 Na₂SO₃混合物中各组分的含量。
(3)方案一:称取30g样品,置于坩埚中加热至恒重,冷却、称量,剩余固体质量为31.6g, 计算。
①实验中加热至恒重的目的是 。
②样品中 Na₂CO₃的质量分数为 。
(4)方案二: 用如图所示装置(铁架台、 铁夹等仪器未在图中画出)进行实验。
①装置C的作用是 ;装置F的作用是 。
②实验过程中,当装置A内的固体反应完全后,需打开活塞 K,向 A 中通入大量的氮气。这样做的目的
是 。
(5)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量 BaCl₂溶液。过滤、
洗 涤 、 干 燥 沉 淀 , 称 量 固 体 质 量 。 实 验 中 判 断 沉 淀 洗 涤 干 净 的 方 法 是
。
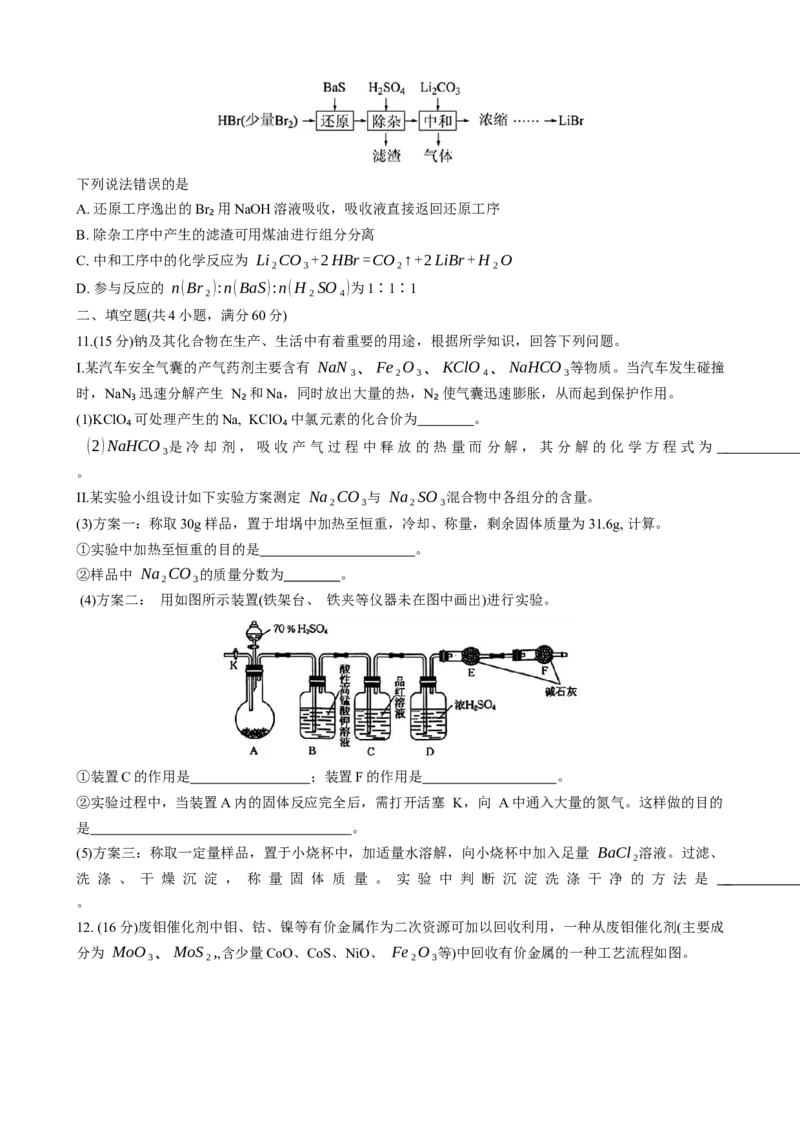
12. (16分)废钼催化剂中钼、钴、镍等有价金属作为二次资源可加以回收利用,一种从废钼催化剂(主要成
分为 MoO₃、MoS₂,,含少量CoO、CoS、NiO、 Fe₂O₃等)中回收有价金属的一种工艺流程如图。已知: 溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Fe³⁺ Co²⁺ Ni²⁺
开始沉淀时 (c=0.01 mol·L⁻¹) 的pH 2.2 6.4 7.2
沉淀完全时(c=1.0×10⁻⁵mol·L⁻¹) 的 pH 3.2 9.0 8.7
回答下列问题:
(1)Ni在元素周期表中的位置为 , “焙烧”时产生的气体 A的主要成分为
。
(2)“焙烧”时 MoS₂转化为 MoO₃,,写出“碱浸”时 MoO₃参与反应的离子方程式
。
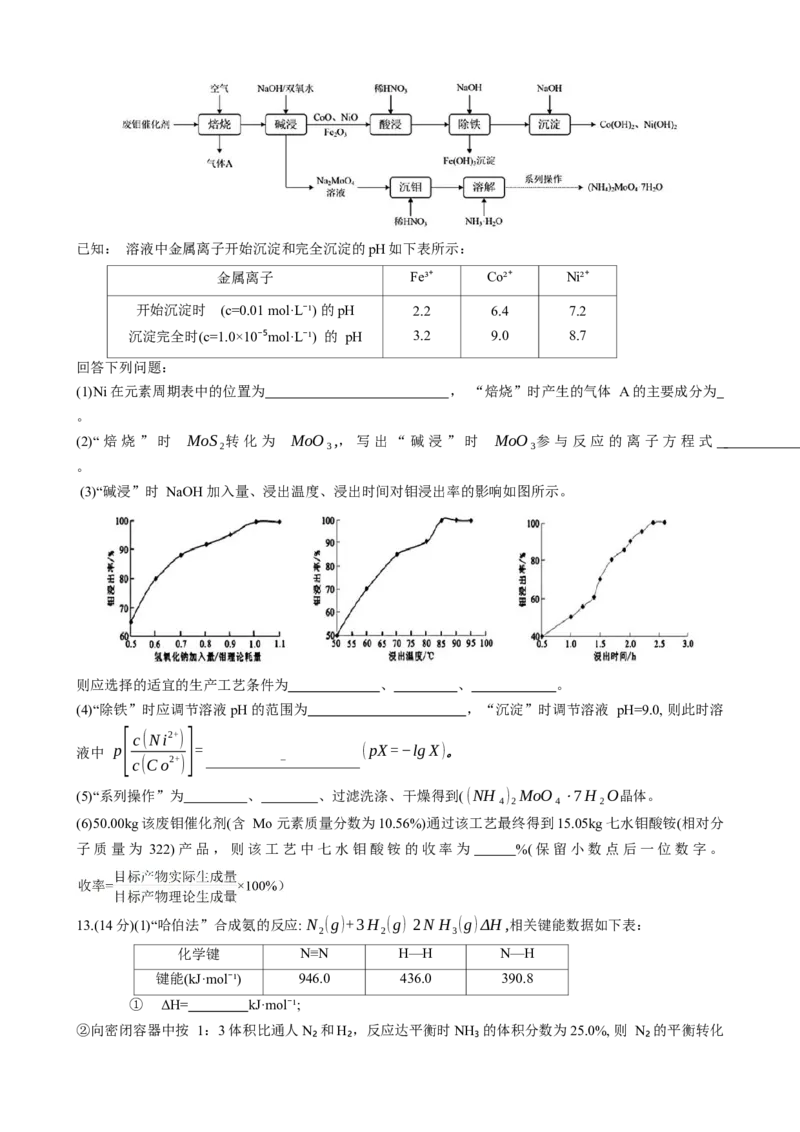
(3)“碱浸”时 NaOH 加入量、浸出温度、浸出时间对钼浸出率的影响如图所示。
则应选择的适宜的生产工艺条件为 、 、 。
(4)“除铁”时应调节溶液pH的范围为 ,“沉淀”时调节溶液 pH=9.0, 则此时溶
[ c(Ni2+)]
液中 p = (pX=−lgX)。
c(Co2+)
¯
(5)“系列操作”为 、 、过滤洗涤、干燥得到( (NH₄)₂MoO₄⋅7H₂O晶体。
(6)50.00kg该废钼催化剂(含 Mo 元素质量分数为10.56%)通过该工艺最终得到15.05kg七水钼酸铵(相对分
子质量为 322)产品,则该工艺中七水钼酸铵的收率为 %(保留小数点后一位数字。
13.(14分)(1)“哈伯法”合成氨的反应: N (g)+3H (g) 2N H (g)ΔH,相关键能数据如下表:
2 2 3
化学键 N≡N H—H N—H
键能(kJ·mol⁻¹) 946.0 436.0 390.8
① ΔH= kJ·mol⁻¹;
②向密闭容器中按 1:3 体积比通人N₂和H₂,反应达平衡时NH₃的体积分数为25.0%, 则 N₂的平衡转化率( a(N₂)= 。
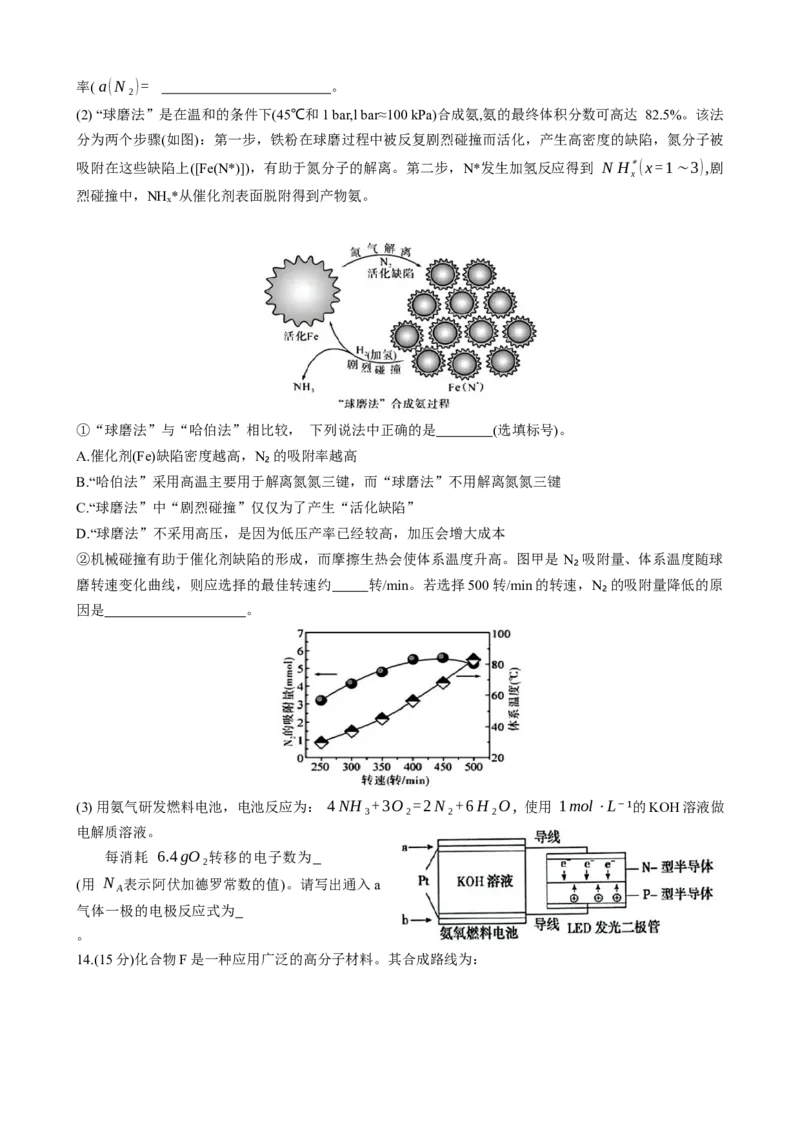
(2) “球磨法”是在温和的条件下(45℃和1 bar,l bar≈100 kPa)合成氨,氨的最终体积分数可高达 82.5%。该法
分为两个步骤(如图):第一步,铁粉在球磨过程中被反复剧烈碰撞而活化,产生高密度的缺陷,氮分子被
吸附在这些缺陷上([Fe(N*)]),有助于氮分子的解离。第二步,N*发生加氢反应得到 N H∗(x=1∼3),剧
x
烈碰撞中,NHₓ*从催化剂表面脱附得到产物氨。
①“球磨法”与“哈伯法”相比较, 下列说法中正确的是 (选填标号)。
A.催化剂(Fe)缺陷密度越高,N₂的吸附率越高
B.“哈伯法”采用高温主要用于解离氮氮三键,而“球磨法”不用解离氮氮三键
C.“球磨法”中“剧烈碰撞”仅仅为了产生“活化缺陷”
D.“球磨法”不采用高压,是因为低压产率已经较高,加压会增大成本
②机械碰撞有助于催化剂缺陷的形成,而摩擦生热会使体系温度升高。图甲是 N₂吸附量、体系温度随球
磨转速变化曲线,则应选择的最佳转速约 转/min。若选择500转/min的转速,N₂的吸附量降低的原
因是 。
(3) 用氨气研发燃料电池,电池反应为: 4NH₃+3O₂=2N₂+6H₂O, 使用 1mol⋅L⁻¹的KOH溶液做
电解质溶液。
每消耗 6.4gO₂转移的电子数为
(用 N 表示阿伏加德罗常数的值)。请写出通入a
A
气体一极的电极反应式为
。
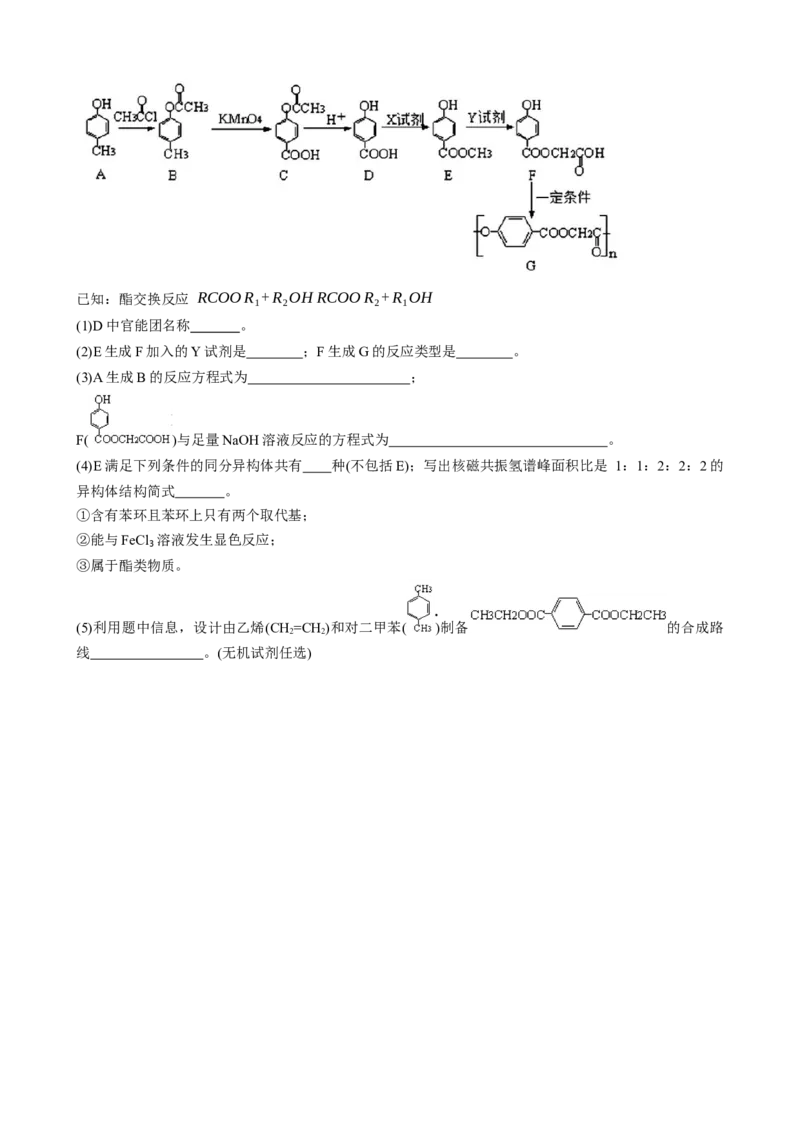
14.(15分)化合物F是一种应用广泛的高分子材料。其合成路线为:已知:酯交换反应 RCOOR +R OH RCOOR +R OH
1 2 2 1
(1)D中官能团名称 。
(2)E生成F加入的Y试剂是 ;F生成G的反应类型是 。
(3)A生成B的反应方程式为 ;
F( )与足量NaOH溶液反应的方程式为 。
(4)E满足下列条件的同分异构体共有 种(不包括E);写出核磁共振氢谱峰面积比是 1:1:2:2:2的
异构体结构简式 。
①含有苯环且苯环上只有两个取代基;
②能与FeCl₃溶液发生显色反应;
③属于酯类物质。
(5)利用题中信息,设计由乙烯(CH=CH )和对二甲苯( )制备 的合成路
2 2
线 。(无机试剂任选)莆田一中 2023-2024 学年度上学期第一学段考试试卷
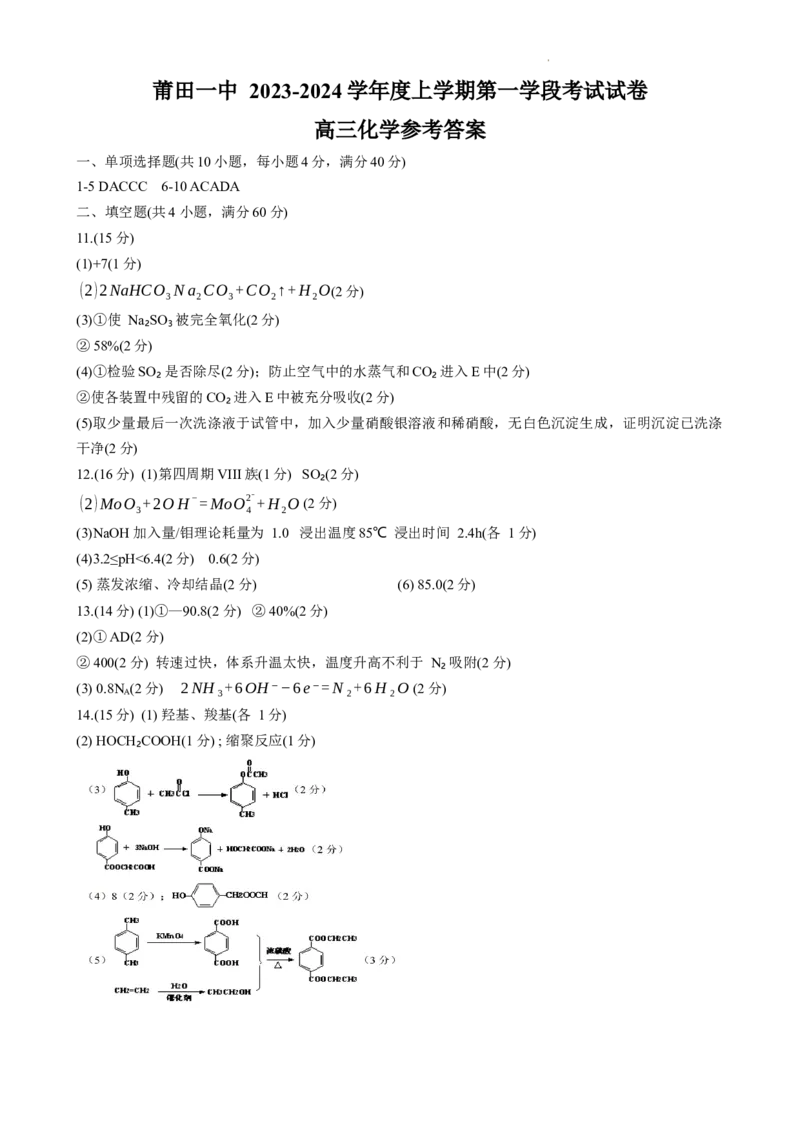
高三化学参考答案
一、单项选择题(共10小题,每小题4分,满分40分)
1-5 DACCC 6-10 ACADA
二、填空题(共4 小题,满分60分)
11.(15 分)
(1)+7(1分)
(2)2NaHCO Na CO +CO ↑+H O(2分)
3 2 3 2 2
(3)①使 Na₂SO₃被完全氧化(2分)
②58%(2分)
(4)①检验SO₂ 是否除尽(2分);防止空气中的水蒸气和CO₂进入E中(2分)
②使各装置中残留的CO₂进入E中被充分吸收(2分)
(5)取少量最后一次洗涤液于试管中,加入少量硝酸银溶液和稀硝酸,无白色沉淀生成,证明沉淀已洗涤
干净(2分)
12.(16分) (1)第四周期VIII族(1分) SO₂(2分)
(2)MoO
+2OH−=MoO2−+H
O (2分)
3 4 2
(3)NaOH 加入量/钼理论耗量为 1.0 浸出温度85℃ 浸出时间 2.4h(各 1分)
(4)3.2≤pH<6.4(2分) 0.6(2分)
(5) 蒸发浓缩、冷却结晶(2分) (6) 85.0(2分)
13.(14分) (1)①—90.8(2 分) ②40%(2分)
(2)①AD(2 分)
②400(2 分) 转速过快,体系升温太快,温度升高不利于 N₂吸附(2 分)
(3) 0.8N (2分) 2NH₃+6OH⁻−6e⁻=N₂+6H₂O (2分)
A
14.(15分) (1) 羟基、羧基(各 1分)
(2) HOCH₂COOH(1分) ; 缩聚反应(1分)
学科网(北京)股份有限公司