文档内容
2025-2026 学年第一学期高二年级期中考试
化学试题
考试时间:75分钟 考试分值:100分
一.单选题(共15道,每道3分,共45分)
1.已知热化学方程式:
①CO(g)+1/2O (g)=CO (g) ΔΗ= -283.0kJ/mol
2 2
②H(g)+1/2O (g)=HO(g) ΔΗ= -241.8kJ/mol
2 2 2
据此判断下列说法正确的是
A.H(g)+1/2O (g)=HO(l) ΔΗ>-241.8kJ/mol
2 2 2
B.H(g)的燃烧热ΔΗ =-241.8 kJ/mol
2
C.H(g)转变成HO(g)的化学反应一定放出能量
2 2
D.CO(g)+ H O(g)= CO (g)+ H (g)的ΔΗ =-41.2kJ/mol
2 2 2
2.下列说法正确的是
A.已知 的燃烧热: ,则 反应的
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H O(l)ΔH=−57.3kJ⋅mol−1,则含 的稀溶液
2
与稀醋酸完全中和,放出 的热量
C.生成物的总能量大于反应物的总能量时,
D.一定条件下将 和 置于密闭容器中充分反应,放出热量 ,则:
❑
2SO (g)+O (g)⇌2SO (g)ΔH=−158.4kJ⋅mol−1
2 2 3
3.下列说法不正确的是
A.需要加热才能发生的化学反应不一定是吸热反应
B.放热反应在常温下一定很容易发生
C.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(ΔH)决
定
D.化学反应除了生成新的物质外,还伴随着能量的变化4.下列属于放热反应的是
A.镁条溶于盐酸 B.氨气液化 C.碳酸钙分解 D.硝酸铵溶于水
5.化学家格哈德·埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
下列关于合成氨反应的叙述中不正确的是
A.常温下该反应难以进行,是因为常温下生成物的化学键难以形成
B.该过程表明,在化学反应中存在化学键的断裂与形成
C.在催化剂的作用下,反应物的化学键变得容易断裂
D.过程②需吸收能量,过程③则放出能量
6.对于反应4NH
3
(g)+5O
2
(g) 4NO(g)+6H
2
O(g) △H=−905.8 kJ∙mol−1,下列说法正确的是
A.该反应须在高温下才能自发进行
B.升高温度、增大压强都有利于提高NH 的平衡转化率
3
C.0.4 mol NH 与0.5 mol O 充分反应可释放90.58 kJ的能量
3 2
D.及时分离出混合体系中的水可以促使平衡正向移动
7.已知298 K下反应2Al O(s)+3C(s)=4Al(s)+3CO(g) ΔH=+2171 kJ/mol,ΔS=+635.5 J/(mol·K),则下
2 3 2
列说法正确的是
A.由题给ΔH值可知,该反应是一个放热反应B.ΔS>0表明该反应是一个熵增加的反应
C.该反应在室温下可能自发 D.不能确定该反应能否自发进行
8.下列食品添加剂中,其使用目的与反应速率有关的是
A.甜味剂 B.着色剂 C.调味剂 D.抗氧化剂
9.有关下列实验操作中说法正确的是( )
A.萃取操作中倒转分液漏斗用力振荡时,应关闭玻璃塞和活塞
B.蒸馏时若选择球形冷凝管,冷凝效果更好
C.渗析使用的半透膜是一种离子交换膜
D.可用pH试纸测定NaClO溶液的pH
10.下列物质中,属于强电解质的是
A.SO B.饱和食盐水 C.NH •H O D.BaSO
3 3 2 4
11.下列根据实验操作和现象所得结论正确的是选
实验操作 实验现象 结论
项
A 向某溶液中滴加少量酚酞试液 溶液变红 该溶液一定是碱
B 向NaCO 溶液中滴加盐酸 有气泡产生 非金属性:Cl>C
2 3
C 向饱和AgCl溶液中滴加饱和食盐水 产生白色沉淀 AgCl溶液中存在沉淀溶解平衡
D 向FeI 溶液中逐滴滴加氯水 溶液变黄 氧化性:Cl>Fe3+
2 2
A.A B.B C.C D.D
12.N 是阿伏加 德罗常数的值。下列说法正确的是
A
A.16.25g FeC1 水解形成的Fe(OH) 胶体粒子数为0.1N
3 3 A
B.pH=1的HPO 溶液中,含有0.1N 个H+
3 4 A
C.常温常压下,124 gP 中所含P—P键数目为4N
4 A
D.15.6g由NaS和NaO 组成的混合物中,含有的阴离子数目为0.2N
2 2 2 A
13.碱性电池具有容量大.放电电流大的特点,因而得到广泛应用。碱性锌锰电池以氢氧化钾溶液为电解
液,电池反应方程式为:
Zn(s)+2MnO (s)+HO(l)=Zn(OH) (s)+MnO(s),下列说法中错误的是
2 2 2 2 3
A.电池工作时,电子由正极通过外电路流向负极
B.电池正极的电极反应式为2MnO (s)+HO(l)+2e-=Mn O(s)+2OH-(aq)
2 2 2 3
C.电池工作时,锌失去电子
D.外电路中每通过0.2 mol电子,锌的质量减少6.5 g
14.下列说法正确的是
A.钢铁发生电化学腐蚀时负极反应式为
B.明矾净水过程中发生反应:
C.常温下,向 的“84”消毒液中加入少量水, 增大
D.常温下,向纯碱溶液中加入少量CaCl 固体,可以增强其去油污能力
2
15.利用CH 和O 的反应,用铂电极在KOH溶液中构成燃料电池。下列说法错误的是
4 2
A.通入O 一极发生还原反应
2
B.负极的电极反应式为:CH-8e-+8OH-=CO +6H O
4 2 2
C.该电池总反应为:CH+2O +2KOH=K CO+3H O
4 2 2 3 2D.KOH溶液需要定期补充
二、非选择题(共55分)
16.研究弱电解质的电离,有重要的实际意义。
I.醋酸是一种常见的有机酸
(1)醋酸的电离方程式为 。
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是___________。
A.c(CHCOO-) B.c(H+)
3
C.c(OH-) D.CHCOOH电离平衡常数
3
(3)将0.1mol·L-1CHCOOH溶液中加水稀释,c(CHCOO-)/c(CH COOH)的比值将 (填“变大”、
3 3 3
“不变”或“变小”),溶液导电性 (填“变大”、“不变”或“变小”)。
(4)弱电解质达电离平衡说法正确的是___________(填字母)。
A.分子和离子的浓度均不再发生变化,所以说电离平衡是静态平衡
B.电解质达到电离平衡后,各离子浓度均相等
C.电离平衡是相对的、暂时的,外界条件改变时平衡可能发生移动
D.弱电解质分子电离产生离子与离子结合生成弱电解质分子速率相等
II.对比酸性的相对强弱
(5)某些弱酸在25℃时的电离常数如下:
化学式 CHCOOH HSCN HCN HClO HCO
3 2 3
电离常 1.3×10- 4.9×10- 3.0×10- K=4.4×10-7,K=4.7×10-
1.8×10-5 1 2
数 1 10 8 11
①下列反应可以发生的是 (填字母)。
A.CHCOOH+NaCO=NaHCO+CHCOONa B.CHCOOH+NaCN=CHCOONa+HCN
3 2 3 3 3 3 3
C.CO+HO+2NaClO=Na CO+2HClO D.NaHCO +HCN=NaCN+HO+CO↑
2 2 2 3 3 2 2
②将20mL1mol·L-1CHCOOH溶液和20mL1mol·L-1HSCN溶液分别与20mL1mol·L-1NaHCO 溶液混合,
3 3
画出产生的CO 气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式 。
2
17.有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸
取试样进行检测。(1)该学生的操作 (填“正确”或“错误”),该操作是否一定有误差?并说明原因
。
(2)若用此方法分别测定c(OH-)相等的氢氧化钠溶液和氨水的pH,误差较大的是 ,原因是
。
(3)只从下列试剂中选择实验所需的试剂,你能否区分0.1mol∙L-1硫酸溶液和0.01mol∙L-1硫酸溶液?
,简述操作过程: 。
试剂:A.紫色石蕊试液 B.酚酞试液 C.甲基橙溶液 D.蒸馏水 E.氯化钡溶液 F.pH试纸
18.(1)向0.1mol/L Na CO 溶液中滴入酚酞,溶液呈现 色,原因是 (用离子方程
2 3
式表达),加热后颜色 。
(2)向0.1mol/L FeCl 溶液中滴入石蕊,溶液呈现 色,所以配制FeCl 溶液时需要加入 。
3 3
A 稀HSO B HCl溶液 C NaCl溶液 D NaOH溶液
2 4
(3)若将0.1mol/L FeCl 溶液蒸干得到的固体物质为 ,灼烧后得到的固体物质为 。
3
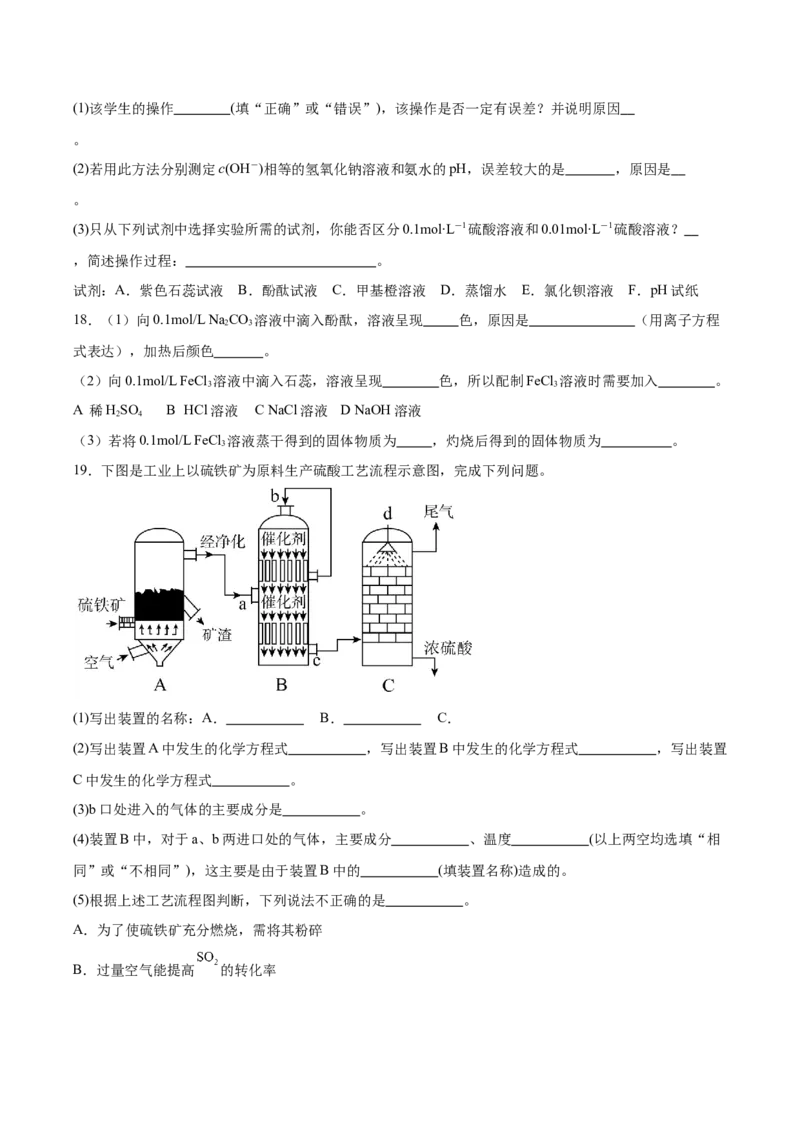
19.下图是工业上以硫铁矿为原料生产硫酸工艺流程示意图,完成下列问题。
(1)写出装置的名称:A. B. C.
(2)写出装置A中发生的化学方程式 ,写出装置B中发生的化学方程式 ,写出装置
C中发生的化学方程式 。
(3)b口处进入的气体的主要成分是 。
(4)装置B中,对于a、b两进口处的气体,主要成分 、温度 (以上两空均选填“相
同”或“不相同”),这主要是由于装置B中的 (填装置名称)造成的。
(5)根据上述工艺流程图判断,下列说法不正确的是 。
A.为了使硫铁矿充分燃烧,需将其粉碎
B.过量空气能提高 的转化率C.使用催化剂能提高 的转化率和反应速率
D.装置A排出的矿渣可供炼铁
E.装置C中填入空心瓷砖是为了增大接触面积,提高 的吸收率
F.从装置A中出来的气体需要净化,其主要目的是为了降低混合气体的温度
(6)装置C中排出的尾气不能直接排放到空气中,主要是因为尾气中含有 等气体,直接排放到
空气中可能造成的污染是 。实验室中,通常用 吸收该尾气,反应的化学方程式
。题号 1 2 3 4 5 6 7 8 9 10
答案 D A B A A D B D A D
题号 11 12 13 14 15
答案 C D A C B
16.(1)CH COOH H+ +CH COO-
3 3
(2)B
(3) 变大 变小
(4)CD
(5) AB
17. 错误 不一定产生误差,因为原溶液不是中性时,稀释后溶液pH发生了变化;若是中性溶
液,稀释不会产生误差 氢氧化钠溶液 稀释过程中,NH ∙H O继续电离出OH-,减弱了因稀释
3 2
OH-浓度减小程度,所以测得氢氧化钠溶液误差较大 能 用玻璃棒分别蘸取两种溶液滴在两张
pH试纸上,其显示的颜色与标准比色卡对照,pH较大的是0.01mol∙L-1硫酸溶液
18. 红 CO +HO HCO +OH- 变深 红 B Fe(OH) Fe O
2 3 2 3
19.(1) 沸腾炉 接触室 吸收塔
(2) 4FeS +11O 2Fe O+8SO ; 2SO (g)+O(g) 2SO (g) SO +HO=HSO 。
2 2 2 3 2 2 2 3 3 2 2 4
(3)氧气、氮气、二氧化硫等
(4) 相同 不相同 热交换器
(5)CF