文档内容
2024—2025 学年度第二学期期中考试高二年级化学试题
卷面满分值:100分、考试时间:75分钟
可能用到的相对原子质量:H 1、C 12、N 14、O 16、S 32、Cl 35.5、K 39、Mn 55、Cu 64、Sn 119
第 I 卷 选 择 题 ( 共 3 9 分 )
一 、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.2025央视春晚舞台上,创意融合舞蹈《秧BOT》,不仅仅是一场视觉盛宴,更是科技与
传统文化的完美结合。下列说法不正确的是
A.为机器人提供续航的锂电池,轻便稳定,比能量较低
B.B.机器人穿着喜庆的红色棉袄,其中棉花属于天然有机高分子
C.机器人的机身应用了碳纤维,是一种含碳量在90%以上的高强度纤维
D.铝合金和钛合金也是制造机器人的重要原材料,钛合金强度高耐腐蚀,铝合金轻质成
本低,都是极为重要的金属材料
2.反应 可用于制备火箭推进剂N H 。下列说法正确的是
2 4
A.N H 分子中N的化合价为-3 B.Na+的结构示意图:
2 4
C.H O的结构式: D.NH 的分子构型为平面正三角形
2 3
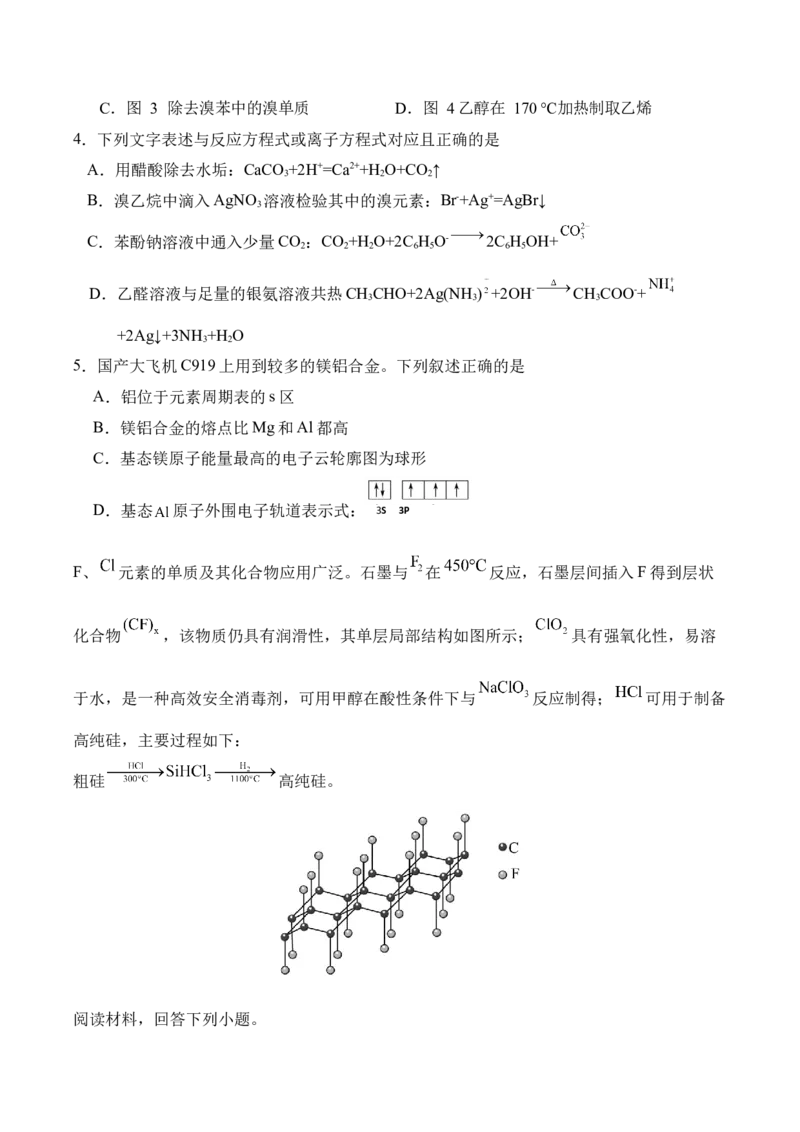
3.下列实验装置能达到实验目的的是
A.图 1 分离乙醇和乙酸 B.图 2 除去甲烷中的乙烯C.图 3 除去溴苯中的溴单质 D.图 4乙醇在 170 ℃加热制取乙烯
4.下列文字表述与反应方程式或离子方程式对应且正确的是
A.用醋酸除去水垢:CaCO +2H+=Ca2++H O+CO ↑
3 2 2
B.溴乙烷中滴入AgNO 溶液检验其中的溴元素:Br-+Ag+=AgBr↓
3
C.苯酚钠溶液中通入少量CO :CO +H O+2C H O- 2C H OH+
2 2 2 6 5 6 5
D.乙醛溶液与足量的银氨溶液共热CH CHO+2Ag(NH ) +2OH- CH COO-+
3 3 3
+2Ag↓+3NH +H O
3 2
5.国产大飞机C919上用到较多的镁铝合金。下列叙述正确的是
A.铝位于元素周期表的s区
B.镁铝合金的熔点比Mg和Al都高
C.基态镁原子能量最高的电子云轮廓图为球形
D.基态 原子外围电子轨道表示式: 3S 3P
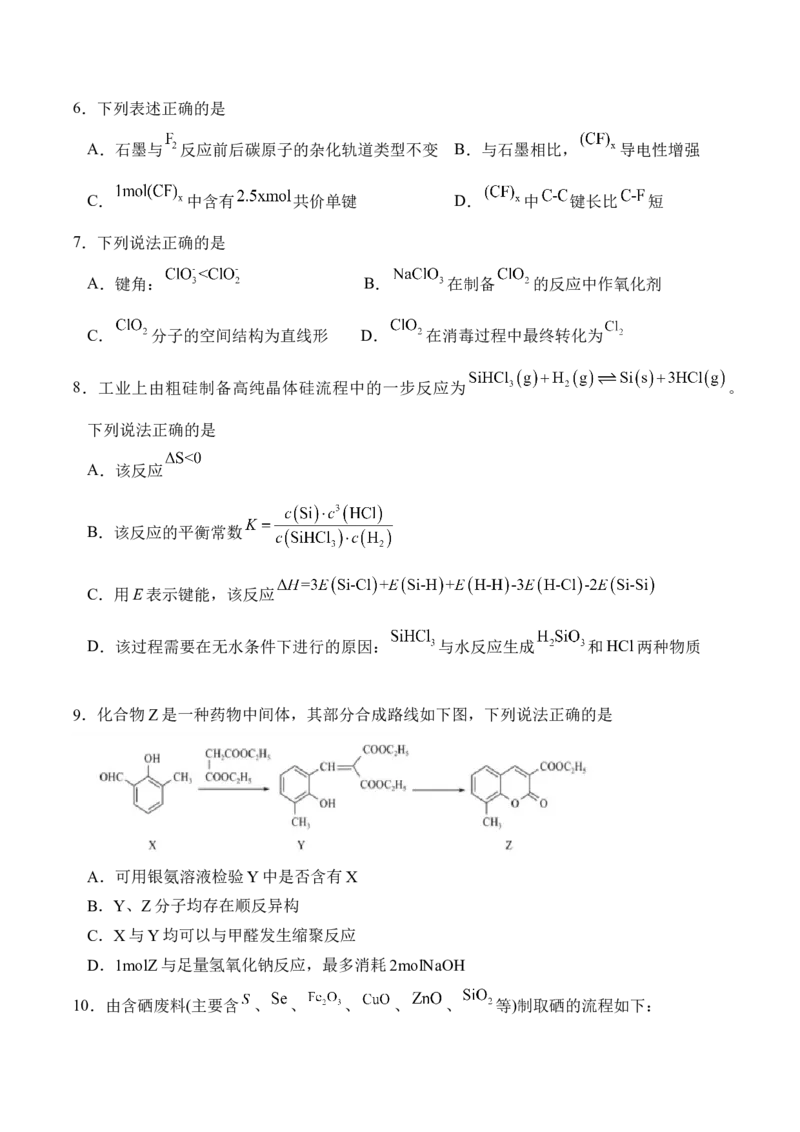
F、 元素的单质及其化合物应用广泛。石墨与 在 反应,石墨层间插入F得到层状
化合物 ,该物质仍具有润滑性,其单层局部结构如图所示; 具有强氧化性,易溶
于水,是一种高效安全消毒剂,可用甲醇在酸性条件下与 反应制得; 可用于制备
高纯硅,主要过程如下:
粗硅 高纯硅。
阅读材料,回答下列小题。6.下列表述正确的是
A.石墨与 反应前后碳原子的杂化轨道类型不变 B.与石墨相比, 导电性增强
C. 中含有 共价单键 D. 中 键长比 短
7.下列说法正确的是
A.键角: B. 在制备 的反应中作氧化剂
C. 分子的空间结构为直线形 D. 在消毒过程中最终转化为
8.工业上由粗硅制备高纯晶体硅流程中的一步反应为 。
下列说法正确的是
A.该反应
B.该反应的平衡常数
C.用E表示键能,该反应
D.该过程需要在无水条件下进行的原因: 与水反应生成 和HCl两种物质
9.化合物Z是一种药物中间体,其部分合成路线如下图,下列说法正确的是
A.可用银氨溶液检验Y中是否含有X
B.Y、Z分子均存在顺反异构
C.X与Y均可以与甲醛发生缩聚反应
D.1molZ与足量氢氧化钠反应,最多消耗2molNaOH
10.由含硒废料(主要含 、 、 、 、 、 等)制取硒的流程如下:下列有关说法正确的是
A.“分离”的方法是分液
B.“滤液”中主要存在的阴离子有: 、
C.若向“酸溶”所得的滤液中加入少量铜,铜不会溶解
D.“酸化”的离子反应方程式为
11.根据下列实验操作和现象所得到的结论正确的是
实验操作 实验现象 结论
向 溶液缓慢滴加 溶液由黄色 增大 有利于CrO (黄
A
转变 为橙色
稀硫酸 色)转化为Cr O (橙色)
2
气体红棕色
B 将充满 的密闭玻璃球浸泡在热水中
加深
向 溶液中加入
溶液变成红 与I-所发生的反应为可逆反
C 溶液,萃取分液
色 应
后,向水层滴入KSCN溶液
向锌粒和稀硫酸反应的试管中,滴加几 气体生成速 是锌和稀硫酸反应的催化
D
滴 溶液 率加快 剂
A.A B.B C.C D.D
12.室温下,通过下列实验探究NaClO的性质。已知:K (HClO)=3×10-8,K (H CO )=4×10-
a a1 2 3
7,K (H CO )=5×10-11。
a2 2 3
实验1:测定0.1mol·L-1NaClO溶液的pH。
实验2:向0.1mol·L-1NaClO溶液中加入稀硫酸至pH=7。
实验3:向0.1mol·L-1NaClO溶液中通入少量CO 。
2
实验4:向0.1mol·L-1NaClO溶液中通入少量SO ,再加入BaCl 溶液,产生白色沉淀。
2 2
下列说法正确的是A.实验1所测NaClO溶液的pH>11
B.实验2所得的溶液中:c(HClO)=2c(SO )
C.实验3所得溶液中:c(CO )>c(HCO )
D.实验4所得的溶液中:c(Ba2+)·c(SO )=K (BaSO )
sp 3
13.甲醇-水催化重整可获得H 其主要反应为
2.
反应Ⅰ CH OH(g) + H O(g) = CO (g) + 3H (g) ΔH = 49.4 kJ·mol−1
3 2 2 2
反应Ⅱ CO (g) + H (g) = CO(g) + H O(g) ΔH = 41.2 kJ·mol−1
2 2 2
在1.0×105Pa、n (H O)∶n (CH OH)=1.2时,若仅考虑上述反应,平衡时CO的选择性、
始 2 始 3
CH OH的转化率和H 的产率随温度的变化如图所示。
3 2
CO的选择性= × 100%
下列说法正确的是
A.一定温度下,增大 可提高CO的选择性
B.平衡时CH OH的转化率一定大于H O的转化率
3 2
C.图中曲线①表示平衡时H 产率随温度的变化
2
D.一定温度下,降低体系压强,反应Ⅰ的平衡常数增大
第 II 卷 非 选 择 题 ( 共 61 分 )
14.锡(Sn)是现代“五金”之一,广泛应用于合金、半导体工业等。
为
(1)Sn位于元素周期表第5周期ⅣA族。则基态Sn原子外围电子排布式 ▲ 。(2) 和 是锡的常见氯化物。
① 分子中 原子的杂化方式为 ▲ ,分子空间构型是 ▲ 。
② 易溶于四氯化碳、苯等有机溶剂,可能原因是 ▲ 。
(3)白锡和灰锡是单质 的常见同素异形体。二者晶胞如图:
白锡具有体心立方结构,灰锡具有类似于金刚石的结构。
①灰锡中每个Sn原子周围与它最近且距离相等的Sn原子有 ▲ 个。
②若白锡和灰锡的晶胞体积分别为 和 ,则白锡和灰锡晶体密度之比是 ▲ 。
(4)单质 的制备:将 与焦炭充分混合后,于惰性气氛中加热至800℃,由于固体之
间反应慢,未明显发生反应。在800℃下通入空气, 能迅速被还原为单质 ,则通
入空气的作用是 ▲ 。
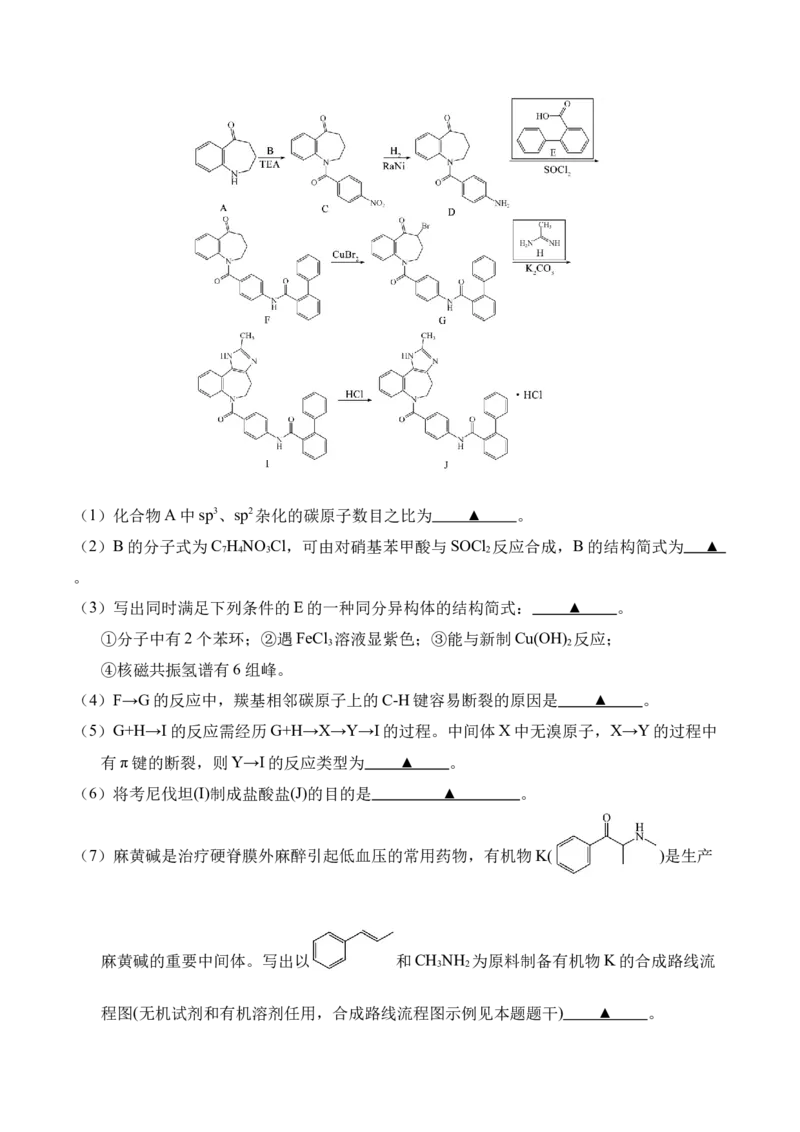
15.盐酸考尼伐坦(J)可用于治疗血容量正常的低钠血症,其合成路线如下:(1)化合物A中sp3、sp2杂化的碳原子数目之比为 ▲ 。
(2)B的分子式为C H NO Cl,可由对硝基苯甲酸与SOCl 反应合成,B的结构简式为 ▲
7 4 3 2
。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式: ▲ 。
①分子中有2个苯环;②遇FeCl 溶液显紫色;③能与新制Cu(OH) 反应;
3 2
④核磁共振氢谱有6组峰。
(4)F→G的反应中,羰基相邻碳原子上的C-H键容易断裂的原因是 ▲ 。
(5)G+H→I的反应需经历G+H→X→Y→I的过程。中间体X中无溴原子,X→Y的过程中
有π键的断裂,则Y→I的反应类型为 ▲ 。
(6)将考尼伐坦(I)制成盐酸盐(J)的目的是 ▲ 。
(7)麻黄碱是治疗硬脊膜外麻醉引起低血压的常用药物,有机物K( )是生产
麻黄碱的重要中间体。写出以 和CH NH 为原料制备有机物K的合成路线流
3 2
程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) ▲ 。16.工业废渣中Ca(OH) 的综合利用。
2
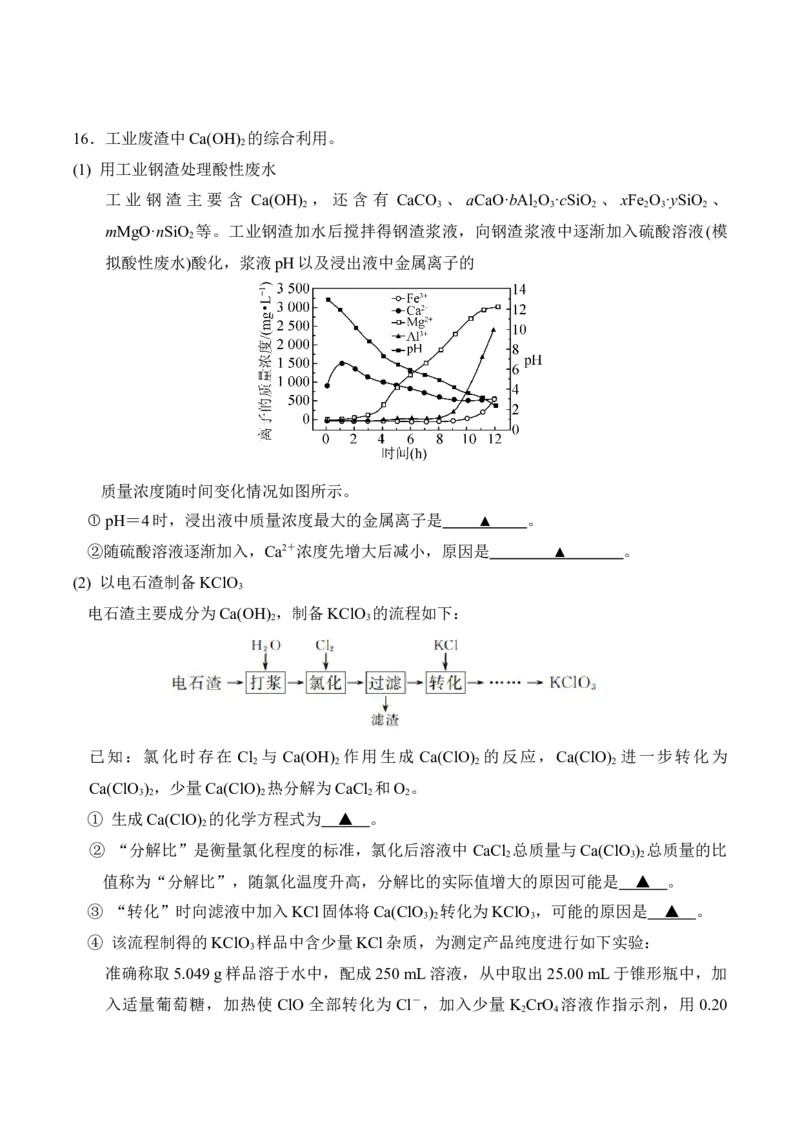
(1) 用工业钢渣处理酸性废水
工 业 钢 渣 主 要 含 Ca(OH) , 还 含 有 CaCO 、 aCaO·bAl O ·cSiO 、 xFe O ·ySiO 、
2 3 2 3 2 2 3 2
mMgO·nSiO 等。工业钢渣加水后搅拌得钢渣浆液,向钢渣浆液中逐渐加入硫酸溶液(模
2
拟酸性废水)酸化,浆液pH以及浸出液中金属离子的
质量浓度随时间变化情况如图所示。
① pH=4时,浸出液中质量浓度最大的金属离子是 ▲ 。
②随硫酸溶液逐渐加入,Ca2+浓度先增大后减小,原因是 ▲ 。
(2) 以电石渣制备KClO
3
电石渣主要成分为Ca(OH) ,制备KClO 的流程如下:
2 3
已知:氯化时存在 Cl 与 Ca(OH) 作用生成 Ca(ClO) 的反应,Ca(ClO) 进一步转化为
2 2 2 2
Ca(ClO ) ,少量Ca(ClO) 热分解为CaCl 和O 。
3 2 2 2 2
① 生成Ca(ClO) 的化学方程式为 ▲ 。
2
② “分解比”是衡量氯化程度的标准,氯化后溶液中 CaCl 总质量与Ca(ClO ) 总质量的比
2 3 2
值称为“分解比”,随氯化温度升高,分解比的实际值增大的原因可能是 ▲ 。
③ “转化”时向滤液中加入KCl固体将Ca(ClO ) 转化为KClO ,可能的原因是 ▲ 。
3 2 3
④ 该流程制得的KClO 样品中含少量KCl杂质,为测定产品纯度进行如下实验:
3
准确称取5.049 g样品溶于水中,配成250 mL溶液,从中取出25.00 mL于锥形瓶中,加
入适量葡萄糖,加热使 ClO全部转化为 Cl-,加入少量 K CrO 溶液作指示剂,用 0.20
2 4mol·L-1 AgNO 溶液进行滴定至终点,消耗AgNO 溶液体积21.00 mL。计算KClO 样品
3 3 3
的纯度(写出计算过程)。
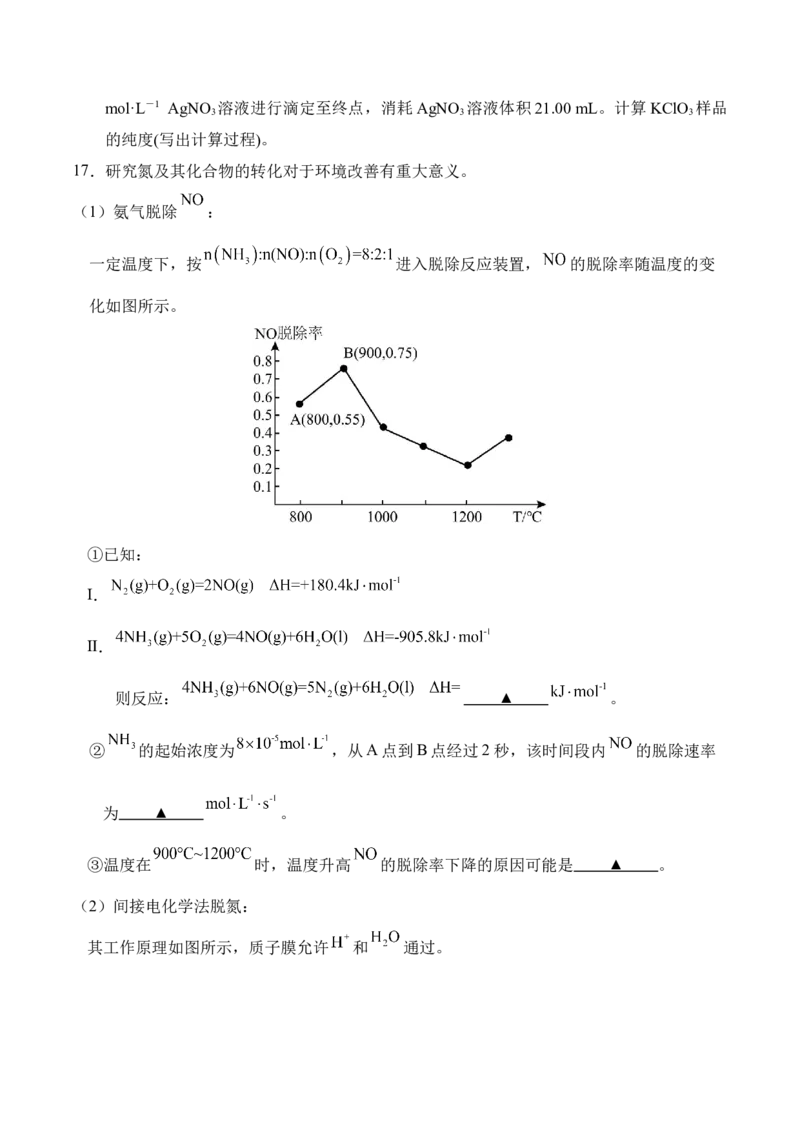
17.研究氮及其化合物的转化对于环境改善有重大意义。
(1)氨气脱除 :
一定温度下,按 进入脱除反应装置, 的脱除率随温度的变
化如图所示。
①已知:
I.
Ⅱ.
则反应: ▲ 。
② 的起始浓度为 ,从A点到B点经过2秒,该时间段内 的脱除速率
为 ▲ 。
③温度在 时,温度升高 的脱除率下降的原因可能是 ▲ 。
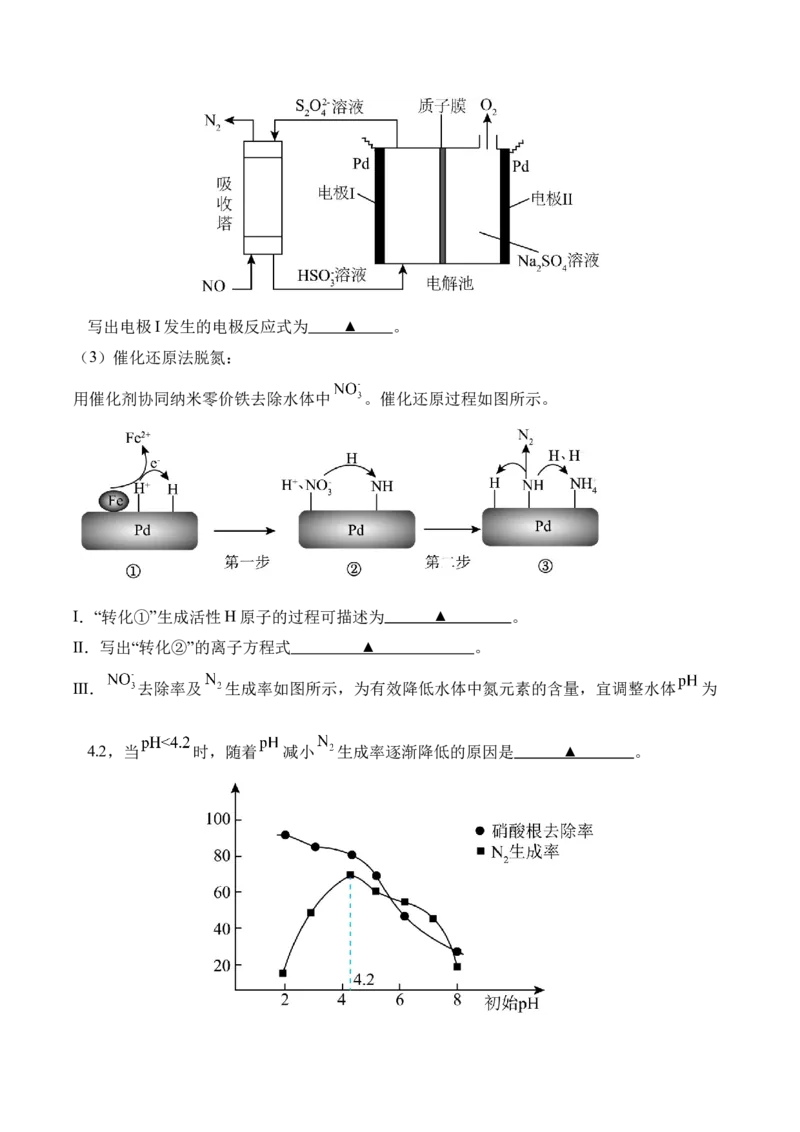
(2)间接电化学法脱氮:
其工作原理如图所示,质子膜允许 和 通过。写出电极I发生的电极反应式为 ▲ 。
(3)催化还原法脱氮:
用催化剂协同纳米零价铁去除水体中 。催化还原过程如图所示。
I.“转化①”生成活性H原子的过程可描述为 ▲ 。
Ⅱ.写出“转化②”的离子方程式 ▲ 。
Ⅲ. 去除率及 生成率如图所示,为有效降低水体中氮元素的含量,宜调整水体 为
4.2,当 时,随着 减小 生成率逐渐降低的原因是 ▲ 。高二期中考试化学试题参考答案
一 、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1-5 ACDDC 6-10 CBCAD 11-13 ABB
二、非选择题共4题,共61分
14.(每空2分,共14分)
(1)
(2)①. ;②. V;③. 是非极性分子,根据相似相溶原理,易溶于非极性溶剂
(3)①. 4 ②.
(4)氧气与焦炭在高温下反应生成CO,CO将SnO 还原为单质Sn
2
15.(除合成路线5分,其余每空2分,共17分)
(1)3:7 (2)
(3)
(4)羰基为吸电子基团,使得相邻碳原子上的C-H共用电子对更偏向羰基碳原子,C-H键
的极性增强
(5)消去反应 (6)增加药物的水溶性和稳定性
(7) 其他合理路线也给分
16.(15分)
C.① Mg2+(2分)② 开始时加入的硫酸会促进Ca(OH) 溶解,溶液中Ca2+浓度增加;随着硫酸加入量增加,
2
SO42-浓度增大,Ca2+与SO42-结合生成CaSO ,沉淀逐渐增多,浸出液中Ca2+浓度逐
4
渐减小(3分)
(2)
① 2Cl +2Ca(OH) =Ca(ClO) +CaCl +2H O(2分)
2 2 2 2 2
②升高温度,Ca(ClO) 分解增多,使CaCl 的量变多,Ca(ClO ) 的量变少(2分)
2 2 3 2
③相同温度下,KClO 的溶解度比Ca(ClO ) 的小(2分)
3 3 2
④ 97.05%(4分)需要写出解题过程,有效数字现不着要求。97%、97.0%等均算正确
解题过程:在25.00mL溶液中:
n(AgNO )=0.20mol·L-1×0.021L=0.0042mol,n(KCl)总=0.0042mol,
3
n(KClO )+n(KCl)=0.0042mol,
3
n(KClO )×122.5g·mol-1+n(KCl)×74.5g·mol-1=0.5049g,
3
两式联立,解得n(KClO )=0.0040mol,m(KClO )=0.004mol×122.5g·mol-1=0.49g,
3 3
KClO 样品的纯度= =97.05% 4分
3
17.(除最后一空3分外,其他每空2分,共15分)
(1)①. ②. ③. 温度高于900℃时,NH 与O 气生成NO的量增
3 2
大(或NH 转化为NO的选择性增大),故NO的脱除率下降。
3
(2)
(3)①. 纳米零价铁在催化剂 Pd表面失去电子生成Fe2 +, H+在催化剂Pd表面得到电子
生成活性氢原子。
②. +H++6H=NH+3H O
2
③. pH越小,H+浓度越大,会生成更多的活性氢原子,使 NO -生成的中间产物NH
3
更多的与H+反应生成 ,从而减少N 的生成。
2