文档内容
2023—2024 学年度下学期高三第二次模拟考试试题
化学
姓名: 考生考号:
命题人:丹东二中 王婷婷 沈阳第一二〇中学 孙铁铮
时间:75分钟 试卷满分:100分
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.答选择题时,选出每小题答案后,用铅笔把答案卡对应题目的答案标号涂黑。如需改
动,用橡皮擦干净后,再选涂其它答题标号。答非选择题时,将答案写在答题卡上。写在本
试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:
H−1B−11C−12O−16Al−27K−39Ca−40Cu−64Cd−112I−127Tl−204
第Ⅰ卷(选择题,共45分)
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个选项符合要求)
1.《厉害了,我的国》展示了中国科技举世瞩目的成就。下列说法错误的是( )
A.“祝融号”火星车储能用的正十一烷属于烃类
B.港珠澳大桥使用高性能富锌底漆是依据外加电流法防腐
C.“天和核心舱”电推进系统采用的氮化硼陶瓷属于新型无机非金属材料
D.月球探测器带回的月壤样品中含磷酸盐晶体,其结构可用X射线衍射仪测定
2.烟气中的二氧化硫可用于处理含铬(Ⅵ)废水,其反应为:
K Cr O +3SO +H SO =K SO +Cr (SO ) +H O,下列化学用语正确的是( )
2 2 7 2 2 4 2 4 2 4 3 2
A.基态Cr原子的价电子排布式:3d44s2
SO VSEPR
2
B. 的 模型:
C.中子数为21的K核素符号:❑ 21K
19
H O O
2
D.用轨道表示式表示 中 原子的杂化:
3.类比是一种重要的学习方法,下列“类比”中错误的是( )
A.电解熔融NaCl可制Na,则电解熔融MgCl 可制Mg
2
B.Na N与盐酸反应生成NaCl和NH Cl,则Mg N 与盐酸反应生成MgCl 和NH Cl
3 4 3 2 2 4
C.NaOH溶液与少量AgNO 溶液反应生成AgOH和NaNO ,则氨水与少量AgNO 溶液反应生成
3 3 3
AgOH和NH NO
4 3
D.Al3+与HCO−在溶液中可发生相互促进的水解反应生成沉淀和气体,Fe3+与HCO−也如此
3 3
4.新制氢氧化铜和葡萄糖的反应可用来检验血糖,其反应为:¿,设N 为阿伏加德罗常数的值,下列说
A
法正确的是( )
A.18gCH OH(CHOH) CHO中含有羟基的数目为0.6N
2 4 A
B.每消耗1molCu(OH) ,转移电子的数目为2N
2 A
C.1L1mol⋅L−1CH OH(CHOH) COONa溶液中含有的离子数目为2N
2 4 A
D.标准状况下,112mLH O(l)中含有的分子数目约为6.2N
2 A
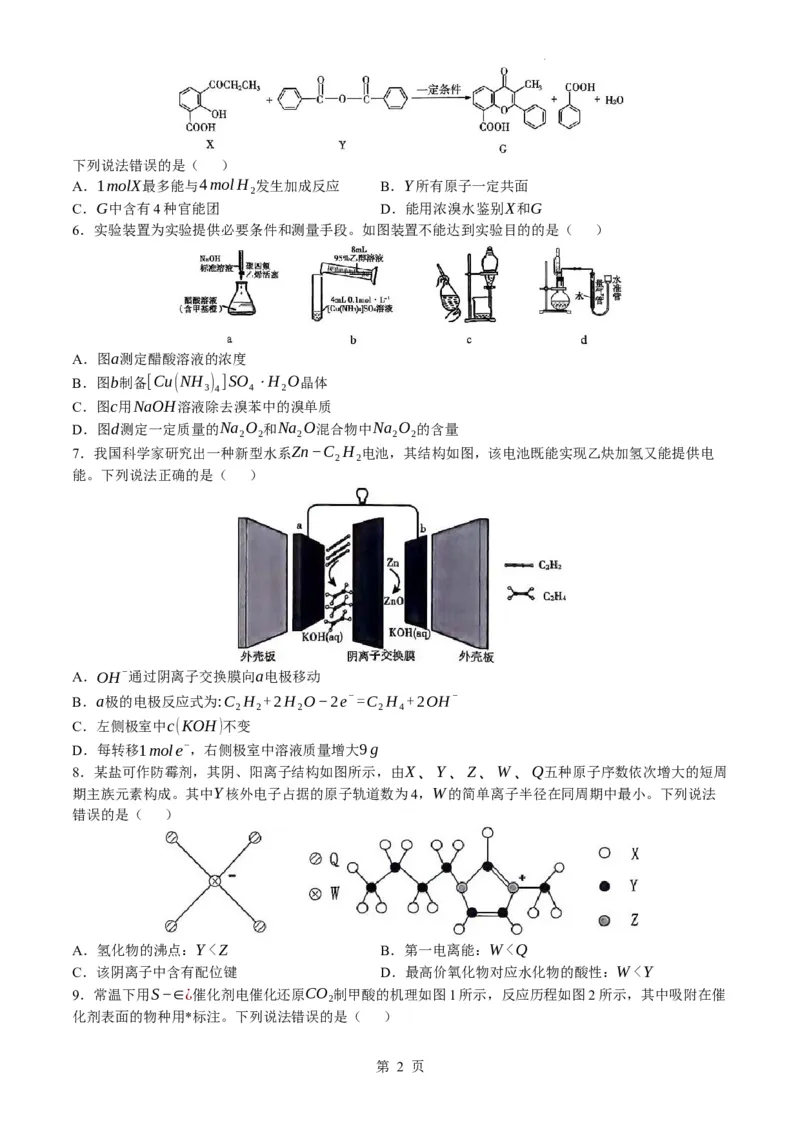
5.合成有机中间体G的反应如图:
第 1 页
学科网(北京)股份有限公司下列说法错误的是( )
A.1molX最多能与4molH 发生加成反应 B.Y所有原子一定共面
2
C.G中含有4种官能团 D.能用浓溴水鉴别X和G
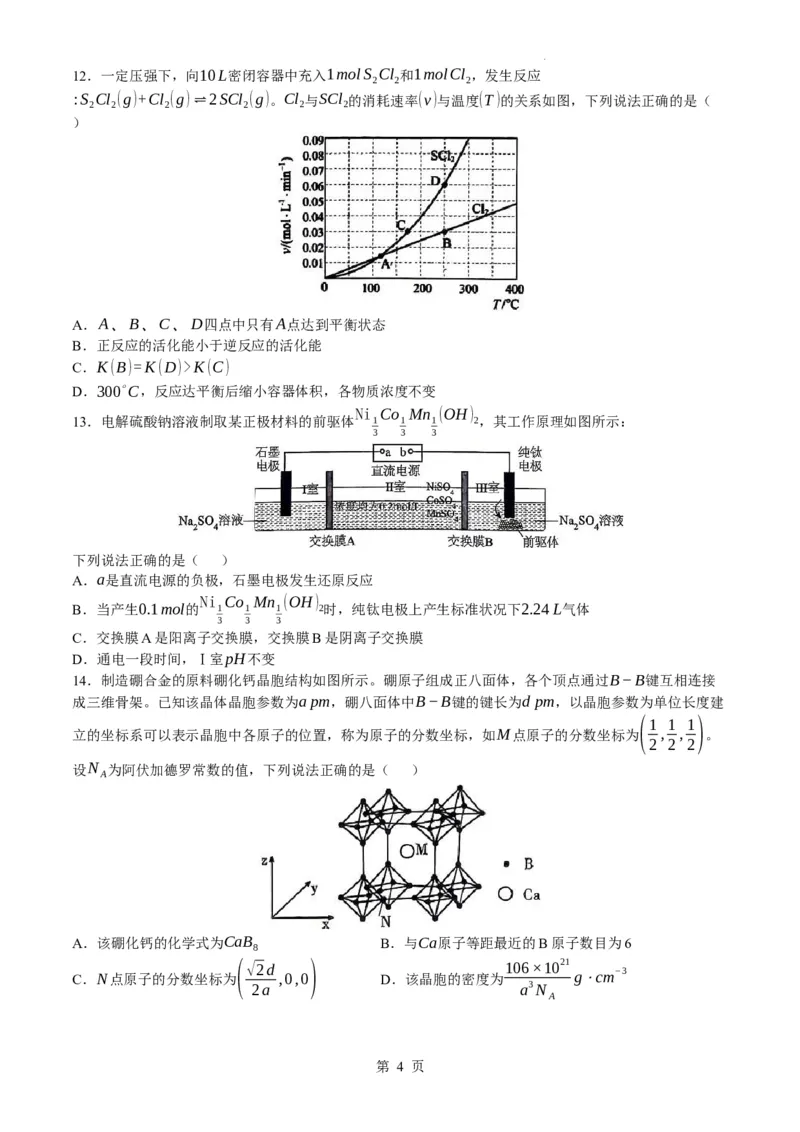
6.实验装置为实验提供必要条件和测量手段。如图装置不能达到实验目的的是( )
A.图a测定醋酸溶液的浓度
B.图b制备[Cu(NH ) ]SO ⋅H O晶体
3 4 4 2
C.图c用NaOH溶液除去溴苯中的溴单质
D.图d测定一定质量的Na O 和Na O混合物中Na O 的含量
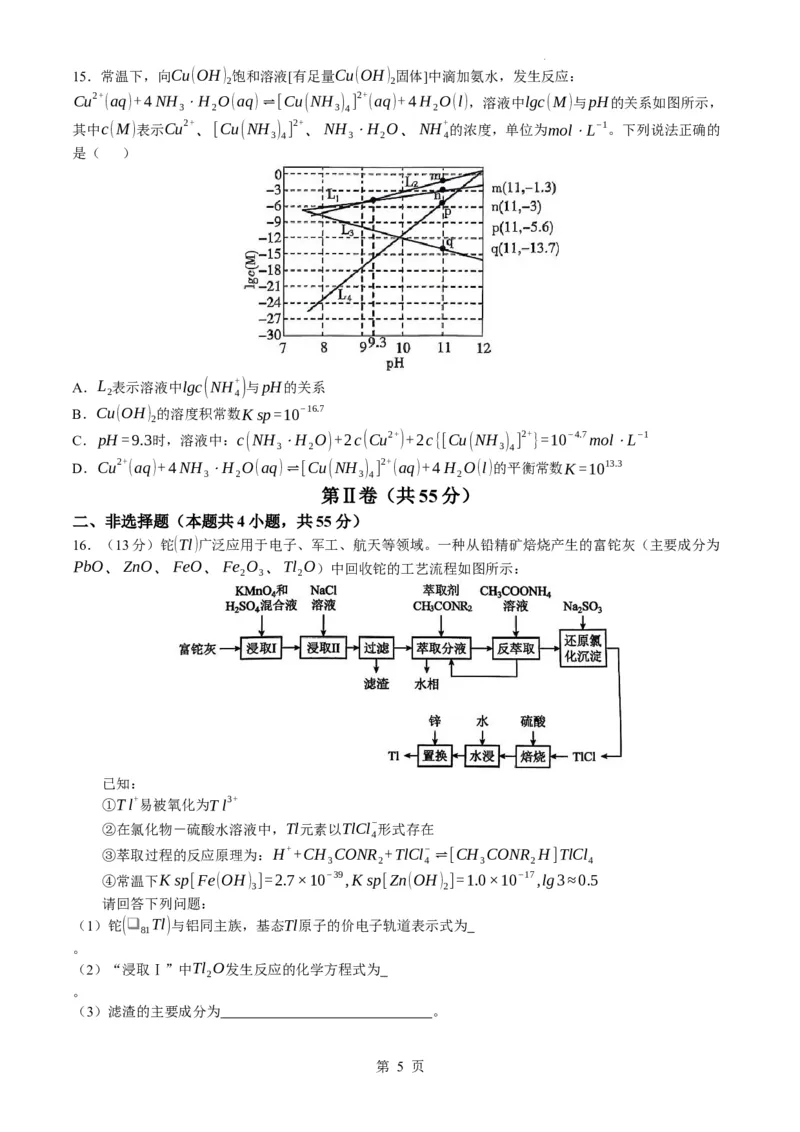
2 2 2 2 2
7.我国科学家研究出一种新型水系Zn−C H 电池,其结构如图,该电池既能实现乙炔加氢又能提供电
2 2
能。下列说法正确的是( )
A.OH−通过阴离子交换膜向a电极移动
B.a极的电极反应式为:C H +2H O−2e−=C H +2OH−
2 2 2 2 4
C.左侧极室中c(KOH)不变
D.每转移1mole−,右侧极室中溶液质量增大9g
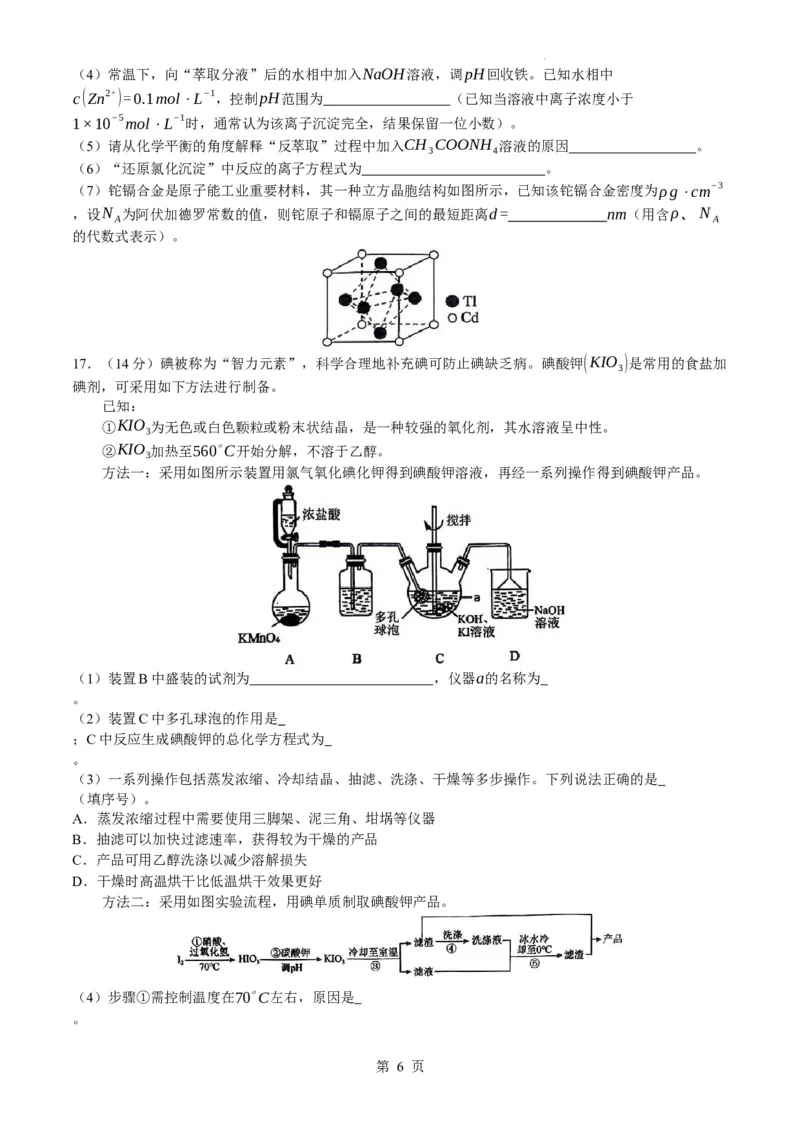
8.某盐可作防霉剂,其阴、阳离子结构如图所示,由X、Y、Z、W、Q五种原子序数依次增大的短周
期主族元素构成。其中Y核外电子占据的原子轨道数为4,W的简单离子半径在同周期中最小。下列说法
错误的是( )
A.氢化物的沸点:YCu2+
3 3 6
加入铜粉后产生蓝色
量铜粉
沉淀
B 将C H Br与NaOH溶液共热。冷却后,加入 没有产生淡黄色沉淀 C H Br没有发生水解反应
2 5 2 5
AgNO 溶液
3
C 将CoCl 固体溶于水,加入适量浓盐酸后,再加 溶液先由粉红色变为 稳定性:[CoCl ] 2−>[ZnCl ] 2−
2 4 4
入少量ZnCl 固体 蓝色,再由蓝色变成
2
粉红色
D 常温下,分别测定1mol⋅L−1CH COONH 溶 pH都等于7 同温下,不同浓度
3 4
液和0.1mol⋅L−1CH COONH 溶液的pH CH 3 COONH 4 溶液中水的电离
3 4
程度相同
第 3 页
学科网(北京)股份有限公司12.一定压强下,向10L密闭容器中充入1molS Cl 和1molCl ,发生反应
2 2 2
:S Cl (g)+Cl (g)⇌2SCl (g)。Cl 与SCl 的消耗速率(v)与温度(T)的关系如图,下列说法正确的是(
2 2 2 2 2 2
)
A.A、B、C、D四点中只有A点达到平衡状态
B.正反应的活化能小于逆反应的活化能
C.K(B)=K(D)>K(C)
D.300∘C,反应达平衡后缩小容器体积,各物质浓度不变
Ni Co Mn (OH)
13.电解硫酸钠溶液制取某正极材料的前驱体 1 1 1 2,其工作原理如图所示:
3 3 3
下列说法正确的是( )
A.a是直流电源的负极,石墨电极发生还原反应
Ni Co Mn (OH)
B.当产生0.1mol的 1 1 1 2时,纯钛电极上产生标准状况下2.24L气体
3 3 3
C.交换膜A是阳离子交换膜,交换膜B是阴离子交换膜
D.通电一段时间,Ⅰ室pH不变
14.制造硼合金的原料硼化钙晶胞结构如图所示。硼原子组成正八面体,各个顶点通过B−B键互相连接
成三维骨架。已知该晶体晶胞参数为apm,硼八面体中B−B键的键长为d pm,以晶胞参数为单位长度建
(1 1 1)
立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如M点原子的分数坐标为 , , 。
2 2 2
设N 为阿伏加德罗常数的值,下列说法正确的是( )
A
A.该硼化钙的化学式为CaB B.与Ca原子等距最近的B原子数目为6
8
C.N点原子的分数坐标为
(√2d
,0,0
)
D.该晶胞的密度为
106×1021
g⋅cm−3
2a a3N
A
第 4 页
学科网(北京)股份有限公司15.常温下,向Cu(OH) 饱和溶液[有足量Cu(OH) 固体]中滴加氨水,发生反应:
2 2
Cu2+ (aq)+4NH ⋅H O(aq)⇌[Cu(NH ) ] 2+ (aq)+4H O(l),溶液中lgc(M)与pH的关系如图所示,
3 2 3 4 2
其中c(M)表示Cu2+ 、[Cu(NH ) ] 2+ 、NH ⋅H O、NH+ 的浓度,单位为mol⋅L−1。下列说法正确的
3 4 3 2 4
是( )
A.L 表示溶液中lgc(NH+)与pH的关系
2 4
B.Cu(OH) 的溶度积常数Ksp=10−16.7
2
C.pH=9.3时,溶液中:c(NH ⋅H O)+2c(Cu2+)+2c{[Cu(NH ) ] 2+ }=10−4.7mol⋅L−1
3 2 3 4
D.Cu2+ (aq)+4NH ⋅H O(aq)⇌[Cu(NH ) ] 2+ (aq)+4H O(l)的平衡常数K=1013.3
3 2 3 4 2
第Ⅱ卷(共55分)
二、非选择题(本题共4小题,共55分)
16.(13分)铊(Tl)广泛应用于电子、军工、航天等领域。一种从铅精矿焙烧产生的富铊灰(主要成分为
PbO、ZnO、FeO、Fe O 、Tl O)中回收铊的工艺流程如图所示:
2 3 2
已知:
①Tl+易被氧化为Tl3+
②在氯化物-硫酸水溶液中,Tl元素以TlCl−
形式存在
4
③萃取过程的反应原理为:H++CH CONR +TlCl− ⇌[CH CONR H]TlCl
3 2 4 3 2 4
④常温下Ksp[Fe(OH) ]=2.7×10−39,Ksp[Zn(OH) ]=1.0×10−17,lg3≈0.5
3 2
请回答下列问题:
(1)铊(❑ Tl)与铝同主族,基态Tl原子的价电子轨道表示式为
81
。
(2)“浸取Ⅰ”中Tl O发生反应的化学方程式为
2
。
(3)滤渣的主要成分为 。
第 5 页
学科网(北京)股份有限公司(4)常温下,向“萃取分液”后的水相中加入NaOH溶液,调pH回收铁。已知水相中
c(Zn2+)=0.1mol⋅L−1,控制pH范围为 (已知当溶液中离子浓度小于
1×10−5mol⋅L−1时,通常认为该离子沉淀完全,结果保留一位小数)。
(5)请从化学平衡的角度解释“反萃取”过程中加入CH COONH 溶液的原因 。
3 4
(6)“还原氯化沉淀”中反应的离子方程式为 。
(7)铊镉合金是原子能工业重要材料,其一种立方晶胞结构如图所示,已知该铊镉合金密度为ρg⋅cm−3
,设N 为阿伏加德罗常数的值,则铊原子和镉原子之间的最短距离d= nm(用含ρ、N
A A
的代数式表示)。
17.(14分)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO )是常用的食盐加
3
碘剂,可采用如下方法进行制备。
已知:
①KIO 为无色或白色颗粒或粉末状结晶,是一种较强的氧化剂,其水溶液呈中性。
3
②KIO 加热至560∘C开始分解,不溶于乙醇。
3
方法一:采用如图所示装置用氯气氧化碘化钾得到碘酸钾溶液,再经一系列操作得到碘酸钾产品。
(1)装置B中盛装的试剂为 ,仪器a的名称为
。
(2)装置C中多孔球泡的作用是
;C中反应生成碘酸钾的总化学方程式为
。
(3)一系列操作包括蒸发浓缩、冷却结晶、抽滤、洗涤、干燥等多步操作。下列说法正确的是
(填序号)。
A.蒸发浓缩过程中需要使用三脚架、泥三角、坩埚等仪器
B.抽滤可以加快过滤速率,获得较为干燥的产品
C.产品可用乙醇洗涤以减少溶解损失
D.干燥时高温烘干比低温烘干效果更好
方法二:采用如图实验流程,用碘单质制取碘酸钾产品。
(4)步骤①需控制温度在70∘C左右,原因是
。
第 6 页
学科网(北京)股份有限公司(5)步骤②中生成气体的反应的离子方程式为
。
(6)产品碘酸钾纯度的测定:准确称ag产品配成250mL溶液,取25.00mL该溶液于碘量瓶中,加入稍过
量的碘化钾溶液,用适量硫酸酸化。用cmol⋅L−1的硫代硫酸钠标准溶液滴定,滴定至淡黄色,加入少许
淀粉溶液。平行滴定三次,平均消耗硫代硫酸钠标准溶液V mL。已知:I +2S O2−=2I−+S O2− ,产品
2 2 3 4 6
的纯度为 (用含a、c、V的代数式表示)。
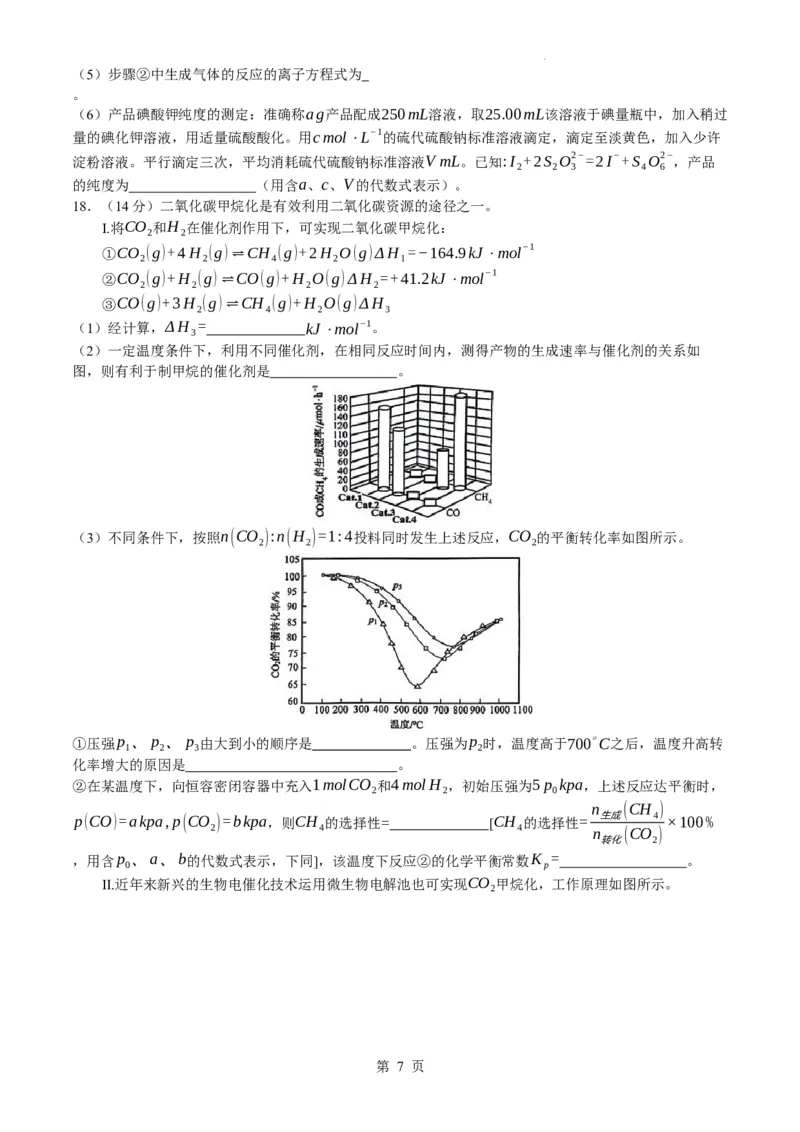
18.(14分)二氧化碳甲烷化是有效利用二氧化碳资源的途径之一。
Ⅰ.将CO 和H 在催化剂作用下,可实现二氧化碳甲烷化:
2 2
①CO (g)+4H (g)⇌CH (g)+2H O(g)ΔH =−164.9kJ⋅mol−1
2 2 4 2 1
②CO (g)+H (g)⇌CO(g)+H O(g)ΔH =+41.2kJ⋅mol−1
2 2 2 2
③CO(g)+3H (g)⇌CH (g)+H O(g)ΔH
2 4 2 3
(1)经计算,ΔH = kJ⋅mol−1。
3
(2)一定温度条件下,利用不同催化剂,在相同反应时间内,测得产物的生成速率与催化剂的关系如
图,则有利于制甲烷的催化剂是 。
(3)不同条件下,按照n(CO ):n(H )=1:4投料同时发生上述反应,CO 的平衡转化率如图所示。
2 2 2
①压强p 、p 、p 由大到小的顺序是 。压强为p 时,温度高于700∘C之后,温度升高转
1 2 3 2
化率增大的原因是 。
②在某温度下,向恒容密闭容器中充入1molCO 和4molH ,初始压强为5p kpa,上述反应达平衡时,
2 2 0
n (CH )
p(CO)=akpa,p(CO )=bkpa,则CH 的选择性= [CH 的选择性= 生成 4 ×100%
2 4 4 n (CO )
转化 2
,用含p 、a、b的代数式表示,下同],该温度下反应②的化学平衡常数K = 。
0 p
Ⅱ.近年来新兴的生物电催化技术运用微生物电解池也可实现CO 甲烷化,工作原理如图所示。
2
第 7 页
学科网(北京)股份有限公司(4)阴极电极反应式为
。
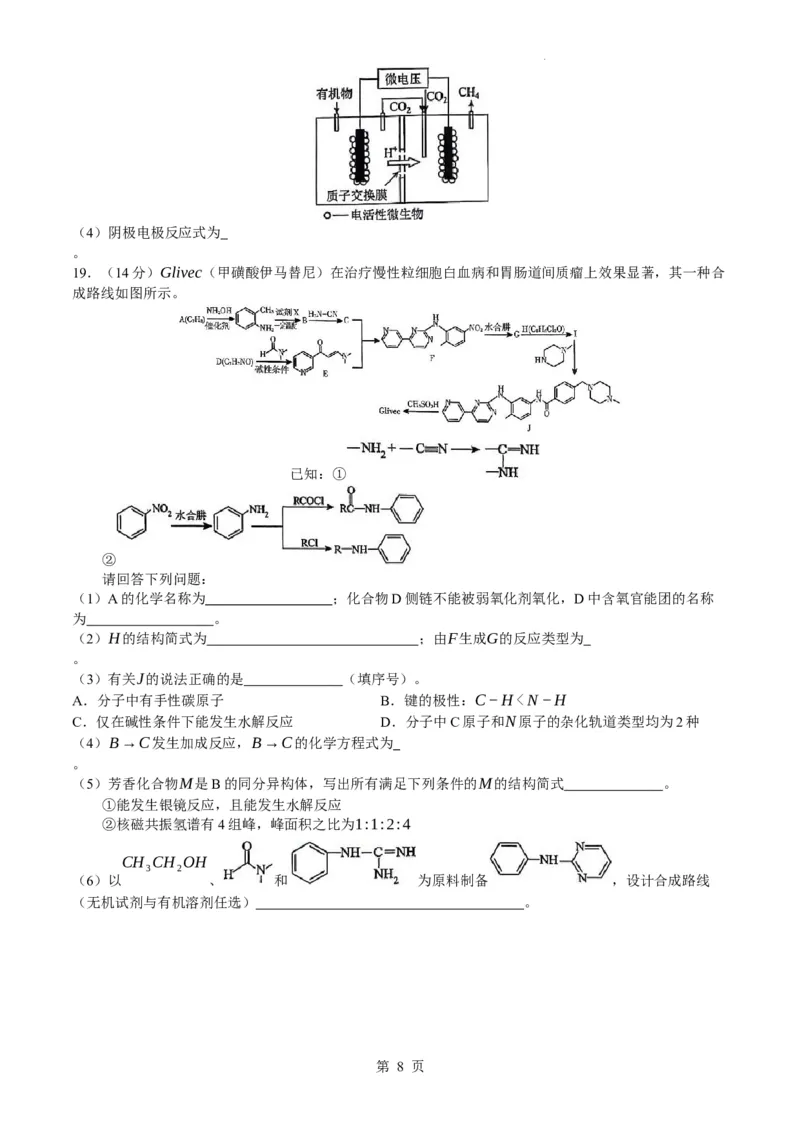
19.(14分)Glivec(甲磺酸伊马替尼)在治疗慢性粒细胞白血病和胃肠道间质瘤上效果显著,其一种合
成路线如图所示。
已知:①
②
请回答下列问题:
(1)A的化学名称为 ;化合物D侧链不能被弱氧化剂氧化,D中含氧官能团的名称
为 。
(2)H的结构简式为 ;由F生成G的反应类型为
。
(3)有关J的说法正确的是 (填序号)。
A.分子中有手性碳原子 B.键的极性:C−H