文档内容
2025-2026 学年度第一学期赣州市十三校期中联考
A.11.2LH O所含原子总数为1.5N
2 A
高二化学试卷 B.0.1mol·L-1HClO 溶液中含有的H+离子数为0.1N
4 A
C.25℃时1LpH=13的Ba(OH) 溶液中含有的OH-离子数为0.2N
2 A
D.0.1molH 和0.1molI 在密闭容器中充分反应后,容器内分子总数为0.2N
2 2 A
6.常温下,下列各组离子在指定溶液中可能大量共存的是( )
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32
A.pH=1的溶液中:HCO - 、SO 2- 、K+、CH COO-
第Ⅰ卷(选择题 共42分) 3 4 3
一、选择题:本题共14个小题,每小题3分,共42分。
B.遇酚酞变红的溶液中:NO
3
- 、Na+、CO
3
2- 、NH
4
+
1.化学与生活密切相关。下列说法正确的是( ) C.与铝反应放出H 的溶液中:SO 2-、Fe2+、NO -、Cu2+
2 4 3
A.通过寻找新能源来替代化石燃料,减少对环境的污染 D.水电离出的c(H+)=1.0×10-13mol·L-1的溶液中:Na+、Cl-、CO 2- 、NO -
3 3
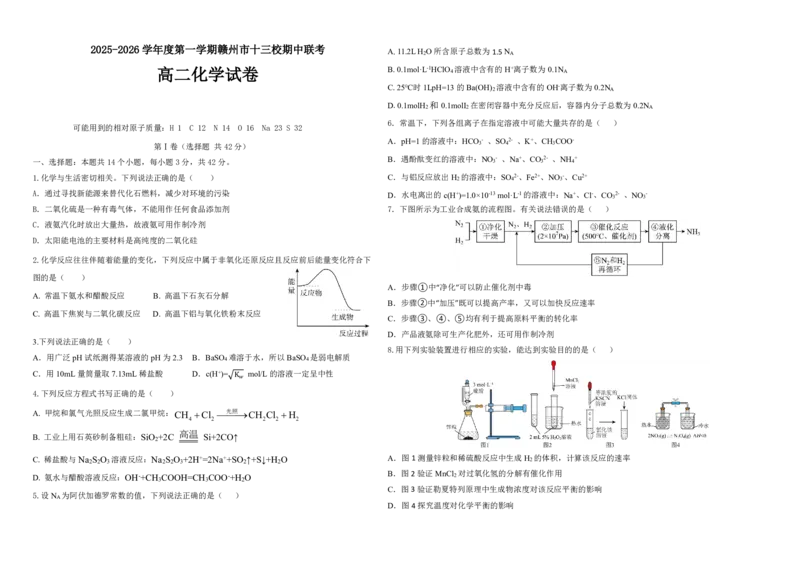
B.二氧化硫是一种有毒气体,不能用作任何食品添加剂 7.下图所示为工业合成氨的流程图。有关说法错误的是( )
C.液氨汽化时放出大量热,故液氨可用作制冷剂
D.太阳能电池的主要材料是高纯度的二氧化硅
2.化学反应往往伴随着能量的变化,下列反应中属于非氧化还原反应且反应前后能量变化符合下
图的是( )
A.步骤①中“净化”可以防止催化剂中毒
A. 常温下氨水和醋酸反应 B. 高温下石灰石分解
B.步骤②中“加压”既可以提高产率,又可以加快反应速率
C. 高温下焦炭与二氧化碳反应 D. 高温下铝与氧化铁粉末反应
C.步骤③、④、⑤均有利于提高原料平衡的转化率
D.产品液氨除可生产化肥外,还可用作制冷剂
3.下列说法正确的是( )
8.用下列实验装置进行相应的实验,能达到实验目的的是( )
A.用广泛pH试纸测得某溶液的pH为2.3 B.BaSO 难溶于水,所以BaSO 是弱电解质
4 4
C.用10mL量筒量取7.13mL稀盐酸 D.c(H+)= mol/L的溶液一定呈中性
4.下列反应方程式书写正确的是( ) K
A. 甲烷和氯气光照反应生成二氯甲烷:CH Cl 光照CH Cl H
4 2 2 2 2
高温
B. 工业上用石英砂制备粗硅:SiO +2C Si+2CO↑
SiO22C Si2CO
2
C. 稀盐酸与Na 2 S 2 O 3 溶液反应:Na 2 S 2 O 3 +2H+=2Na++SO 2 ↑+S↓+H 2 O A.图1测量锌粒和稀硫酸反应中生成H 2 的体积,计算该反应的速率
B.图2验证MnCl 对过氧化氢的分解有催化作用
D. 氨水与醋酸溶液反应:OH-+CH COOH=CH COO-+H O 2
3 3 2
C.图3验证勒夏特列原理中生成物浓度对该反应平衡的影响
5.设N 为阿伏加德罗常数的值,下列说法正确的是( )
A
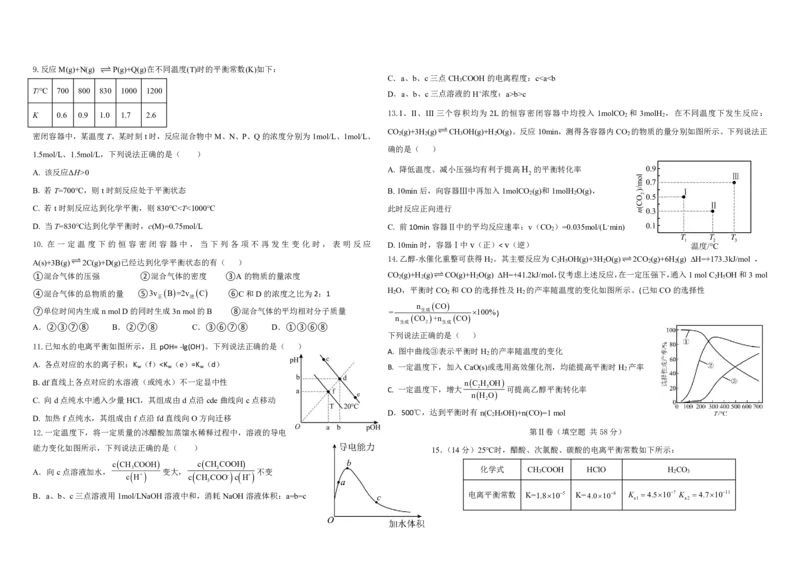
D.图4探究温度对化学平衡的影响9.反应M(g)+N(g) P(g)+Q(g)在不同温度(T)时的平衡常数(K)如下:
C.a、b、c三点CH COOH的电离程度:cb>c
K 0.6 0.9 1.0 1.7 2.6 13.I、II、III 三个容积均为 2L 的恒容密闭容器中均投入 1molCO 2 和 3molH 2 ,在不同温度下发生反应:
CO (g)+3H (g)CH OH(g)+H O(g)。反应10min,测得各容器内CO 的物质的量分别如图所示。下列说法正
密闭容器中,某温度T、某时刻t时,反应混合物中M、N、P、Q的浓度分别为1mol/L、1mol/L、 2 2 3 2 2
确的是( )
1.5mol/L、1.5mol/L,下列说法正确的是( )
A. 该反应ΔH>0 A. 降低温度、减小压强均有利于提高H 2 的平衡转化率
B. 若T=700℃,则t时刻反应处于平衡状态 B.10min后,向容器Ⅲ中再加入1molCO (g)和1molH O(g),
2 2
C. 若t时刻反应达到化学平衡,则830℃”、“<”或“=”)。
A.HCl B.Cu(OH) C.CuO D.CuCl
2 2
(6)在新制氯水中加入少量的NaCl固体,水的电离平衡_____移动(填“正向”、“逆向”或“不”)。
(5)“沉铜”过程中会产生一种无色无味的气体,请写出该过程发生的离子方程式:
(7)已知:H+(aq)+OH-(aq)═H O(l) ∆H= 57.3kJ/mol,1mol醋酸在水溶液中完全电离吸收0.3kJ ______________________________________
2
热量。则稀醋酸与稀NaOH溶液反应的
−
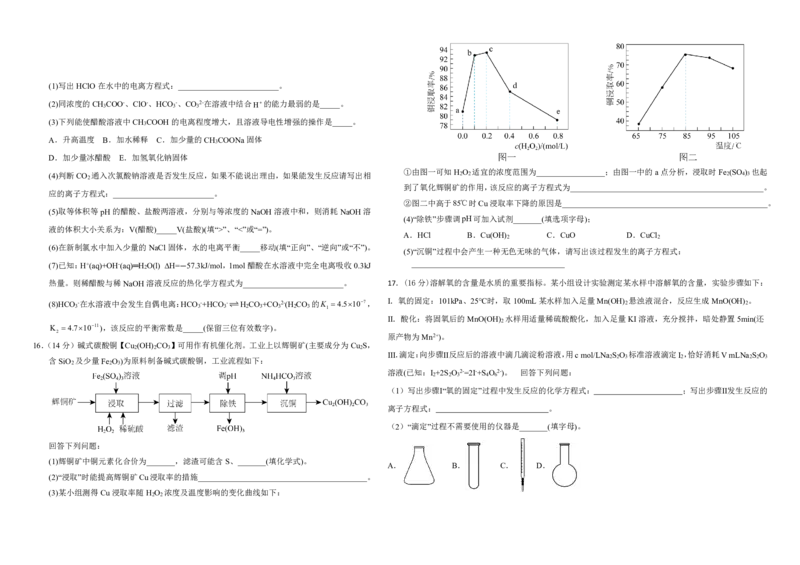
热化学方程式为_________________________。 17.(16分)溶解氧的含量是水质的重要指标。某小组设计实验测定某水样中溶解氧的含量,实验步骤如下:
(8)HCO -在水溶液中会发生自偶电离:HCO -+HCO -H CO +CO 2-(H CO 的K 4.5107,
I.氧的固定:101kPa、25℃时,取100mL某水样加入足量Mn(OH)
2
悬浊液混合,反应生成MnO(OH)
2
。
3 3 3 2 3 3 2 3 1
Ⅱ.酸化:将固氧后的MnO(OH) 水样用适量稀硫酸酸化,加入足量KI溶液,充分搅拌,暗处静置5min(还
2
K 4.71011),该反应的平衡常数是_____(保留三位有效数字)。
2
原产物为Mn2+)。
16.(14分)碱式碳酸铜【Cu (OH) CO 】可用作有机催化剂。工业上以辉铜矿(主要成分为Cu S,
2 2 3 2
Ⅲ.滴定:向步骤Ⅱ反应后的溶液中滴几滴淀粉溶液,用cmol/LNa S O 标准溶液滴定I ,恰好消耗VmLNa S O
含SiO 及少量Fe O )为原料制备碱式碳酸铜,工业流程如下: 2 2 3 2 2 2 3
2 2 3
溶液(已知:I +2S O 2-=2I-+S O 2-)。 回答下列问题:
2 2 3 4 6
(1)写出步骤Ⅰ“氧的固定”过程中发生反应的化学方程式: ;写出步骤Ⅱ发生反应的
离子方程式: 。
(2)“滴定”过程不需要使用的仪器是_______(填字母)。
回答下列问题:
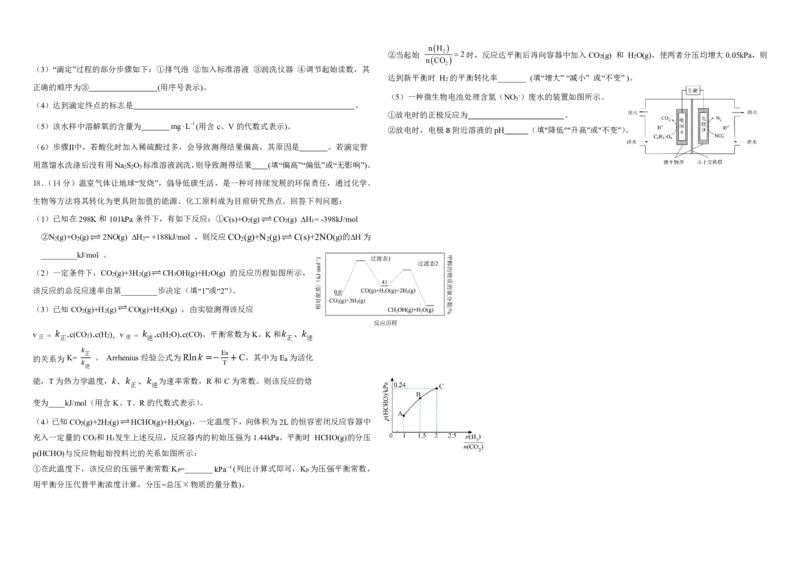
(1)辉铜矿中铜元素化合价为_______,滤渣可能含S、_______(填化学式)。
A. B. C. D.
(2)“浸取”时能提高辉铜矿Cu浸取率的措施__________________________________________。
(3)某小组测得Cu浸取率随H O 浓度及温度影响的变化曲线如下:
2 2nH
②当起始 2 2时,反应达平衡后再向容器中加入CO (g) 和 H O(g),使两者分压均增大0.05kPa,则
nCO 2 2
2
(3)“滴定”过程的部分步骤如下:①排气泡 ②加入标准溶液 ③润洗仪器 ④调节起始读数,其
达到新平衡时 H 的平衡转化率_______ (填“增大”“减小” 或“不变”)。
2
正确的顺序为③ (用序号表示)。
(5)一种微生物电池处理含氮(NO -)废水的装置如图所示。
3
(4)达到滴定终点的标志是 。
①放电时的正极反应为________________________。
(5)该水样中溶解氧的含量为 mgL1(用含c、V的代数式表示)。
②放电时,电极B附近溶液的pH______(填“降低”“升高”或“不变”)。
(6)步骤Ⅱ中,若酸化时加入稀硫酸过多,会导致测得结果偏高,其原因是 。若滴定管
用蒸馏水洗涤后没有用Na S O 标准溶液润洗,则导致测得结果 (填“偏高”“偏低”或“无影响”)。
2 2 3
18.(14分)温室气体让地球“发烧”,倡导低碳生活,是一种可持续发展的环保责任,通过化学、
生物等方法将其转化为更具附加值的能源、化工原料成为目前研究热点。回答下列问题:
(1)已知在298K和101kPa条件下,有如下反应:①C(s)+O (g)CO (g) ∆H =-398kJ/mol
2 2 1
②N
2
(g)+O
2
(g)2NO(g) ∆H
2
=+188kJ/mol ,则反应CO
2
(g)+N
2
(g)C(s)+2NO(g)的∆H为
_________kJ/mol 。
(2)一定条件下,CO (g)+3H (g)CH OH(g)+H O(g) 的反应历程如图所示,
2 2 3 2
该反应的总反应速率由第_________步决定(填“1”或“2”)。
(3)已知CO (g)+H (g)CO(g)+H O(g) ,由实验测得该反应
2 2 2
v 正 = 正 .c(CO 2 ).c(H 2 ),v 逆 = 逆 .c(H 2 O).c(CO),平衡常数为K,K和 正 、 逆
正 Ea
的关系为K= 。 Arrhenius经验公式为R n C,其中为Ea 为活化
逆 T
能,T为热力学 温度,k、 、 为速率常 l 数 , = R − 和C + 为常数。则该反应的焓
正 逆
变为____kJ/mol(用含K、 T、R 的代数式表示)。
(4)已知CO (g)+2H (g)HCHO(g)+H O(g),一定温度下,向体积为2L的恒容密闭反应容器中
2 2 2
充入一定量的CO₂和H₂发生上述反应,反应器内的初始压强为1.44kPa,平衡时 HCHO(g)的分压
p(HCHO)与反应物起始投料比的关系如图所示:
①在此温度下,该反应的压强平衡常数K
P
=_______kPa1(列出计算式即可,K
P
为压强平衡常数,
用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。2025-2026 学年度第一学期赣州市期中联考 C.1LpH=13的Ba(OH) 溶液中OH-的数目为0.1N ,C错误;
2 A
D.H 和I 反应前后分子数目不变,D正确;
2 2
高二化学答案
6.答案D
1.答案A
【详解】A. pH=1的溶液呈较强的酸性,HCO - 和CH COO-会与酸反应,不能大量共存,A错误;
【详解】A.开发新能源,减少化石能源的使用,减少对化石燃料的依赖,减少污染,A正确; 3 3
B.为防止红酒中维生素被氧化,并防止细菌滋生,通常往红酒中添加少量二氧化硫,用于红酒
B.遇酚酞变红的溶液呈碱性,NH
4
+会与OH-反应,不能大量共存,B错误;
的抗氧化和除菌,B错误; C.与铝反应放出H
2
的溶液可能呈酸性,也可能呈碱性,若为酸性,Fe2+、NO
3
-不能大量共存,且有NO
3
-存
C.液氨汽化时,会吸收大量的热,故液氨可用作制冷剂,C错误; 在,铝与该溶液反应不放H ,若为碱性,Fe2+和Cu2+与OH-不能大量共存,C错误;
2
D.单晶硅能将太阳能转化为电能,则太阳能电池的主要材料是高纯度的单质硅,D错误;
D.水电离出的c(H+)=1.0×10-13mol·L-1的溶液中水的电离被抑制,溶液可能显酸性,也可能显碱性,如果显
2.答案A 酸性,CO 2-不能大量共存,如果显碱性,所有离子均可大量共存,故D正确;
3
解析:由图可知,该反应的反应物总能量高于生成物,属于放热反应。 7. 答案C
解析:A.合成氨使用含铁催化剂,为防止催化剂中毒,须将原料“净化”处理,A正确;
A.氨水和醋酸反应为酸碱中和反应,为放热反应,且无元素化合价变化,A正确;
B.步骤②中“加压”,可增大氮气、氢气浓度,加快合成氨反应速率又能使平衡右移,提高产率,B正确;
B.石灰石分解为吸热反应,B错误;
C.合成氨反应放热,步骤③使用较高温度不利于提高原料转化率,同时使用催化剂也不能使平衡移动,步骤
C.焦炭与二氧化碳反应属于氧化还原反应,且该反应为吸热反应,C错误;
④、⑤能有利于提高原料的转化率,故C错误;
D.铝与氧化铁粉末反应为氧化还原反应,且为放热反应,D错误;
D.产品液氨可用酸吸收生成铵态氮肥。液氨汽化时会吸收大量热,可用作制冷剂,D正确。
3.答案D
8. 答案D
【详解】A.广泛pH试纸读数为整数,pH应为2,故A错误;
解析:A.稀硫酸与锌反应可以生成氢气,右边抽气装置可以作为收集氢气的装置,抽气装置无刻度,不能
B.BaSO 难溶于水,但溶于水的部分可以完全电离,所以硫酸钡是强电解质,故B错误;
4
测定生成氢气的体积,该装置不能测量锌粒和一定浓度的稀硫酸反应的速率,A错误;
C.量筒的精度是0.1mL,不能用10mL量筒量取7.13mL稀盐酸,故C错误;
B.在控制变量法的实验中,通常只能有一个变量,图2的对比实验中,除了所加氯化锰不同外,两者的温度
D.根据K =c(H+)•c(OH-),c(H+)= mol/L,说明溶液中c(H+)=c(OH-),溶液一定呈中性,故D
w
不同,故不能用于验证MnCl 对过氧化氢分解的催化作用,B错误;
2
正确; K
C.KCl在该反应中实际上不参加反应,所以KCl浓度大小不影响平衡移动,所以不能实现实验目的,C错误;
4. 答案B D.通过观察烧瓶中气体颜色的变化(热水中烧瓶中气体的颜色加深,冷水中烧瓶中气体的颜色变浅)可以探
解析:A.甲烷与Cl 光照下取代反应是分步进行的,生成CH Cl 时应伴随生成2HCl而非H ,A
2 2 2 2 究温度对化学平衡的影响,D正确;
错误;B.工业制粗硅反应为SiO 与C高温下生成Si和CO,方程式书写正确,B正确;C.稀盐酸
2 9. 答案A
与Na S O 溶液反应:S O 2-+2H+=SO ↑+S↓+H O,C错误;D.氨水中的NH .H O是弱电解质,不可
2 2 3 2 3 2 2 3 2
【分析】由表格数据可知,升高温度,平衡常数增大,说明平衡向正反应方向移动,该反应为吸热反应。
拆,D错误;
【详解】A.由分析可知,该反应为吸热反应,故A正确;
5.答案D
1.51.5
B.若温度为700℃,由题给数据可知,反应的浓度熵Q= =2.25>K=0.6,则反应向逆反应方向进行,
解析:A.未说标况,且标况下水不是气体,无法确定物质的量,原子总数也无法确定,A错误; 11
B.没有说明体积,不能计算个数,B错误;
故B错误;1.51.5 cCH COOH
c
CH
COO-
C.由题给数据可知,t时刻反应达到化学平衡,则反应的平衡常数K=
11
=2.25,平衡常数 解析:A.由电离常数可知,溶液中
c
3 H+ =
K
3 ,向c点溶液加水稀释时,醋酸的电离常数
a
2.25介于1.7和2.6之间,则反应温度介于1000℃和1200℃之间,故C错误;
c
CH
COO- cCH COOH
D.若温度为830℃时,由题给数据可知,反应的浓度熵Q=
1.51.5
=2.25>1,反应向逆反应方
Ka不变,溶液中醋酸根离子浓度减小,则
K
3
a
和
c
3
H+
的值减小;溶液中
11
cCH COOH
1
cCH COOH
向进行,设反应生成M的物质的量浓度为amol/L,则由题意可建立如下三段式:
c
CH CO
3 O-
c
H+=
K
,由分析可知醋酸溶液加水稀释时,醋酸的电离常数不变,则
c
CH CO
3 O-
c
H+ 的值
3 a 3
M g + N g P g + Q g
不变,故A错误;
起(mol/L) 1 1 1.5 1.5
B.由稀释定律可知,醋酸溶液加水稀释时,溶液中醋酸的物质的量不变,中和能力不变,所以a、b、c三点
变(mol/L) a a a a
平(mol/L) 1+a 1+a 1.5-a 1.5-a
溶液用等浓度的氢氧化钠溶液中和时,消耗氢氧化钠溶液的体积相同,故B正确;
C.醋酸溶液加水稀释时,溶液的浓度减小,电离程度增大,由图可知,a、b、c三点醋酸的浓度依次减小,
(1.5-a)(1.5-a)
由平衡常数可得: =1,解得a=0.25mol/L,则平衡时M的浓度为(1+0.25)mol/L 则a、b、c三点醋酸的电离程度大小顺序为aa>c,溶液中氢离子浓度大小顺序为b>a>c,故D错误;
=1.25mol/L,故D错误;
13. 答案C
10. 答案B
解析:A.该反应为放热反应,温度降低,平衡正向移动,H 的平衡转化率增大;反应后气体体积减小,减小
2
解析:①反应前后气体分子数不变,混合气体的压强始终不变,①错误;
②根据ρ=m÷V,混合气体的质量增大,恒容V不变,故密度随着反应的进行增大,混合气体的 压强,平衡逆向移动,H 的平衡转化率减小,A错误;
2
密度不变时反应达到平衡,②正确;
B.容器Ⅲ反应到10min时已经达到平衡状态,列三段式得:
③A为固体,浓度为常数,③错误;
CO (g)3H (g) CH OH(g)H O(g)
2 2 3 2
④根据反应有3分子气体得到3分子气体,气体的总物质的量始终不变,,④错误;
起始/molL1 0.5 1.5 0 0
⑤3v B=2v C,说明正逆反应速率不相等,没有得到平衡状态,⑤错误; 转化/molL1 0.15 0.45 0.15 0.15
正 逆
⑥根据方程式可知C和D的浓度比值始终是2:1,不能判断化学平衡状态,⑥错误; 平衡/molL1 0.35 1.05 0.15 0.15
⑦单位时间内生成nmolD的同时生成3nmol的B,说明正逆反应速率相等,⑦正确; c(CH OH)c(H O) 0.150.15
该温度下平衡常数 K 3 2 = ,再加入1molCO g 和1molH O g 时,
⑧根据M=m÷n,混合气体的质量增大,n不变,故M随着反应的进行增大,混合气体的平均相 c(CO )c3(H ) 0.351.053 2 2
2 2
对分子质量不变时达到平衡,⑧正确;
c(CH OH)c(H O) 0.150.65 0.65 0.15 0.15 0.15
Q 3 2 = K ,平衡将向逆方向移动,B错误;
11.答案D c(CO )c3(H ) 0.851.053 0.85 1.053 0.35 1.053
2 2
解析:A.由于水的电离吸热,所以升高温度,水的离子积K 增大,故A错误 10.3
w C.容器Ⅱ反应10min时,CO 浓度减少量为c(CO ) molL1 0.35molL1,用CO 表示的平衡
2 2 2 2
B.当pOH=pH时,溶液均中性,故B错误
c(CO ) 0.35molL1
C.向d点纯水中通入少量HCl,其组成由d点沿cde曲线向e点移动,C错误 速率为v(CO ) 2 0.035molL1min1,C正确;
2 t 10min
D.加热f点纯水,其组成由f点沿Of直线向O方向迁移,D正确;
12. 答案B
D.根据分析知,10min时,容器Ⅰ中的反应正向进行且未达平衡状态,v(正)v(逆),D错误14.答案:D 给信息会产生一种无色无味的气体,因此该无色气体为CO ,则该过程发生的离子方程式为:
2
【分析】根据已知,反应I、II均为吸热反应,升高温度均有利于平衡正向移动,且反应I的热效 2Cu2 4HCO Cu (OH) CO 3CO H O;据此分析回答问题;
3 2 2 3 2 2
应更大,温度升高的时候对反应I影响更大一些,但平衡时CO
2
和CO的选择性之和为100%,故
【详解】(4)“除铁”步骤调pH的目的是将Fe3转化为FeOH 沉淀而除去,因此需要加入碱性物质,且不引
3
平衡时CO 和CO的选择性的变化趋势相反,只有第二个反应生成CO,因此升温CO的选择性
2
入新的杂质,故可选用CuOH 和CuO;
升高,故曲线③表示CO的选择性随温度的变化,曲线②表示平衡时H 的产率随温度的变化, 2
2
曲线①表示CO 2 的选择性随温度的变化,据此作答; 17.【答案】(每空2分)(1)2Mn(OH) +O =2MnO(OH) MnO(OH) 2I4H Mn2 I 3H O
2 2 2 2 2 2
【详解】A.由分析可知②代表H 的产率随温度的变化,A错误;
2
(2)BD(写对1个给1分,有错不给分) (3)②①④ (有错不给分)
B.选用高效催化剂可加快反应速率,不能使平衡发生移动,故H 平衡产率不变,B错误;
2
(4)滴入最后半滴硫代硫酸钠标准液,溶液由蓝色变为无色,且半分钟不恢复蓝色(未写完整扣1分)
nC H OH
C.一定温度下, 2 5 增大,可以认为开始时水蒸气物质的量不变,增大乙醇物质的量,
nH O (5)80cV
2
乙醇的平衡转化率降低,,C错误; (6)硫代硫酸钠能与硫酸反应,消耗硫代硫酸钠溶液体积增大,测定结果偏高 偏高
D.500℃,达到平衡时有2n(C H OH)+n(CO)+n(CO )=2mol,n(CO)=n(CO ),
2 5 2 2 【解析】(1)步骤Ⅰ过程中氢氧化锰悬浊液吸收氧气生成MnO(OH) ,化学方程式为:
2
n(C H OH)+n(CO)=1mol,D正确;
2 5
2Mn(OH) +O =2MnO(OH) ;步骤Ⅱ中MnO(OH) 氧化碘离子生成碘单质和锰离子、水,离子方程式为:
15、【答案】(除标注外,每空2分)(1)HClO⇌H++ClO- (2)CH COO- (1分) (3)AE 2 2 2 2
3
(4)CO +ClO-+H O=HClO+HCO - (5)> (1分) (6)正向 MnO(OH) 2I4H Mn2 I 3H O。
2 2 3 2 2 2
(7)CH 3 COOH(aq)+NaOH(aq)=CH 3 COONa(aq)+H 2 O(l) ΔH=-57.0KJ/mol (状态标错或者无单位扣 (2)滴定实验需要使用滴定管、锥形瓶等,不需要试管和圆底烧瓶,答案选BD;(3)滴定实验中的操作步
1分,数值错误没有分)
骤:检查仪器是否漏液→润洗仪器→加入标准溶液→排气泡→调节起始读数;答案为②①④;(4)碘单质中
(8)1.04×10-4
加入淀粉后显蓝色,然后滴入硫代硫酸钠后但反应,颜色褪去,故终点现象为:滴入最后半滴硫代硫酸钠标
K
解析【小题8】根据反应HCO 3 HCO 3 H 2 CO 3 CO 3 2,其平衡常数K= K 1 2 =1.04×10-4 准液,溶液由蓝色变为无色,且半分钟不恢复蓝色;(5)根据反应式或电子守恒知,nO 2 1 4 nNa 2 S 2 O 3 ,
16.【答案】(除标注外每空2分)(1)+1 (1分) SiO (1分)
2
1
cV10332103
(2)适当升高温度、适当增大硫酸浓度、粉碎固体增大接触面积等 (任写一条即可) 故溶解氧含量 4 mgL1 80cVmgL1 。
100103
(3)0.1mol/L~0.2mol/L (无单位不扣分) 4Fe3 Cu S4Fe2 2Cu2 S 温度过高,
2
(6)如果硫酸过多,硫代硫酸钠与硫酸反应,消耗硫代硫酸钠溶液体积增大,测定结果偏高;如果没有润洗
H O 分解,Cu浸取率降低 (4)BC(写对1个给1分,有错不给分)
2 2
滴定管,滴定管附着的水会稀释溶液,消耗标准的体积增大,导致结果偏高。
(5)2Cu2 4HCO Cu (OH) CO 3CO H O(无↓、↑不扣分)
3 2 2 3 2 2
0.24kPa0.24kPa
【分析】辉铜矿的主要成分为Cu
2
S,含SiO
2
及少量Fe
2
O
3
,浸取时,Fe
2
SO
4
3
起到了氧化辉铜矿 18.【答案】(每空2分)(1)+586(无+不扣分) (2)1 (3)-TRlnK(4)①
(
0.5mol
1.2kPa)(
1mol
1.2kPa)2
2.5mol 2.5mol
的作用,因此Fe SO 做氧化剂氧化Cu S,生成硫沉淀,涉及的离子方程式为:
2 4 3 2
4Fe3 Cu
2
S4Fe2 2Cu2 S,H
2
O
2
的作用是将Fe2氧化为Fe3,便于后续“除铁”的时候除去; 或 ②不变 (5)①2NO
3
-+10e-+12H+ N
2
+6H
2
O ②升高
0.24×0.24
SiO 不溶于稀硫酸,因此过滤所得滤渣为S和SiO ;“沉铜”过程中加入NH HCO ,根据题目所 2
2 2 4 3 详解0:(.244×)0①.48由图可知,投料比为2时,甲醛的分压为0.24kPa,设初始氢气和二氧化碳的物质的量为2mol和1mol,平衡时甲醛的物质的量为amol,由题意可建立如下三段式:
CO g+ 2H g HCHOg+ H Og
2 2 2
起(mol) 1 2 0 0
变(mol) a 2a a a
平(mol) 1-a 2-2a a a
1.44kPa(3-a)mol
由气体的物质的量之比等于压强之比可知,平衡时的压强为 ,由甲醛的分压为
3mol
amol 1.44kPa(3-a)mol
0.24kPa可得: × =0.24kPa,解得a=0.5,则平衡时总压为
(3-a)mol 3mol
0.24kPa0.24kPa
1.44kPa2.5mol
=1.2kPa,则该反应的压强平衡常数K = 0.5mol 1mol
3mol P ( 1.2kPa)( 1.2kPa)2
2.5mol 2.5mol
nH
;②当起始 2 2时,反应达平衡后再向容器中加入二氧化碳和水蒸气,使两者分压均增
nCO
2
0.24kPa0.29kPa
大0.05kPa,反应的浓度熵Q= =K ,则平衡不移动,氢气的平衡转化率不变
(0.29kPa)(0.48kPa)2 P