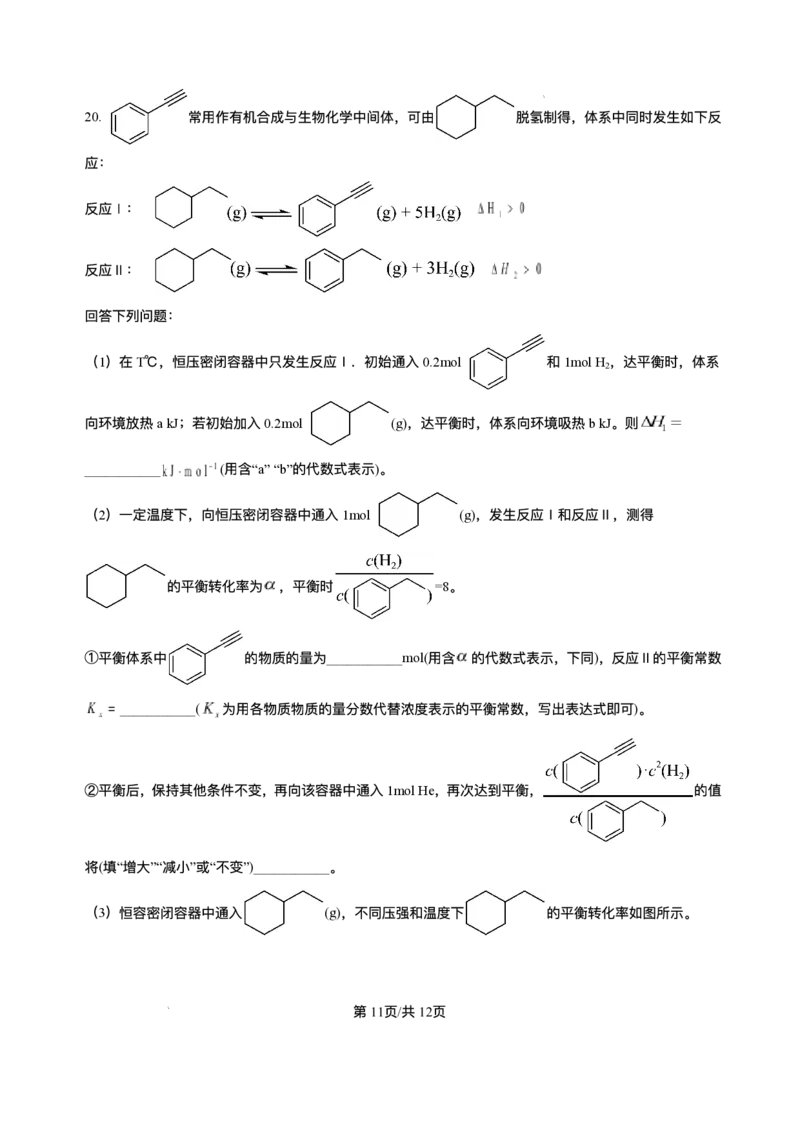
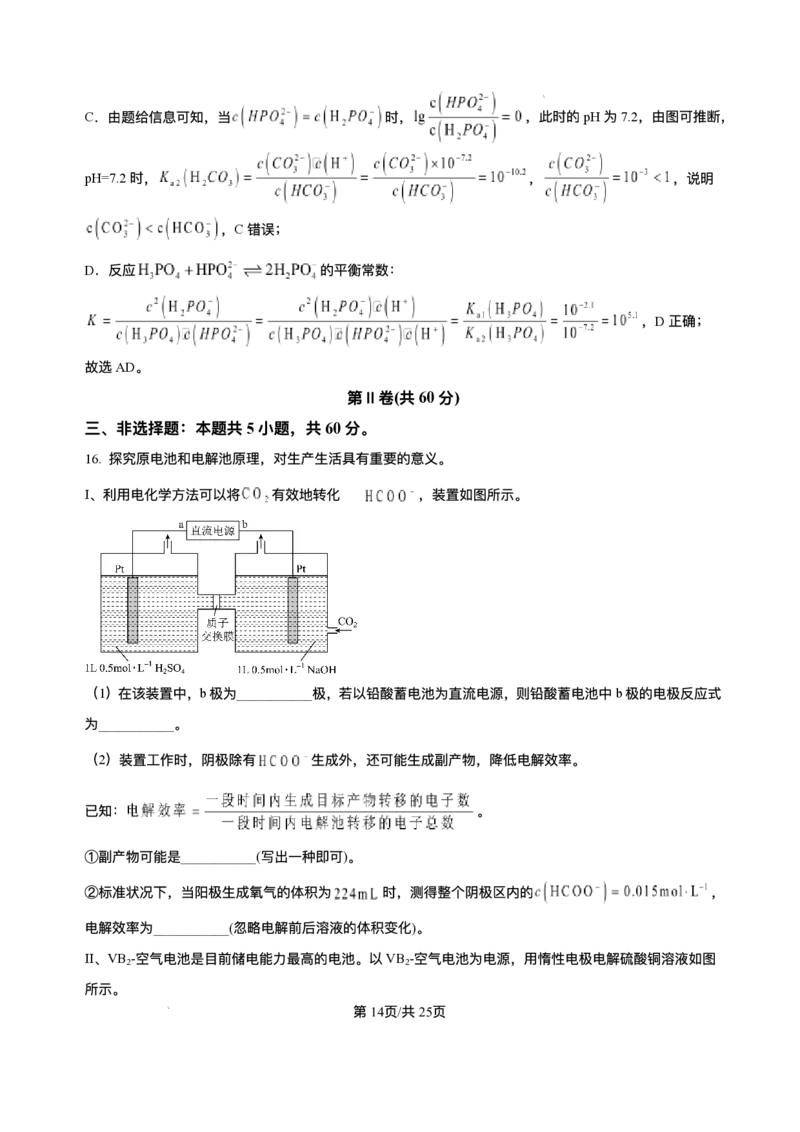
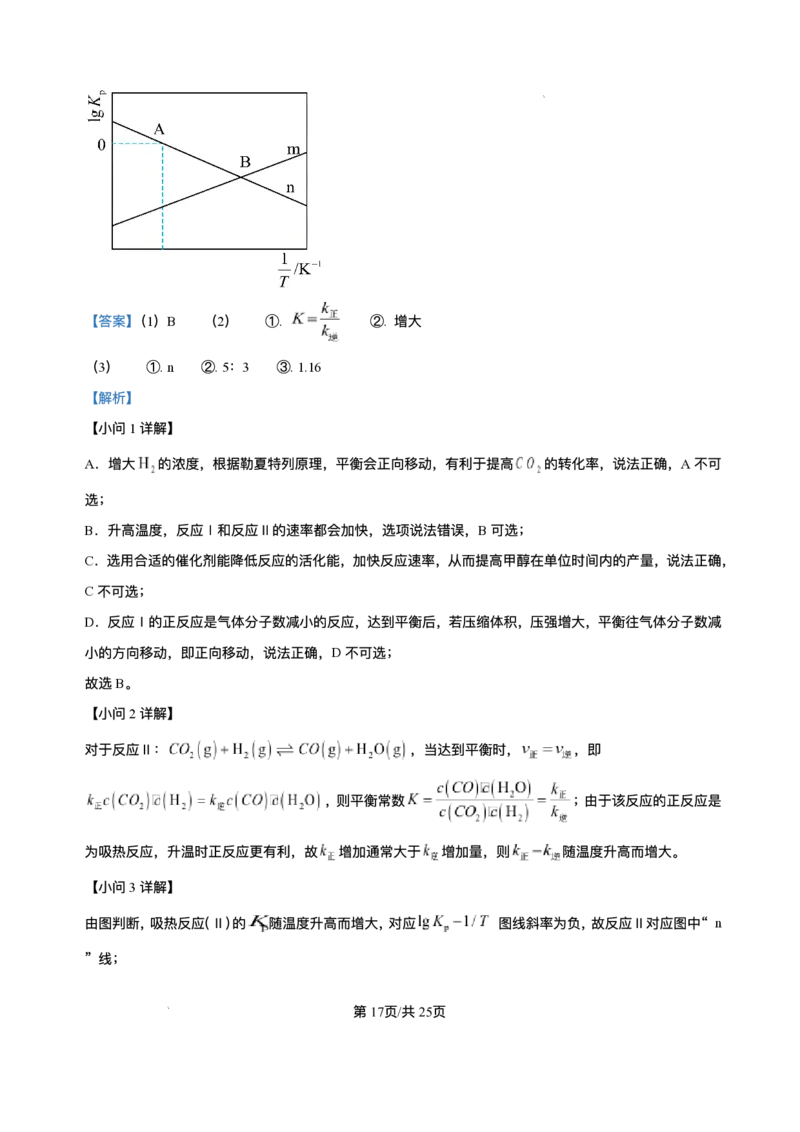
文档内容
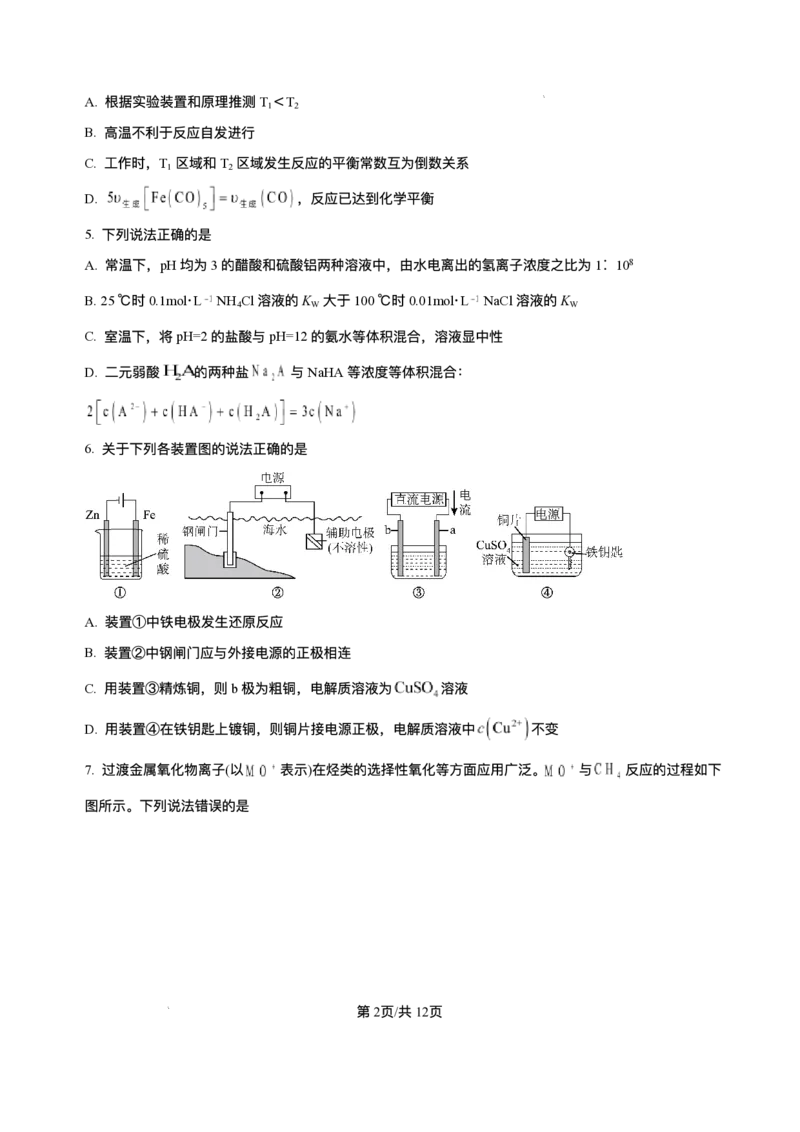
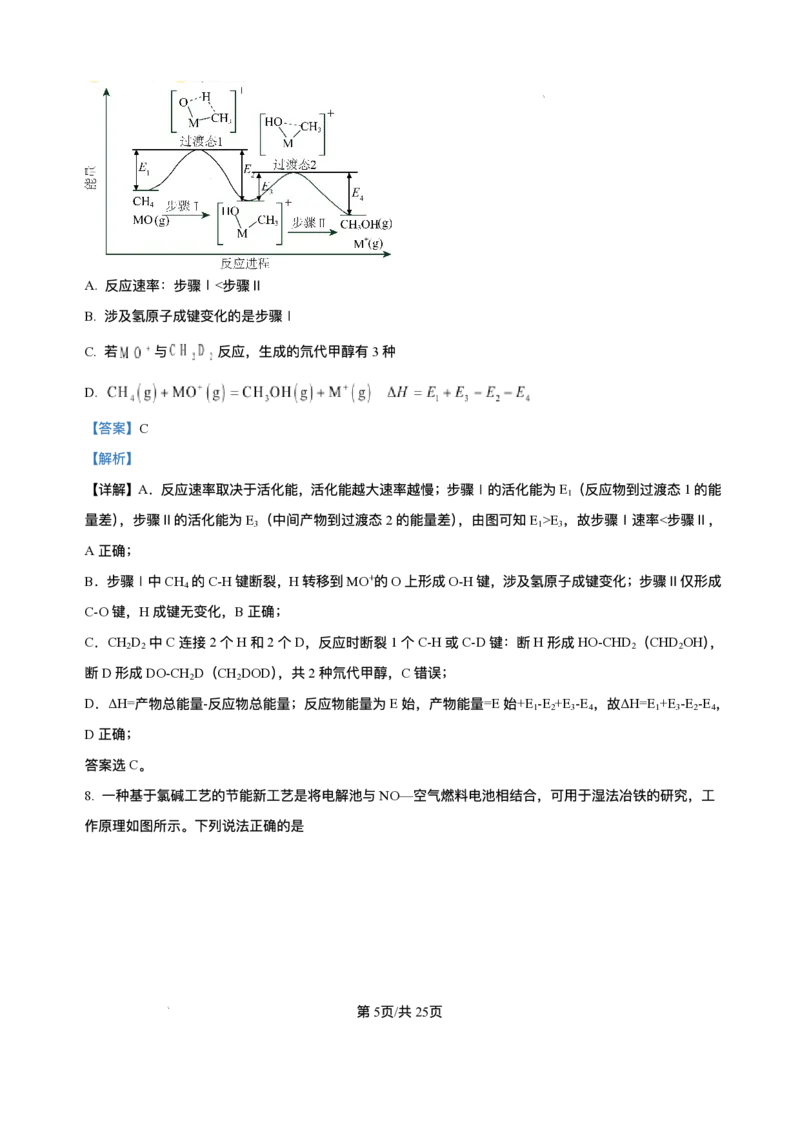
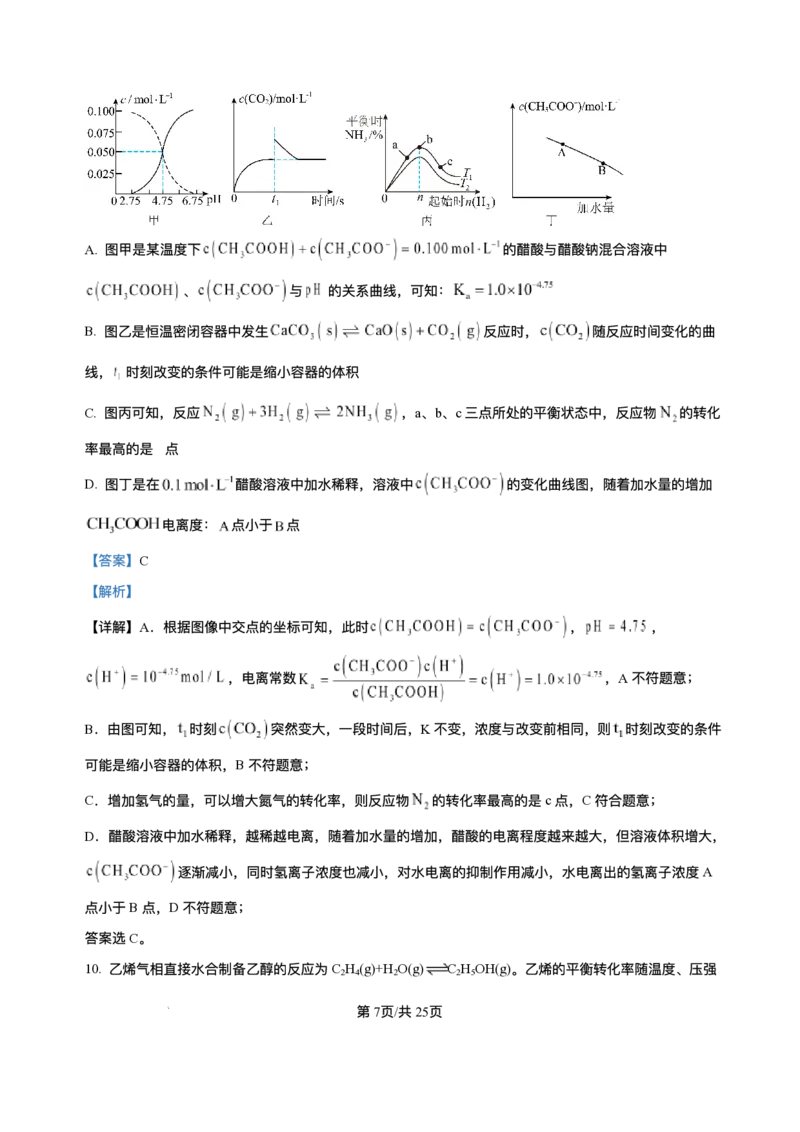
b D. 图中a点对应的压强平衡常数K = P ⼆、选择题:本题共5⼩题,每⼩题4分,共20分。每⼩题只有⼀个或两个选项符合题⽬要 求,全部选对得4分,选对但不全的得2分,有选错的得0分。 11. 下列设计⽅案、现象和结论都正确,且能达到实验⽬的的是 实验⽬的 ⽅案设计 现象 结论 第4⻚/共12⻚ 学科⽹(北京)股份有限公司向饱和Na CO 溶液中加 相同温度下,Ka 2 3 A ⽐较酸性强弱 ⽆明显⽓泡 ⼊过量酸HB (HB)<Ka (H CO ) 1 2 3 向恒温恒容密闭玻璃容器 对于反应前后⽓体 探究压强对化 中充⼊100mLHI⽓体,分 总体积不变的可逆 B 学平衡移动的 ⽓体颜⾊不变 解达到平衡后再充⼊ 反应,改变压强平衡 影响 100mLAr 不移动 向FeCl 溶液中滴加 3 探究浓度对化 KSCN溶液发⽣反应 增⼤⽣成物浓度,平 加KCl后溶液红 C 学平衡移动的 FeCl (aq)+3KSCN(aq) 衡向逆反应⽅向移 3 ⾊变浅 影响 Fe(SCN) (aq)+3KCl(aq), 动 3 再加⼊少量KCl固体 检验FeCl 中是 取FeCl 样品溶于⽔配成 3 3 溶液紫红⾊褪 FeCl 中含有FeCl 3 2 D 否含有FeCl 杂 溶液,将该溶液加⼊酸性 2 去 杂质 质 ⾼锰酸钾溶液中 A.A B.B C.C D.D 12. 以“全氢电池”为电源直接电解氯化钠溶液制备H 和HClO的装置如图所示(⼯作时,H O在双极膜界⾯ 2 2 处被催化解离成H+和OH-)。下列说法正确的是 A.“全氢电池”的总反应为H++OH-=H O 2 B. 电解池中Na+向左移动 C. 阳极区发⽣的电极反应为2Cl--2e-=Cl ↑ 2 D. 理论上负极消耗1molH ,电解池阳极区减少1mol阳离⼦(忽略HClO的电离) 2 13. 某矿⽯主要成分为 ,含有 、 等杂质。以该矿⽯为原料制备 ⼯艺流程如 第5⻚/共12⻚ 学科⽹(北京)股份有限公司下图所示: 下列说法正确的是 A. 在实验室模拟进⾏“焙烧”可以选⽤⽯英坩埚 B. 滤渣1只含有 C. 物质Y可选⽤ ,也可选⽤氨⽔ D.“沉铈”时消耗的 与 物质的量之⽐为2∶ 3 14. 室温下,某溶液初始时仅溶有A和B且浓度相等,同时发⽣以下两个反应:① ,② ;反应①的速率可表示为 ,反应②的速率可表示为 ( 为 速率常数)。反应体系中组分A、Z的浓度随时间变化情况如图,下列说法正确的是 A.0~300S时间段内,Y的平均反应速率为 B. 反应开始后,体系中Y和Z 浓度之⽐不断变化 C. 如果反应能进⾏到底,反应结束时60%的A转化为Z D. 反应② 活化能⽐反应①的活化能⼤ 15. ⼈体⾎液存在 和 等缓冲对。常温下,⽔溶液中各缓冲对的微粒浓度之 ⽐的对数值lgx[x表示 或 与pH的关系如图所示。 第6⻚/共12⻚ 学科⽹(北京)股份有限公司已知: , , , , 。 下列说法正确的是 A. 曲线Ⅰ表示 与pH的变化关系 B. ⽔的电离程度:a点 >b点 C. 当 时, D. 反应 的平衡常数K=105.1 第Ⅱ卷(共60分) 三、⾮选择题:本题共5⼩题,共60分。 16. 探究原电池和电解池原理,对⽣产⽣活具有重要的意义。 I、利⽤电化学⽅法可以将 有效地转化为 ,装置如图所示。 (1)在该装置中,b极为___________极,若以铅酸蓄电池为直流电源,则铅酸蓄电池中b极的电极反应式 为___________。 (2)装置⼯作时,阴极除有 ⽣成外,还可能⽣成副产物,降低电解效率。 已知: 。 第7⻚/共12⻚ 学科⽹(北京)股份有限公司①副产物可能是___________(写出⼀种即可)。 ②标准状况下,当阳极⽣成氧⽓的体积为 时,测得整个阴极区内的 , 电解效率为___________(忽略电解前后溶液的体积变化)。 II、VB -空⽓电池是⽬前储电能⼒最⾼的电池。以VB -空⽓电池为电源,⽤惰性电极电解硫酸铜溶液如图 2 2 所示。 (3)该电池⼯作时 反应为4VB +11O =4B O +2V O 。其中正极的电极反应式为___________,负极的 2 2 2 3 2 5 电极反应式为___________。 (4)电解⼀段时间后,B池中溶液的pH将___________(填“ 增⼤” 、“ 减⼩” 或“ 不变” )。 17. 利⽤ 和 合成 对节能减排、降低碳排放具有重⼤意义。 催化加氢制甲醇是极具前景的资源化研究领域,主要反应有: Ⅰ.CO (g)+3H (g) CH OH(g)+H O(g) ; 2 2 3 2 Ⅱ.CO (g)+H (g) CO(g)+H O(g) ; 2 2 2 回答下列问题: (1)在该反应体系中,下列有关说法错误的是___________。 A. 增⼤ 的浓度有利于提⾼ 的转化率 B. 升⾼温度,反应Ⅱ的速率加快,反应Ⅰ的速率减慢 C. 选⽤合适的催化剂可以提⾼甲醇在单位时间内的产量 D. 达到平衡后,若压缩体积,反应Ⅰ平衡正向移动 (2)反应Ⅱ的反应速率 ,其中 分别为正、逆 反应速率常数。该反应的平衡常数K=___________(写出含 的表达式),升⾼温度时, ___________(填“ 增⼤” 、“ 减⼩” 或“ 不变” )。 (3)在恒压密闭容器中,按照 投料进⾏反应,反应 以物质的分压表示的平 第8⻚/共12⻚ 学科⽹(北京)股份有限公司衡常数 随温度T的变化关系如图所示(体系总压为3kPa)。反应Ⅱ对应图中___________(填“ m” 或“ n” 线);A点对应温度下体系达到平衡时 的转化率为80%,则平衡时CH OH与CO的物质的量之⽐为 3 ___________,反应Ⅰ的 ___________ (保留三位有效数字)。 18. 甲酸( )是⼀种有机化⼯原料,⼴泛⽤于农药、医药等⼯业。回答下列问题: (1)已知室温时, 在⽔中有1%发⽣电离,⽔电离出的H+浓度为___________mol/L 。 (2)部分弱酸、弱碱的电离平衡常数如下表: 弱酸、弱碱 或 (25℃) = = ①常温下,0.1mol/L 溶液加⽔稀释过程中,下列数据变⼤的是___________(填标号)。 A. B. C. D. ②常温下⽤ 溶液作 捕捉剂不仅可以降低碳排放,还可得到重要化⼯产品纯碱。某次捕捉后得到 的纯碱溶液,则溶液中 ___________。 ③25℃时,向 的氨⽔中滴加 的 溶液,当滴加 溶液 时,混合溶液的 ,则V___________ (填“>”“<”或“=”)。 ④25℃时,将 的 与 的 溶液等体积混合(忽略溶液体积变化),充分 反应后,溶液中存在 ,则该混合溶液中 的电离常数 第9⻚/共12⻚ 学科⽹(北京)股份有限公司___________(⽤含a和b的代数式表示)。 (3)可利⽤如图装置由甲醇( )制备甲酸或甲酸盐,电极均为惰性电极,⼯作原理如图所示。 若有4molH+通过质⼦交换膜时,则该装置 ⽣成 和 共计___________mol。 19. 五氧化⼆钽(Ta O )主要⽤作钽酸锂单晶和制造⾼折射低⾊散特种光学玻璃等。⼀种以含钽废料(主要成 2 5 分为NaTaO 、SiO 以及少量的FeO、Fe O 、Al O 等)为原料制备Ta O 的⼯艺流程如图所示: 3 2 2 3 2 3 2 5 已知:H TaF 是弱酸。回答下列问题: 2 7 (1)“ 酸溶” 时,Fe O 发⽣反应的化学⽅程式为___________,滤渣的主要成分是___________(填化学式)。 2 3 (2)“ 氧化” 时,发⽣反应的离⼦⽅程式为___________。 (3)“ 调pH” 使溶液的pH=5时Al3+刚好沉淀完全,则反应Al(OH) (s) Al3+(aq)+3OH-(aq)的平衡常数 3 K=___________(mol/L)4。(已知:溶液中⾦属离⼦浓度⼩于或等于1× 10−6时可视为沉淀完全)。 (4)“ 浸钽” 时,加⼊4g/L的HF溶液,浸出时间为4h,钽的浸出率随温度的变化如图所示,则浸出的最 佳温度为___________℃;“ 调pH” 后,溶液中溶质主要为NaTaO ,写出“ 浸钽” 时⽣成H TaF 的离⼦⽅ 3 2 7 程式:___________。 (5)“ 沉钽” 时,⽣成Ta(OH) ,反应化学⽅程式为___________。 5 第10⻚/共12⻚ 学科⽹(北京)股份有限公司20. 常⽤作有机合成与⽣物化学中间体,可由 脱氢制得,体系中同时发⽣如下反 应: 反应Ⅰ: 反应Ⅱ: 回答下列问题: (1)在T℃,恒压密闭容器中只发⽣反应Ⅰ.初始通⼊0.2mol 和1molH ,达平衡时,体系 2 向环境放热akJ;若初始加⼊0.2mol (g),达平衡时,体系向环境吸热bkJ。则 ___________ (⽤含“a”“b”的代数式表示)。 (2)⼀定温度下,向恒压密闭容器中通⼊1mol (g),发⽣反应Ⅰ和反应Ⅱ,测得 的平衡转化率为 ,平衡时 =8。 ①平衡体系中 的物质的量为___________mol(⽤含 的代数式表示,下同),反应Ⅱ的平衡常数 ___________( 为⽤各物质物质的量分数代替浓度表示的平衡常数,写出表达式即可)。 ②平衡后,保持其他条件不变,再向该容器中通⼊1molHe,再次达到平衡, 的值 将(填“增⼤”“减⼩”或“不变”)___________。 (3)恒容密闭容器中通⼊ (g),不同压强和温度下 的平衡转化率如图所示。 第11⻚/共12⻚ 学科⽹(北京)股份有限公司①压强⼤⼩:p(Q)___________p(M)(填“>”“<”或“=”)。 ②N点的平衡转化率⽐M点⾼,原因可能是___________。 第12⻚/共12⻚ 学科⽹(北京)股份有限公司济南⼀中 级⾼⼆期中学情检测 2024 化学试题 说明:本试题分为第Ⅰ卷和第Ⅱ卷两部分,第Ⅰ卷为第1⻚⾄第6⻚,共15⼩题,第Ⅱ卷为 第6⻚⾄第10⻚,共5题。请将答案按要求填写在答题纸相应位置,答在其它位置⽆效,考 试结束后将答题卡上交。试题满分100分,考试时间90分钟。 第Ⅰ卷(共40分) 可能⽤到的相对原⼦质量 Fe56 ⼀、选择题:本题共10⼩题,每⼩题2分,共20分。每⼩题只有⼀个选项符合题⽬要求。 1. 化学与科技、⽣产、⽣活息息相关。下列说法错误的是 A. ⻓期过量使⽤NH Cl等铵态化肥易导致⼟壤酸化 4 B. 采⽤催化转换技术能提⾼汽⻋尾⽓中有害⽓体的平衡转化率 C.“ 奋⽃者” 号载⼈潜⽔器使⽤的锂离⼦电池是⼆次电池 D. 煤⽓中毒与⾎红蛋⽩跟 、CO结合过程中的平衡移动有关 【答案】B 【解析】 【详解】A.铵态化肥中的铵根离⼦会发⽣⽔解反应,其⽔解⽅程式为 , ⽔解产⽣氢离⼦,使得⼟壤溶液中氢离⼦浓度增⼤,⻓期过量使⽤铵态化肥,会导致⼟壤酸化,A正确; B.催化剂只能加快反应速率,不影响平衡转化率,B错误; C.锂离⼦电池可充电,属于⼆次电池,C正确; D.⾎红蛋⽩与氧⽓结合形成氧合⾎红蛋⽩,存在平衡 ,当煤⽓中毒时,⼀氧化碳与⾎ 红蛋⽩的结合能⼒⽐氧⽓强,⼀氧化碳与⾎红蛋⽩结合形成碳氧⾎红蛋⽩,使上述平衡向左移动,导致⾎ 红蛋⽩不能正常携带氧⽓,从⽽引起中毒,D正确; 故答案选B。 2. 下列说法错误的是 A. 在任何温度下,纯⽔都呈中性 B. 熵增加的反应都能正向⾃发进⾏ C. 医⽤药品通常在低温、⼲燥的环境中密封保存 D. 平衡常数数值越⼤,说明该反应可以进⾏得越完全 第1⻚/共25⻚ 学科⽹(北京)股份有限公司【答案】B 【解析】 【详解】A.任何温度下,纯⽔中存在c(H+)=c(OH-),呈中性,故A说法正确; B.仅从焓变或熵变不能准确判断反应进⾏的⽅向,需要根据复合判据:ΔG=ΔH-TΔS,如某些吸热且属于 熵增的反应,在低温下不能⾃发进⾏,故B说法错误; C.药品密闭保存可避免吸潮⽽变质,在低温下药品分解和变质速度减慢,对药品保管有利,因此医⽤药品 通常在低温、⼲燥的环境中密封保存,故C说法正确; D.平衡常数是表明化学反应限度的⼀个特征值,K越⼤,说明平衡体系中⽣成物所占的⽐例越⼤,正反应 进⾏程度越⼤,即该反应进⾏得越完全,故D说法正确; 答案为B。 3. 若溶液中由⽔电离产⽣的 mol⋅L ,该溶液中⼀定能⼤量共存的离⼦组是 A. 、 、 、 B. 、 、 、 C. 、 、 、 D. 、 、 、 【答案】A 【解析】 【分析】溶液中由⽔电离产⽣的 ,溶液可能呈强酸性或强碱性。 【详解】A. 、 、 、 在强酸性条件下或强碱性条件下均能⼤量共存,A项符合题意; B. 和 均不能在强酸性条件下⼤量共存,B项不符合题意; C. 既不能在强酸性条件下⼤量共存,也不能在强碱性条件下⼤量共存,C项不符合题意; D. 不能在强碱性条件下⼤量共存, 不能在强酸性条件下⼤量共存,D项不符合题意; 故选A。 4. 以羰基化合物为载体运⽤化学平衡分离、提纯某纳⽶级活性铁粉,反应原理为 装置如下: 第2⻚/共25⻚ 学科⽹(北京)股份有限公司下列说法错误的是 A. 根据实验装置和原理推测T <T 1 2 B. ⾼温不利于反应⾃发进⾏ C. ⼯作时,T 区域和T 区域发⽣反应的平衡常数互为倒数关系 1 2 D. ,反应已达到化学平衡 【答案】C 【解析】 【详解】A.ΔH<0,为放热反应,当羰基合铁挥发到较⾼温度区域,五羰基合铁分解,纯铁粉残留在右端, ⼀氧化碳循环利⽤,铁粉和⼀氧化碳化合成五羰基合铁时放出热量,反应Fe(s)+5CO(g) Fe(CO) (g)ΔH 5 <0,因此T <T ,A正确; 1 2 B.该反应为放热反应,ΔH<0,熵变⼩于0,根据反应△G=ΔH-T△S,,⾼温不利于反应⾃发进⾏,反应 △G增⼤,B正确; C.T 区域Fe(s)+5CO(g) Fe(CO) (g)K ,T 区域发⽣反应Fe(s)+5CO(g) Fe(CO) (g)K ,两者温度不 1 5 1 2 5 2 同,则平衡常数不是互为倒数关系,C错误; D.根据Fe(s)+5CO(g) Fe(CO) (g),根据计量数之间的关系,5 [Fe(CO) ]= (CO),反应已达到化 5 ⽣成 5 ⽣成 学平衡,D正确; 故答案为:C。 5. 下列说法正确的是 A. 常温下,pH均为3的醋酸和硫酸铝两种溶液中,由⽔电离出的氢离⼦浓度之⽐为1∶ 108 B.25℃时0.1mol⋅L NH Cl溶液的K ⼤于100℃时0.01mol⋅L NaCl溶液的K 4 W W C. 室温下,将pH=2的盐酸与pH=12的氨⽔等体积混合,溶液显中性 D. ⼆元弱酸 的两种盐 与NaHA等浓度等体积混合: 【答案】A 【解析】 【详解】A.醋酸溶液中⽔电离的 浓度等于溶液中 的浓度( ),硫酸铝溶液中⽔电离 的 浓度等于溶液中的 浓度( ),两者之⽐为 ,A正确; B.⽔的离⼦积(K )仅与温度有关,25℃时K (约1× 10-14)⼩于100℃时的K (约1× 10-12),B错误; w w w 第3⻚/共25⻚ 学科⽹(北京)股份有限公司C.pH=12的氨⽔浓度远⼤于pH=2的盐酸浓度,等体积混合后氨⽔过量,溶液显碱性,C错误; D.混合后 有三份,⽽与A有关的粒⼦有两份,所以物料守恒为 , D错误; 故答案选A。 6. 关于下列各装置图的说法正确的是 A. 装置①中铁电极发⽣还原反应 B. 装置②中钢闸⻔应与外接电源 正极相连 C. ⽤装置③精炼铜,则b极为粗铜,电解质溶液为 溶液 D. ⽤装置④在铁钥匙上镀铜,则铜⽚接电源正极,电解质溶液中 不变 【答案】D 【解析】 【详解】A.装置①中铁电极为阳极,发⽣氧化反应,故A错误; B.装置②为外加电源的阴极保护法,钢闸⻔与外接电源的负极相连,电源提供电⼦⽽防⽌铁被氧化,故B 错误; C.根据电流的⽅向可知a为电解池的阳极,则⽤来精炼铜时,a极为粗铜,电解质溶液为CuSO 溶液,故 4 C错误; D.在铁钥匙上镀铜,铜为阳极,接电源正极,阴极上Cu2++2e-=Cu,阳极上Cu-2e-=Cu2+,故电解质溶液中 不变,故D正确; 答案选D; 7. 过渡⾦属氧化物离⼦(以 表示)在烃类的选择性氧化等⽅⾯应⽤⼴泛。 与 反应的过程如下 图所示。下列说法错误的是 第4⻚/共25⻚ 学科⽹(北京)股份有限公司A. 反应速率:步骤Ⅰ<步骤Ⅱ B. 涉及氢原⼦成键变化的是步骤Ⅰ C. 若 与 反应,⽣成的氘代甲醇有3种 D. 【答案】C 【解析】 【详解】A.反应速率取决于活化能,活化能越⼤速率越慢;步骤Ⅰ的活化能为E(反应物到过渡态1的能 1 量差),步骤Ⅱ的活化能为E (中间产物到过渡态2的能量差),由图可知E >E ,故步骤Ⅰ速率<步骤Ⅱ, 3 1 3 A正确; B.步骤Ⅰ中CH 的C-H键断裂,H转移到MO+的O上形成O-H键,涉及氢原⼦成键变化;步骤Ⅱ仅形成 4 C-O键,H成键⽆变化,B正确; C.CH D 中C连接2个H和2个D,反应时断裂1个C-H或C-D键:断H形成HO-CHD (CHD OH), 2 2 2 2 断D形成DO-CH D(CH DOD),共2种氘代甲醇,C错误; 2 2 D.ΔH=产物总能量-反应物总能量;反应物能量为E始,产物能量=E始+E -E +E -E ,故ΔH=E +E -E -E , 1 2 3 4 1 3 2 4 D正确; 答案选C。 8. ⼀种基于氯碱⼯艺的节能新⼯艺是将电解池与NO—空⽓燃料电池相结合,可⽤于湿法冶铁的研究,⼯ 作原理如图所示。下列说法正确的是 第5⻚/共25⻚ 学科⽹(北京)股份有限公司A.a极为阳极,发⽣氧化反应 B. 阴极区溶液的 保持不变 C.d极为负极,其电极反应式为 D. 理论上每⽣成 ⽓体,可得到2.8gFe 【答案】C 【解析】 【分析】NO-空⽓燃料电池中,通⼊NO的多孔碳棒d电极为负极,通⼊O 的多孔碳棒c电极为正极,则 2 b电极为阳极,b电极的电极反应: ,a电极为阴极,发⽣还原反应,Fe O 在碱性条件 2 3 下转化为Fe,电极反应: ,中间为阳离⼦交换膜,Na+由阳极移向阴极, 据此分析判断。 【详解】A.结合分析可知,b极为阳极,发⽣氧化反应,A错误; B.结合分析可知,a电极为阴极,发⽣还原反应,Fe O 在碱性条件下转化为Fe,电极反应: 2 3 ,阴极区溶液中 浓度逐渐升⾼,pH增⼤,B错误; C.结合分析可知,d为负极,该电极NO失去电⼦,⽣成硝酸,电解质溶液为酸性,电极反应为: ,C正确; D.结合分析可知,X为氯⽓,则每⽣成 ⽓体,转移 电⼦,结合阴极电极反应式 可知,此时可以⽣成 ,质量为 ,D错误; 故选C。 9. 下列图示与对应的叙述不相符的是 第6⻚/共25⻚ 学科⽹(北京)股份有限公司A. 图甲是某温度下 的醋酸与醋酸钠混合溶液中 、 与 的关系曲线,可知: B. 图⼄是恒温密闭容器中发⽣ 反应时, 随反应时间变化的曲 线, 时刻改变的条件可能是缩⼩容器的体积 C. 图丙可知,反应 ,a、b、c三点所处的平衡状态中,反应物 的转化 率最⾼的是 点 D. 图丁是在 醋酸溶液中加⽔稀释,溶液中 的变化曲线图,随着加⽔量的增加 电离度: 点⼩于 点 【答案】C 【解析】 【详解】A.根据图像中交点的坐标可知,此时 , , ,电离常数 ,A不符题意; B.由图可知, 时刻 突然变⼤,⼀段时间后,K不变,浓度与改变前相同,则 时刻改变的条件 可能是缩⼩容器的体积,B不符题意; C.增加氢⽓的量,可以增⼤氮⽓的转化率,则反应物 的转化率最⾼的是c点,C符合题意; D.醋酸溶液中加⽔稀释,越稀越电离,随着加⽔量的增加,醋酸的电离程度越来越⼤,但溶液体积增⼤, 逐渐减⼩,同时氢离⼦浓度也减⼩,对⽔电离的抑制作⽤减⼩,⽔电离出的氢离⼦浓度A 点⼩于B点,D不符题意; 答案选C。 10. ⼄烯⽓相直接⽔合制备⼄醇的反应为C H (g)+H O(g) C H OH(g)。⼄烯的平衡转化率随温度、压强 2 4 2 2 5 第7⻚/共25⻚ 学科⽹(北京)股份有限公司的变化关系如下[起始时,n(H O)=n(C H )=1mol,a点平衡时容器体积为1L]。下列分析错误的是 2 2 4 A. ⼄烯⽓相直接⽔合反应的∆H<0 B. 图中压强 ⼤⼩关系为p
b
D. 图中a点对应的压强平衡常数K =
P
【答案】D
【解析】
【详解】A.压强不变时,升⾼温度⼄烯转化率降低,平衡逆向移动,正反应为放热反应,则 ,A
正确;
B.相同温度下,增⼤压强平衡正向移动,⼄烯转化率增⼤,根据图知,压强: ,B正确;
C.温度越⾼、压强越⼤,化学反应速率越快,反应达到平衡时间越短;已知温度、压强 ,则反应速
率 ,所需要的时间 ,C正确;
D.a点⼄烯转化率为20%,则消耗的 ,列出三段式:
,则
,D错误;
故选D。
⼆、选择题:本题共5⼩题,每⼩题4分,共20分。每⼩题只有⼀个或两个选项符合题⽬要
求,全部选对得4分,选对但不全的得2分,有选错的得0分。
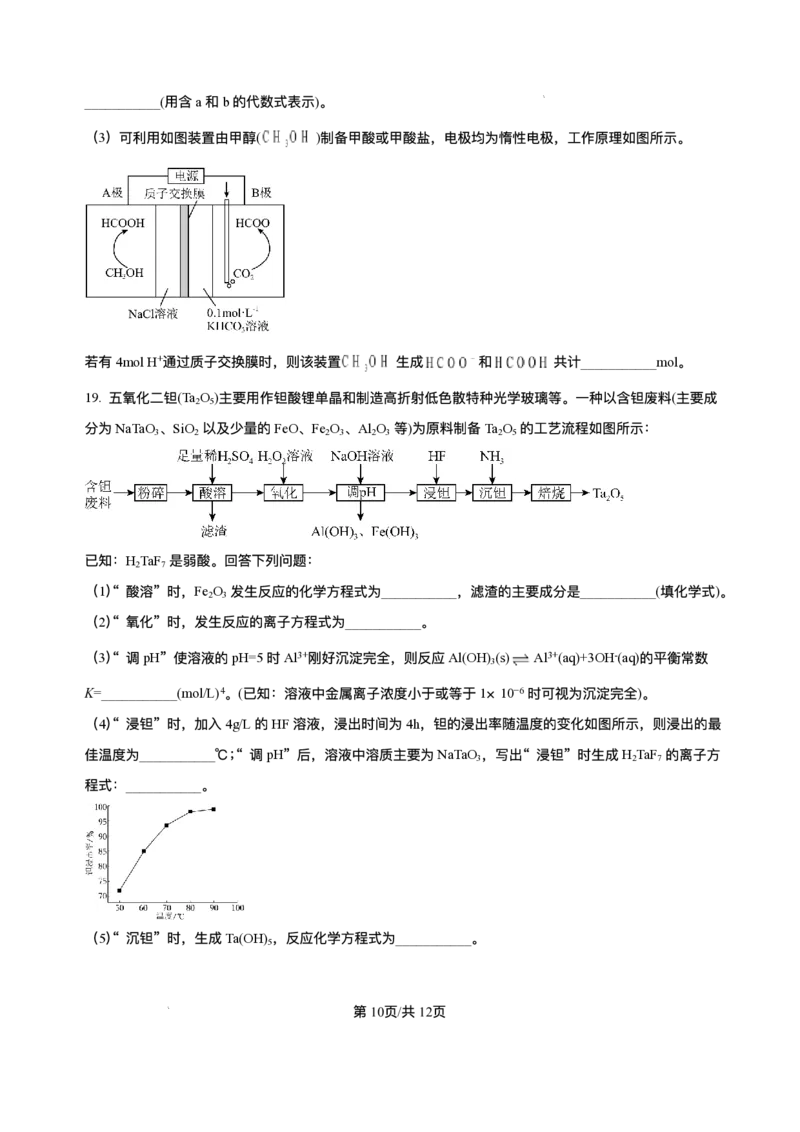
第8⻚/共25⻚
学科⽹(北京)股份有限公司11. 下列设计⽅案、现象和结论都正确,且能达到实验⽬的的是
实验⽬的 ⽅案设计 现象 结论
向饱和Na CO 溶液中加 相同温度下,Ka
2 3
A ⽐较酸性强弱 ⽆明显⽓泡
⼊过量酸HB (HB)<Ka (H CO )
1 2 3
向恒温恒容密闭玻璃容器 对于反应前后⽓体
探究压强对化
中充⼊100mLHI⽓体,分 总体积不变的可逆
B 学平衡移动的 ⽓体颜⾊不变
解达到平衡后再充⼊ 反应,改变压强平衡
影响
100mLAr 不移动
向FeCl 溶液中滴加
3
探究浓度对化 KSCN溶液发⽣反应 增⼤⽣成物浓度,平
加KCl后溶液红
C 学平衡移动的 FeCl (aq)+3KSCN(aq) 衡向逆反应⽅向移
3
⾊变浅
影响 Fe(SCN) (aq)+3KCl(aq), 动
3
再加⼊少量KCl固体
检验FeCl 中是 取FeCl 样品溶于⽔配成
3 3
溶液紫红⾊褪 FeCl 中含有FeCl
3 2
D 否含有FeCl 杂 溶液,将该溶液加⼊酸性
2
去 杂质
质 ⾼锰酸钾溶液中
A.A B.B C.C D.D
【答案】A
【解析】
【详解】A.饱和 Na CO 溶液中加⼊过量酸 HB,⽆⽓泡产⽣,可知碳酸的酸性强,则 K
2 3 a
(HB)<K (H CO ),A符合题意;
a1 2 3
B.向恒容容器中充⼊不参与反应的氩⽓,任意可逆反应的平衡体系中各物质的浓度不变,反应速率不变,
平衡不移动,则向恒温恒容密闭玻璃容器中充⼊100mL碘化氢⽓体,分解达到平衡后再充⼊100mL氩⽓,
⽓体颜⾊不变不能说明对于反应前后⽓体总体积不变的可逆反应,改变压强平衡不移动,B不合题意;
C.存在的化学平衡为:Fe3++3SCN- Fe(SCN) ,加⼊少量KCl固体,溶液中Fe3+、SCN-浓度不变,平衡
3
不移动,C不合题意;
D.亚铁离⼦、氯离⼦均可被酸性⾼锰酸钾溶液氧化,则紫⾊褪去,不能证明FeCl 中含有FeCl 杂质,D
3 2
第9⻚/共25⻚
学科⽹(北京)股份有限公司不合题意;
故答案为:A。
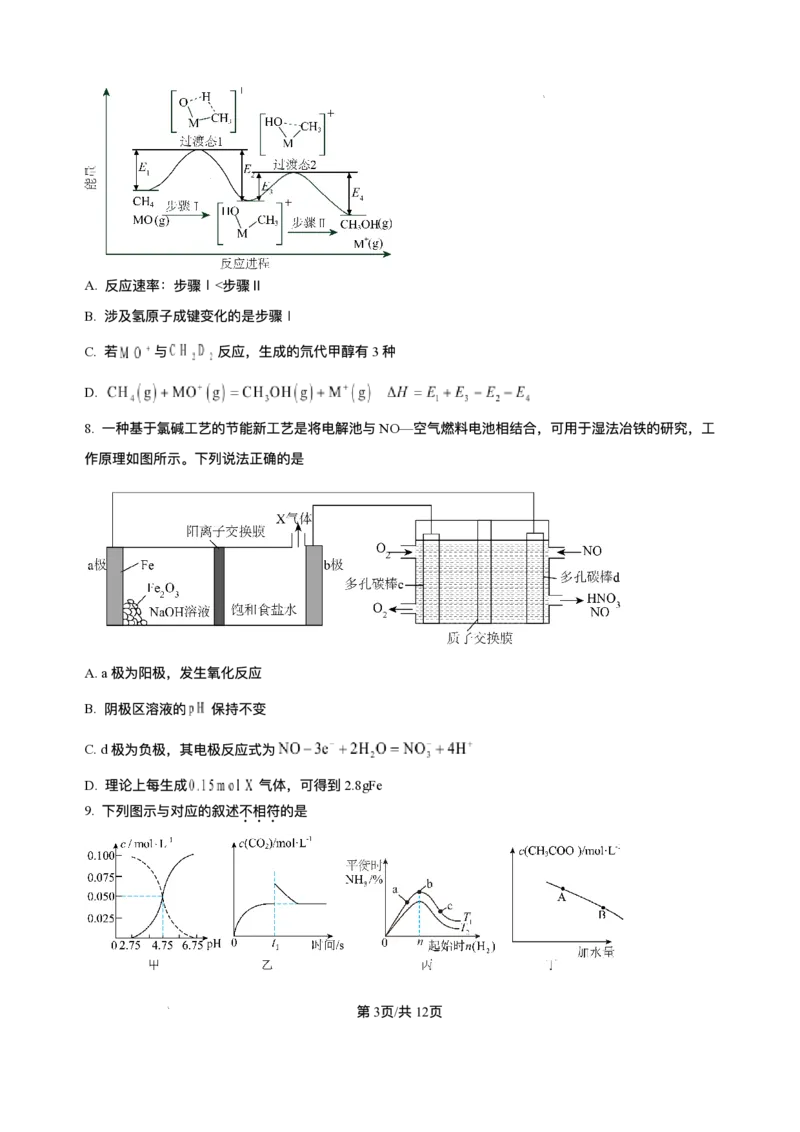
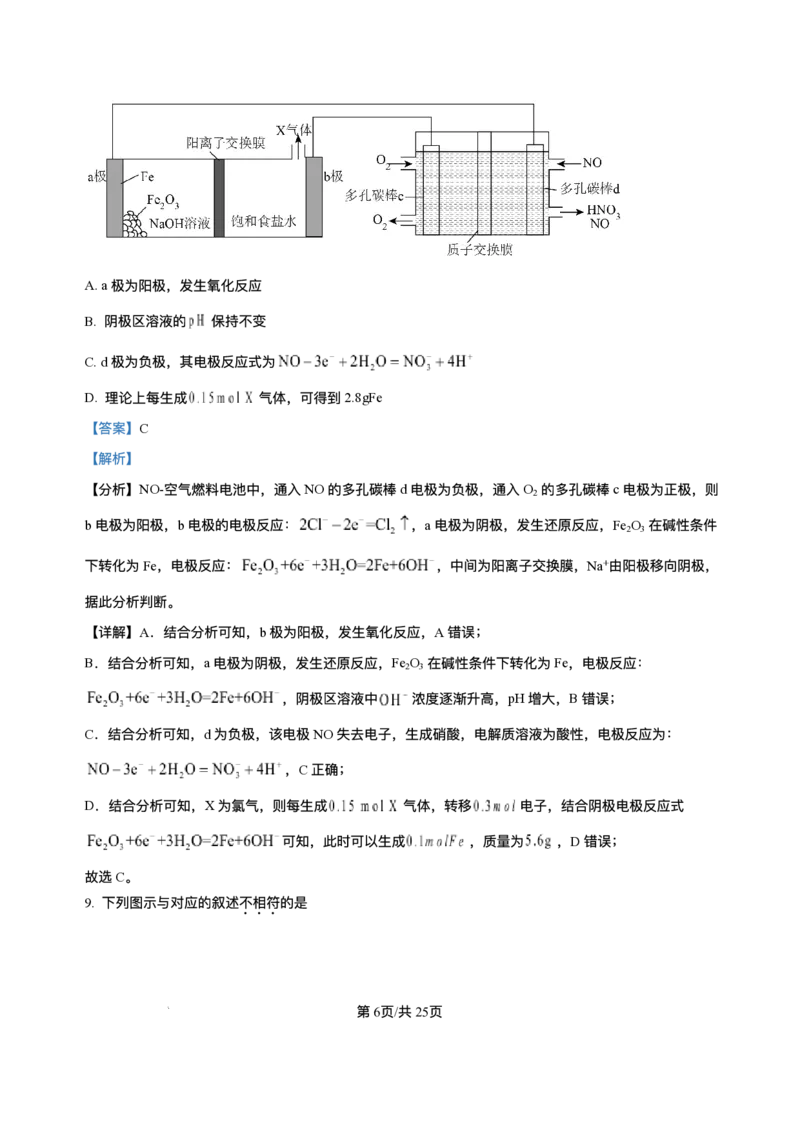
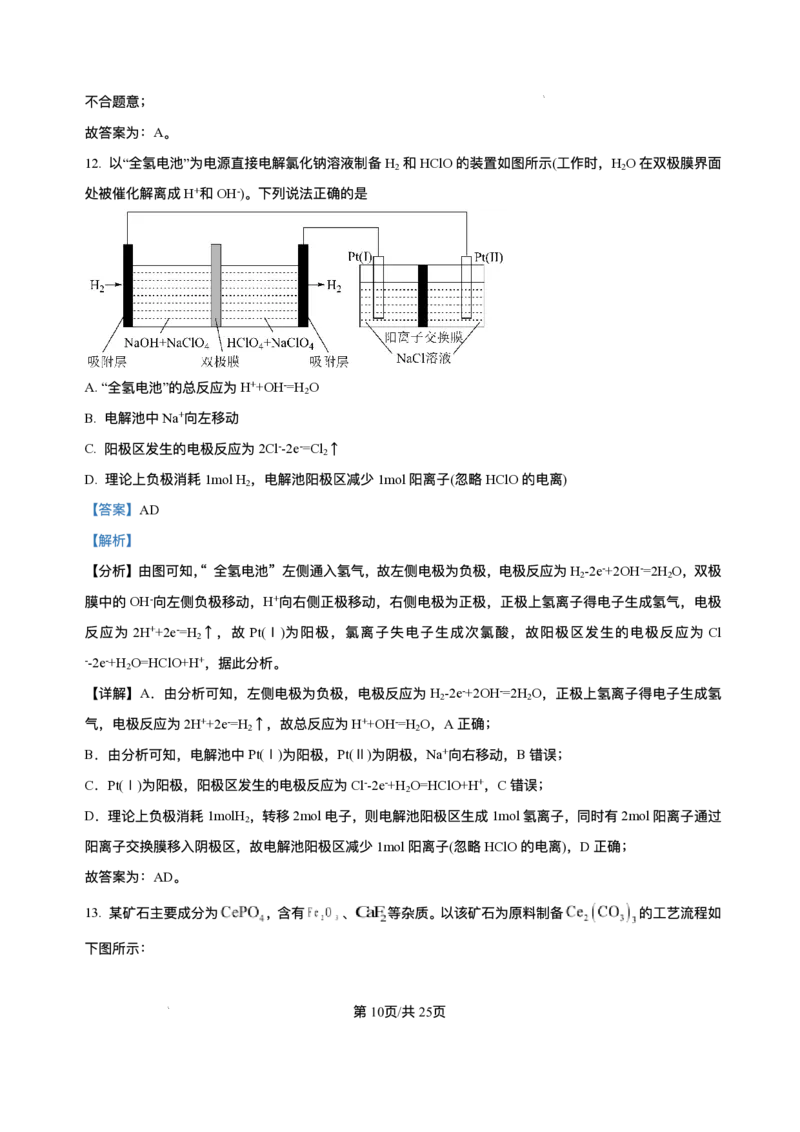
12. 以“全氢电池”为电源直接电解氯化钠溶液制备H 和HClO的装置如图所示(⼯作时,H O在双极膜界⾯
2 2
处被催化解离成H+和OH-)。下列说法正确的是
A.“全氢电池”的总反应为H++OH-=H O
2
B. 电解池中Na+向左移动
C. 阳极区发⽣的电极反应为2Cl--2e-=Cl ↑
2
D. 理论上负极消耗1molH ,电解池阳极区减少1mol阳离⼦(忽略HClO的电离)
2
【答案】AD
【解析】
【分析】由图可知,“ 全氢电池” 左侧通⼊氢⽓,故左侧电极为负极,电极反应为H -2e-+2OH-=2H O,双极
2 2
膜中的OH-向左侧负极移动,H+向右侧正极移动,右侧电极为正极,正极上氢离⼦得电⼦⽣成氢⽓,电极
反应为 2H++2e-=H ↑,故 Pt(Ⅰ)为阳极,氯离⼦失电⼦⽣成次氯酸,故阳极区发⽣的电极反应为 Cl
2
--2e-+H O=HClO+H+,据此分析。
2
【详解】A.由分析可知,左侧电极为负极,电极反应为H -2e-+2OH-=2H O,正极上氢离⼦得电⼦⽣成氢
2 2
⽓,电极反应为2H++2e-=H ↑,故总反应为H++OH-=H O,A正确;
2 2
B.由分析可知,电解池中Pt(Ⅰ)为阳极,Pt(Ⅱ)为阴极,Na+向右移动,B错误;
C.Pt(Ⅰ)为阳极,阳极区发⽣的电极反应为Cl--2e-+H O=HClO+H+,C错误;
2
D.理论上负极消耗1molH ,转移2mol电⼦,则电解池阳极区⽣成1mol氢离⼦,同时有2mol阳离⼦通过
2
阳离⼦交换膜移⼊阴极区,故电解池阳极区减少1mol阳离⼦(忽略HClO的电离),D正确;
故答案为:AD。
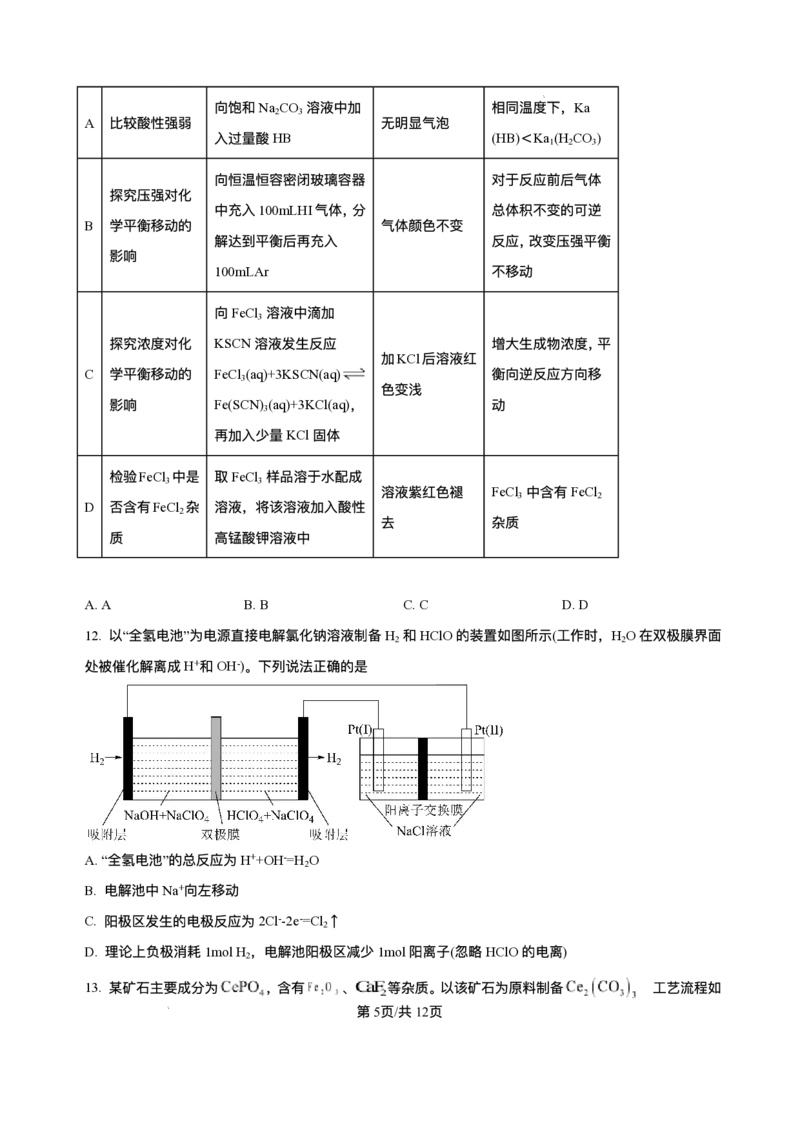
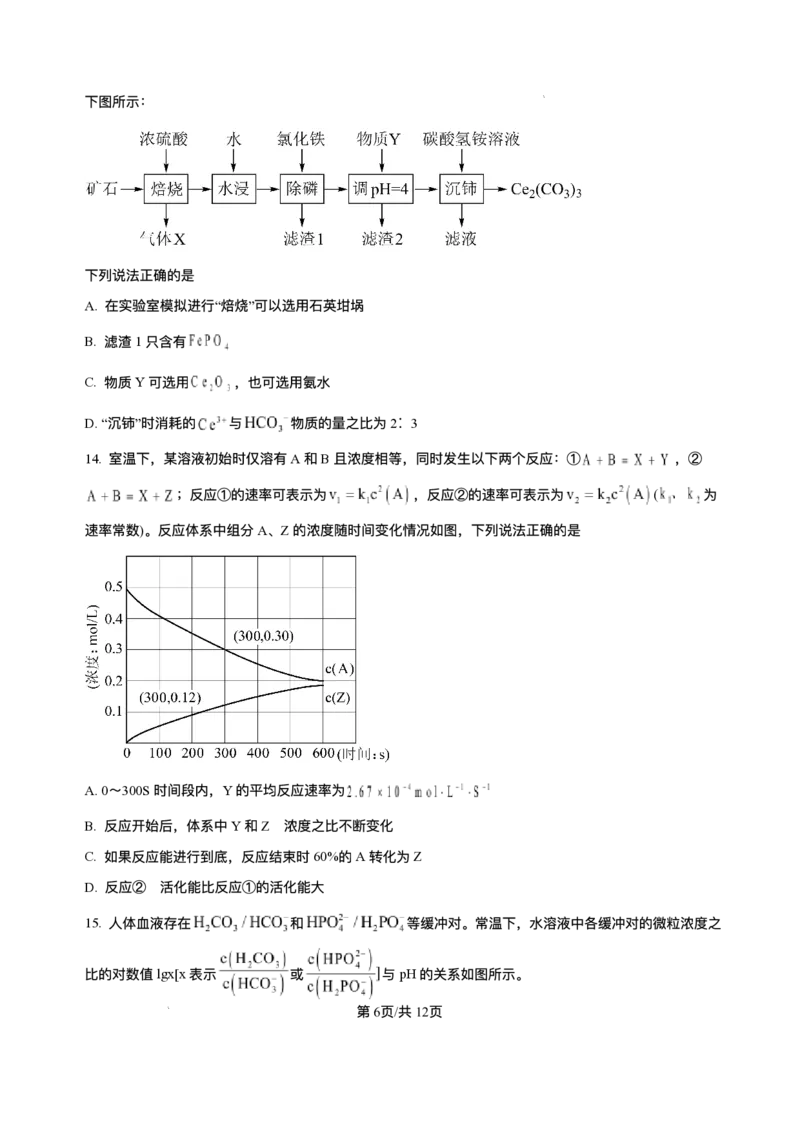
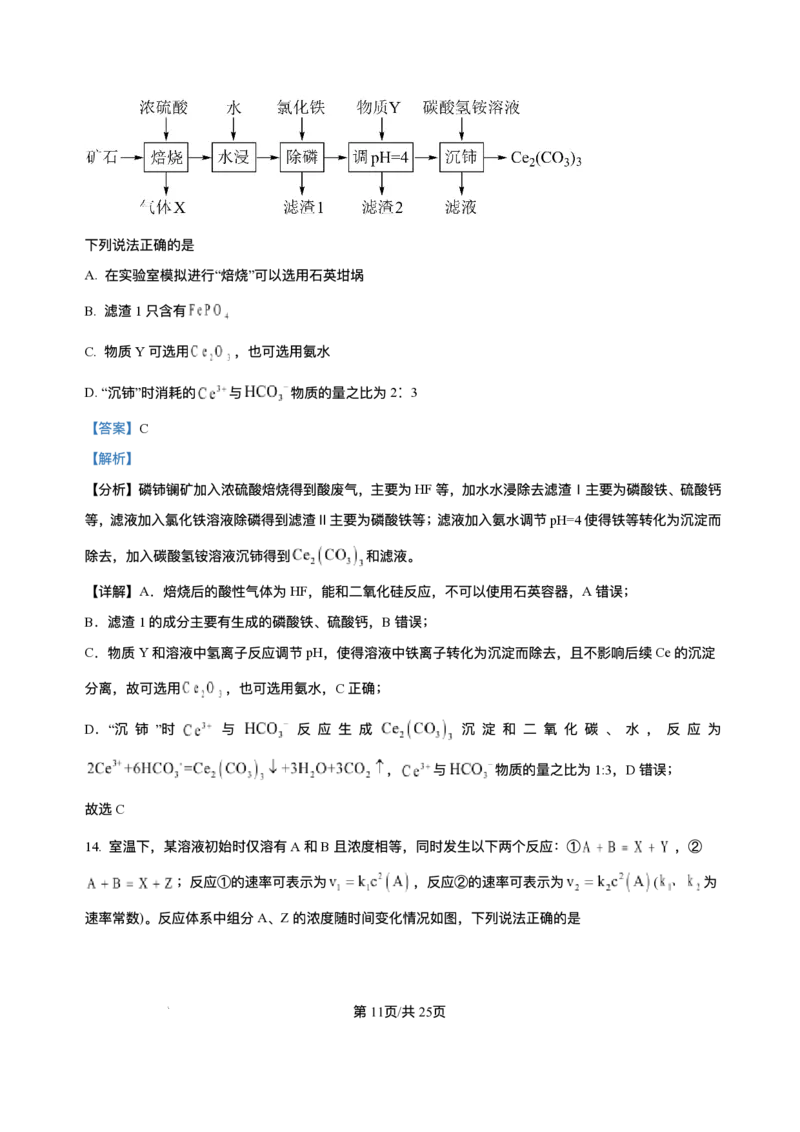
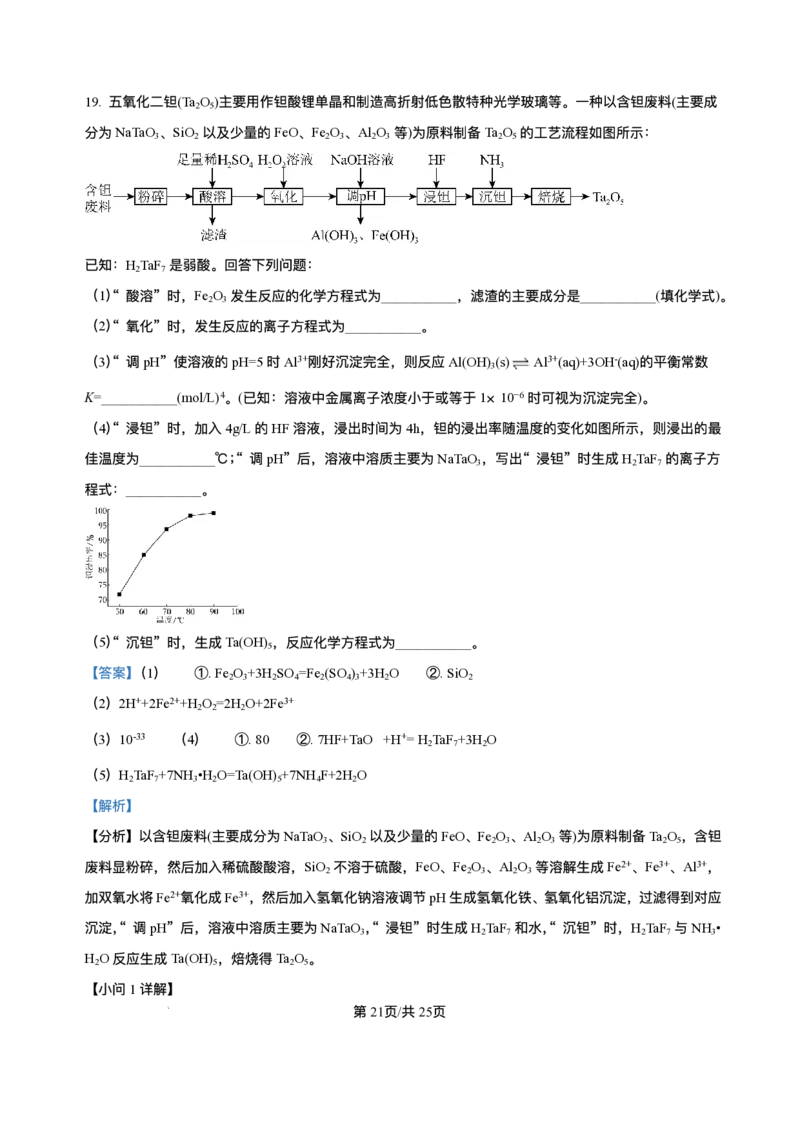
13. 某矿⽯主要成分为 ,含有 、 等杂质。以该矿⽯为原料制备 的⼯艺流程如
下图所示:
第10⻚/共25⻚
学科⽹(北京)股份有限公司下列说法正确的是
A. 在实验室模拟进⾏“焙烧”可以选⽤⽯英坩埚
B. 滤渣1只含有
C. 物质Y可选⽤ ,也可选⽤氨⽔
D.“沉铈”时消耗的 与 物质的量之⽐为2∶ 3
【答案】C
【解析】
【分析】磷铈镧矿加⼊浓硫酸焙烧得到酸废⽓,主要为HF等,加⽔⽔浸除去滤渣Ⅰ主要为磷酸铁、硫酸钙
等,滤液加⼊氯化铁溶液除磷得到滤渣Ⅱ主要为磷酸铁等;滤液加⼊氨⽔调节pH=4使得铁等转化为沉淀⽽
除去,加⼊碳酸氢铵溶液沉铈得到 和滤液。
【详解】A.焙烧后的酸性⽓体为HF,能和⼆氧化硅反应,不可以使⽤⽯英容器,A错误;
B.滤渣1的成分主要有⽣成的磷酸铁、硫酸钙,B错误;
C.物质Y和溶液中氢离⼦反应调节pH,使得溶液中铁离⼦转化为沉淀⽽除去,且不影响后续Ce的沉淀
分离,故可选⽤ ,也可选⽤氨⽔,C正确;
D.“沉 铈 ”时 与 反 应 ⽣ 成 沉 淀 和 ⼆ 氧 化 碳 、 ⽔ , 反 应 为
, 与 物质的量之⽐为1:3,D错误;
故选C
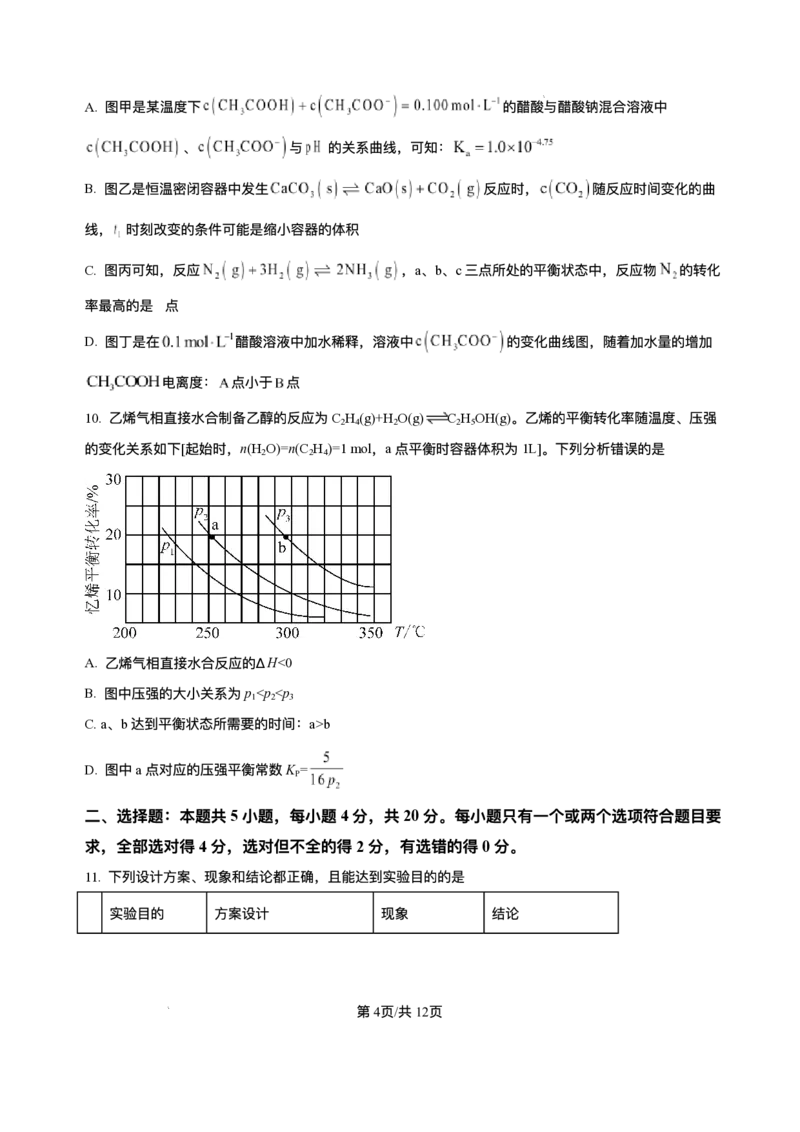
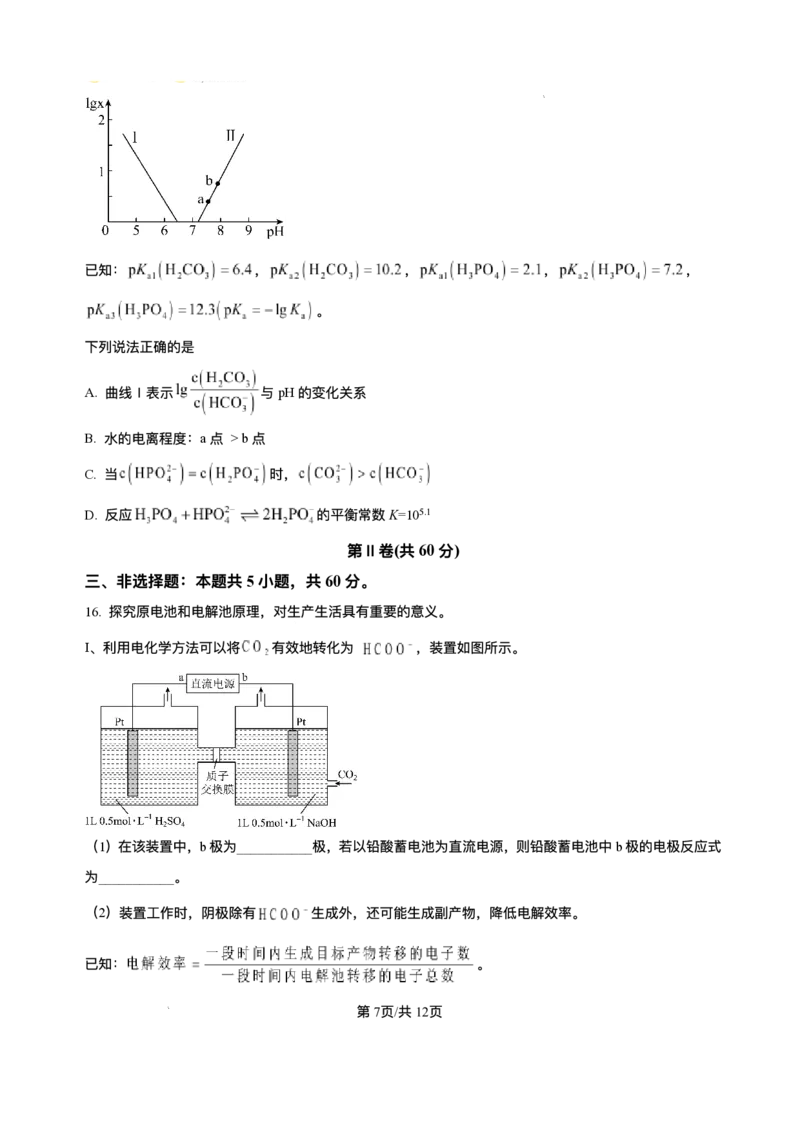
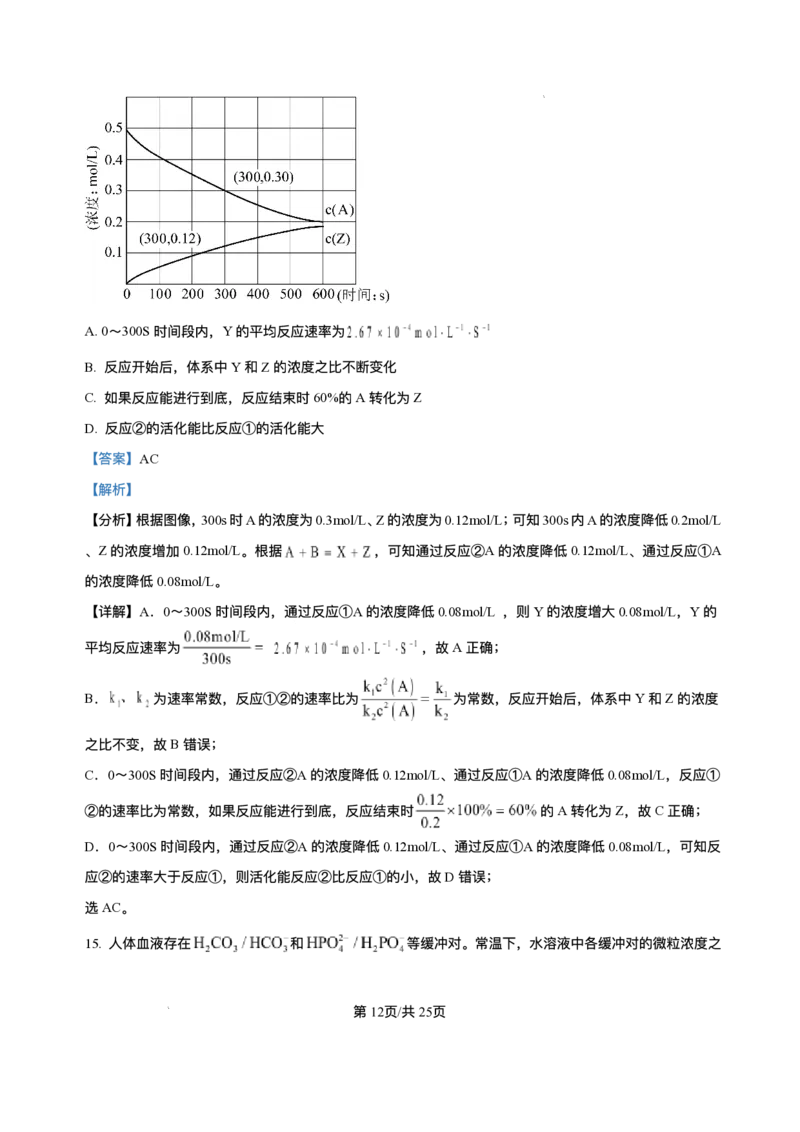
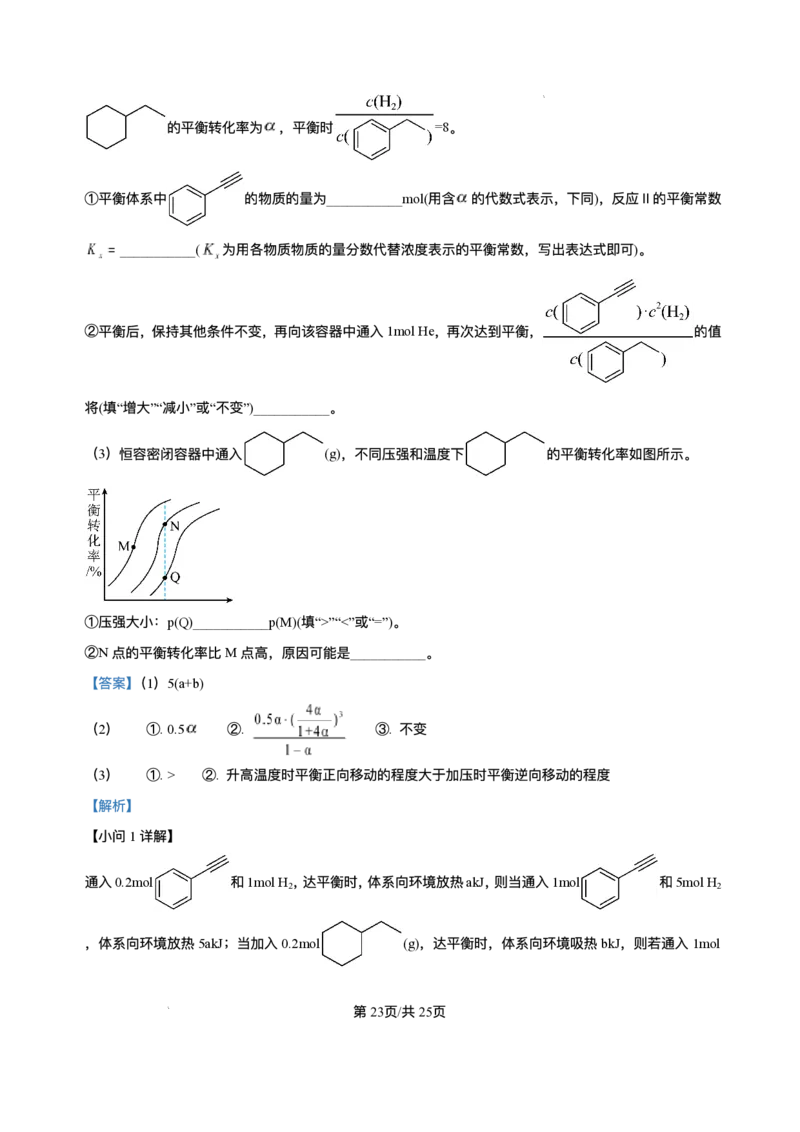
14. 室温下,某溶液初始时仅溶有A和B且浓度相等,同时发⽣以下两个反应:① ,②
;反应①的速率可表示为 ,反应②的速率可表示为 ( 为
速率常数)。反应体系中组分A、Z的浓度随时间变化情况如图,下列说法正确的是
第11⻚/共25⻚
学科⽹(北京)股份有限公司A.0~300S时间段内,Y的平均反应速率为
B. 反应开始后,体系中Y和Z的浓度之⽐不断变化
C. 如果反应能进⾏到底,反应结束时60%的A转化为Z
D. 反应②的活化能⽐反应①的活化能⼤
【答案】AC
【解析】
【分析】根据图像,300s时A的浓度为0.3mol/L、Z的浓度为0.12mol/L;可知300s内A的浓度降低0.2mol/L
、Z的浓度增加0.12mol/L。根据 ,可知通过反应②A的浓度降低0.12mol/L、通过反应①A
的浓度降低0.08mol/L。
【详解】A.0~300S时间段内,通过反应①A的浓度降低0.08mol/L ,则Y的浓度增⼤0.08mol/L,Y的
平均反应速率为 ,故A正确;
B. 为速率常数,反应①②的速率⽐为 为常数,反应开始后,体系中Y和Z的浓度
之⽐不变,故B错误;
C.0~300S时间段内,通过反应②A的浓度降低0.12mol/L、通过反应①A的浓度降低0.08mol/L,反应①
②的速率⽐为常数,如果反应能进⾏到底,反应结束时 的A转化为Z,故C正确;
D.0~300S时间段内,通过反应②A的浓度降低0.12mol/L、通过反应①A的浓度降低0.08mol/L,可知反
应②的速率⼤于反应①,则活化能反应②⽐反应①的⼩,故D错误;
选AC。
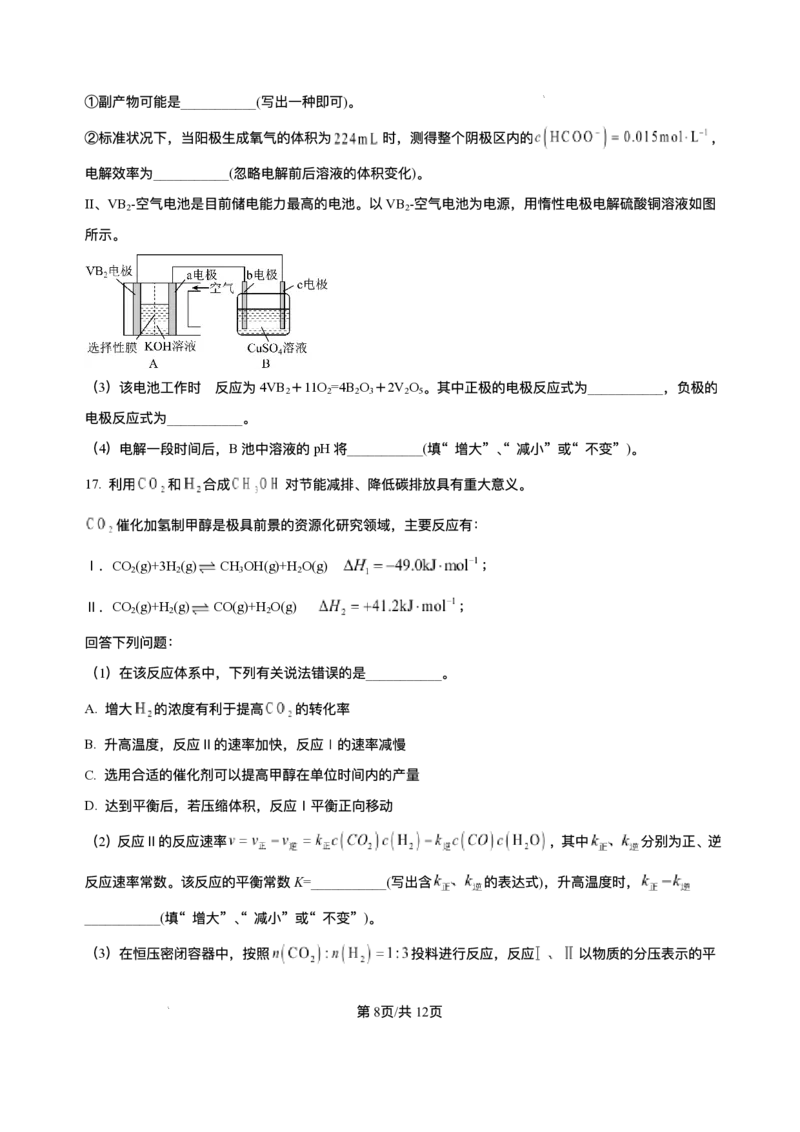
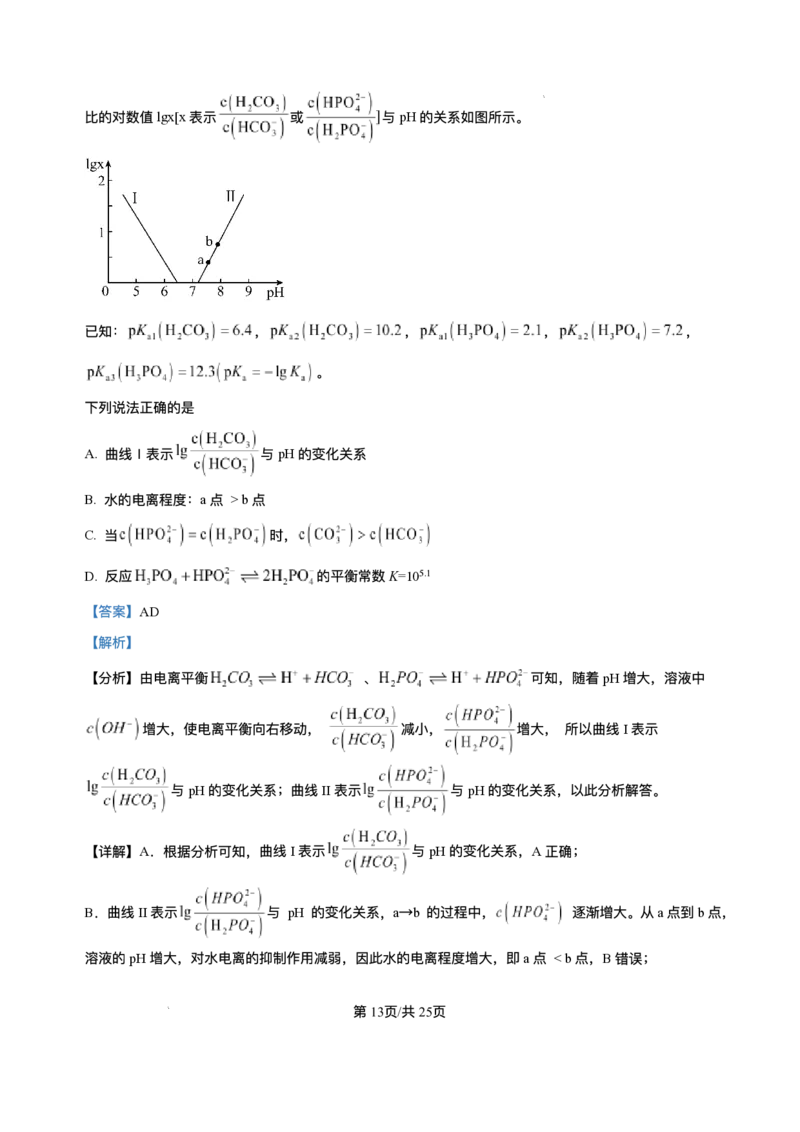
15. ⼈体⾎液存在 和 等缓冲对。常温下,⽔溶液中各缓冲对的微粒浓度之
第12⻚/共25⻚
学科⽹(北京)股份有限公司⽐的对数值lgx[x表示 或 与pH的关系如图所示。
已知: , , , ,
。
下列说法正确的是
A. 曲线Ⅰ表示 与pH的变化关系
B. ⽔的电离程度:a点 >b点
C. 当 时,
D. 反应 的平衡常数K=105.1
【答案】AD
【解析】
【分析】由电离平衡 、 可知,随着pH增⼤,溶液中
增⼤,使电离平衡向右移动, 减⼩, 增⼤, 所以曲线I表示
与pH的变化关系;曲线II表示 与pH的变化关系,以此分析解答。
【详解】A.根据分析可知,曲线I表示 与pH的变化关系,A正确;
B.曲线II表示 与 pH 的变化关系,a→b 的过程中, 逐渐增⼤。从a点到b点,
溶液的pH增⼤,对⽔电离的抑制作⽤减弱,因此⽔的电离程度增⼤,即a点