文档内容
重庆乌江新高考协作体 2024 届高考模拟监测(二)
化学试题
(分数:100分,时间:75分钟)
一、选择题
1.质量相同的N 和CO,下列物理量不一定相同的是( )
2
A.物质的量 B.分子个数 C.原子个数 D.气体体积
2.下列各组离子,能在溶液中大量共存的是
A.K+、H+、Mg2+、 B.Na+、Ca2+、 、Cl-
C.Na+、H+、Cl-、OH- D. 、Ba2+、OH-、
3.以下不属于氯气用途的
A.消毒杀菌 B.制漂粉精 C.制盐酸 D.制食盐
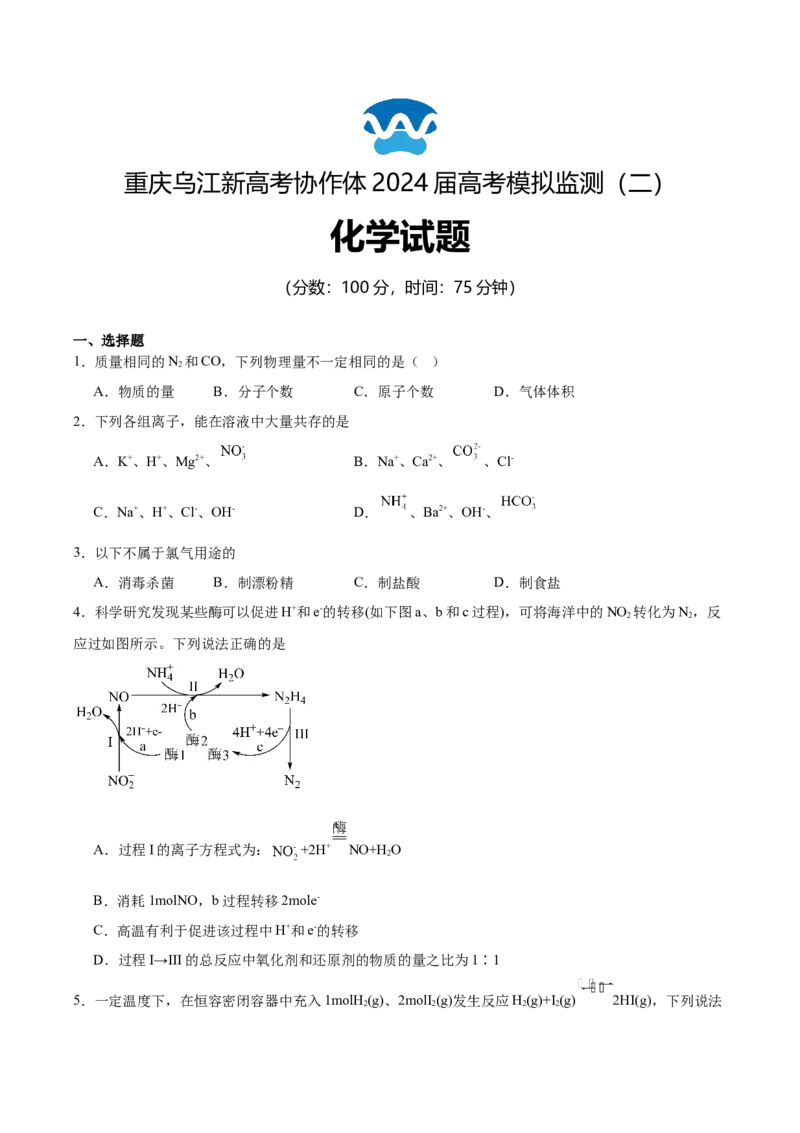
4.科学研究发现某些酶可以促进H+和e-的转移(如下图a、b和c过程),可将海洋中的NO 转化为N,反
2 2
应过如图所示。下列说法正确的是
A.过程I的离子方程式为: +2H+ NO+H O
2
B.消耗1molNO,b过程转移2mole-
C.高温有利于促进该过程中H+和e-的转移
D.过程I→III的总反应中氧化剂和还原剂的物质的量之比为1∶1
5.一定温度下,在恒容密闭容器中充入1molH (g)、2molI (g)发生反应H(g)+I (g) 2HI(g),下列说法
2 2 2 2中不能确定反应达到平衡状态的是
A.混合气体的颜色不再改变
B.混合气体的平均相对分子质量不再改变
C.有1molI—I键形成,同时有2molH—I键形成
D.混合气体中H 与I 的物质的量之比保持恒定
2 2
6.分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
A.根据酸分子中含氢原子个数将酸分为一元酸、二元酸等
B.根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
C.根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
D.根据元素原子最外层电子数的多少将元素分为金属和非金属
7.在一定条件下,CH 和CO燃烧的热化学方程式分别为CH(g)+2O(g)=2HO(l)+CO (g) ΔH=-890
4 4 2 2 2
kJ·mol-1,2CO(g)+O(g)=2CO (g) ΔH=-566 kJ·mol-1。若某CH 和CO的混合气体充分燃烧,放出的热量为
2 2 4
262.9 kJ,生成的CO 用过量的饱和石灰水完全吸收,得到50 g白色沉淀。则混合气体中CH 和CO的体
2 4
积比为
A.1∶2 B.1∶3 C.2∶3 D.3∶2
8.能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。下列做法不利于能源“开
源节流”的是
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源
D.减少资源消耗,增加资源的重复使用和循环再生
9.化学中常用pH表示水溶液的酸碱度,其定义为 。下列有关叙述不正确的是
A.0.1mol/L盐酸和0.1mol/L醋酸分别加水稀释至pH=5,盐酸加水体积更多
B.等质量的NaOH分别与pH均为3的盐酸和醋酸溶液恰好完全反应,消耗盐酸的体积更少
C.pH=3的醋酸溶液加水稀释使其体积变为原来的10倍,所得溶液pH小于4
D.向pH=3的醋酸溶液中加入等体积pH=3的盐酸溶液,醋酸的电离平衡不移动
10.设N 为阿伏加德罗常数值。关于常温下pH=2的HPO 溶液,下列说法正确的是
A 3 4
A.1L该溶液中H+数目为0.03N B.加水稀释使HPO 电离度增大,溶液pH升高
A 3 4
C.加入少量NaOH固体,会使c(PO )减小 D.加入NaH PO 固体,溶液酸性增强
2 4
11.下列叙述正确的是A.将5.85 g NaCl晶体溶入100 mL水中,制得0.1 mol/L的NaCl溶液
B.将25 g无水CuSO 溶于水制成100 mL溶液,其浓度为1 mol/L
4
C.将w g a%的NaCl饱和溶液蒸发掉 g水,得到2a%的NaCl溶液
D.将1体积c mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c mol/L
1 1
12.下列指定反应的离子方程式正确的是
A.足量的CO 通入饱和碳酸钠溶液中:CO+CO +H O=2HCO
2 2 2
B.200mL1mol·L-1溴化亚铁溶液中通入4.48LCl (标准状况下):Fe2++2Br-+2Cl=Fe3++Br +4Cl-
2 2 2
C.Ca(ClO) 溶液中通入SO :Ca2++2ClO-+SO+H O=CaSO↓+2HClO
2 2 2 2 3
D.NaAlO 溶液和过量NaHSO 溶液混合:AlO +4H+=Al3++2H O
2 4 2
13.实验室有一包白色固体,可能含有硫酸铵、硫酸氢铵中的一种或两种,为确定其成分,现称取24.70g
的白色固体溶于适量水中,然后滴加4mol·L-1的氢氧化钠溶液50.00mL,加热(此温度下铵盐不分解)充
分反应使氨气全部逸出,测得氨气在标况下的体积为2.24L,则下列表述正确的是
A.白色固体一定只含有硫酸铵
B.若氢氧化钠溶液足量,则生成氨气的体积应为6.72L(标况)
C.从上述数据能求算出白色固体中(NH )SO 、NH HSO 的物质的量之比为1∶2
4 2 4 4 4
D.将某白色固体加热分解,若产生的气体不能使湿润的红色石蕊试纸变蓝,则该固体中一定不含铵
盐
14.下列说法正确的是
A.甲烷的摩尔燃烧焓为 =-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH(g)
4
+2O (g)=CO (g)+2HO(g) = -890.3kJ/mol
2 2 2
B.500℃、30MPa下,将0.5molN(g)和1.5molH(g)置于密闭容器中充分反应生成NH (g),放热
2 2 3
19.3kJ,其热化学方程式为N(g)+3H(g) 2NH (g) = -38.6kJ/mol
2 2 3
C.中和反应的反应热实验中将环形玻璃搅拌棒改为铁质搅拌器对实验结果没有影响
D.已知C(s)+O(g)=CO (g) = - a kJ/mol,C(s)+ O(g)=CO(g) = - b kJ/mol,则a>b
2 2 2
二、非选择题
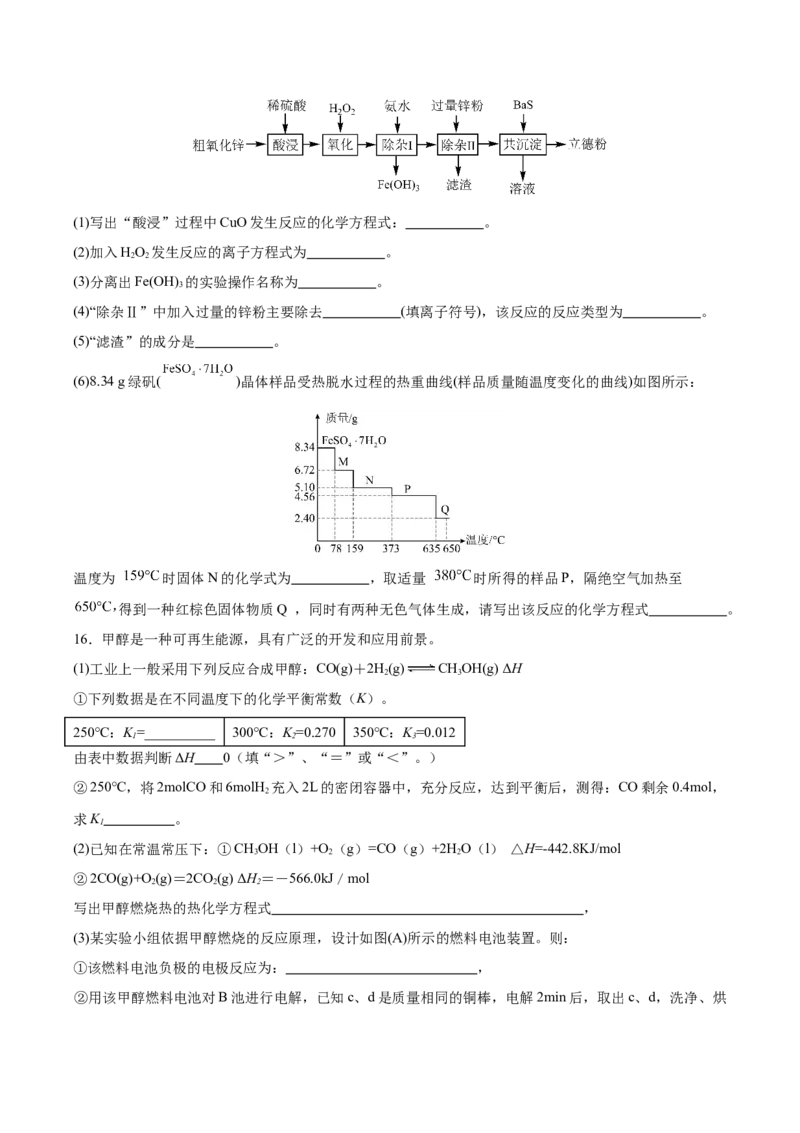
15.立德粉(主要成分为BaSO ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe O 等
4 3 4
杂质)和BaS为原料制备立德粉的流程如图所示:(1)写出“酸浸”过程中CuO发生反应的化学方程式: 。
(2)加入HO 发生反应的离子方程式为 。
2 2
(3)分离出Fe(OH) 的实验操作名称为 。
3
(4)“除杂Ⅱ”中加入过量的锌粉主要除去 (填离子符号),该反应的反应类型为 。
(5)“滤渣”的成分是 。
(6)8.34 g绿矾( )晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示:
温度为 时固体N的化学式为 ,取适量 时所得的样品P,隔绝空气加热至
得到一种红棕色固体物质Q ,同时有两种无色气体生成,请写出该反应的化学方程式 。
16.甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列反应合成甲醇:CO(g)+2H(g) CHOH(g) ΔH
2 3
①下列数据是在不同温度下的化学平衡常数(K)。
250℃:K =__________ 300℃:K =0.270 350℃:K =0.012
1 2 3
由表中数据判断ΔH 0(填“>”、“=”或“<”。)
②250℃,将2molCO和6molH 充入2L的密闭容器中,充分反应,达到平衡后,测得:CO剩余0.4mol,
2
求K 。
1
(2)已知在常温常压下:①CHOH(l)+O (g)=CO(g)+2H O(l) △H=-442.8KJ/mol
3 2 2
②2CO(g)+O(g)=2CO(g) ΔH=-566.0kJ/mol
2 2 2
写出甲醇燃烧热的热化学方程式 ,
(3)某实验小组依据甲醇燃烧的反应原理,设计如图(A)所示的燃料电池装置。则:
①该燃料电池负极的电极反应为: ,
②用该甲醇燃料电池对B池进行电解,已知c、d是质量相同的铜棒,电解2min后,取出c、d,洗净、烘干、称量,质量差为0.64g,在通电过程中,电路中通过的电子为 mol。
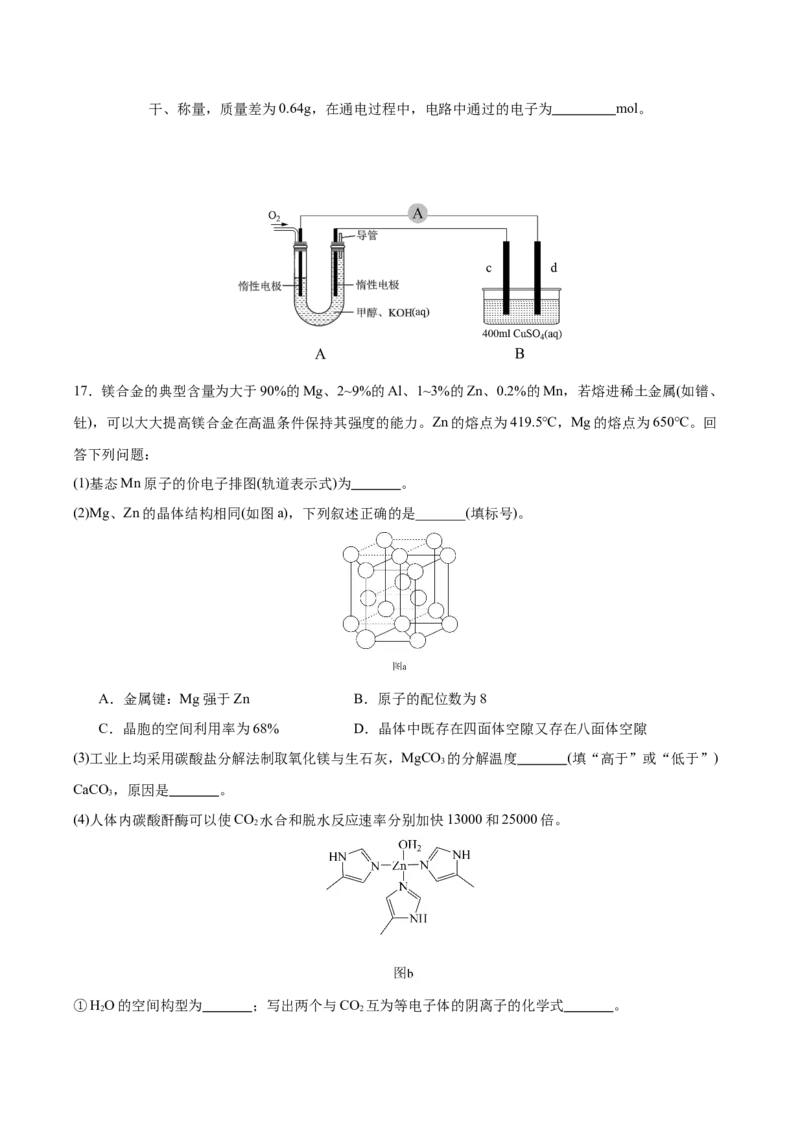
17.镁合金的典型含量为大于90%的Mg、2~9%的Al、1~3%的Zn、0.2%的Mn,若熔进稀土金属(如镨、
钍),可以大大提高镁合金在高温条件保持其强度的能力。Zn的熔点为419.5℃,Mg的熔点为650℃。回
答下列问题:
(1)基态Mn原子的价电子排图(轨道表示式)为 。
(2)Mg、Zn的晶体结构相同(如图a),下列叙述正确的是_______(填标号)。
A.金属键:Mg强于Zn B.原子的配位数为8
C.晶胞的空间利用率为68% D.晶体中既存在四面体空隙又存在八面体空隙
(3)工业上均采用碳酸盐分解法制取氧化镁与生石灰,MgCO 的分解温度 (填“高于”或“低于”)
3
CaCO ,原因是 。
3
(4)人体内碳酸酐酶可以使CO 水合和脱水反应速率分别加快13000和25000倍。
2
①HO的空间构型为 ;写出两个与CO 互为等电子体的阴离子的化学式 。
2 2②碳酸酐酶的部分结构如图b所示,为Zn2+提供电子对形成配位键的原子有 个,图b中碳原子的
杂化类型为 。
(5)一种锌镁合金的六方晶胞如图c所示,除棱心和顶角外,晶胞内还有六个 原子,所有的Mg均在晶
胞内部。则合金密度为 g▪ cm-3 (写出计算式即可,阿伏加德常数用N 表示)。
A
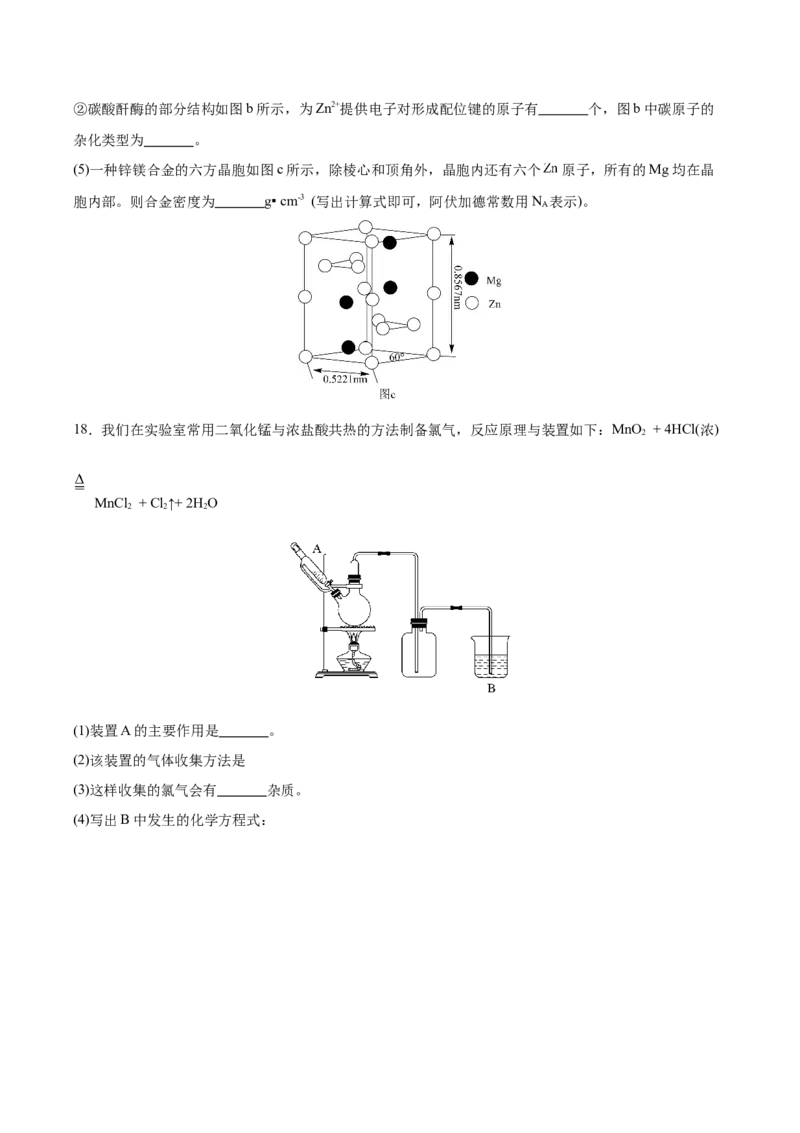
18.我们在实验室常用二氧化锰与浓盐酸共热的方法制备氯气,反应原理与装置如下:MnO + 4HCl(浓)
2
MnCl + Cl ↑+ 2H O
2 2 2
(1)装置A的主要作用是 。
(2)该装置的气体收集方法是
(3)这样收集的氯气会有 杂质。
(4)写出B中发生的化学方程式: