文档内容
化学参考答案
一、选择题:本题共14小题,每小题3分。
题号 1 2 3 4 5 6 7
答案 B B A C D D A
题号 8 9 10 11 12 13 14
答案 D C C B B C C
【解析】
1.B项,列车使用的动力电机是电能转化为动能。
2.图为氯原子,而不是氯离子,A错误。氮原子孤对电子未画出,C错误。2s轨道未画出,
D错误。
3.A项,所有离子都共存;B项,为酸性环境,HCO不共存;C项,KI与ClO−不共存;D
3
项,Fe (SO ) 与[Al(OH) ]−不共存。
2 4 3 4
4.生成1mol氢气时Cl不足,阳极上只有0.5mol氯气生成,另外还有氧气生成,Cl—Cl键的数
目为0.5N ,A错误。常温不是标准状况,所以22.4LH 和Cl 的混合气体中所含原子数目
A 2 2
不等于2N ,B 错误。常温下,1molCl 与足量的 NaOH 溶液发生歧化反应,生成氯化钠
A 2
和次氯酸钠,转移电子的数目为N ,C正确。没有说明体积无法确定离子个数,D错误。
A
5.FeCl 6H O需要在HCl气体环境下加热才可制取无水FeCl 固体,A错误。KMnO 溶液
3 2 3 4
不可使用碱式滴定管,B错误。乙醇和乙酸互溶,不可用分液的方法分离,C错误。
6.A 项,正确不选;B 项,该物质含有一个酰胺基和一个酯基所以1mol奥司他韦最多能与
2molNaOH反应正确,不选;C项,奥司他韦只有一个碳碳双键能与氢气发生加成反应,
所以正确不选;D项,奥司他韦只有3个手性碳原子,所以错误。
7.A项,正确。B项,稀硫酸只是提供氢离子,并不说明稀硫酸的氧化性比稀硝酸的强;C项,
新制氯水和久置氯水都含有氯离子,无法用硝酸银鉴别,所以错误;D项,将浓硫酸与碳反
应会同时生成二氧化硫也会使澄清石灰水变浑浊无法证明生成了二氧化碳,所以错误。
化学参考答案·第1页(共6页)8.第四周期中还有 K 和 Cr 的基态原子最外层电子数与基态铜原子相同,A 正确。取硫酸铜
溶液于试管中,滴加少量10%的乙二胺溶液,产生紫色沉淀硫酸二乙二胺合铜说明与Cu2
的配合能力:水<乙二胺,B正确。乙二胺含有氨基,能和水形成氢键而易溶于水,C正确。
因为4个氨基处于同一平面,所以铜原子不采用sp3杂化,所以采用sp3杂化的原子只有4
个C和4个N共8个,D错误。
9.因为氯水过量,所以无法确定是Cl 还是Br 氧化的KI,无法判断Br 与I 的氧化性强弱,
2 2 2 2
A错误。生成的乙烯中混有二氧化硫,二者均与溴水反应,则溴水褪色,不能证明乙醇发
生消去反应,B错误。C正确。只能证明溶液含有NH,溶质可以是铵盐也可以是一水合
4
氨,D错误。
10.电极a上二氧化碳转化为乙烯得电子所以a为阴极连接电源负极,A正确。B项正确。阳
极上:4OH−−4e−=2H O+O ↑,同时会有等量的OH−从左室补充过来所以OH−的个数
2 2
不变,但由于生成水所以 pH 会降低,C 错误。阳极上:4OH−−4e−=2H O+O ↑,若
2 2
电路中通过0.4mol电子时,理论上电极b产生2.24L气体(标准状况),D正确。
11.X、Y、Z、Q、R 分别为 C、O、F、S、Sc。A 错误。原子半径:S>O>F,B 正确。同周
期稀有气体基态原子中第一电离能最大,C错误。SF 中S不满足8电子结构,D错误。
6
12.Au原子配位数为12,A错误。顶点体心互换后,面心与棱心互换,B正确。β−Ti Au晶
3
682
体的密度是 1030g/cm3,C 错误。与 β−Ti Au 晶体相比,α−Ti Au 晶体有更长的
N a3 3 3
A
Ti—Au键键长,所以α−Ti Au晶体熔点更低,D错误。
3
13.升温平衡转化率降低,H 0,A错误。C点和D点均为平衡点,都有v v ,D点转
正 逆
化率低,反应物浓度大且温度更高,所以正反应速率大于 C 点,可以推出该反应的逆反
应速率:D点大于C 点,B 错误。T 时A点CH OH(g)和CO(g)为0.12mol,平衡态由B
1 3
点计算可得CH OH(g)和CO(g)平衡浓度为0.04mol/L,所以A点体积将体积扩大到3L即
3
平衡,C 正确。T 时,若将 C 点体系体积压缩为 1L,平衡后,甲醇浓度=0.04mol/L,D
2
错误。
K 1014
14.CO2的第二步水解平衡常数为 W 107.63,所以数量级为10−8,A正确。由图乙
3 K 106.37
a1
得 Q 大于 2 种沉淀的 K ,所以会产生沉淀,B 正确。由图乙得 Q >K (MgCO )所以会
C sp C sp 3
化学参考答案·第2页(共6页)产生 MgCO 沉淀,c(H CO )+c(HCO)+c(CO2)<0.1mol/L,C 错误。由图甲得 pH=8.3
3 2 3 3 3
时溶液为0.1mol/L NaHCO 溶液,再由图乙可知,此时只产生MgCO 而没有Mg(OH) 生
3 3 2
成,D正确。
二、非选择题:本题共4小题,共58分。
15.(除特殊标注外,每空2分,共15分)
(1)第四周期ⅢB族 正四面体形(1分)
(2)[Al(OH) ]−(或AlO)
4 2
(3)①SO +2Fe3++2H O=SO2+2Fe2++4H+
2 2 4
②pH<1时,TiO2++2HA 2H++TiOA 逆向移动,提取率降低
2
(4)TiOA +2Na CO +2H O=TiO(OH) ↓+2NaHCO +2NaA
2 2 3 2 2 3
(5)6
(6)3∶2
【解析】(1)Sc在周期表中的位置为第四周期ⅢB族,SO2的价电子对数为4,所以杂化
4
类型为sp3,空间构型为正四面体形。
(2)Al O 在碳酸钠中煅烧后得到NaAlO ,遇水后会变成[Al(OH) ]−。
2 3 2 4
(3)①结合图中信息,HA对Fe2+萃取率低,故为除去铁元素,要将铁都转化成Fe2+,故
通入SO 发生的离子方程式为SO +2Fe3++2H O=SO2+2Fe2++4H+。
2 2 2 4
②因为存在TiO2++2HA 2H++TiOA 萃取平衡,若pH<1时,则该平衡逆向移动,则
2
钛的提取率明显降低。
(4)煤油相 E 中的 TiOA 是与CO2转化成水相中 TiO(OH) ,因为 TiOA 变成 TiO(OH)
2 3 2 2 2
沉淀需要结合水的氢氧根离子,则会产生H+,则H+可能与CO2结合,也可能与产生的
3
A−结合,因为酸性大小顺序为H CO >HA>HCO,故结合H+的离子为CO2,故在足量
2 3 3 3
Na CO 中生成HCO,不会生成 HA,则化学方程式为 TiOA +2Na CO +2H O=
2 3 3 2 2 3 2
TiO(OH) ↓+2NaHCO +2NaA。
2 3
化学参考答案·第3页(共6页)(5)常温下,“沉淀分离”时加入NaOH溶液,使c(Sc3+)=1×10−6mol/L,因为K [Sc(OH) ]=
sp 3
1×10−30,则c(OH−)=10−8,pH=6。
(6)因为草酸为弱酸,故不能拆分,所以加入草酸发生反应生成Sc (C O ) 沉淀的离子方
2 2 4 3
程式为 2Sc3++3H C O =Sc (C O ) ↓+6H+,最后再将 Sc (C O ) 固体置于空气中灼烧
2 2 4 2 2 4 3 2 2 4 3
得Sc O ,因为C O2变成CO ,变化2价,则Sc (C O ) 一共变化6价,而氧气变价为4
2 3 2 4 2 2 2 4 3
价,故该反应的氧化剂和还原剂的物质的量之比为3∶2。
16.(除特殊标注外,每空2分,共14分)
(1)三颈烧瓶(1分)
△
(2)MnO +4H++2Cl−=Cl ↑+Mn2++2H O
2 2 2
(3)饱和食盐水
(4)Na++Bi(OH) +3OH−+Cl =NaBiO +2Cl−+3H O
3 2 3 2
(5)防止Cl 过量使溶液呈酸性,导致NaBiO 分解(1分) 吸收装置内的Cl ,防止
2 3 2
污染环境(1分)
(6)不能(1分)
因为存在ClO−+Cl−+2H+=Cl ↑+H O,故不能说明氧化性NaBiO >Cl
2 2 3 2
(7)70
【解析】(1)仪器A的名称三颈烧瓶。
△
(2)A为实验室制备Cl 的装置,其离子方程式MnO +4H++2Cl−=Cl ↑+Mn2++2H O。
2 2 2 2
(3)装置C是除去氯气中的HCl,所以所装试剂为饱和食盐水。
(4)装置D中生成NaBiO 的反应物为Bi(OH) 和Cl ,因为NaBiO 难溶于水,不能拆分,
3 3 2 3
溶液为碱性,则离子方程式为Bi(OH) +3OH−+Cl =NaBiO +2Cl−+3H O。
3 2 3 2
(5)装置D中白色固体恰好消失表示刚好完全反应,同时NaBiO 遇沸水或酸则迅速分解,
3
所以此需要立即关闭 K 和 K ,防止 Cl 过量使溶液呈酸性,导致 NaBiO 分解,之后需
1 3 2 3
要打开K ,其目的是用NaOH溶液吸收装置内的Cl ,防止污染环境。
2 2
(6)制备NaBiO 的实验结束后,某同学取少量D中液体于试管中,加入过量稀硫酸,生
3
成黄绿色的能使湿润的淀粉碘化钾试纸变蓝的气体,该操作不能说明氧化性NaBiO >Cl ,
3 2
因为存在ClO−+Cl−+2H+=Cl ↑+H O,故不能说明氧化性NaBiO >Cl 。
2 2 3 2
化学参考答案·第4页(共6页)(7)因为存在如下关系式:5NaBiO ~2MnO~10(NH ) Fe(SO ) ,所以 NaBiO ~
3 4 4 2 4 2 3
1
2(NH ) Fe(SO ) ,则n(NaBiO )=25.00×0.2000×10−3mol× =2.5×10−3mol,则m(NaBiO )=
4 2 4 2 3 3
2
2.5×10−3×280g=0.7g,则纯度为70%。
17.(除特殊标注外,每空2分,共14分)
高温
(1)①2C+SiO =Si+2CO↑ ②C(1分)
2
2000K
③反应①−③得 C+SiO =Si+CO ↑ GG G 0,不能自发进行,反应②−③
2 2 1 3
2000K
得2C+SiO =Si+2CO↑ GG G 0,能自发进行
2 2 3
(2)CD
(3)①减小 ②0.048
(4)甲醇(1分) 甲醇、乙醇、正丙醇为同系物,甲醇的相对分子质量最小,分子间
作用力最小,沸点最低
【解析】(2)虽然温度升高一般会加快反应速率,但温度过高可能会导致催化剂失活,而
且温度升高,会降低气体在催化剂表面的吸附率,导致CO转化率降低,所以反应温度越
高,CO 的转化率不一定越大,A 错误。根据勒夏特列原理,提高 H 浓度,平衡会向逆
2
反应方向移动,会使烯烃的产率降低,B错误。催化剂表面水及时脱附有利于下一步催化
反应的进行,故能提高反应速率,C正确。氢气可以与催化剂表面的氧化膜发生反应,从
而激活催化剂,去除表面氧化膜,使催化剂更好地发挥作用,D正确。
c(CO)c(H O) k
(3)①当达到平衡时,正逆反应速率相等,则K 2 正 ,反应为吸热反应,
c(CO )c(H ) k
2 2 逆
k
降低温度,平衡逆向移动,K值变小,则lgk lgk lg 正 变小。
正 逆 k
逆
②达到平衡,此时容器内CH OH的物质的量为0.5mol,CO为0.2mol;根据C原子守恒
3
求 得 n(CO )1n(CH OH)n(CO)0.3mol , 根 据 O 原 子 守 恒 求 得
2 3
n(H O)22n(CO )n(CH OH)n(CO)0.7mol , 根 据 H 原 子 守 恒 求 得
2 2 3
化学参考答案·第5页(共6页)n(H )0.5[64n(CH OH)2n(H O)]1.3mol,则反应后总的物质的量为3mol。则:
2 3 2
0.5 0.7
10 10
p(CH OH)p(H O) 3 3
K 3 2 0.047792。
p p(CO )p3(H ) 0.3 1.3 3
2 2 10 10
3 3
18.(除特殊标注外,每空2分,共15分)
(1)氨基乙腈(1分)
(2)还原反应
(3)醚键
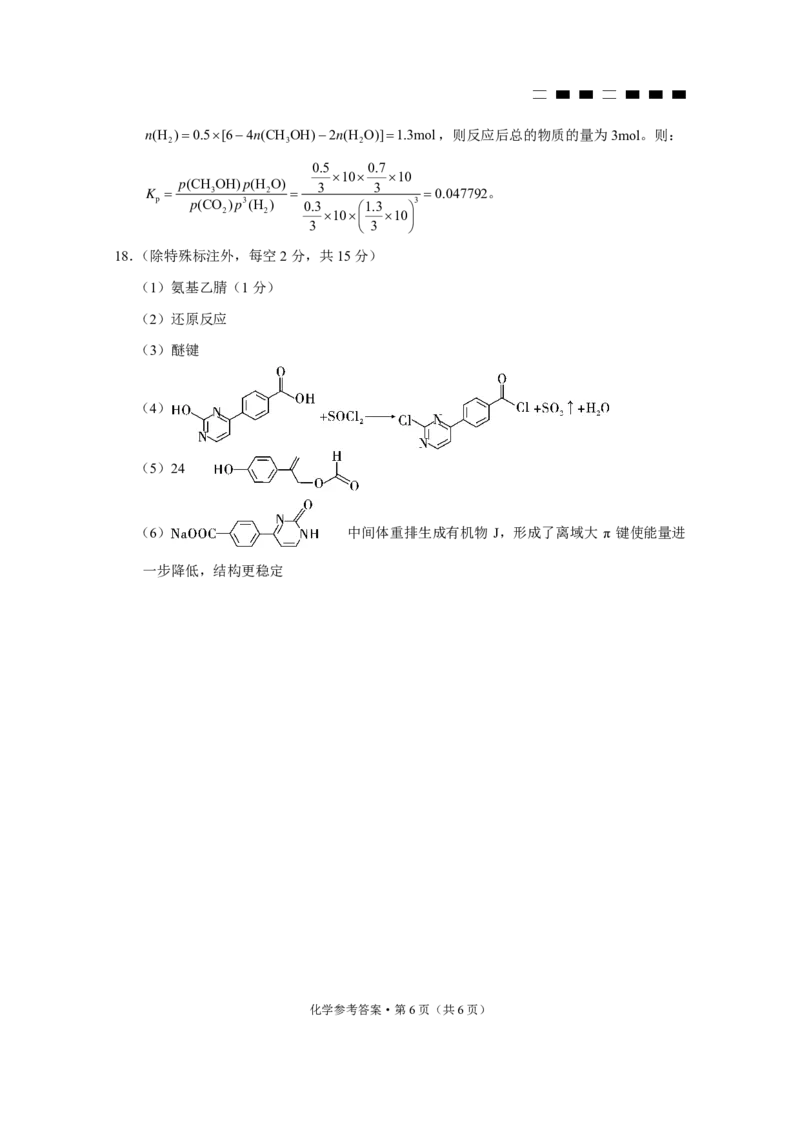
(4)
(5)24
(6) 中间体重排生成有机物 J,形成了离域大 π 键使能量进
一步降低,结构更稳定
化学参考答案·第6页(共6页)